用于亲和纯化的免疫球蛋白结合蛋白的制作方法
1.本发明涉及免疫球蛋白(ig)结合蛋白,其包含具有带有支链侧链的高度疏水性氨基酸(iso、leu、val)或者芳香族氨基酸(tyr、phe或trp)的一个或多个结构域,这些氨基酸对应于seq id no:1的ig结合蛋白或功能类似蛋白的位置4或6或8。该新型蛋白对于抗体(免疫球蛋白)的高效纯化方法具有优良性质,例如,该蛋白具有高结合量和高化学稳定性。本发明还涉及包含本发明的ig结合蛋白的亲和基质。本发明还涉及这些ig结合蛋白或亲和基质用于亲和纯化免疫球蛋白的用途,并且涉及使用本发明的ig结合蛋白的亲和纯化方法。
背景技术:
2.多种生物技术和药物应用需要从含有抗体的样品中去除污染物。捕获和纯化抗体的既定程序是亲和色谱,其使用来自金黄色葡萄球菌(staphylococcus aureus)的细菌细胞表面蛋白a作为免疫球蛋白的选择性配体(参见,例如,huse et al.,j.biochem.biophys.methods 51,2002:217-231的综述)。野生型蛋白a以高亲和力和选择性结合igg分子的fc区。具有改善的性质,如碱性稳定性的蛋白a的变体对于纯化抗体可用,并且包含蛋白a配体的多种色谱基质是可商购的。然而,目前可用的基于蛋白a的色谱基质在暴露于碱性条件后显示失去对免疫球蛋白的结合能力并且需要在低于4的ph下的洗脱条件。
3.本发明的技术问题
4.大多数抗体或含fc的融合蛋白的大规模生产过程使用蛋白a进行亲和纯化。然而,由于蛋白a在亲和色谱中的应用的限制,本领域需要提供具有改善性质的新型ig结合蛋白,其特异性结合免疫球蛋白以有助于免疫球蛋白的亲和纯化。为了最大限度地利用包含ig结合蛋白的色谱基质的价值,期望多次使用亲和配体基质。在色谱循环之间,需要进行彻底的清洗程序以消毒和去除基质上残留的污染物。在该程序中,一般的做法是将含有高浓度的naoh的碱性溶液应用于亲和配体基质。野生型蛋白a结构域不能长时间承受这种苛刻的碱性条件,并且快速失去对免疫球蛋白的结合能力。此外,对于亲和配体基质的重复使用,需要在苛刻的酸性条件下进行清洗步骤。
5.因此,本领域持续需要获得能够结合包含ig序列的蛋白质(例如,抗体)并耐受免疫球蛋白亲和纯化中应用的苛刻清洗条件的新型蛋白质。
6.本发明提供了特别适用于免疫球蛋白的亲和纯化的ig结合蛋白。具体地,本发明的ig结合蛋白具有几个优势。本发明的ig结合蛋白的一个显著优势是它们在高ph值下对于延长的一段时间(如大于2天)的改善的稳定性,同时不会降低ig结合能力以及高动态结合能力。此外,本发明的新型蛋白对于其中需要弱酸洗脱条件的抗体的亲和纯化特别有用。
7.以上概述不必然描述通过本发明所解决的所有问题。
技术实现要素:
8.本发明的一个方面是提供适用于亲和纯化的ig结合蛋白。
9.[1]这通过包含一个或多个ig结合结构域的免疫球蛋白(ig)结合蛋白实现,其中至少一种ig结合结构域对应于与seq id no:1(cs26)具有至少80%的氨基酸同一性的ig结合蛋白,其中对应于seq id no:1的位置4、6或8的氨基酸为异亮氨酸(i)或亮氨酸(l)或者芳香族氨基酸。该ig结合蛋白是碱性稳定的(在0.5m naoh下至少20h)。在各个实施方式中,ig结合蛋白包含一个或多个ig结合结构域,其中至少一种ig结合结构域对应于与seq id no:1具有至少80%的氨基酸同一性的ig结合蛋白,其中对应于seq id no:1的位置8的氨基酸为异亮氨酸(i)、亮氨酸(l)、缬氨酸(v)或芳香族氨基酸,并且其中ig结合蛋白在0.5m naoh的碱性条件下稳定至少20h。
[0010]
[2]根据项目[1]的ig结合蛋白,其中
[0011]
(a)对应于seq id no:1的位置8的氨基酸为异亮氨酸(i)或酪氨酸(y),优选地其中对应于seq id no:1的位置8的氨基酸为异亮氨酸(i),或者
[0012]
(b)其中对应于seq id no:1的位置4的氨基酸为色氨酸(w)或苯丙氨酸(f),或者
[0013]
(c)其中对应于seq id no:1的位置6的氨基酸为异亮氨酸(i)、色氨酸(w)或酪氨酸(y)或亮氨酸(l)。
[0014]
[3]根据项目[1]或[2]的ig结合蛋白,其中对应于seq id no:1的位置10、14、16、17、18或28的一个或多个氨基酸选自组氨酸(h),或者选自天冬氨酸(d)或谷氨酸(e)的酸性氨基酸的组,优选地在位置14或28处。在各个实施方式中,ig结合蛋白与seq id no:1(cs26)具有至少80%的氨基酸同一性,其中对应于seq id no:1的位置8的氨基酸为异亮氨酸(i)或亮氨酸(l)或缬氨酸(v)或芳香族氨基酸,并且对应于seq id no:1的位置14的氨基酸为组氨酸。在各个实施方式中,ig结合蛋白与seq id no:1(cs26)具有至少80%的氨基酸同一性,其中对应于seq id no:1的位置8的氨基酸为异亮氨酸(i)或亮氨酸(l)或缬氨酸(v)或芳香族氨基酸,对应于seq id no:1的位置14的氨基酸为组氨酸(h),并且对应于seq id no:1的位置29的氨基酸为赖氨酸(k)。优选地,对应于seq id no:1的位置8的氨基酸为异亮氨酸(i)或亮氨酸(l)或芳香族氨基酸,其可以是色氨酸(w)、苯丙氨酸(f)或酪氨酸(y)中的任一种。更优选地,对应于seq id no:1的位置8的氨基酸为异亮氨酸(i)或亮氨酸(l),更优选地对应于seq id no:1的位置8的氨基酸为异亮氨酸(i)。在各个实施方式中,ig结合蛋白可以在对应于seq id no:1的位置43或46的位置处具有半胱氨酸(c)残基。
[0015]
[4]根据项目[1]-[3]中任一项的ig结合蛋白,其中对应于seq id no:1的位置29的氨基酸为赖氨酸(k)。
[0016]
[5]根据项目[1]-[4]中任一项的ig结合蛋白,其中至少一种结构域包含seq id no:4-36和40-49中任一项所示的氨基酸序列或由其组成。在各个实施方式中,ig结合蛋白包含seq id no:4-9、20-36和40-49中任一项所示的氨基酸序列,或者与seq id no:4-36、40-49中任一项具有至少89.5%的同一性的氨基酸序列。
[0017]
[6]根据项目[1]-[5]中任一项的ig结合蛋白,其中蛋白结合至igg1、igg2、igg4、igm、iga、ig片段、fc片段、fab片段、包含ig区的融合蛋白和包含ig区的缀合物中的一种或多种。在各个实施方式中,ig结合蛋白结合至包含fc区的蛋白或者结合至fc片段。
[0018]
[7]根据项目[1]-[6]中任一项的ig结合蛋白,其中蛋白包含2、3、4、5或6个彼此连
接的结构域。
[0019]
[8]根据项目[7]的ig结合蛋白,其中蛋白是同源多聚体或异源多聚体。在一些实施方式中,ig结合蛋白是包含seq id no:37、seq id no:50或seq id no:51的序列的二聚体。
[0020]
[9]根据项目[1]-[8]中任一项的ig结合蛋白,其中蛋白固定至固体载体。在一些实施方式中,通过对应于seq id no:1的位置43或46的位置处的半胱氨酸(c)将ig结合蛋白固定至固体载体。
[0021]
[10]根据项目[1]-[9]中任一项的ig结合蛋白,其中ig结合蛋白在碱性条件下稳定,可选地在0.5m naoh下稳定至少20h。
[0022]
[11]一种亲和分离基质,其包含连接至所述亲和分离基质的根据项目[1]至[10]中任一项的ig结合蛋白。
[0023]
[12]根据项目[1]至[10]中任一项的ig结合蛋白或者根据项目[11]的亲和分离基质用于通过对ig结合蛋白的亲和力亲和纯化任何蛋白的用途。
[0024]
[13]一种亲和纯化包含ig序列的蛋白的方法,方法包括:
[0025]
a)提供含有包含ig序列的蛋白的液体;
[0026]
b)提供根据项目[11]的亲和分离基质,其包含连接至根据项目[11]的亲和分离基质的根据项目[1]至[10]中任一项的至少一种ig结合蛋白;
[0027]
c)在允许至少一种根据项目[1]-[10]中任一项的ig结合蛋白与包含ig序列的蛋白结合的条件下,将亲和分离基质与液体接触;和
[0028]
d)从亲和纯化基质洗脱包含ig序列的蛋白,由此获得含有免疫球蛋白的洗脱液。
[0029]
[14]根据项目[13]的方法,其中在步骤(d)中,大于95%的包含ig序列的蛋白在ph 3.7或以上从包含根据项目[1]-[10]中任一项的ig结合蛋白的亲和分离基质上洗脱。在各个实施方式中,在步骤(d)中,大于95%的包含ig序列的蛋白在ph 4.5从包含根据项目[1]-[10]中任一项的ig结合蛋白的亲和分离基质上洗脱。
[0030]
[15]根据项目[13]-[14]中任一项的方法,包括用碱性清洗液清洗亲和纯化基质的额外步骤(e),可选地其中至少90%的ig结合蛋白在0.5mnaoh下温育至少20h后保留ig结合活性。
[0031]
[16]本发明提供了免疫球蛋白(ig)结合结构域,结合结构域与seq id no:1(cs26)具有至少80%的氨基酸同一性,其中对应于seq id no:1的位置4、6或8的氨基酸为异亮氨酸(i)或亮氨酸(l)或者芳香族氨基酸。优选地,免疫球蛋白(ig)结合结构域是/对应于与seq id no:1(cs26)具有至少80%的氨基酸同一性的ig结合蛋白,其中对应于seq idno:1的位置4、6或8的氨基酸为异亮氨酸(i)或亮氨酸(l)或者芳香族氨基酸,如以上项目[1]。
[0032]
本发明内容不必需描述本发明的所有特性。通过审阅以下具体实施方式,其它实施方式将变得显而易见。
附图说明
[0033]
图1。新型ig结合蛋白的氨基酸序列。顶行中的数字表示ig结合蛋白中相应的氨基酸位置。
[0034]
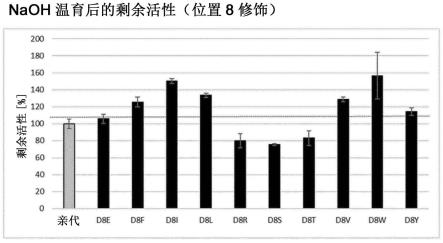
图2、3、4。在与0.5m naoh温育20h后,连接至praesto epoxy 85树脂(在35℃连接18h)的ig结合蛋白的严苛稳定性。使用6mg gammanorm的sbc确定。经由位于第三螺旋(位置43c)的半胱氨酸的变体和亲代蛋白与树脂的连接。
[0035]
图2。变体8i、8v、8f、8w、8l和8y显示与亲代分子(cs26)相比,在碱性条件下长期温育后,显著改善的保留的活性。
[0036]
图3。变体4f和4w显示与亲代分子(cs26)相比,在碱性条件下长期温育后,改善的保留的活性。
[0037]
图4。变体6f、6i、6l、6v、6w、6y、6r显示与亲代分子(cs26)相比,在碱性条件下长期温育后,改善的保留的活性。
[0038]
图5。贝利木单抗从亲和配体(seq id no:51)的洗脱谱。将抗体上样至具有固定化亲和配体(seq id no:51)的柱上并通过ph 6.0至2.0的线性ph梯度洗脱。将最大洗脱峰用作读数。
[0039]
图6。亲和配体seq id no:51的dbc10%确定。将贝利木单抗加载到具有固定化亲和配体seq id no:51的树脂上(图中的“id51”)直至10%目标穿透。在ph 4.8下进行贝利木单抗的洗脱,然后在ph 1.7进行cip。色谱图显示在ph 4.8下结合的贝利木单抗完全洗脱。
具体实施方式
[0040]
在以下详细描述本发明之前,应理解本发明不局限于本文描述的具体方法、规程和试剂,并且这些是可以变化的。还应理解本文所使用的术语仅出于描述具体实施方式的目的,并且不意欲限制将可以仅由所附权利要求限制的本发明的范围。除非另外定义,否则本文所使用的所有技术和科学术语具有与本发明所属领域的技术人员通常理解的含义相同的含义。
[0041]
优选地,本文所使用的术语与“a multilingual glossary of biotechnological terms:(iupac recommendations)”,leuenberger,h.g.w,nagel,b.andh主编.(1995),helvetica chimica acta,ch-4010basel,switzerland中所提供的定义一致。
[0042]
在整个说明书和所附权利要求中,除非上下文另外要求,否则单词“包含(comprise)”和变化形式如“包含(comprises)”和“包含(comprising)”将被理解为表示对成员、整数或步骤或成员、整数或步骤的组的包含,但不排除任何其它成员、整数或步骤或成员、整数或步骤的组。
[0043]
除非上下文中明确指出,否则如本发明描述和所附权利要求中所使用的,单数形式的“一个”和“该”是可互换使用的,并且还意在包括复数形式,并且属于每种含义内。另外,如本文所使用的,“和/或”是指并涵盖一个或多个所列项目的任何和全部可能的组合,并且当以替代方式(“或”)解释时缺少组合。
[0044]
如本文所使用的,术语“约”涵盖了明确列举的量以及与之
±
10%的偏差。更优选地,术语“约”涵盖了5%的偏差。
[0045]
在本说明书的整个文本中引用了一些文档(例如:专利、专利申请、科技出版物、生产商的说明书等)。在本文中任何事物均不应被视为承认本发明因在先发明而无权先于这种发明公开。本文引用的一些文档可以被称为“作为参考并入”。如果这些并入的参考文献的定义或教导内容与在本说明书中所列举的定义或教导内容矛盾,则以本发明的文本为
准。
[0046]
在所附序列表中公开了本文所提及的所有序列,序列表以其整个内容和公开内容是本说明书的一部分。
[0047]
在本发明的背景中,术语“ig结合蛋白”或“免疫球蛋白结合蛋白”用于描述能够特异性结合至免疫球蛋白的蛋白质。此外,在本发明的背景中,术语“ig结合域”或“免疫球蛋白结合域”用于描述能够特异性结合至免疫球蛋白的蛋白质。本发明的ig结合蛋白或ig结合结构域有时在本文中被称为本发明的配体。如本文所理解的,“免疫球蛋白”或“ig”可以包括但不必需限于哺乳动物igg,如(例如)人igg1、人igg2、人igg4、小鼠igg、大鼠igg、山羊igg、牛igg、豚鼠igg、兔igg;人igm、人iga;和包含fc区的免疫球蛋白片段(也称为“fc片段”或“fc”)和/或包含fab区的免疫球蛋白片段(也称为“fab片段”或“fab”)。ig结合蛋白能够结合至整个免疫球蛋白并且结合至包含fc区的ig片段和/或包含fab区的ig片段。如本文所理解的,定义“免疫球蛋白”包括包含免疫球蛋白的融合蛋白、包含fc区的免疫球蛋白片段(fc片段)、包含fab区的免疫球蛋白片段(fab片段)、包含含有fc区的免疫球蛋白的片段的融合蛋白、包含含有fab区的免疫球蛋白的片段的融合蛋白、包含ig或包含fc区的ig片段(fc片段)的缀合物,以及包含含有fab区的ig片段(fab片段)是缀合物。
[0048]
如本领域的常规技术人员将理解的,术语“免疫球蛋白”和“抗体”在本文中可以可互换地使用。因此,与术语“免疫球蛋白”有关的本文公开的任何定义适用于术语“抗体”。
[0049]
根据本发明的术语“结合”优选地涉及特异性结合。“特异性结合”是指ig结合蛋白或ig结合结构域与其特异性的免疫球蛋白的结合比与另一种非免疫球蛋白靶标的结合更强。
[0050]
术语“结合活性”是指本发明的ig结合蛋白或者ig结合结构域结合免疫球蛋白的能力。例如,可以在碱处理之前和/或之后确定结合活性。可以在本文中可互换地使用术语(免疫球蛋白)“结合活性”和“结合能力”。可以确定ig结合蛋白或者连接至基质的ig结合蛋白,即固定化的ig结合蛋白的结合活性。另外,可以确定ig结合结构域或者连接至基质的ig结合结构域,即固定化的ig结合结构域的结合活性。术语“人工”是指天然存在的对象,即该术语是指通过人产生或修饰的对象。例如,通过人(例如,例如,在实验室中通过基因工程、通过改组方法或通过化学反应等)产生或有意修饰的多肽或多核苷酸序列是人工的。
[0051]
术语“解离常数”或“k
d”定义了特异性结合亲和力。如本文所使用的,术语“k
d”(通常以“mol/l”测量,有时缩写为“m”)旨在表示第一蛋白和第二蛋白之间的特定相互作用的解离平衡常数。在本发明的背景中,具体地,术语kd用于描述ig结合蛋白或ig结合结构域和免疫球蛋白之间的结合亲和力。如果本发明的ig结合蛋白或ig结合结构域对免疫球蛋白的解离常数kd为至少500nm或以下,或者优选地100nm或以下,更优选地50nm或以下,更优选地10nm或以下,则认为本发明的ig结合蛋白或ig结合结构域与免疫球蛋白结合。
[0052]
术语“蛋白质”和“多肽”是指通过肽键连接的两个或多个氨基酸的任何线性分子链,而不是指特定长度的产物。因此,用于表示两个或更多个氨基酸的链的“多肽”、“蛋白”、“氨基酸链”或任何其它术语包括在“多肽”的定义内,并且术语“多肽”可以代替任何这些术语或与任何这些术语可互换地使用。术语“多肽”也意指多肽翻译后修饰的产物,其无限制地包括糖基化、乙酰化、磷酸化、酰胺化、蛋白水解切割、通过非天然存在的氨基酸修饰和本领域中熟知的类似修饰。因此,包含两个或更多个蛋白质结构域的ig结合蛋白也属于术语“蛋白质”或“多肽”的定义。
[0053]
术语“碱性稳定的”或“碱性稳定性”或“苛性稳定的”或“苛性稳定性”(本文也缩写为“cs”)可以在本文中可互换地使用并且是指本发明的ig结合蛋白或ig结合结构域耐受碱性条件的能力,且不显著丧失结合免疫球蛋白的能力。本领域技术人员可以通过以下方式容易地测试碱性稳定性:将ig结合蛋白或ig结合结构域与(例如)氢氧化钠溶液一起温育,例如,如实施例中,并通过本领域技术人员已知的常规实验,例如,通过色谱法后续测试与免疫球蛋白的结合能力或结合活性。可以通过将本发明的ig结合蛋白或ig结合结构域连接至表面等离子共振(spr)传感器芯片并测定暴露于碱性溶液前后免疫球蛋白的结合能力或结合活性来确定碱性稳定性。可以(例如)在0.5m naoh中进行延长的一段时间,例如,至少20h的碱处理。
[0054]
本发明的ig结合蛋白或ig结合结构域以及包含本发明的ig结合蛋白或ig结合结构域的基质表现出“提高”或“改善”的碱性稳定性,这表示并入所述ig结合蛋白或ig结合结构域的分子和基质相对于参考在碱性条件下对于延长的时间段是稳定的。在各个实施方式中,参考可以是具有seq idno:1-3中任一项的序列的亲代分子cs26,优选地seq id no:3的序列(cs26 43c)。在多个其它实施方式中,参考可以是具有取代d8e(asp8glu)的seq id no:1-3中任一项所示的亲代分子cs26,优选地具有取代d8e(asp8glu)的seq id no:3所示的亲代分子cs26。
[0055]
如本文所使用的,术语“变体”包括ig结合蛋白或ig结合结构域的氨基酸序列,其通过至少一个氨基酸替代、缺失或插入与另一种氨基酸序列不同。这些修饰可以通过基因工程或通过人工进行的化学合成或化学反应产生。
[0056]
如本文所使用的,术语“缀合物”涉及包含化学连接至其它物质,如连接至第二蛋白质或非蛋白质部分的至少第一蛋白质或基本上由其组成的分子。
[0057]
术语“修饰”或“氨基酸修饰”是指氨基酸在多肽序列中的特定位置被另一种氨基酸交换、缺失或插入。考虑到已知的遗传密码以及重组和合成dna技术,熟练的科学家可以容易地构建编码氨基酸变体的dna。
[0058]
术语“替换”或“氨基酸替换”是指氨基酸在多肽序列中的特定位置被另一种氨基酸交换。术语“缺失”或“氨基酸缺失”是指氨基酸在多肽序列中的特定位置处的移除。
[0059]
术语“插入”或“氨基酸插入”是指氨基酸向多肽序列的添加。
[0060]
在整个说明书中,氨基酸残基位置编号被指定为对应于(例如)seq id no:1的那些。
[0061]
术语“氨基酸序列同一性”是指两种或更多种蛋白的氨基酸序列的同一性(或差异)的定量比较。将相对于参考多肽序列的“氨基酸序列同一性百分比(%)”或“百分比同一的”或“同一性百分比”定义为在序列比对(并且如有必要,引入缺口(gap))以实现最大序列同一性百分比后,与参考多肽序列中的氨基酸残基相同的序列中的氨基酸残基的百分比。在各个实施方式中,术语“序列同一性”表示当最优比对时,如使用默认缺口权重(gap weight),通过程序gap或bestfit进行最优比对时,两条(核苷酸或)氨基酸序列共有至少70%的序列同一性,或者至少80%的序列同一性,或者至少85%的序列同一性,或者至少90%的序列同一性,或者至少95%的序列同一性或更高的序列同一性。
[0062]
为了确定序列同一性,将查询蛋白序列与参考蛋白序列进行比对和比较。用于序
列比对和序列比较算法的方法在本领域中是熟知的。例如,为了确定任意多肽相对于参考氨基酸序列的氨基酸序列同一性程度,优选地使用sim局部相似性程序。对于多重比对分析,优选地使用本领域技术人员已知的clustalw。
[0063]
通常相对于未修饰序列的总长计算序列同一性程度。如本文所使用的,在两条多肽序列的背景中,短语“百分比同一的”或“百分比(%)氨基酸序列同一性”或“百分比同一性”是指当对于最大对应性进行比较和比对时,具有在一些实施方式中至少89.5%,在一些实施方式中至少91%,在一些实施方式中至少92%,在一些实施方式中至少93%,在一些实施方式中至少94%,在一些实施方式中至少95%,在一些实施方式中至少96%,在一些实施方式中至少97%,在一些实施方式中至少98%并且在一些实施方式中至少100%的氨基酸残基同一性的两条或更多条序列或子序列,如使用以下序列比较算法之一或者通过目视检查所测量的。为清楚起见,例如,具有至少89.5%的同一性的序列包括具有大于89.5%的同一性的所有序列,例如,具有至少89.6%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%氨基酸同一性的实施方式。
[0064]
百分比同一性在一些实施方式中存在于至少52个残基的区域上,在一些实施方式中存在于至少53个残基的区域上,在一些实施方式中存在于至少54个残基的区域上,在一些实施方式中存在于至少55个残基的区域上,在一些实施方式中存在于至少56个残基的区域上,在一些实施方式中存在于至少57个残基的区域上并且在一些实施方式中存在于至少58个残基的区域上。
[0065]
术语“融合”是指通过肽键直接或经由肽接头连接多肽组分或单元。在各个实施方式中,术语“融合的”可以表示通过非肽接头,例如,通过化学缀合连接的多肽组分或单元。
[0066]
术语“融合蛋白”涉及包含基因连接至至少第二蛋白的至少第一蛋白的蛋白。融合蛋白是通过连接两个或多个最初编码单独的蛋白的基因所产生的。因此,融合蛋白可以包含相同或不同蛋白的多聚体,这些蛋白表达为单个线性多肽。在各个实施方式中,通过经由非肽接头,例如,通过化学缀合连接两个或更多个多肽产生融合蛋白。在各个实施方式中,本发明的ig结合蛋白或ig结合结构域的二聚体可以被认为是“融合蛋白”。
[0067]
如本文所使用的,术语“接头”以其最广泛的含义表示共价连接至少两个其它分子的分子。在本发明的典型实施方式中,“接头”将被理解为将ig结合蛋白或ig结合结构域与至少一个其它ig结合蛋白或ig结合结构域连接的部分,即将两个蛋白结构域彼此连接以产生二聚体或多聚体的部分。在优选的实施方式中,“接头”是肽接头,即连接两个结合蛋白或结合结构域的部分是一个单一氨基酸或者包含两个或更多个氨基酸的肽。在各个实施方式中,本发明的二聚体或多聚体可以包含将两个或更多个ig结合蛋白或ig结合结构域彼此连接的接头。
[0068]
术语“色谱”是指使用流动相和固定相将样品中的一种类型的分子(例如,免疫球蛋白)与其它分子(例如,污染物)分离的分离技术。液体流动相含有分子的混合物,并将这些分子输送穿过或通过固定相(例如,固体基质)。由于流动相中不同分子与固定相的不同相互作用,可以分离流动相中的分子。术语“亲和色谱”是指一种特定的色谱模式,其中与固定相连接的配体与流动相(样品)中的分子(即免疫球蛋白)相互作用,即配体对要纯化的分子具有特异性结合亲和力和结合能力。如在本发明的上下文中所理解的,亲和色谱包括将
含有免疫球蛋白的(液体)样品添加至包含色谱配体,如本发明的ig结合蛋白或ig结合结构域的固定相。
[0069]
术语“固体载体”或“固体基质”在本文中是可互换使用的,并且在各个实施方式中,用于固定相。
[0070]
如在本文中可互换使用的,术语“亲和基质”或“亲和分离基质”或“亲和色谱基质”是指基质,例如色谱基质,其上连接了亲和配体,例如本发明的ig结合蛋白或ig结合结构域。配体(例如,ig结合蛋白或ig结合结构域)能够特异性结合至将从(液体样品中)的混合物中纯化或除去的所关注的分子(例如,如上定义的免疫球蛋白)。如本领域的常规技术人员将理解的,术语“亲和基质”或“亲和分离基质”或“亲和色谱基质”描述了通过使用本发明的ig结合蛋白或ig结合结构域对所关注的分子(具体地免疫球蛋白)的分离。因此,术语“亲和基质”或“亲和分离基质”或“亲和色谱”或“分离基质”在本文中可以可互换地使用。
[0071]
如本文所使用的术语“亲和纯化”是指通过将如上定义的所关注的免疫球蛋白结合至固定至基质的ig结合蛋白或ig结合结构域,从液体(样品)纯化如上定义的所关注的免疫球蛋白的方法。借此,除去除所关注的免疫球蛋白之外的混合物的所有其它组分。在各个实施方式中,混合物的其它组分可以包括,例如,不是所关注的其它免疫球蛋白。在其它步骤之后,以纯化形式洗脱所关注的免疫球蛋白。术语“亲和纯化”或“亲和色谱纯化”或“亲和分离”或“分离色谱分离”在本文中可以可互换地使用。
[0072]
本发明的实施方式
[0073]
现将进一步描述本发明。在以下段落中,更详细地定义了本发明的不同实施方式。除非明确相反指明,否则以下定义的每个实施方式可以与任何其它实施方式组合。具体地,指明为优选的或有利的任何特征可以与指明为优选或有利的任何其它一种或多种特征组合。
[0074]
本发明提供了ig结合结构域,其对应于与seq id no:1(cs26)具有至少80%的氨基酸同一性的ig结合蛋白,其中对应于seq id no:1的位置8的氨基酸为异亮氨酸(i)或亮氨酸(l)或缬氨酸(v)或者芳香族氨基酸,芳香族氨基酸可以是色氨酸(w)、苯丙氨酸(f)或酪氨酸(y)中的任一种。优选地,对应于seq id no:1的位置8的氨基酸为异亮氨酸(i)或亮氨酸(l),更优选地对应于seq id no:1的位置8的氨基酸为异亮氨酸(i)。在各个实施方式中,对应于seq id no:1的位置14的氨基酸为组氨酸(h),和/或对应于seq id no:1的位置29的氨基酸为赖氨酸(k)。ig结合结构域还可以在对应于seq id no:1的位置43或46的位置处具有半胱氨酸(c)残基。ig结合结构域在0.5m naoh的碱性条件下稳定至少20h。如在本文其它地方描述的,本发明的ig结合蛋白包含一种或多种这类ig结合结构域。
[0075]
在一个实施方式中,ig结合蛋白包含一个或多个结构域,其中至少一个结构域包含在对应于seq id no:1的位置4、6或8的一个或多个氨基酸处的氨基酸替换或基本由其组成或由其组成,对应于seq id no:1的位置4、6或8的氨基酸处的替换为选自iso(i)、leu(l)、tyr(y)、phe(f)、val(v)或trp(w)的组的氨基酸,并且其中ig结合蛋白的氨基酸序列与seq id no:1至少80%同一。
[0076]
在一个实施方式中,ig蛋白包含一个或多个结构域,其中至少一个结构域包含在对应于seq id no:1的位置8的氨基酸处的氨基酸替换,氨基酸替换选自具有支链侧链的高度疏水性氨基酸(iso、leu、val)或者芳香族氨基酸(tyr、phe或trp),并且其中ig结合蛋白
的氨基酸序列与seq id no:1至少80%同一。在一些实施方式中,对应于seq id no:1的位置8的氨基酸为异亮氨酸(i)或酪氨酸(y)。在一些优选的实施方式中,对应于seq id no:1(或功能等效蛋白)的位置8的氨基酸为异亮氨酸(i)。在各个实施方式中,在对应于seq id no:1的位置8的位置处的异亮氨酸(i)改善了ig的结合能力和严苛稳定性。此外,在对应于seq id no:1(或功能等效蛋白)的位置8的位置处的异亮氨酸可以改善蛋白的表达。对于本发明的适合于在亲和色谱中使用的具有高结合能力和严苛稳定性的ig结合配体,重要的是位置8处的氨基酸不选自精氨酸(r)、丝氨酸(s)、苏氨酸(t)或丙氨酸(a)中的任一种(参见图2)。本发明证实相对于seq id no:1的位置8处的这些取代以及相对于取代d8e(asp8glu)的改善的严苛稳定性。因此,在本发明的各个实施方式中,对应于seq id no:1的位置8的氨基酸不是谷氨酸(e)。
[0077]
在一些实施方式中,本发明的ig结合蛋白或ig结合结构域选自以下(1)至(3):(1)包含对应于seq id no:1的氨基酸序列的蛋白,其中第8位处的氨基酸残基被ile、leu、val或者芳香族氨基酸替换;(2)包含(1)中所指明的氨基酸序列的蛋白,其还具有位于除第8位以外的位置处的一个或多个氨基酸残基的缺失、替换和/或添加;(3)包含与(1)中所指明的氨基酸序列具有至少80%或以上的序列同一性的氨基酸序列的蛋白,条件是(1)中所指明的在第8位处的氨基酸替换在(3)中未进一步突变。
[0078]
本发明还提供了在对应于seq id no:1的位置4的位置处包含氨基酸替换的ig蛋白,氨基酸替换选自具有支链侧链的高度疏水性氨基酸(iso、leu)或者芳香族氨基酸(tyr、phe或trp)的组,并且其中ig结合蛋白的氨基酸序列与seq id no:1至少80%同一。在优选的实施方式中,对应于seq id no:1的位置4的氨基酸为色氨酸(w)或苯丙氨酸(f)。对应于seq id no:1的位置4的位置处的芳香族氨基酸,如w或f改善了亲和色谱中配体的结合能力和严苛稳定性。对于适合于在亲和色谱中使用的具有高结合能力和严苛稳定性的ig结合配体,重要的是位置4处的氨基酸不选自精氨酸(r)、丝氨酸(s)、苏氨酸(t)、丙氨酸(a)或缬氨酸(v)(参见图3)。
[0079]
在一些实施方式中,本发明的蛋白选自以下(1)至(3):(1)包含对应于seq id no:1的氨基酸序列的蛋白,其中对应于第4位的氨基酸残基被ile、leu或者芳香族氨基酸替换;(2)包含(1)中所指明的氨基酸序列的蛋白,其还具有位于除第4位以外的位置处的一个或多个氨基酸残基的缺失、替换和/或添加;(3)包含与(1)中所指明的氨基酸序列具有至少80%或以上的序列同一性的氨基酸序列的蛋白,条件是(1)中所指明的在第4位处的氨基酸替换在(3)中未进一步突变。
[0080]
本发明还提供了在对应于seq id no:1的位置6的位置处包含氨基酸替换的ig蛋白,氨基酸替换选自iso、leu、tyr、phe或trp,并且其中ig结合蛋白的氨基酸序列与seq id no:1至少80%同一。在优选的实施方式中,对应于seq id no:1的位置6的氨基酸为异亮氨酸(i)、色氨酸(w)或酪氨酸(y)或亮氨酸(l)。对应于seq id no:1的位置6的位置处的芳香族氨基酸,如trp(w)或tyr(y),或者选自iso(i)或leu(l)的氨基酸改善了亲和色谱中配体的结合能力和严苛稳定性。对于适合于在亲和色谱中使用的具有高结合能力和严苛稳定性的ig结合配体,重要的是位置6处的氨基酸不选自缬氨酸(v)、丝氨酸(s)或丙氨酸(a)(参见图4)。
[0081]
在一些实施方式中,本发明的蛋白选自以下(1)至(3):(1)包含seq id no:1的氨
基酸序列的蛋白,其中第6位处的氨基酸残基被ile、leu或者芳香族氨基酸替换;(2)包含(1)中所指明的氨基酸序列的蛋白,其还具有位于除第6位以外的位置处的一个或多个氨基酸残基的缺失、替换和/或添加;(3)包含与(1)中所指明的氨基酸序列具有至少80%或以上的序列同一性的氨基酸序列的蛋白,条件是(1)中所指明的在第6位处的氨基酸替换在(3)中未进一步突变。
[0082]
本发明的ig结合蛋白和ig结合结构域的出乎意料的优势在于在极端条件下,如高ph(ph 13及以上)下的稳定性,且不损失ig结合性质。如本文描述的ig结合蛋白和ig结合结构域证实了对于持续延长的时间段的碱稳定性,且不损害ig结合性质(参见图2、3、4和实施例)。此外,它们在低ph下稳定且不显著丧失ig结合性质。碱稳定性特性对于使用具有高naoh浓度的碱性溶液除去基质上的污染物,从而(例如)可以将基质使用几次的清洗程序的色谱方法是特别重要的。除高严苛稳定性外,ig结合蛋白显示出高连接效率,如实施例中所示。
[0083]
此外,亲和色谱中的重要步骤是结合至本发明的ig结合蛋白或ig结合结构域的所关注的蛋白,具体地所关注的免疫球蛋白的洗脱。该步骤通常在低ph下进行。本发明的亲和配体不会在该处理后失去对ig的结合性质,同时在低ph下对所关注的蛋白的洗脱是可能的。
[0084]
在一些情况下,重要的是使从亲和配体洗脱抗体(免疫球蛋白)的条件在3.7以上,如ph 4.3及以上,例如,最高至ph 5.5之间的ph下。为了改善本发明的配体的特征,可以对以上描述的配体进行进一步修饰。在一些实施方式中,对应于seq id no:1的位置10、14、16、17、18或28的一个或多个氨基酸选自组氨酸(h)的组,或者选自天冬氨酸(d)或谷氨酸(e)的酸性氨基酸。在一些实施方式中,对应于seq id no:1的位置14的氨基酸为h。在一些实施方式中,对应于seq id no:1的位置16的氨基酸为h。在其它实施方式中,对应于seq id no:1的位置28的氨基酸为h。在一些实施方式中,对应于seq id no:1的位置28的氨基酸为e。在其它实施方式中,对应于seq id no:1的位置9的氨基酸为h。在一些实施方式中,对应于seq id no:1的位置10的氨基酸为h。在对应于seq id no:1的位置10、14、16、17、18或28的位置处具有his(h)、asp(d)或glu(e)的本发明的配体削弱了fc结合亲和力并且允许结合的所关注的ig蛋白在高于4.0的ph,或甚至在ph 4.3,最高至ph 5.5下洗脱。
[0085]
出乎意料地发现包含位于对应于seq id no:1的位置14的位置处的组氨酸(h)或者位于对应于seq id no:1的位置16的位置处的组氨酸(h)的本发明的ig结合蛋白或ig结合结构域特别适合于在弱ph条件(最高ph 5.5)下从固定化配体上洗脱所关注的ig分子(参见表3)。这种特性对于使用分离基质分离免疫球蛋白,具体地具有fc区的ig特别有用,其中必须在高于ph 3.7的弱酸性条件,具体地在ph 4.0至最高且包括ph 5.5的范围内实施洗脱步骤。
[0086]
在一些实施方式中,ig结合蛋白或ig结合结构域选自以下(1)至(3):(1)包含对应于seq id no:1的氨基酸序列的蛋白,其中对应于第8位的氨基酸残基为ile、leu、val或者芳香族氨基酸;(2)包含(1)中所指明的氨基酸序列的蛋白,其中对应于第10、14、16、17、18或28位的氨基酸残基是his、asp或glu,优选地其中对应于位置14的氨基酸是his,对应于位置16的氨基酸是his,对应于位置10的氨基酸是asp或his,对应于位置17的氨基酸是his,对应于位置18的氨基酸是glu,或者对应于位置28的氨基酸是his或glu,更优选地其中对应于
位置14的氨基酸是组氨酸,(3)包含与(1)中所指明的氨基酸序列具有至少80%或以上的序列同一性的氨基酸序列的蛋白,条件是对应于第8位的(1)中所指明的氨基酸和对应于第10、14、16、17、18或28位的(2)中的氨基酸在(3)中不进一步突变。
[0087]
可以将其它修饰引入蛋白以对于亲和色谱改变某些性质。例如,可以将半胱氨酸添加至c末端。可替换地,可以将半胱氨酸引入蛋白的螺旋3内的位置,例如,位置43或位置46,以使得能够有效连接至基质。
[0088]
在另一个实施方式中,对应于位置29的位置可以交换以降低ig的结合(通过消除fab-vh3结合)并改善高ph值下的洗脱性质。在一些实施方式中,对应于seq id no:1的位置29的氨基酸为lys(k)。在一些实施方式中,所得的本发明的配体与seq id no:1具有至少80%的同一性。
[0089]
在一些实施方式中,ig结合蛋白或ig结合结构域选自以下(1)至(3):
[0090]
(1)包含对应于seq id no:1的氨基酸序列的蛋白,其中对应于第8位的氨基酸残基为ile、leu、val或者芳香族氨基酸;
[0091]
(2)包含(1)中所指明的氨基酸序列的蛋白,其中对应于第10、14、16、17、18或28位的氨基酸残基是his、asp或glu,优选地其中对应于位置14的氨基酸是his,对应于位置16的氨基酸是his,对应于位置10的氨基酸是asp或his,对应于位置17的氨基酸是his,对应于位置18的氨基酸是glu,或者对应于位置28的氨基酸是his或glu,更优选地其中对应于位置14的氨基酸是his;
[0092]
(3)包含(1)中所指明的氨基酸序列的蛋白,其中对应于第29位的氨基酸残基为lys;
[0093]
(4)包含与(1)中所指明的氨基酸序列具有至少80%或以上的序列同一性的氨基酸序列的蛋白,条件是(1)、(2)和(3)中所指明的氨基酸在(4)中不进一步突变。
[0094]
优选的ig结合结构域。在各个实施方式中,ig结合结构域包含seq idno:4-36和40-49中任一项所示的氨基酸序列,或者与其具有至少80%、至少85%、至少89.5%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的同一性的氨基酸序列,或由其组成。在各个实施方式中,ig结合结构域包含seq id no:4-36和40-49中任一项所示的氨基酸序列,或者与seq idno:4-36和40-49中任一项具有至少95%、至少96%、至少97%、至少98%或者至少99%的同一性的氨基酸,或基本由其组成,或由其组成。
[0095]
优选的ig结合蛋白。在一些实施方式中,ig结合蛋白包含一个或多个结合结构域,其中至少一个结构域包含seq id no:4-36和40-49中任一项所示的氨基酸序列,或者与其具有至少80%、至少85%、至少89.5%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的同一性的氨基酸,或者由其组成。在一些实施方式中,ig结合蛋白包含一个或多个结构域,其中至少一个结构域包含seq id no:4-36和40-49中任一项所示的氨基酸序列,或者与seq id no:4-36和40-49中任一项具有至少95%、至少96%、至少97%、至少98%或者至少99%的同一性的氨基酸,或基本由其组成,或由其组成。
[0096]
对免疫球蛋白的亲和力。如本文描述的所有ig结合蛋白或ig结合结构域以优选地低于200nm,或者低于100nm,更优选地10nm或以下的解离常数kd结合至免疫球蛋白。在一些
实施方式中,ig结合蛋白或ig结合结构域以优选地低于200nm,或者低于100nm,更优选地10nm或以下的解离常数kd结合至igg1、igg2、igg4、igm、iga、ig片段、fc片段、fab片段、包含ig区的融合蛋白和包含ig区的缀合物。用于确定ig结合蛋白或结构域的结合亲和力或结合能力,即用于确定解离常数kd的方法是本领域的常规技术人员已知的并且可以(例如)选自本领域中已知的以下方法:表面等离子共振(spr)基技术、动力学排除分析(kinexa测定)、生物膜干涉技术(bli)、酶联免疫吸附测定(elisa)、流式细胞术、等温滴定量热法(itc)、分析超速离心、放射免疫测定(ria或irma)和增强化学发光(ecl)。在实施例中进一步描述了一些方法。通常,在20℃、25℃或30℃下确定解离常数kd。如果没有另外具体指明,则本文所列举的kd值是在22℃+/-3℃下通过表面等离子共振光谱确定的。在一个实施方式中,ig结合蛋白对人igg1的解离常数kd在0.1nm至100nm的范围内,优选地0.1nm至50nm。
[0097]
ig结合蛋白的高碱性稳定性。如实施例和附图中所示,除了高动态结合容量(dbc)外,本发明的ig结合蛋白和ig结合结构域提供了出乎意料地特别优良的碱性稳定性。通过比较ig结合活性的损失来确定ig结合蛋白或ig结合结构域的碱性稳定性。在一些实施方式中,碱性液体包含0.1-1.0m的naoh或koh,优选0.25-0.5m的naoh或koh。由于本发明的ig结合蛋白和ig结合结构域的高碱性稳定性,ph高于13的碱性液体可用于清洗具有本发明的固定ig结合蛋白或固定ig结合结构域的亲和基质。在一些实施方式中,通过比较在0.5m naoh中温育至少24h后ig结合活性的损失来确定ig结合蛋白或ig结合结构域的碱性稳定性(参见图2、图3、图4和实施例)。在一些实施方式中,通过比较在碱性溶液中长期温育,例如,在0.5m naoh中温育至少2天(至少48h)(参见实施例)后的ig结合活性的损失来确定ig结合蛋白或ig结合结构域的碱性稳定性,其反映了如本文描述的ig结合蛋白的出众的稳定性。
[0098]
本发明的ig结合蛋白和ig结合结构域在碱性条件下稳定,具体地在0.5m naoh的碱性条件下稳定至少20h。在各个实施方式中,本发明的ig结合蛋白或ig结合结构域在碱性条件下稳定,具体地在0.5m naoh的碱性条件下稳定至少24h。在优选的实施方式中,本发明的ig结合蛋白或ig结合结构域在碱性条件下稳定,具体地在0.5m naoh的碱性条件下稳定至少48h,更优选地至少50h。
[0099]
本发明的ig结合蛋白和ig结合结构域是免疫球蛋白的碱性稳定的配体。在对0.5m naoh暴露至少20h后,本发明的ig结合蛋白和ig结合结构域保留了对免疫球蛋白的结合能力(或者结合亲和力)。如本文进一步描述的,在对如本文描述的碱性条件暴露后,本发明的ig结合蛋白和ig结合结构域保留了至少85%或至少90%的对免疫球蛋白的结合能力。在其它优选实施方式中,在对碱性条件暴露后(0.5m naoh暴露至少20h或24h),优选地在对0.5m naoh暴露至少48h后,更优选地在对0.5mnaoh暴露至少50h后,本发明的ig结合蛋白和ig结合结构域保留了至少94%的对免疫球蛋白的结合能力。在各个实施方式中,当固定至固体载体,优选地固定至亲和分离基质的固体载体时,本发明的ig结合蛋白和ig结合结构域保留了对如以上描述的免疫球蛋白的结合能力。
[0100]
如本文进一步描述的,本发明的ig结合蛋白和ig结合结构域通常在碱性条件下,在室温下稳定。术语室温可以包括15℃至25℃的温度,更具体地20℃至25℃的温度。在各个实施方式中,本发明的ig结合蛋白或ig结合结构域在碱性条件下,在22℃
±
3℃稳定。
[0101]
在各个实施方式中,如以上描述的ig结合蛋白或ig结合结构域的碱性稳定性表示固定至固体载体,优选地固定至亲和分离基质的固体载体的ig结合蛋白或ig结合结构域的
碱性稳定性。因此,在各个实施方式中,通过比较当固定至固体载体,优选地固定至亲和分离基质的固体载体时,ig结合蛋白或ig结合结构域的ig结合活性或ig结合能力的损失来确定ig结合蛋白或ig结合结构域的碱性稳定性。因此,在其它实施方式中,当固定至固体载体时,在碱处理延长的时间后,通过比较ig结合蛋白或ig结合结构域的ig结合活性确定ig结合蛋白或ig结合结构域的碱性稳定性(参见图2、3、4)。
[0102]
技术人员可以使用本领域中熟知的方法,具体地,确定如在本文其它地方描述的解离常数kd的方法评价本发明的ig结合蛋白或ig结合结构域对免疫球蛋白的结合能力或结合亲和力。在各个实施方式中,还如本文其它处描述的,使用表面等离子共振(spr)光谱确定本发明的ig结合蛋白或ig结合结构域对免疫球蛋白的结合能力或结合亲和力。在其它实施方式中,如在本文其它地方描述的,使用动力学排除分析(kinexa测定)或酶联免疫吸附测定(elisa)确定本发明的ig结合蛋白或ig结合结构域对免疫球蛋白的结合能力或结合亲和力。
[0103]
可以在暴露于如本文描述的碱性条件前后对每个候选配体评价本发明的ig结合蛋白或ig结合结构域对免疫球蛋白的结合能力或结合亲和力。
[0104]
多聚体。在一个实施方式中,ig结合蛋白包含1、2、3、4、5或6个彼此连接的ig结合结构域,即ig结合蛋白可以是(例如)单体、二聚体、三聚体、四聚体、五聚物或六聚体。多聚体可以包含2、3、4或甚至更多个结合结构域。本发明的多聚体是通常通过技术人员熟知的dna重组技术人工产生的融合蛋白。
[0105]
在一些实施方式中,多聚体是同源多聚体,例如,ig结合蛋白的所有ig结合结构域的氨基酸序列是相同的。在一些实施方式中,多聚体是异源多聚体,例如,至少一种ig结合结构域具有不同于ig结合蛋白内的其它ig结合结构域的氨基酸序列。
[0106]
多聚体可以包含两种或更多种ig结合结构域,其中ig结合结构域优选地包含如以上描述的氨基酸序列或者基本由其组成。在一些实施方式中,多聚体是二聚体。本发明提供了包含seq id no:4-36和40-49中任一项所示的单体的二聚体。在各个实施方式中,本发明的ig结合蛋白是包含两个ig结合结构域的二聚体,其中两个ig结合结构域中的每一个对应于与seq id no:4-36和40-49中任一项具有至少80%氨基酸同一性的ig结合蛋白,其中二聚体ig结合蛋白在碱性条件下稳定。在优选的实施方式中,本发明的ig结合蛋白是包含两个ig结合结构域的二聚体,其中两个ig结合结构域中的每一个对应于与seq id no:4-9、20-36和40-49中任一项具有至少80%氨基酸同一性的ig结合蛋白,其中对应于seq idno:4-9、20-36和40-49的位置8的氨基酸为异亮氨酸(i)或亮氨酸(l)或缬氨酸(v)或芳香族氨基酸(y、f或w),并且其中二聚体ig结合蛋白在0.5m naoh的碱性条件下稳定至少20h。在更优选的实施方式中,本发明的二聚体ig结合蛋白包含对应于与seq id no:4-5、20-36和40-49中任一项具有至少80%氨基酸同一性的ig结合蛋白的ig结合结构域,其中对应于seq id no:4-5、20-36和40-49的位置8的氨基酸是异亮氨酸(i),并且其中二聚体ig结合蛋白在0.5m naoh的碱性条件下稳定至少20h。在更优选的实施方式中,本发明的二聚体ig结合蛋白包含对应于与seq id no:4-5、20-36和40-49中任一项具有至少80%氨基酸同一性的ig结合蛋白的ig结合结构域,其中对应于seq id no:4-5、20-36和40-49的位置8的氨基酸是异亮氨酸(i),并且其中二聚体ig结合蛋白在0.5m naoh的碱性条件下稳定至少20h,并且其中二聚体ig结合蛋白允许靶标在至少4.0的ph的温和洗脱条件下洗脱。在各个实施方式中,
包含两个ig结合结构域的二聚体的n末端ig结合结构域分别在对应于seq id no:1或者seq id no:4-36和40-49中任一项的位置43或46的位置处具有半胱氨酸(c)。
[0107]
在其它优选实施方式中,本发明的ig结合蛋白包含两个ig结合结构域,其中一个ig结合结构域对应于与seq id no:4具有至少80%氨基酸同一性的ig结合蛋白,并且另一个ig结合结构域对应于与seq id no:5具有至少80%氨基酸同一性的ig结合蛋白。优选地,基于seq id no:5的结构域位于基于seq id no:4的结构域的上游。在其它特别优选的实施方式中,本发明的ig结合蛋白包含两个ig结合结构域,其中一个ig结合结构域对应于与seq id no:43具有至少80%氨基酸同一性的ig结合蛋白,并且另一个ig结合结构域对应于与seq id no:46具有至少80%氨基酸同一性的ig结合蛋白。优选地,基于seq id no:46的结构域位于基于seq id no:43的结构域的上游。
[0108]
在一些具体的实施方式中,ig结合蛋白是包含seq id no:37、seq id no:50或者seq id no:51的序列的二聚体。
[0109]
接头。在各个实施方式中,一个或多个ig结合结构域直接彼此连接。在其它实施方式中,一个或多个ig结合结构域通过一个或多个接头彼此连接。在这些典型的实施方式中,肽接头是优选的。这表示肽接头是一个或多个氨基酸,例如氨基酸序列,其将第一ig结合结构域与第二ig结合结构域连接。通过结构域的c末端和n末端之间的肽键,将肽接头连接至第一ig结合结构域并连接至第二ig结合结构域,借此产生单一线性多肽链。接头的长度和组成可以在至少一个至高达约30个氨基酸之间改变。更具体地,肽接头具有1至30个氨基酸之间的长度;例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30个氨基酸。优选地,肽接头的氨基酸序列对严苛条件和蛋白酶稳定。接头不应使ig结合蛋白中的结构域的构象不稳定。包含小氨基酸,如甘氨酸和丝氨酸或由其组成的接头是熟知的。接头可以是富含甘氨酸的(例如,接头中超过50%的残基可以是甘氨酸残基)。包含其它氨基酸的接头也是优选的。本发明的其它实施方式包含由丙氨酸、脯氨酸和丝氨酸组成的接头。用于蛋白融合的其它接头在本领域中是已知的并且可以使用。在一些实施方式中,ig结合蛋白的多聚体包含连接ig结合结构域的一个或多个接头,其中接头是相同的或不同的。
[0110]
非ig结合蛋白。在一些实施方式中,如以上描述的ig结合蛋白还包括不同于如公开的ig结合蛋白或ig结合结构域的至少一种其它多肽。在各个实施方式中,不同于如本文公开的ig结合蛋白或ig结合结构域的其它多肽可以是非ig结合蛋白,例如(但不限于)不结合至免疫球蛋白的fc部分的蛋白。因此,一些实施方式涵盖了包含如本文公开的其一种或两种或更多种ig结合蛋白和一种或两种或更多种非ig结合多肽的融合蛋白。在一些实施方式中,融合蛋白可以包含一种(或多种)ig结合蛋白和/或一种(或多种)如本文公开的融合至一种(或多种)非ig结合蛋白的ig结合结构域。
[0111]
在一些实施方式中,非ig结合蛋白与seq id no:38或seq id no:39具有至少89.5%,或者至少91%,或者至少93%,或者至少95%,或者至少96%,或者至少98%,或者100%的同一性。seq id no:39是非ig结合蛋白。seq id no:39具有与seq id no:1相同的基本骨架,但是在seq id no:1中具有修饰d8i、f13d、y14k、131r、l42a,这导致产生了seq id no:39的非ig结合性质。在位置8处向异亮氨酸的修饰在非ig结合蛋白中导致了改善的生物化学性质,如高稳定性,例如在碱性条件下的高稳定性。因此,不考虑功能(即ig结合蛋
flow等)、纤维素或纤维素衍生物、可控孔隙玻璃(例如,va树脂)、整体柱(例如,整体柱)、二氧化硅、氧化锆(例如,cm zirconia或)、氧化钛或合成聚合物(例如,聚苯乙烯,如poros 50a或porosa树脂、聚乙烯醚、聚乙烯醇、单分散聚丙烯酸酯树脂(例如,unimab
tm
unimab
tm
pro)、丙烯酸聚羟基烷基酯、甲基丙烯酸聚羟基烷基酯、聚丙烯酰胺、聚甲基丙烯酰胺等)和多种组合物的水凝胶。在某些实施方式中,载体包含多羟基聚合物,例如,多糖。适用于载体的多糖的实例包括(但不限于)琼脂、琼脂糖、葡聚糖、淀粉、纤维素、普鲁兰多糖等,以及这些的稳定变体。
[0126]
固体载体基质的形式可以是任何适合的熟知的类型。用于连接如本文描述的ig结合蛋白或ig结合结构域的这种固体载体基质可以包括(例如)以下中的一种:柱、毛细管、颗粒、膜、过滤器、整体柱、纤维、垫、凝胶、载玻片、板、盒或色谱中常用的且本领域技术人员已知的任何其它形式。
[0127]
在一个实施方式中,基质由基本球形的颗粒(也称为珠)组成,例如,sepharose或agarose珠或单分散聚丙烯酸酯珠。合适的粒度可以在5-500μm,如10-100μm,如20-80μm,如40-70μm的直径范围内。颗粒形式的基质可用作填充床或包括膨胀床的悬浮形式。
[0128]
在替代实施方式中,固体载体基质为膜,例如,水凝胶膜。在一些实施方式中,亲和纯化涉及作为基质的膜,一个实施方式的ig结合蛋白或ig结合结构域与膜共价结合。固体载体还可以处于盒(cartridge)中的膜的形式。
[0129]
在一些实施方式中,亲和纯化涉及含有固体载体基质的色谱柱,一个实施方式的ig结合蛋白或ig结合结构域与固体载体基质共价结合。
[0130]
向固体载体的固定。在本发明的实施方式中,ig结合蛋白或ig结合结构域缀合至固体载体。在本发明的一些实施方式中,ig结合蛋白或ig结合结构域可以在n末端和/或c末端包含另外的氨基酸残基。本发明的ig结合蛋白或ig结合结构域可以经由常规连接技术连接至适合的固体载体基质。将蛋白配体固定至固体载体的方法在本领域中是熟知的,并且本领域技术人员使用标准技术和设备易于实施方法。在一些实施方式中,连接可以是多点连接,例如经由几个赖氨酸,或单点连接,例如经由半胱氨酸。
[0131]
在一些实施方式中,碱性稳定的ig结合蛋白或ig结合结构域包含与固相(基质)共价连接的连接位点。位点特异的连接位点包含天然氨基酸,如半胱氨酸或赖氨酸,其使得能够与固相或者固相和蛋白之间的接头的反应基团发生特异性化学反应。
[0132]
在一些实施方式中,连接位点可以直接位于ig结合蛋白或ig结合结构域的c末端或n末端。在一些实施方式中,单一半胱氨酸位于用于ig结合蛋白或ig结合结构域的位点特异的固定化的c末端。具有c末端半胱氨酸的优势在于可以通过半胱氨酸硫醇与载体上的亲电基团的反应,从而导致硫醚桥连接来实现ig结合蛋白或ig结合结构域的连接。这提供了连接蛋白的优良移动性,从而提供了提高的结合能力。
[0133]
在其它实施方式中,连接位点可以位于ig结合蛋白或ig结合结构域的第三螺旋,例如位于对应于seq id no:1的位置43或位置46的位置处。
[0134]
在其它实施方式中,在n末端或c末端和连接位点之间可以存在接头。在本发明的一些实施方式中,ig结合蛋白或ig结合结构域可以包含3-20个氨基酸,优选地4-10个氨基酸的具有末端半胱氨酸的n末端或c末端氨基酸序列。用于末端连接位点的氨基酸可以选自
脯氨酸、甘氨酸、丙氨酸和丝氨酸,其在c末端具有单一半胱氨酸用于连接。
[0135]
在本发明的一些实施方式中,ig结合蛋白或ig结合结构域还可以在n末端和/或c末端包含其它氨基酸残基,如(例如)n末端的前导序列和/或位于n末端或c末端的具有或不具有标签的连接序列。
[0136]
ig结合蛋白的用途。在一个实施方式中,本发明涉及一个实施方式的ig结合蛋白或ig结合结构域或一个实施方式的亲和基质用于免疫球蛋白或其变体的亲和纯化的用途,即将本发明的ig结合蛋白或ig结合结构域用于亲和色谱。在一些实施方式中,将本发明的ig结合蛋白或ig结合结构域固定至如本发明的一个实施方式中的固体载体上。
[0137]
免疫球蛋白亲和纯化的方法。在一个实施方式中,本发明涉及免疫球蛋白亲和纯化的方法,方法包括以下步骤:
[0138]
(a)提供含有ig,如igg1、igg2、igg4、igm、iga、ig片段、fc片段或fab片段(包括融合蛋白和缀合物,如上定义)的液体(样品);
[0139]
(b)提供包含固定至亲和分离基质的如以上描述的固定ig结合蛋白或ig结合结构域的亲和分离基质;
[0140]
(c)在允许如以上描述的至少一种ig结合蛋白或ig结合结构域与ig结合的条件下,将液体与亲和分离基质接触;和
[0141]
(d)从基质洗脱ig,借此获得含有ig的洗脱液。
[0142]
在一些实施方式中,亲和纯化方法还可以在足以从亲和分离基质除去一些或全部与其非特异性结合的分子的条件下在步骤(c)和(d)之间进行的一个或多个清洗步骤。非特异性结合表示不涉及至少一种ig结合蛋白或ig结合结构域和ig之间的相互作用的任何结合。
[0143]
适合于公开的用途和方法的亲和分离基质是根据以上描述的实施方式且如本领域技术人员已知的那些基质。
[0144]
在一些实施方式中,在步骤(d)中免疫球蛋白从(包含)ig结合蛋白或ig结合结构域(的基质)的洗脱是通过ph改变和/或盐浓度改变实现的。通常,适合实施亲和纯化方法的条件对于本领域技术人员是熟知的。在一些实施方式中,公开的包含公开的ig结合蛋白或ig结合结构域的亲和纯化的用途或方法可以提供至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或者100%的含ig的蛋白在大于或等于3.7的ph(例如,约ph 4.0、约ph 4.5、约ph 5.0或约ph 5.5)下的洗脱。由于本发明的ig结合蛋白和ig结合结构域的高稳定性,ph大于或等于3.7的溶液可以用于ig蛋白的洗脱(参见实施例)。
[0145]
在一些实施方式中,在亲和纯化方法的步骤(d)中,大于95%的包含ig序列(例如,抗体)的蛋白在ph 3.7或以上(最高约ph 5.5)从包含如以上描述的固定ig结合蛋白或ig结合结构域的基质上洗脱。在一些实施方式中,优选地,通过使用碱溶液,例如,ph 13-14的碱溶液,添加用于亲和基质的有效清洗的其它步骤(e)。在某些实施方式中,清洗液包含0.1-1.0m naoh或koh,优选地0.25-0.5m naoh或koh。由于本发明的ig结合蛋白或ig结合结构域的高碱性稳定性,这种强碱性溶液可以用于清洗目的。在用碱清洗液清洗亲和纯化基质后,在一些实施方式中,如果在0.5m naoh下温育至少48h,则至少88%的ig结合蛋白或ig结合结构域具有ig结合活性。在一些实施方式中,ig结合蛋白或ig结合结构域的ig结合能力是在碱性条件下温育前的ig结合能力的至少约80%、至少约90%或100%,例如,在0.5m naoh
中温育至少20h后,通过保留的ig结合能力所确定的。
[0146]
本发明还提供了分离免疫球蛋白的方法,其包括步骤(a)将包含免疫球蛋白的液体样品与包含多种ig结合蛋白或ig结合结构域(连接至固体载体)的分离基质接触;(b)用ph在ph 3.7以上(最高至5.5)的清洗液清洗分离基质;(c)从分离基质洗脱免疫球蛋白;和(d)获得免疫球蛋白。
[0147]
核酸分子。在一个实施方式中,本发明涉及核酸分子,优选地分离的核酸分子,其编码如以上公开的ig结合蛋白或ig结合结构域。在一个实施方式中,本发明涉及包含核酸分子的载体。载体表示可以用于将蛋白编码信息转移至宿主细胞的任何分子或实体(例如,核酸、质粒、噬菌体或病毒)。在一个实施方式中,载体是表达载体。
[0148]
在一个实施方式中,本发明涉及表达系统,表达系统包含如以上公开的核酸或载体,例如,原核宿主细胞,例如,大肠杆菌(e.coli),或真核宿主,例如,酵母酿酒酵母(saccharomyces cerevisiae)或巴斯德毕赤氏酵母(pichia pastoris),或者哺乳动物细胞,如cho细胞。
[0149]
生产ig结合蛋白的方法。在一个实施方式中,本发明涉及用于生产本发明的ig结合蛋白或ig结合结构域的方法,方法包括以下步骤:(a)在适合于结合蛋白或ig结合结构域表达的条件下培养一个实施方式的宿主细胞以获得所述ig结合蛋白或ig结合结构域;和(b)可选地分离所述ig结合蛋白或ig结合结构域。适合于培养原核或真核宿主的条件对于本领域技术人员是熟知的。
[0150]
可以通过多种常规且熟知的技术中的任一种制备本发明的ig结合分子,技术如简单的有机合成策略、固相辅助合成技术或者通过可商购的自动合成仪。另一方面,它们还可以通过单独或与常规合成技术结合的常规重组技术制备。
[0151]
本发明的一个实施方式涉及制备如以上详细说明的根据本发明的ig结合蛋白或ig结合结构域的方法,方法包括以下步骤:(a)制备编码如上定义的ig结合蛋白或ig结合结构域的核酸;(b)将所述核酸引入表达载体;(c)将所述表达载体引入宿主细胞;(d)培养宿主细胞;(e)使宿主细胞经受培养条件,在培养条件下表达ig结合蛋白或ig结合结构域,借此(e)产生如以上描述的ig结合蛋白或ig结合结构域;可选地(f)分离步骤(e)中所产生的ig结合蛋白或ig结合结构域;和(g)可选地将ig结合蛋白或ig结合结构域缀合至如以上描述的固体基质。在本发明的其它实施方式中,通过无细胞体外转录/翻译进行ig结合蛋白或ig结合结构域的生产。
[0152]
实施例
[0153]
提供以下实施例以进一步说明本发明。然而,本发明并不限于此,并且以下实施例仅基于以上描述显示本发明的实用性。
[0154]
实施例1:本发明的ig结合蛋白的产生
[0155]
通过单个氨基酸残基的定点饱和突变在seq id no:1(cs26)中引入修饰。引入以下交换并分析在亲和色谱中的性质:8i、8f、8y、8w、8l、8v、6i、6y、6w、6l、4i、4f、4w、4y、4l;位置43交换为c(半胱氨酸)用于连接至基质。
[0156]
实施例2.ig结合蛋白的表达
[0157]
用编码ig结合蛋白的表达质粒(例如,203524和203550)转化bl21(de3)感受态细胞。将细胞在选择性琼脂平板(卡那霉素)上涂布并在21℃温育2天或在37℃温育过夜。将预
培养物从单一集落接种到补充有50μg/ml卡那霉素的50ml 2xyt培养基中,并在37℃,在250ml三角瓶中在常规定轨振荡器中以210rpm培养17小时。od
600
读数应在3.5-6的范围内。在1l厚壁三角瓶中,在补充有50μg/ml卡那霉素和微量元素(参见studier 2005)的300ml超富培养基(由2%葡萄糖、5%酵母提取物、0.89%甘油、0.76%乳糖、250mm mops、202mm tris、10mm mgso4、ph 7.4、消泡剂se15组成的改良的h15培养基)中,使用0.3的调整的起始od
600
,从先前的过夜培养物中接种主要培养物。将培养物转移到共振声混合器(rambio)中,并在37℃,以20
×
g温育。通过oxy-pump塞子辅助通气。通过代谢葡萄糖并随后允许乳糖进入细胞来诱导重组蛋白表达。使细胞过夜生长约18小时以达到约35-55的最终od
600
。在收获前,测量od
600
,取出调节至0.6/od
600
的样品,制粒并在-20℃下冷冻。为了收集生物质,将细胞在20℃,以12000
×
g离心20分钟。称重颗粒(湿重)。处理前将细胞储存在-20℃下。
[0158]
实施例3:ig结合蛋白的表达和溶解度的sds-page分析
[0159]
将样品在90μl的提取缓冲液(补充有0.2mg/ml的溶菌酶、0.5
×
bugbuster、6mm mgso4、6mm mgcl2、15u/ml的核酸酶的pbs)中再混悬并通过在热混合器(thermomixer)中以850rpm搅拌溶解,室温下搅拌15min,随后在-80℃下温育15min。融化后,通过离心(16000
×
g,2min,rt)将可溶性蛋白与不溶性蛋白分离。取出上清液(可溶性部分)并将颗粒(不溶性部分)在等量的脲缓冲液(8m脲、0.2m tris、20mm edta,ph 7.0)中再混悬。从可溶性和不溶性部分中取出35μl,并添加10μl的5
×
样品缓冲液以及5μl的0.5m dtt。将样品在95℃下煮沸5分钟。最后,将5μl那些样品应用于nupage novex 4-12% bis-tris sds凝胶,将其根据制造商的建议运行并用考马斯法(coomassie)染色。结果:在选择的时间段内,在优化条件下观察到高水平表达。根据sds-page,所有表达的ig结合蛋白是100%可溶的。
[0160]
实施例4:ig结合蛋白的纯化
[0161]
在大肠杆菌的可溶性部分中表达ig结合蛋白。将细胞在细胞破碎缓冲液中再混悬并通过超声细胞破碎系统(sonopuls hd 2200,bandelin)裂解。使用ph 3.0的柠檬酸缓冲液(20mm的柠檬酸,1mm edta,ph 3.0),使用系统(ge healthcare),根据生产商的说明使用iec sepharose sp-hp(ge healthcare)进行纯化步骤。通过将氯化钠浓度升高到1m以10个柱体积的线性梯度洗脱纯蛋白部分。使用ph 6.0的柠檬酸缓冲液(20mm柠檬酸,150mm nacl,1mm edta,ph 6.0),根据生产商的说明,通过尺寸排阻色谱(superdex 75)进行进一步的纯化。结果:在se-hplc后,变体8i和6l的纯度》95%,在rp hplc后》90%。
[0162]
实施例5.ig结合蛋白以高亲和力结合至igg(spr)
[0163]
用表面等离子共振(spr)运行的缓冲液平衡cm5传感器芯片(ge healthcare)。通过使edc和nhs的混合物通过以产生反应性酯基来激活表面暴露的羧基。将700-1500ru的结合配体(on-ligand)固定化在流通池上,将解离配体(off-ligand)固定化在另一个流通池上。在配体固定化后,注入乙醇胺以除去非共价结合的ig结合蛋白。一旦配体结合,蛋白分析物在表面上积累,从而提高折射率。实时测量折射率的这种变化,并作为响应或共振单位(ru)相对于时间绘图。将分析物以适合的流速(μl/min)以连续稀释的形式施加到芯片上。在每次运行后,用再生缓冲液使芯片表面再生并用运行缓冲液平衡。将对照样品应用于基质。如前进行再生和再平衡。通过使用3000(ge healthcare),在25℃下进行结合研究;数据评价通过生产商所提供的biaevaluation 3.0软件,通过使用langmuir 1:1模型(ri=0)进行。将所评价的解离常数(kd)相对于脱靶进行标准化,并且ig结合蛋白对于西妥
昔单抗(igg1)、那他珠单抗(igg4)和帕尼单抗(igg2)的kd值在表1中显示。
[0164]
表1.ig结合蛋白对igg的kd值
[0165][0166]
实施例6:ig结合蛋白连接至基于琼脂糖的色谱珠praesto
tm
pure85—连接效率、dbc10%、洗脱
[0167]
dbc10%:根据生产商的说明将纯化的ig结合蛋白连接至基于琼脂糖的色谱珠(praesto
tm
pure85,purolite;产品目录no.pr01265-164)(连接条件:ph 9.5,3小时,35℃,4.1m naso4,用乙醇胺封闭过夜)。将连接树脂装填至超紧凑型5/50柱(super compact 5/50column,gmbh)。将多克隆人igg(ocatpharm)用作igg样品(浓度2.2mg/ml)。将多克隆higg样品以饱和的量施加到包含固定ig结合蛋白的基质上。结果:与亲代变体(203447)相比,变体8i(203550)显示出稍微提高的dbc10%。
[0168]
免疫球蛋白从基质的洗脱:用100mm乙酸缓冲液,ph 3.7清洗基质,然后用0.1m磷酸ph 1.7以洗脱结合至固定化的ig结合蛋白的higg(载量:2.2mg/ml gammanorm,6min停留时间)。结果:对于所有所测试的变体,与如果固定化亲代分子时的96%的洗脱相比,大于99%的抗体洗脱(例如,d8i、d6l);参见表2。
[0169]
实施例7.连接至环氧活化的基质上的ig结合蛋白的碱性稳定性
[0170]
在室温(22℃+/-3℃)下,将柱与0.5m naoh温育0h和24h。在与0.5m naoh温育后,分析固定蛋白的ig结合活性。图2、图3和图4显示了结果。在室温下(22℃+/-3℃),将具有固定的25mg/ml变体6l(203524)和8i(203550)的praesto 85环氧树脂和对照与0.5m naoh温育50h。结果:即使在强碱溶液中超过2天后,变体8i和变体6l分别对于ig显示出94.4%和88.5%的剩余结合能力。与亲代(seq id no:3所示的稳定的ig结合蛋白;cid203447)相比,在碱处理50h后,剩余igg结合能力得到改善(对于ig,83%的剩余结合能力)。结果参见表2。
[0171]
表2.严苛稳定性和洗脱
[0172][0173]
实施例8.higg从固定化配体的洗脱
[0174]
具有ph梯度的洗脱ph的确定。将1mg/ml higg(gammanorm)在pbs ph 7.3中的溶液进样至柱;接触时间:6min。用0.1m ph 6.0的柠檬酸盐清洗柱。经由ph 6.0-2.0的ph梯度形式洗脱结合至固定化配体的higg。确定所洗脱的主要部分的ph(峰最大值)。表3显示与对于
cs26的ph 3.7的峰最大值相比,所有变体在ph 4.2至ph 5.5的范围内显示出峰最大值。
[0175]
表3.洗脱ph(梯度)
[0176][0177][0178]
高ph(ph 4.5)下的洗脱。用50mm乙酸缓冲液,ph 4.5清洗基质,然后用100mm乙酸以洗脱结合至固定化亲和配体(变体)的higg(载量:2.2mg/ml gammanorm,6min停留时间)。表4显示与cs26相比,所有配体在ph 4.5显示出显著更高的回收抗体的百分比。
[0179]
表4.洗脱回收率(%)
[0180][0181]
实施例9.seq id no:51作为igg亲和纯化的配体的鉴定
[0182]
除非在本文中提及不同的程序,否则如以上描述的进行实验。
[0183]
纯度:在rp hplc后,seq id no:51的亲和配体纯度为100%。通过220nm吸收值检测蛋白。
[0184]
对于higg1的亲和力:对于亲和配体seq id no:51的分析,将单克隆抗体西妥昔单抗(igg1)和贝利木单抗(igg1)用作靶标。seq id no:51对于igg西妥昔单抗的kd为40.8nm,并且对于igg1贝利木单抗为47.4nm。
[0185]
结合能力:通过igg1样品确定结合能力。将抗体进样至具有亲和配体seq id no:51的连接树脂,直至6min停留时间时的10%目标穿透。将所加载的抗体定量并计算为动态结合能力dbc10%。使用2.2mg/ml贝利木单抗的6min停留时间时的dbc10%与cs26相比为104.1%。
[0186]
严苛稳定性:将具有固定化的19.6mg/ml seq id no:51的praesto 85环氧树脂(在ph=10.5和2.05m na2so4下连接)与0.5m naoh在室温(22℃+/-3℃)下温育24h。即使在强碱溶液中24h后,seq id no:51显示对于ig的结合能力未降低(99%)。
[0187]
洗脱ph:如以上描述的确定峰最大值的洗脱ph。与cs26(ph 3.5)相比,seq id no:51显示出对于gammanorm和贝利木单抗的高洗脱ph(ph 5.0),参见表5。
[0188]
表5.峰最大值的洗脱。
[0189][0190]
分步洗脱:对于ph 4.8时的靶标洗脱分析了分步洗脱。在100mm磷酸cip后,在ph 1.7分析了靶标(gammanorm或贝利木单抗)从配体(seq id no:51)的残余洗脱(回收)。在ph 4.8,靶标蛋白接近从seq id no:51配体完全洗脱,参见表6。
[0191]
表6.与ph 1.7相比,ph 4.8时的靶标洗脱
[0192]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1