多特异性免疫调节剂的制作方法
1.本发明涉及多特异性和双特异性tnf超家族融合蛋白组装体,其包含至少(i)一种包含单链tnf超家族受体结合结构域的蛋白质部分和(ii)能够特异性结合细胞表面抗原或免疫调节蛋白的蛋白质部分。在优选实施方案中,第一(i)和第二(ii)蛋白质部分通过杵入臼结构(knob-into-hole)fc融合蛋白技术(us 5,731,168;us 7,695,936)连接。本发明进一步涉及核酸和转染的宿主细胞用于生产多特异性tnf超家族融合蛋白组装体。
背景技术:
2.免疫系统的各种功能通过刺激和抑制信号的复杂且微妙的平衡相互作用来协调。免疫细胞功能的许多关键调节因子属于所谓的肿瘤坏死因子超家族(tnfsf)及其同源受体(所谓的tnf受体超家族)。tnfsf由19种结构相关的配体组成,每一种与tnf受体超家族的29个成员中的一个或多个结合。
3.tnfsf受体在抗肿瘤免疫应答和炎症过程的调节中非常重要。它们由多种免疫细胞表达,包括t细胞和抗原呈递细胞群体,例如树突状细胞和巨噬细胞,以及由肿瘤细胞其自身表达。这种不同的表达模式突出了tnfsf受体在身体的许多部分中以及在抗肿瘤免疫应答的不同阶段中发挥的关键作用。
4.wo 2010/010051公开了作为单个单链融合蛋白的三价蛋白质部分。所述融合蛋白包含由基于短(3-8个)氨基酸的接头连接的三个可溶的、柄缺失(stalk depleted)的tnf超家族(tnfsf)受体结合结构域。它们基本上是非聚集性的并且非常适合于治疗应用。在wo 2015/164588、wo 2016/177771、wo 2017/068183、wo 2017/068180、wo 2017/068185、wo 2017/072080和wo 2017/068192(所有前述专利申请的内容通过引用以其整体并入本文)中公开了具有降低的免疫原性和改变的稳定性的其它三价单链tnfsf受体结合结构域。
技术实现要素:
5.尽管已经公开了三价tnfsf蛋白质部分,但仍需要其特异性靶向构建体。此类靶向构建体将允许局部增强或局部富集tnf受体超家族(tnfrsf)激动活性。因此,本发明的一个目的是提供多功能和双功能融合蛋白,其包含用于组织或细胞靶向或活性调节的至少两种不同的三价tnfsf蛋白质部分或三价tnfsf蛋白质部分和特异性抗原结合部分。
6.本发明进一步涉及编码如本文所述的融合蛋白的核酸分子,以及用如本文所述的核酸分子转化或转染的细胞或非人生物体。
7.本发明还涉及药物或诊断组合物,其包含如本文所述的多特异性融合蛋白、核酸分子或细胞作为活性剂。
8.本发明还涉及如本文所述的多特异性融合蛋白、核酸分子或细胞用于治疗的用途,例如,如本文所述的融合蛋白、核酸分子或细胞用于制备药物组合物的用途,所述药物组合物用于预防和/或治疗由tnfsf细胞因子功能障碍引起的、与之相关的和/或伴随的病症,特别是增殖性病症,诸如肿瘤,例如实体瘤或淋巴肿瘤;传染性疾病;炎性疾病;代谢性
疾病;自身免疫性病症,例如类风湿性和/或关节炎疾病;退行性疾病,例如神经退行性疾病如多发性硬化;细胞凋亡相关疾病或移植排斥。
附图说明
9.图1双特异性fab-fc/sctnfsf-rbd-fc异聚融合蛋白(所谓的单臂-双特异性或sab蛋白)的示意图。三价sctnfsf-rbd-fc和fab-fc的异二聚化是基于相应fc-部分的野生型或特异性ch3-结构域变体。
10.图2双特异性、六价sctnfsf配体的示意图。两个三价sctnfsf-rbd-fc融合蛋白的异二聚化是基于ch3结构域。这可以通过相应fc-部分的野生型或特异性ch3-结构域变体实现。
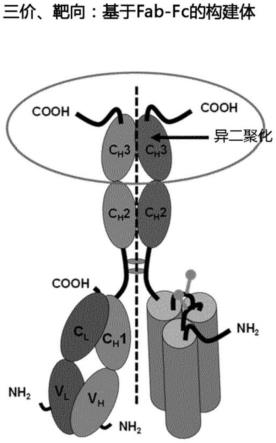
11.图3双特异性、三价靶向构建体的示意图;构建体是基于fab重链部分与三价sctnfsf-rbd的直接或接头介导的融合体。
12.图4gitr激动剂的细胞体外活性以gitr荧光素酶报告基因检测示出。apdl1-scgitrl-sab示出显著的gitr激动,其与scgitrl-fc相比较低。
13.图5gitr激动剂的细胞体外活性以gitr荧光素酶报告基因检测示出。apdl1-scgitrl-sab示出显著的gitr激动,其与scgitrl-fc相比较低,与apdl1-scgitrl(三价)相比较高。
14.图6gitr激动剂的细胞体外活性以gitr荧光素酶报告基因检测示出。apdl1-scgitrl-sab示出显著的gitr激动,其与apdl1-scgitrl(三价)相比较高。通过与抗人fc(x-连接)交联,两种化合物的活性明显增强。
15.图7pd-l1抑制剂的细胞体外活性以pdl1荧光素酶报告基因检测示出。apdl1-scgitrl-sab示出显著的pdl1抑制,其与apdl1-mab相比在相似的范围内。
16.图8pd-l1抑制剂的细胞体外活性以pdl1荧光素酶报告基因检测示出。apdl1-sccd27l-sab示出显著的pdl1抑制,其与apdl1-mab相比在相似的范围内。
17.图9pdl1抑制剂的细胞体外活性以pdl1荧光素酶报告基因检测示出。apdl1-sccd40l-sab示出显著的pdl1抑制,其与apdl1-mab相比在相似的范围内。
18.图10pdl1抑制剂的细胞体外活性以pdl1荧光素酶报告基因检测示出。apdl1-sccd40l和apdl1-sccd40l-fc示出显著的pdl1抑制,其与apdl1-mab相比在相似的范围内。
19.图11pdl1抑制剂的细胞体外活性以pdl1荧光素酶报告基因检测示出。apdl1-sccd40l-fc示出显著的pdl1抑制,其与apdl1-mab相比在相似的范围内。
20.图12pd-l1抑制剂的细胞体外活性以pdl1荧光素酶报告基因检测示出。apdl1-sccd40l-sab和apdl1-sccd40l示出显著的pdl1抑制,其与apdl1-mab相比在相似的范围内。
21.图13cd95l抑制剂的体外活性通过评估cd95l-诱导的细胞凋亡的拮抗以jurkat a3细胞检测示出。细胞凋亡抑制与半胱天冬酶3/7活性的降低并行。acd95l-sccd40l、acd95l-mab和acd95l-sccd40l-fc示出在相似的范围内的显著的细胞凋亡抑制。acd95l-mab和acd95l-sccd40l-fc比acd95l-sccd40l活性高一点。
22.图14cd95l抑制剂的体外活性通过评估cd95l-诱导的细胞凋亡的拮抗以jurkat a3细胞检测示出。细胞凋亡抑制与半胱天冬酶3/7活性的降低并行。acd95l-sccd40l和acd95l-mab示出在相似范围内的显著的细胞凋亡抑制。acd95l-mab比acd95l-sccd40l活性
高一点。
23.图15cd27激动剂的细胞体外活性以cd27荧光素酶报告基因检测示出。apdl1-sccd27l-sab示出轻微的cd27激动,其通过与抗人fc(x-连接)交联明显增强。sccd27l-fc活性较高并且可以通过与抗人fc(x-连接)交联进一步增强。
24.图16cd40激动剂的细胞体外活性以cd40荧光素酶报告基因检测示出。三聚体cd40l和三聚体cd40l(stab)[stab=稳定化]在该检测中示出基础活性。apdl1-sccd40l-sab和apdl1-sccd40l示出明显较高的cd40激动,这表明pdl1-靶向对cd40激动活性的贡献。该发现由acd95l-sccd40l(该化合物靶向cd95l而不是pd-l1)的较低活性证实。
[0025]
图17cd40激动剂的细胞体外活性以cd40荧光素酶报告基因检测示出。三聚体cd40l在该检测中示出基础活性。相比之下,acd95l-sccd40l示出较高的cd40激动。
[0026]
图18cd40激动剂的细胞体外活性以cd40荧光素酶报告基因检测示出。sccd40l-fc、apdl1-sccd40l-sab和apdl1-sccd40l-fc示出明显的cd40激动,其可通过与抗人fc(x-连接)交联明显增强。六价cd40l-形式sccd40l-fc和apdl1-sccd40l-fc显示比三价cd40l-形式apdl1-sccd40l-sab高的激动活性。
[0027]
图19cd40激动剂的细胞体外活性以cd40荧光素酶报告基因检测示出。sccd40l-fc、apdl1-sccd40l和三聚体cd40l(stab)示出明显的cd40激动,其可通过与strepmab immo(x-连接)交联明显增强。六价cd40l-形式sccd40l-fc示出比三价cd40l-形式apdl1-sccd40l高的激动活性,两种形式的活性都明显高于三聚体cd40l(stab)[stab=稳定化]。
[0028]
图20cd40激动剂的细胞体外活性以cd40荧光素酶报告基因检测示出。将恒定浓度(如所示)的cd40激动剂与浓度增加直至100μg/ml的apdl1-mab一起孵育。如所预期的,sccd40l-fc的cd40激动不受apdl1-mab竞争的影响,这是由于该分子不包含pdl1-靶向结构域。相比之下,apdl1-sccd40l-sab和apdl1-sccd40l示出随着竞争性apdl1-mab的浓度的增加而明显降低的cd40激动。总之,apdl1-sccd40l-sab和apdl1-sccd40l的pd-l1-靶向结构域明显有助于它们的cd40激动活性。
[0029]
图21cd40激动剂的细胞体外活性以cd40荧光素酶报告基因检测示出。将恒定浓度(如所示)的cd40激动剂与浓度增加直至100μg/ml的apdl1-mab一起孵育。如所预期的,sccd40l-fc的cd40激动不受apdl1-mab竞争的影响,这是由于该分子不包含a pdl1-靶向结构域。相比之下,apdl1-sccd40l-sab示出随着竞争性apdl1-mab的浓度的增加而明显降低的cd40激动。总之,apdl1-sccd40l-sab的pdl1-靶向结构域明显有助于其cd40激动活性。
[0030]
图22elisa阐释了cea靶向构建体与cea的结合。acea-fab、acea-sccd40l和acea-sccd40l-fc与人cea以剂量依赖性方式结合。acea-fab和acea-sccd40l-fc的结合与acea-sccd40l的结合相当并且明显更强。
[0031]
图23elisa阐释了cea靶向构建体与cea的结合。acea-fab和acea-sccd40l与人cea以剂量依赖性方式结合。acea-fab的结合比acea-sccd40l的结合明显更强。
[0032]
图24描绘了非常适合于本发明的第一、第二和第三方面的多特异性和双特异性tnf超家族融合蛋白组装体的示例性sctnf rbd序列。
[0033]
图25双特异性、三价靶向构建体的示意图;构建体是基于一个(a)或两个(b)单-结构域抗体部分(vhh)与三价sctnfsf-rbd的直接或接头介导的融合体。
[0034]
图26双特异性vhh-fc/sctnfsf-rbd-fc异聚融合蛋白(所谓的单臂双特异性(sab)
蛋白,基于一个(a)或两个(b)单-结构域抗体部分(vhh))的示意图。三价sctnfsf-rbd-fc和vhh-fc的异二聚化是基于相应fc-部分的野生型或特异性ch3-结构域变体。
[0035]
图27双特异性scfv-fc/sctnfsf-rbd-fc异聚融合蛋白(所谓的单臂双特异性(sab)蛋白,基于scfv抗体片段)的示意图。三价sctnfsf-rbd-fc和scfv-fc的异二聚化是基于相应fc-部分的野生型或特异性ch3-结构域变体。
[0036]
图28双特异性、六价靶向fab-sctnfsf-rbd-fc融合蛋白的示意图。构建体是基于fab结构域与三价sctnfsf-rbd-fc的直接融合,以及随后的fab-sctnfsf-rbd-fc经由fc结构域如apdl1-sccd40l-fc的同二聚化。
[0037]
图29cd137激动剂的细胞体外活性以cd137荧光素酶报告基因检测示出。sccd137l-fc(a)和乌瑞芦单抗(urelumab)(b)与ht1080细胞的细胞交联示出中度的活性增加,而非靶向对照acd95l-sccd137l-sab(c)未示出相关的活性增加。d apdl1-sccd137l-sab示出轻微的cd137激动,其通过与ht1080细胞(99%的ht1080细胞确实表达pd-l1)的交联而大幅增强。峰值活性比六价sccd137l-fc所观察到的活性高约16倍(参见a)。
[0038]
图30cd27激动剂的细胞体外活性以cd27荧光素酶报告基因检测示出。非靶向对照acd95l-sccd27l-sab与mda-mb231细胞的细胞交联未示出活性增加。b apdl1-sccd27l-sab示出轻微的cd27激动,其通过与mda-mb231细胞(99%的mda-mb231细胞确实表达pd-l1)的交联而大幅增强。峰值活性比六价sccd27l-fc所观察到的活性高约3倍(参见a)。
[0039]
图31天然人t细胞活化检测。染色强度随着每个细胞分裂而降低,即,未分裂的细胞对于tag it violet染色是最阳性的。天然pan t细胞分离自人pbmc。第0天用1μg/ml包被的抗-cd3(okt3)刺激和添加培养基或100ng/ml apdl1-sccd137l-sab或100ng/ml acd95l-sccd137l-sab。第5天流式细胞术。双特异性分子apdl1-sccd137l-sab和acd95l-sccd137l-sab,在抗-cd3刺激(24.6和25.2%增殖vs.16.0%增殖(对于单独的cd3刺激))的存在下,导致相似的t细胞增殖。
[0040]
图32采用试剂盒(stem cell)从来自健康人供体的血沉棕黄层(buffy coats)分离单核细胞。通过添加50ng/ml gm-csf 3天、接着50ng/ml gm-csf+50ng/ml il-4另外3天,实现单核细胞的分化。然后用100ng/ml的指定化合物处理细胞24h,接着流式细胞术评估cd86和cd83表达。
[0041]
三价sccd40l与抗pd-l1抗体片段结合的双特异性分子apdl1-sccd40l-sab是最有效的树突细胞激活剂,激活水平(cd86+/cd83+)为88.31%。因此,将两个部分结合在一个分子中远比将这些部分作为两个单独的分子即apd-l1抗体+cd40l(三聚体)(示出仅39.48%的活化水平)添加更有效。acd40和cd40l(三聚体)均示出中等水平的活性(40.59%和46.10%),而apd-l1具有与培养基对照相同的活性。
[0042]
图33采用试剂盒(stem cell)从来自健康人供体的血沉棕黄层分离单核细胞。通过添加50ng/ml gm-csf 3天、接着50ng/ml gm-csf+50ng/ml il-4另外3天,实现单核细胞的分化。然后用100ng/ml的指定化合物处理细胞24h,接着流式细胞术评估cd86和cd83表达。
[0043]
三价sccd40l与抗pd-l1抗体片段结合的双特异性分子是非常有效的树突细胞激活剂,激活水平(cd86+/cd83+)与sccd40l-fc相似:对于apdl1-sccd40l-sab为73.00%,对于apdl1-sccd40l(三价)为87.18%和对于apdl1-sccd40l-fc为96.12%(图28中示出的形
式)。相比之下,由于单核细胞上缺乏cd95l表达,靶向cd95l而不是pd-l1的双特异性分子acd95l-sccd40l-sab仅具有中等水平的活化。低活化水平还见于acd40和cd40l(三聚体)。
[0044]
图34gitr激动剂的细胞体外活性以gitr荧光素酶报告基因检测示出。apdl1-scgitrl示出显著的gitr激动,其与scgitrl-fc相比较低。三价gitr激动剂apdl1-scgitrl的活性通过与抗人fc(x-连接)的交联而明显增强至六价gitr激动剂scgitrl-fc所观察到的水平。
具体实施方式
[0045]
定义
[0046]
二聚体形成:本文所用,二聚化是指折叠的肽链能够与折叠的第二条多肽链形成稳定结构,并且在多肽链中实现的某些二聚化结构域执行该过程。二聚体形成发生于两条多肽的每一条中存在的这些特定结构域之间。二聚化结构域的实例是本领域众所周知的。在天然人iga-、igd-和igg抗体中,ch3结构域是重链的二聚化的驱动力。在天然ige或igm抗体中,ch4结构域在结构和功能上等同于igg-ch3结构域,执行其重链二聚化。ch3结构域或它们的等同物仅对其自身具有选择性。这意味着,由于ch3/ch3二聚体形成,天然地或通过工程化方法包含功能性ch3结构域的任何多肽能够与包含功能性ch3结构域的第二多肽形成二聚体。
[0047]
两条含ch3结构域的多肽异二聚化为功能性双特异性融合蛋白是通过在合适的宿主细胞中共表达两条多肽来实现的,确保在蛋白质折叠过程中同时存在两条链。宿主细胞中的蛋白质合成过程中,将形成本多肽链的任何ch3结构域组合:异二聚体以及同二聚体。所需的异二聚体蛋白产物需要通过合适的层析法程序在以后进行纯化。含ch3的多肽的共表达方法和异二聚体产物的后续纯化概念是本领域众所周知的。所用的ch3结构域可为野生型、或者它们可以包含稳定化某些组装体的点突变,例如如carter等人所述(merchant,a.,zhu,z.,yuan,j.等人.an efficient route to human bispecific igg.nat biotechnol 16,677
–
681(1998).https://doi.org/10.1038/nbt0798-677)。为了产生本发明的多特异性免疫调节剂,高度优选使用ch3结构域衍生的二聚化技术。在优选实施方案中,在两条融合蛋白多肽中实现的ch3结构域是天然存在的序列。在优选实施方案中,ch3结构域包含点突变,这旨在稳定当前的二聚化产物。高度优选的是,稳定化突变导致两条多肽的共价连接,例如通过当前组装体的ch3-结构域之间的胱氨酸,从而抑制ch3-结构域解离。因此,减少了生产过程中纯化的异二聚体产物的链间交换反应和随后的多聚体和/或同二聚体形成。在优选实施方案中,ch3结构域包含在蛋白质表达过程中优先导致异二聚体形成的点突变,例如杵入臼结构(kih)技术。除了kih技术以外,还开发了其它更近期的产生基于ch3的异二聚化结构域的技术,采用静电转向(electrostatic steering)或免疫球蛋白结构域界面交换或两者的组合。本领域中存在的基础技术描述于skegro等人.j biol chem.2017jun9;292(23):9745-9759),gunasekaran等人.j biol chem.2010jun18;285(25):19637-46,sampei等人.plos one.2013;8(2):e57479,von kreudenstein等人.mabs.2013sep-oct;5(5):646-54,davis等人.protein eng des sel.2010apr;23(4):195-202。
[0048]
抗体:术语“全长抗体”、“完整抗体”、“全抗体”和“天然抗体”在本文中可交换地使
用,是指具有与天然抗体结构基本相似的结构的抗体。“天然抗体”是指具有不同结构的天然存在的免疫球蛋白分子。例如,天然igg类抗体是约150,000道尔顿的异源四聚糖蛋白,由二硫键连接的两条轻链和两条重链构成。从n末端至c末端,每条重链具有可变区(vh),也称为可变重结构域或重链可变结构域,接着是三个恒定结构域(ch1、ch2和ch3),也称为重链恒定区。如本文所用,本发明的上下文中所用的典型igg衍生的恒定重链结构域是seq-id:28、seq-id:29、seq-id:30、seq-id:31、seq-id:111、seq-id:112,它们都被定义为根据eu编号以ala118开始。如本文所用,本发明的上下文中所用的典型igg衍生的ch1结构域是seq-id:27,clκ是seq-id:26。ch1和ch2结构域通过铰链区连接,所述铰链区通过半胱氨酸桥来稳定抗体。类似地,从n末端至c末端,每条轻链具有可变区(vl),也称为可变轻结构域或轻链可变结构域,然后是轻链恒定结构域(cl),也称为轻链恒定区。抗体的重链可属于五种类型之一,称为α(iga)、δ(igd)、ε(ige)、γ(igg)、或μ(igm),其中一些可进一步分为亚型,例如γ1(igg1)、γ2(igg2)、γ3(igg3)、γ4(igg4)、α1(iga1)和α2(iga2)。抗体的轻链可属于两种类型之一,称为卡帕(κ)和拉姆达(λ)。此外,可以工程化包含λvl和κcl的杂合轻链形式,反之亦然。在优选的实施方案中,轻链是基于κlc或由vlλ/clκ构成的杂合lc,以改善溶解度和更快的折叠动力学。如本文所用,本发明的上下文中所用的典型clκ结构域是seq-id:26。
[0049]
抗体片段:“抗体片段”是指除了完整抗体以外的分子,其包含与完整抗体所结合的抗原结合的一部分完整抗体。抗体片段的实例包括但不限于fv、fab、fab
′
、fab
′‑
sh、f(ab
′
)2;双抗体、三抗体(triabodies)、四抗体(tetrabodies)、交叉fab片段;线性抗体;单链抗体分子(例如scfv);和单结构域抗体(例如vhh)。对于某些抗体片段的综述,参见hudson等人,nat med 9,129-134(2003)。对于scfv片段的综述,参见,例如pl
ü
ckthun,in the pharmacology of monoclonal antibodies,vol.113,rosenburg and moore eds.,springer-verlag,new york,pp.269-315(1994);也参见wo 93/16185;和美国专利号5,571,894和5,587,458。双抗体是具有两个抗原结合位点的抗体片段,可为二价或双特异性的,参见,例如,ep 404,097;wo 1993/01161;hudson等人,nat med 9,129-134(2003);和hollinger等人,proc natl acad sci usa 90,6444-6448(1993)。三抗体和四抗体也描述于hudson等人,nat med 9,129-134(2003)。对于基于双特异性抗体片段的构建体的综述,参见,brinkmann u,kontermann re.mabs.2017feb/mar;9(2):182-212。单结构域抗体是包含抗体的全部或一部分的重链可变结构域或全部或一部分的轻链可变结构域的抗体片段。第一单结构域抗体源自来自骆驼科动物的抗体重链的可变结构域(纳米抗体或vhh片段)。此外,术语单结构域抗体包括源自鲨鱼的自主人重链可变结构域(avh)或vnar片段。在某些实施方案中,单结构域抗体是人单结构域抗体(domantis,inc.,waltham,mass.;参见,例如美国专利号6,248,516b1)。制备抗体片段的方法为本领域技术人员所熟悉的。广泛使用的方法包括蛋白水解消化或在宿主细胞中重组生产。抗体和抗体片段的制备方法的非限制性综述示于us20160200833a1。
[0050]
fab片段和scfv片段:术语“fab片段”指包含由轻链的vl结构域和恒定结构域(cl)构成的轻链片段、和重链的vh结构域和第一恒定结构域(ch1)的抗体片段。ch1和cl结构域可以包含野生型序列或用于改善连接的点突变(ch1:l128f,eu编号)。
[0051]“单链可变片段(scfv)”是抗体重链(vh)和轻链(cl)的可变区的融合蛋白,由10至
约25个氨基酸的短接头肽连接。所述接头通常富含甘氨酸以获得柔性,富含丝氨酸或苏氨酸以获得溶解性,并且可使vh的n末端与vl的c末端连接,反之亦然。尽管去除了恒定区并引入了接头,这种蛋白质仍保留了原始抗体的特异性。scfv抗体例如描述于houston,j.s.,methods in enzymol.203(1991)46-96)。
[0052]
tnf-sf:术语“tnf配体家族成员”或“tnf家族配体”或“tnf超家族”(tnf-sf)指促炎细胞因子。通常,细胞因子,特别是tnf配体超家族的成员,在免疫系统的刺激和协调中起到至关重要的作用。目前,基于序列、功能和结构相似性,已将19种细胞因子鉴定为tnf(肿瘤坏死因子)配体超家族的成员。所有这些配体是ii型跨膜蛋白,具有c末端胞外结构域(胞外域)、n末端胞内结构域和单个跨膜结构域。tnf-sf胞外域包括柄区和位于c末端的序列,称为tnf同源结构域(thd),其在超家族成员之间具有20-30%的氨基酸同一性。tnf胞外域的c末端部分也负责tnf配体以形成被其特异性受体识别的三聚体复合物。这些三聚体复合物是有结合能力的结构(binding competent structure),因为受体结合发生在所谓的tnf-sf受体结合结构域(rbd)的原聚体(protomer)界面处。换言之:三个单独的tnf-sf多肽的c末端区形成功能单元,并且三聚体形成是人tnf-sf成员的适当受体募集的结构前提。
[0053]
fc结构域:本文中的术语“fc结构域”或“fc区”用于定义包含至少一部分的恒定区的抗体重链的c末端区。该术语包括天然序列fc区和变体fc区。igg fc区包含igg ch2和igg ch3结构域。然而,如本文经常使用的,fc从氨基酸残基p230延伸至氨基酸k447(ch2:230-340,ch3:341-447)。人igg fc区的“ch2结构域”通常从约位置231处的氨基酸残基延伸至约位置340处的氨基酸残基。在一个实施方案中,糖链附接至ch2结构域。本文中的ch2结构域可以是天然序列ch2结构域或变体ch2结构域。ch2结构域的位置n297位在天然序列中被糖基化,并且是fc受体结合所需的。在一个实施方案中,n297处的突变消除了fc受体结合。“ch3结构域”包含fc区中c末端至ch2结构域的残基的延伸(即从igg的约位置341处的氨基酸残基至约位置447处的氨基酸残基)。本文中的ch3区可以是天然序列ch3结构域或变体ch3结构域(例如在其一条链中具有引入的“突起”(“杵”)并在其另一条链中具有相应地引入的“空腔”(“臼”)的ch3结构域;参见美国专利号5,821,333,通过引用明确地并入本文)。此类变体ch3结构域可用于促进如本文所述的两条不同的抗体重链的异二聚化。在一个实施方案中,人igg重链fc区从重链的cys226或从pro230延伸至羧基末端。然而,可能存在或也可能不存在fc区的c末端赖氨酸(lys447)。除非本文另有说明,否则fc区或恒定区中的氨基酸残基的编号是根据eu编号系统,也称为eu索引,如edelman,g.m.等人,proc.natl.acad.usa,63,78-85(1969)中所述。
[0054]“杵臼结构”技术描述于例如美国专利号5,731,168;美国专利号7,695,936。通常,所述方法涉及在第一条多肽的界面处引入一个突起(“杵”)并在第二条多肽的界面中引入相应的空腔(“臼”),使得突起可以置于空腔中,从而促进异二聚体形成并阻碍同二聚体形成。通过用较大的侧链(例如酪氨酸或色氨酸)替代来自第一条多肽的界面的小氨基酸侧链来构建突起。通过用较小的氨基酸侧链(例如丙氨酸或苏氨酸)替代大的氨基酸侧链而在第二条多肽的界面中产生与突起相同或类似大小的补偿性空腔。通过改变编码多肽的核酸,例如通过定点诱变,或通过肽合成,可以形成突起和空腔。在一个具体实施方案中,杵修饰包括fc结构域的两个亚基之一中的氨基酸取代t366w,臼修饰包括fc结构域的两个亚基中的另一者中的氨基酸取代t366s、l368a和y407v。在其它具体实施方案中,包含杵修饰的fc
结构域的亚基额外地包含氨基酸取代s354c,包含臼修饰的fc结构域的亚基额外地包含氨基酸取代y349c。这两个半胱氨酸残基的引入导致fc区的两个亚基之间形成二硫键,从而进一步稳定化二聚体(carter,j immunol methods 248,7-15(2001))。编号是根据eu编号。如本文所用,本发明的上下文中所用的典型igg衍生的fc结构域为seq-id:20、seq-id:21、seq-id:22、seq-id:23、seq-id:24、seq-id:25、seq-id:20、seq-id:109和seq-id:110,它们都被定义为根据eu编号以pro230开始。
[0055]“相当于免疫球蛋白的fc区的区域”旨在包括免疫球蛋白的fc区的天然存在的等位基因变体(例如d356e/l358m)以及具有产生取代、添加、或缺失但不会显著降低免疫球蛋白介导效应子功能的能力(例如抗体依赖性细胞毒性)的变化的变体。例如,可以从免疫球蛋白的fc区的n末端或c末端删除一个或多个氨基酸,而基本上不丧失生物学功能。可以根据本领域已知的一般规则选择此类变体,以便对活性具有最小的影响(参见,例如,bowie,j.u.等人,science 247:1306-10(1990))。
[0056]
如本文所用,对于上述提及的三价非聚集tnf-sf受体结合结构域,同义地使用术语单链tnf-sf受体结合结构域、单链tnfsf受体结合结构域以及tnf-sf rbd和tnfsf rbd。此外,当提及所述受体结合结构域时,词语
‘
单链’通常缩写为
‘
sc’,例如sctnfsf-rbd。
[0057]
如本文所用,具有抗pd-l1特异性的抗pd-l1抗体或抗体片段通常被称为“apdl1”或“apd-l1”抗体或相应的抗体片段。对于其它抗体特异性也是如此;例如,对于抗cd95l,也使用acd95l,并且对于抗cea,也使用acea。
[0058]
在本说明书中,本发明的第一方面的蛋白组装体被称为“单臂双特异性”或sabs。
[0059]
此外,特别是在命名本发明的分子或蛋白组装体时,术语抗体通常缩写为“ab”或“ab”。
[0060]
此外,术语“异聚融合蛋白”和“异聚蛋白组装体”或“蛋白组装体”可交换地使用。
[0061]
实施方案
[0062]
根据本发明,多特异性tnf超家族融合蛋白组装体至少包含(i)一种包含单链tnf超家族受体结合结构域的蛋白质部分和(ii)能够特异性结合细胞表面抗原或活性调节效应子的蛋白质部分。
[0063]
在本发明的第一方面中,双特异性tnf超家族融合蛋白组装体至少包含
[0064]
(a)单链tnf-sf受体结合结构域,其融合至
[0065]
(b)第一肽接头,其融合至
[0066]
(c)第一(异)二聚化结构域,和
[0067]
(d)抗原结合或相互作用蛋白质部分,其融合至
[0068]
(e)第二肽接头,其融合至
[0069]
(f)第二(异)二聚化结构域。
[0070]
图1给出了本发明的第一方面的多特异性tnf超家族融合蛋白组装体的总体概述。
[0071]
如图1所示,本发明的典型多特异性免疫调节剂是一种蛋白质单元,其一侧包含igg抗体衍生的重链和轻链组装体,另一侧包含三价单链tnfsf-rbd-fc融合多肽。蛋白质单元的两半的异二聚化由ch3结构域执行,并由铰链链间半胱氨酸额外稳定化。三条多肽链的共表达和正确组装是形成这种功能性双特异性蛋白质单元所必需的。这种融合蛋白形式称为ab-sctnfsf-sab(sab=单臂双特异性)。
lc)和seq-id:46(acd95l-hc-rf-臼)。
[0080]
在一个优选实施方案中,ab-sctnfsf-sab多特异性免疫调节剂将抗cd95l(acd95l)靶向与cd27激动相结合。这种特异性组装体称为acd95l-sccd27l-sab。一个非限制性实例包含作为成熟蛋白质的多肽seq-id:39(sccd27l-fc-杵_b)、seq-id:47(acd95l-lc)和seq-id:46(acd95l-hc-rf-臼)。一个进一步优选的实施方案使用tnfsf模块seq-id:119(sccd27l-v2-rbd)。
[0081]
在一个优选实施方案中,ab-sctnfsf-sab多特异性免疫调节剂将抗cd95l靶向与gitr激动相结合。这种特异性组装体称为acd95l-scgitrl-sab。一个非限制性实例包含作为成熟蛋白质的多肽seq-id:41(scgitrl-fc-杵_b)、seq-id:47(acd95l-lc)和seq-id:46(acd95l-hc-rf-臼)。
[0082]
在一个优选实施方案中,ab-sctnfsf-sab多特异性免疫调节剂将抗cd95l靶向与cd137激动相结合。这种特异性组装体称为acd95l-sccd137l-sab。非限制性实例包含作为成熟蛋白质的多肽seq-id:86(sccd137l-v1-fc-杵_b)或seq-id:90(sccd137l-v2-fc-杵_b)或seq-id:94(sccd137l-v3-fc-杵_b)结合有seq-id:47(acd95l-lc)和seq-id:46(acd95l-hc-rf-臼)。一个进一步优选的实施方案使用tnfsf模块seq-id:107(sccd137l-v4-rbd)或seq-id:108(sccd137l-v5-rbd)。
[0083]
在一个优选实施方案中,ab-sctnfsf-sab多特异性免疫调节剂将抗cd95l靶向与hvem/ltbr激动相结合。这种特异性组装体称为acd95l-sclight-sab。一个非限制性实例包含作为成熟蛋白质的多肽seq-id:98(sclight-fc-杵_b)、seq-id:47(acd95l-lc)和seq-id:46(acd95l-hc-rf-臼)。
[0084]
在一个优选实施方案中,上述cd95l特异性ab-sctnfsf-sab(sab=单臂双特异性)多特异性免疫调节剂(acd95l-sccd40l-sab、acd95l-sccd27l-sab、acd95l-scgitrl-sab、acd95l-sccd137l-sab、acd95l-sclight-sab)包含相同的抗原特异性序列(acd95l抗体的vhch和vlcl)和相同的三价sctnfsf模块,但在其fc部分包含不同的ch3结构域序列。ch3结构域可以是突变的或可以是野生型的,但仍然能够与其对应物形成二聚体,引导结构组装,如图1所示。igg衍生的ch3结构域的非限制性实例表示为seq-id:44、seq-id:45、seq-id:48、seq-id:49、seq-id:52、seq-id:53、seq-id:28、seq-id:29、seq-id:30、seq-id:31、seq-id:111、seq-id:112、seq-id:20、seq-id:21、seq-id:22、seq-id:23、seq-id:24、seq-id:25、seq-id:109、seq-id:110的部分。
[0085]
使用上述acd95l特异性、单臂双特异性免疫调节剂的实例,对于本领域技术人员显而易见的是,这种设计可以容易地与如图24所示的sctnfsf rbd、或其变体结合,以进一步构建具有cd40l、gitrl、ox40l、light、tl1a、cd137l、cd27l或trail作为第二特异性结合靶标的acd95l-sab。
[0086]
在一个优选实施方案中,ab-sctnfsf-sab多特异性免疫调节剂将抗cea(acea)靶向与cd40激动相结合。这种特异性组装体称为acea-sccd40l-sab。一个非限制性实例包含作为成熟蛋白质的多肽seq-id:33(sccd40l-fc-杵_b)、seq-id:51(acea-lc)和seq-id:50(acea-hc-rf-臼)。
[0087]
在一个优选实施方案中,ab-sctnfsf-sab多特异性免疫调节剂将抗cea(acea)靶向与cd27激动相结合。这种特异性组装体称为acea-sccd27l-sab。一个非限制性实例包含
作为成熟蛋白质的多肽seq-id:39(sccd27l-fc-杵_b)、seq-id:51(acea-lc)和seq-id:50(acea-hc-rf-臼)。一个进一步优选的实施方案使用tnfsf模块seq-id:119(sccd27l-v2-rbd)。
[0088]
在一个优选实施方案中,ab-sctnfsf-sab多特异性免疫调节剂将抗cea靶向与gitr激动相结合。这种特异性组装体称为acea-scgitrl-sab。一个非限制性实例包含作为成熟蛋白质的多肽seq-id:41(scgitrl-fc-杵_b)、seq-id:51(acea-lc)和seq-id:50(acea-hc-rf-臼)。
[0089]
在一个优选实施方案中,ab-sctnfsf-sab多特异性免疫调节剂将抗cea靶向与cd137激动相结合。这种特异性组装体称为acea-sccd137l-sab。非限制性实例包含作为成熟蛋白质的多肽seq-id:86(sccd137l-v1-fc-杵_b)或seq-id:90(sccd137l-v2-fc-杵_b)或seq-id:94(sccd137l-v3-fc-杵_b)结合有seq-id:51(acea-lc)和seq-id:50(acea-hc-rf-臼)。一个进一步优选的实施方案使用tnfsf模块seq-id:107(sccd137l-v4-rbd)或seq-id:108(sccd137l-v5-rbd)。
[0090]
在一个优选实施方案中,ab-sctnfsf-sab多特异性免疫调节剂将抗cea靶向与hvem/ltbr激动相结合。这种特异性组装体称为acea-sclight-sab。一个非限制性实例包含作为成熟蛋白质的多肽seq-id:98(sclight-fc-杵_b)、seq-id:51(acea-lc)和seq-id:50(acea-hc-rf-臼)。
[0091]
在一个优选实施方案中,上述cea特异性ab-sctnfsf-sab(sab=单臂双特异性)多特异性免疫调节剂(acea-sccd40l-sab、acea-sccd27l-sab、acea-scgitrl-sab、acea-sccd137l-sab、acea-sclight-sab)包含相同的抗原特异性序列(acea抗体的vhch和vlcl)和相同的三价sctnfsf模块,但在其fc部分包含不同的ch3结构域序列。ch3结构域可以是突变的或可以是野生型的,但仍然能够与其对应物形成二聚体,引导结构组装,如图1所示。igg衍生的ch3结构域的非限制性实例表示为seq-id:44、seq-id:45、seq-id:48、seq-id:49、seq-id:52、seq-id:53、seq-id:28、seq-id:29、seq-id:30、seq-id:31、seq-id:111、seq-id:112、seq-id:20、seq-id:21、seq-id:22、seq-id:23、seq-id:24、seq-id:25、seq-id:109、seq-id:110的部分。
[0092]
使用上述cea特异性、单臂双特异性免疫调节剂的实例,对于本领域技术人员显而易见的是,这种设计可以容易地与如图24中所示的sctnfsf rbd、或其变体结合,以进一步构建具有cd40l、gitrl、ox40l、light、tl1a、cd137l cd27l或trail作为第二特异性结合靶标的acea-sab。
[0093]
sccd27l rbd的一种特异性变体包含seq-id:36(sccd27l-fc-杵_a)、seq-id:37(sccd27l-fc-杵_b)、seq-id:38(sccd27l-fc-臼_a)、seq-id:39(sccd27l-fc-臼_b)、seq-id:70(sccd27l-rbd)的n-末端谷氨酰胺到谷氨酸的交换。
[0094]
在进一步优选的实施方案中,本领域技术人员可以通过将来自apd-l1的vh和vl结构域交换为其他抗体特异性来修饰本发明第一方面中描述的ab-sctnfsf-sab的实例,包括但不仅限于
[0095]-抗cd137(seq-id:59acd137-vh,seq-id:60acd137-vl)
[0096]-抗间皮素(seq-id:61ameso-vh,seq-id:62ameso-vl)
[0097]-抗cd25(seq-id:63acd25-vh,seq-id:64acd25-vl)
[0098]-抗pd-1(seq-id:65apd1-a-vh,seq-id:66apd1-a-vl,seq-id:67apd1-b-vh,seq-id:68apd1-b-vl)
[0099]-抗cea(seq-id:113acea-a-vh,seq-id:114acea-a-vl,seq-id:115acea-b-vh,seq-id:116acea-b-vl)
[0100]-抗cd95l(seq-id:117acd95l-vh,seq-id:118acd95l-vl),
[0101]
从而产生acd137-sctnfsf-sab、ameso-sctnfsf-sab、acd25-sctnfsf-sab、apd1-sctnfsf-sab、acea-sctnfsf-sab或acd95l-sctnfsf-sab。
[0102]
在本发明的第二方面中,多特异性tnf超家族融合蛋白组装体至少包含
[0103]
(a)单链tnf-sf受体结合结构域,其融合至
[0104]
(b)第一肽接头,其融合至
[0105]
(c)第一(异)二聚化结构域,和
[0106]
(d)第二单链tnf-sf受体结合结构域,其融合至
[0107]
(e)第二肽接头,其融合至
[0108]
(f)第二(异)二聚化结构域。
[0109]
图2给出了本发明的第二方面的多特异性tnf超家族融合蛋白组装体的总体概述。
[0110]
如图2所示,本发明的典型多特异性免疫调节剂可通过将本发明的两种sctnfsf-fc融合多肽相结合来实现。在一个优选实施方案中,多特异性免疫调节剂包含作为成熟蛋白质的多肽seq-id:32和seq-id:36。在一个优选实施方案中,多特异性免疫调节剂包含作为成熟蛋白质的多肽seq-id:33和seq-id:37。两种结构对cd40和cd27为双特异性的,对于两种tnfrsf成员各有三个结合位点。
[0111]
在本发明的第二方面中,多特异性tnf超家族融合蛋白组装体包含部分a)(列)的至少一个单链tnf-sf受体结合结构域和部分e)(行)的一个单链结构域。这允许在蛋白组装体内自由组合所有公开的单链tnf-sf受体结合结构域。作为非限制性列表,部分a)(列)和部分e)(行)的可能组合在随后的表中用
‘
x’标记。
[0112][0113]
在本发明的第三方面中,多特异性tnf超家族融合蛋白组装体至少包含
[0114]
(a)抗体的功能性fab结构域,其融合至
[0115]
(b)单链tnf-sf受体结合结构域,
[0116]
其中fab片段(a)的恒定重链结构域的c-末端(c-terminal end)通过肽接头(seq-id:13
–
seq-id:19)融合至单链tnf-sf受体结合。
[0117]
图3给出了本发明的第三方面的多特异性tnf超家族融合蛋白组装体的总体概述。这种融合蛋白形式称为ab-sctnfsf。
[0118]
在一个优选实施方案中,ab-sctnfsf多特异性免疫调节剂将抗pd-l1(apdl1)靶向与cd40激动相结合。这种特异性组装体称为apdl1-sccd40l。一个非限制性实例包含作为成熟蛋白质的多肽seq-id:58(apdl1-hc-sccd40l-rbd)和seq-id:55(apd-l1-lc)。
[0119]
在一个优选实施方案中,ab-sctnfsf多特异性免疫调节剂将抗pd-l1(apdl1)靶向与cd27激动相结合。这种特异性组装体称为apdl1-sccd27l。一个非限制性实例包含作为成熟蛋白质的多肽seq-id:102(apdl1-hc-sccd27l-rbd)和seq-id:55(apd-l1-lc)。一个进一步优选的实施方案使用tnfsf模块seq-id:119(sccd27l-v2-rbd)。
[0120]
在一个优选实施方案中,ab-sctnfsf多特异性免疫调节剂将抗pd-l1靶向与gitr激动相结合。这种特异性组装体称为apdl1-scgitrl。一个非限制性实例包含作为成熟蛋白质的多肽seq-id:104(apdl1-hc-scgitrl-rbd)和seq-id:55(apd-l1-lc)。
[0121]
在一个优选实施方案中,ab-sctnfsf多特异性免疫调节剂将抗cd95l(acd95l)靶向与cd40激动相结合。这种特异性组装体称为acd95l-sccd40l。一个非限制性实例包含作为成熟蛋白质的多肽seq-id:57(acd95l-hc-sccd40l-rbd)和seq-id:47(acd95l-lc)。
[0122]
在一个优选实施方案中,ab-sctnfsf多特异性免疫调节剂将抗cd95l(acd95l)靶向与cd27激动相结合。这种特异性组装体称为acd95l-sccd27l。一个非限制性实例包含作为成熟蛋白质的多肽seq-id:101(acd95l-hc-sccd27l-rbd)和seq-id:47(acd95l-lc)。一个进一步优选的实施方案使用tnfsf模块seq-id:119(sccd27l-v2-rbd)。
[0123]
在一个优选实施方案中,ab-sctnfsf多特异性免疫调节剂将抗cd95l靶向与gitr激动相结合。这种特异性组装体称为acd95l-scgitrl。一个非限制性实例包含作为成熟蛋白质的多肽seq-id:103(acd95l-hc-scgitrl-rbd)和seq-id:47(acd95l-lc)。
[0124]
在进一步优选的实施方案中,ab-sctnfsf多特异性免疫调节剂将抗cd95l靶向与cd137激动或与hvem/ltbr激动相结合。特异性组装体称为acd95l-sccd137l和acd95l-sclight。本领域技术人员可以容易地将上述apdl1靶向或acd95l靶向的ab-sctnfsf实例中的tnfsf模块交换为seq-id:72(sccd137l-rbd)、seq-id:105(sccd137l-v2-rbd)、seq-id:106(sccd137l-v3-rbd)、seq-id:107(sccd137l-v4-rbd)、seq-id:108(sccd137l-v5-rbd)或seq-id:73(sclight-rbd)。
[0125]
在进一步优选的实施方案中,本领域技术人员可以通过将来自apd-l1或acd95l的vh和vl结构域交换为其他抗体特异性来容易地修饰本发明的第三方面中描述的ab-sctnfsf的实例,包括但不仅限于
[0126]-抗cd137(seq-id:59acd137-vh,seq-id:60acd137-vl)
[0127]-抗间皮素(seq-id:61ameso-vh,seq-id:62ameso-vl)
[0128]-抗cd25(seq-id:63acd25-vh,seq-id:64acd25-vl)
[0129]-抗pd-1(seq-id:65apd1-a-vh,seq-id:66apd1-a-vl,seq-id:67apd1-b-vh,seq-id:68apd1-b-vl)
[0130]-抗cea(seq-id:113acea-a-vh,seq-id:114acea-a-vl,seq-id:115acea-b-vh,seq-id:116acea-b-vl;seq-id:56acea-hc-sccd40l-rbd/seq-id:51acea-lc)
[0131]
从而产生acd137-sctnfsf、ameso-sctnfsf、acd25-sctnfsf、apd1-sctnfsf或acea-sctnfsf。
[0132]
使用上述acd95l-sctnfsf双特异性免疫调节剂的实例,对于本领域技术人员显而易见的是,这种设计可以容易地与如图24中所示的sctnfsf rbd、或其变体结合,以进一步构建具有cd40l、gitrl、ox40l、light、tl1a、cd137l、cd27l或trail作为第二特异性结合靶标的acd95l-sctnfsf双特异性免疫调节剂。
[0133]
在本发明的进一步的方面中,多特异性tnf超家族融合蛋白组装体至少包含
[0134]
(a)抗体的功能性单vh(可变重链)结构域,其融合至
[0135]
(b)单链tnf-sf受体结合结构域,
[0136]
其中vh结构域的c-末端通过肽接头融合至单链tnf-sf受体结合(图25)。
[0137]
功能性单vh结构域的实例是所谓的vh衍生的单结构域抗体(vhh)。
[0138]
从wo2010/010051,技术人员已知构建适用于本发明的任何上述方面的单链tnf-sf受体结合结构域的方法。一般而言,合适的非聚集性tnf-sf受体结合结构域由三个可溶性、柄缺失的受体结合结构域组成,它们通过短的、优选3-8个氨基酸长的接头连接。
[0139]
在一个具体实施方案中,受体结合结构域可以通过较短的接头连接或甚至在没有额外氨基酸的情况下融合。
[0140]
如上所述,特别合适的三价的、非聚集性tnf-sf受体结合结构域公开于wo2015/164588、wo2016/177771、wo2017/068183、wo2017/068180、wo2017/068185、wo2017/072080和wo2017/068192。作为一个非限制性实例,有利的单链tnf-sf受体结合结构域可以选自图24的序列。
[0141]
本发明的第一和/或第三方面的抗原结合或相互作用部分可以是抗体片段,例如单特异性抗体片段或其功能性片段。进一步合适的结合和相互作用部分是本领域已知的。非限制性实例是:单链抗体或其功能性片段、单结构域抗体、功能性scfv片段。这些形式的实例在图1、图26、图27以及图3和图25中所示。
[0142]
在本发明的第一和/或第三方面的具体实施方案中,功能性抗体片段针对细胞表面标志物或活性调节靶标。作为非限制性实例,抗体或抗体片段针对:酪氨酸激酶受体(egfr、her2、her3、her4)、vegfr、异聚整合素a或β受体家族包括vla-4和lfa-1、e-选择素、l-选择素、p-选择素、肿瘤基质标志物如成纤维细胞活化蛋白(fap)、endoglyx-1、mcsp或内皮唾液酸蛋白(endosialin)、半乳糖凝集素(galectin)、n-cam(髓鞘蛋白零)、icam1-icam5、vcam-1、pe-cam、l1-cam、粘连蛋白(nectin)(pvrl1、pvrl2、pvrl3)、epcam、肿瘤抗原包括ny-eso-1、mage1、mage2、ca-125、癌胚抗原(cea)、campath-1(cd52)、cd44及其肿瘤特异性变体和其他肿瘤选择性细胞表面标志物,cd2、cd5、cd7、cd19、cd20、cd21、cd22、cd24、cd25、cd30、cd33、cd38、cd40、cd52、cd56、cd71、cd72、cd73、cd105、cd117、cd123、cd133、c-met、pdgfr、igf1-r、hmw-maa、tag-72、gd2、gd3、gm2、叶酸受体、lgr5、ley、muc-1、muc-2、psma、psca和upar。更优选地,靶标分子是fap、egfr、her2或her、黑色素瘤相关的硫酸软骨素蛋白多糖(mcsp)。
[0143]
抗体或抗体片段也可能针对b7家族的成员,包括b7-1(cd80)、b7-2(cd86)、b7-dc
(pdcd1lg2、pd-l2、cd273)、b7-h1(pd-l1、cd274)、b7-h2(icoslg、b7rp1、cd275)、b7-h3(cd276)、b7-h4(vtcn1)、b7-h5(vista、血小板受体gi24、sisp1)、b7-h6(ncr3lg1)和b7-h7(hhla2)。
[0144]
在一个进一步的实施方案中,抗体或抗体片段也可以针对活性调节靶标,包括但不限于ctla-4、pd1、cd3、cd4、cd8、cd28、hla i类和ii类、lag3(cd223),icos(cd278)、cd39、cd73、tigit、cd96、pta1(cd226)、tim-3、tim-1、cd47、sirp-α(sirp-alpha)、dnam-1和白细胞介素(抗炎),包括但不限于il4、il6、il9、il10、il11、il13、il18、il21和il22。
[0145]
应注意,tnf-sf和tnfr-sf的所有胞外域都是特别适合本发明的第一方面的抗体片段的靶标。优选但非限制性列表包含tnf-sf配体结构域如cd95l、tnf-α(tnf-alpha)、cd40l、cd27l、light、tl1a和tweak以及tnf-受体结构域如cd40、cd27、4-1bb、ox40、gitr、hvem、bcma、ltbr和tweakr的胞外域。
[0146]
与tnfr-sf的胞外域结合的抗体的实例是抗cd137 mab乌瑞芦单抗和乌托鲁单抗(utomilumab)。与tnfr-sf的胞外域结合的单克隆抗体的进一步实例是伐立鲁单抗(varlilumab)(抗cd27)、塞鲁单抗(selicrelumab)(抗cd40)、apx005m(抗cd40)和trx518(抗gitr)。
[0147]
从科学和商业的角度来看,tnfsf配体与抗体的组合是特别有吸引力的,所述抗体结合已经评价的癌细胞的表面标志物,如cea或her2,或者干预检查点调节剂(pd-1、ctla4、cd95)的信号级联。因此,实施例和图中所示的具有抗pdl1(apdl1)和抗cd95l(acd95l)或抗cea(acea)活性的肽代表了本发明的进一步特别优选的实施方案。
[0148]
本发明的一个进一步的方面涉及编码如本文所述的多特异性融合蛋白的蛋白质部分的核酸分子。核酸分子可以是dna分子,例如双链或单链dna分子,或rna分子。核酸分子可编码融合蛋白或其前体,例如融合蛋白的原形式(pro-proform)或前形式(pre-proform),其可包含用于分泌或纯化的信号序列或其他异源氨基酸部分,优选位于融合蛋白的n-末端和/或c-末端。异源氨基酸部分可以通过蛋白酶切割位点例如因子xa、凝血酶或iga蛋白酶切割位点连接至第一和/或第二结构域。
[0149]
核酸分子可以可操作地连接至表达控制序列,例如允许核酸分子在所需宿主细胞中表达的表达控制序列。核酸分子可以位于载体上,例如质粒、噬菌体、病毒载体、染色体整合载体等。合适的表达控制序列和载体的实例例如由sambrook等(1989)molecular cloning,a laboratory manual,cold spring harbor出版社和ausubel等(1989),current protocols in molecular biology,john wiley&sons或其更新版本描述。
[0150]
各种表达载体/宿主细胞系统可用于表达编码本发明的融合蛋白的核酸序列。合适的宿主细胞包括但不限于原核细胞如细菌、例如大肠杆菌(e.coli),真核宿主细胞如酵母细胞、昆虫细胞、植物细胞或动物细胞,优选哺乳动物细胞,更优选人细胞。
[0151]
进一步,本发明涉及用如上所述的核酸分子转化或转染的非人生物体。这种转基因生物体可以通过已知的遗传转移方法产生,包括同源重组。
[0152]
本发明的一个进一步的方面涉及药物或诊断组合物,其包含作为活性剂的至少一种融合蛋白、编码融合蛋白的相应核酸、或转化或转染的细胞,全部如本文所述。
[0153]
本发明的融合蛋白、编码所述融合蛋白的相应核酸、用于产生所述融合蛋白的转化或转染的细胞可用于治疗,例如,用于预防和/或治疗由tnf-sf细胞因子功能障碍引起
的、与之相关的和/或伴随的病症,特别是增殖性病症,诸如肿瘤,例如实体瘤或淋巴肿瘤;传染性疾病;炎性疾病;代谢性疾病;自身免疫性病症,例如类风湿和/或关节炎疾病;退行性疾病,例如神经退行性疾病如多发性硬化症;细胞凋亡相关疾病或移植排斥。
[0154]
实施例
[0155]
实施例1:重组多特异性/双特异性tnf超家族融合蛋白组装体的大规模表达和纯化方法
[0156]
对于前述本发明的多特异性免疫调节剂的大规模表达,将编码必要多肽(例如,sctnfsf-fc,抗体-hc,抗体-lc,vh-ch1-sctnfsf)的合成dna盒插入至真核表达载体中,所述真核表达载体包含适当的选择标志物(例如,包含杀稻瘟素、嘌呤霉素、潮霉素、或博莱霉素抗性基因的功能性表达盒)和适于提高宿主细胞基因组内转录活性插入位点数量的遗传元件,例如,人β-珠蛋白核基质附着区(humanβ-globin matrix attachment region,mar)。通过电穿孔将经序列验证的表达载体引入至适应悬浮的中国仓鼠卵巢细胞(cho-s,invitrogen)中。在转染后三天向转染的细胞施加适当的选择压力。通过随后在选择压力下培养来回收携带源自载体的抗性基因的幸存细胞。在所选细胞汇集物(cell pool)在轨道式振荡培养箱(100rpm,50mm摇距(shaking throw))中在37℃和7% co2气氛下在化学成分确定的培养基(powercho-2cd,lonza,补充有4mm谷氨酰胺(glutamine/glutamax))中稳定生长后,通过检测上述蛋白质的elisa检测来分析各个上清液。在摇瓶中扩增具有最高单位生产率(specific productivity)的细胞汇集物(轨道式摇床,100rpm,摇距50mm)用于蛋白质生产。
[0157]
对于实验室规模的生产,将各个细胞汇聚物在轨道式振荡(100rpm,55mm摇距)的摇瓶中或在wave生物反应器20/50eht(ge healthcare/cytiva)中、在37℃和7% co2气氛下在化学成分确定的培养基(powercho-2cd,lonza,补充有4mm glutamax)中培养7-12天。wave培养以0.3x10e6个细胞/ml的活细胞浓度和以下设置(对于五或十升)开始:摇动频率18rpm,摇动角度7
°
,气流0.2-0.3l/分钟,7%co2,36.5℃。wave运行期间,用powerfeed a(lonza)和lipids给细胞培养物进料两次,通常在第3天(20%进料)和第6天(30%进料)。在第二次进料后,将摇动频率增加至22rpm并将摇动角度增加至8
°
。在第7天至第10天之间当细胞活力降至低于80%时收获wave生物反应器。使用深度过滤系统(millipore millistak pod mc0hc 0.054m2)澄清含有双特异性tnfsf激动剂的培养物上清液,然后使用0.22μm瓶顶过滤器(pes,corning)对澄清的收获物进行灭菌过滤并保存在2-8℃直至进一步加工。
[0158]
对于本发明的第一和第二方面的多特异性免疫调节剂的亲和纯化,在层析系统(ge healthcare/cytiva)上进行纯化过程,利用了通过所用的两种fc支架的每一者中的特定突变而引入的前述双特异性tnfsf fc融合蛋白的不同性质。首先,使用作为固相亲和配体的mabselect sure
tm proteina(ge healthcare/cytiva),其以高结合能力与双特异性tnfsf激动剂fc融合蛋白的fc结构域结合。简言之,将无菌过滤的澄清的细胞培养物上清液/收获物加载在hitrap mabselect sure柱(cv=5ml)上,所述柱在洗涤缓冲液1(20mm pi,95mm nacl,ph 7.2)中平衡,不超过每ml柱体积10mg融合蛋白的载量。用10个柱体积(10cv)的洗涤缓冲液1洗涤柱,接着用4个柱体积(4cv)的洗涤缓冲液2(20mm pi,95mm nacl,ph 8.0)洗涤柱,以耗竭宿主细胞蛋白和宿主细胞dna。也去除了缺少蛋白a结合位点的同二聚体污染物,因为它保留在柱流穿液(flowthrough)中并且不与柱结合。在一系列的
洗涤步骤后,用两倍柱体积洗脱缓冲液(20mm pi,95mm nacl,ph 3.5)从柱洗脱蛋白质。收集洗脱液级分,并立即用1m tris-hcl ph 8.0中和至中性ph。在上述亲和层析方法过程中,将线速度设定为150cm/h并保持恒定。
[0159]
在纯化本发明的第二方面的多特异性免疫调节剂的情况下,存在于洗脱液中的异二聚体融合蛋白通过sec和离子交换层析法的组合进行精制。
[0160]
用于本发明第一方面的多特异性免疫调节剂的纯化的第二亲和步骤使用kappaselect
tm
树脂(ge healthcare/cytiva),其与双特异性tnfsf激动剂的fab结构域的cl-κ结构域结合并耗竭同二聚体激动剂fc融合蛋白。可选地,第二亲和步骤使用capture select
tm igg-ch1树脂(thermo scientific),其以高亲和力与fab结构域的ch1结构域结合。这也导致耗竭同二聚体激动剂fc融合蛋白。将第一基于mabselect sure
tm proteina的亲和层析法的洗脱液加载在capture select igg-ch1(thermo scientific)上或加载在用洗涤缓冲液(pbs ph 7.4=10mm pi,2.7mm kcl,140mm nacl)进行平衡的kappaselect树脂(ge healthcare/cytiva)(cv=5ml)上,不超过每ml柱体积10mg fab。在用洗涤缓冲液(6cv)进行的洗涤步骤后,用2cv洗脱缓冲液(0.1m甘氨酸,ph 3.5)洗脱前述双特异性tnfsf激动剂,并立即用1m tris-hcl ph 8.0中和至中性ph(0.4cv)。通过od 280测量来定量洗脱液级分的蛋白质量并通过超滤来浓缩用于随后的尺寸排阻层析法(sec)。
[0161]
对于本发明的第三方面的多特异性免疫调节剂的亲和纯化,仅采用前述基于ch1的亲和纯化,并且通过随后的尺寸排阻层析法对蛋白质进行精制。
[0162]
使用层析系统在hiload 26/600superdex 200pg或superdex 200increase 10/300gl柱(ge healthcare/cytiva)上进行尺寸排阻层析法(sec)。用磷酸盐缓冲盐水或中性ph(ph 7.4)的等效的基于tris的缓冲系统平衡柱。
[0163]
将浓缩的、亲和纯化的蛋白加载在sec柱上,其中样品体积不超过柱体积的2%(v/v)。应用每分钟2.5ml的流速(hiload 26/600superdex 200pg)或每分钟0.5ml的流速(superdex 200increase 10/300gl),并通过280nm处的吸光度来监测洗脱特性。对于确定纯化的蛋白在天然条件下的表观分子量,用具有已知分子量的标准蛋白质加载sec柱。基于标准蛋白质的洗脱体积,绘制校准曲线并确定纯化的蛋白的表观分子量。来自本发明的第一方面的双特异性tnfrsf激动剂融合蛋白(sab形式)和来自本发明的第二方面的双特异性tnfsf-配体融合蛋白从superdex sec柱洗脱,表观分子量为约150kda,而本发明的第三方面的双特异性基于fab的融合蛋白具有约100kda的表观分子量。使用hplc、具有两种靶标的基于elisa的夹心检测法和基于tnfrsf报告基因细胞(reporter-cell)的活性检测用于确定上述双特异性tnfsf激动剂的双特异性性质。
[0164]
实施例2:材料和方法
[0165]
cd40激动化合物的细胞活性
[0166]
使用来自promega的cd40荧光素酶报告基因检测(产品号ja2155)评价cd40激动剂的细胞活性。将表达nfκb-luc2的u2os细胞(其在细胞膜上组成型表达cd40)铺板在96孔板中,并在添加cd40激动剂之前在37℃下培养16-20小时。通过用激动化合物处理来诱导的生产性(productive)cd40信号传导驱动nfκb-luc2 u2os细胞中萤火虫荧光素酶的表达。在37℃下诱导4小时后,添加荧光素酶测定试剂并测量发光(rlu)(tecan infinite f500)。
[0167]
cd27激动化合物的细胞活性
[0168]
使用来自promega的cd27荧光素酶报告基因检测(产品号cs1979a25)评价cd27激动剂的细胞活性。将nfκb-luc2/cd27 jurkat细胞(其在细胞膜上表达cd27)铺板在96孔板中,并在添加cd27激动剂之前在37℃下培养16-20小时。通过用激动化合物处理来诱导的生产性cd27信号传导驱动nfκb-luc2/cd27 jurkat细胞中萤火虫荧光素酶的表达。在37℃下诱导6小时后,添加荧光素酶测定试剂并测量发光(rlu)(tecan infinite f500)。
[0169]
gitr激动化合物的细胞活性
[0170]
使用来自promega的gitr荧光素酶报告基因检测(产品号cs184009)评价gitr激动剂的细胞活性。将nfκb-luc2/gitr jurkat细胞(其在细胞膜上表达gitr)铺板在96孔板中,并在添加gitr激动剂之前在37℃下短暂培养。通过用激动化合物处理来诱导的生产性gitr信号传导驱动nfκb-luc2/gitr jurkat细胞中萤火虫荧光素酶的表达。在37℃下诱导5小时后,添加荧光素酶测定试剂并测量发光(rlu)(tecan infinite f500)。
[0171]
pd-l1靶向化合物的细胞活性
[0172]
使用来自promega的pd-1/pd-l1荧光素酶报告基因检测(产品号j1250)评价pd-l1靶向化合物的细胞活性。将pd-l1 aapc/cho-k1细胞(表达人pd-l1和设计成以抗原非依赖性方式激活同源tcr的工程化细胞表面蛋白的细胞)在添加pd-l1靶向化合物和pd-1效应细胞之前在37℃下培养16-20小时。pd-1效应细胞是表达人pd-1和由nfat应答元件(nfat-re)驱动的荧光素酶报告的jurkat t细胞。在将两种细胞类型共培养时,pd-1/pd-l1相互作用抑制tcr信号传导和nfat-re介导的发光。添加阻断pd-1/pd-l1相互作用的抗pd-1或抗pd-l1抗体中的任一者释放抑制信号并导致tcr激活和nfat-re介导的发光。
[0173]
在37℃下诱导6小时后,添加荧光素酶测定试剂并测量发光(rlu)(tecan infinite f500)。
[0174]
t细胞激活(流式细胞术)
[0175]
为了测试cd137激动剂对原代人t细胞的活性,使用基于间接磁珠的分离试剂盒(目录编号130-094-131,miltenyi)从pbmc分离天然pan t细胞。用tag-it violet
tm
增殖和细胞示踪染料(biolegend)标记纯化的t细胞,重悬浮于培养基(aim-v w/5%人血清,gibco)中,并在37℃下用预包被的抗cd3抗体,克隆okt3,1μg/ml)刺激4h、或用培养基对照刺激。立即添加cd137激动剂(100ng/ml)。在第五天,收获t细胞并通过流式细胞术来检测。
[0176]
未成熟树突状细胞的刺激(流式细胞术)
[0177]
使用标准试剂盒(stem cell)从健康人供体的血沉棕黄层中分离单核细胞。通过添加50ng/ml gm-csf 3天、然后添加50ng/ml gm-csf+50ng/ml il-4另外的3天来实现单核细胞的分化。然后用100ng/ml的指示的cd40激动剂处理细胞24小时,随后通过流式细胞术评价cd86和cd83表达。
[0178]
实施例3:多特异性免疫调节剂的序列
[0179]
对于所有基于fc结构域的异聚体构建体,使用了杵臼结构异二聚化技术,其中杵链的ch3结构域中具有s354c/t366w突变,臼链的ch3结构域中具有相应的y349c/t366s/l368a/y407v突变(carter,j immunol methods 248,7-15(2001))。
[0180]
为了消除与fcγ受体的结合,将n297s突变引入至杵和臼重链的ch2结构域(seq-id 28-31中的“ch2”。在另一实施方案中,根据国际专利申请公开号wo 2012/130831 a1中所述的方法,可将pro329gly、leu234ala和leu235ala突变引入至杵和臼重链的恒定区。
[0181]
表1:示例性铰链-接头序列
[0182][0183][0184]
铰链接头1-5和17可用于构建本发明的第二方面的蛋白质部分。铰链接头6-16可用于构建本发明的第一和第二方面的蛋白质部分。
[0185]
表2:本发明的序列
[0186]
下表2和图24中给出了本发明的关键序列的概述。
[0187]
[0188]
[0189]
[0190]
[0191]
[0192]
[0193]
[0194]
[0195]
[0196]
[0197]
[0198]
[0199]
[0200]
[0201]
[0202]
[0203]
[0204]
[0205]
[0206]
[0207]
[0208]
[0209]
[0210]
[0211]
[0212]
[0213]
[0214]
[0215]
[0216]
[0217][0218]
实施例4:靶向增加sab分子的激动活性
[0219]
已经证明了靶向结构域对双特异性分子的激动活性的贡献。在cd137荧光素酶检测中,通过添加ht1080细胞的apdl1-sccd137l-sab的激动活性的极大增加是明显的(参见图29)。几乎每个ht1080细胞表达pd-l1,然而它们对于cd95l表达为阴性的。因此,这些细胞未能相应增加acd95l-sccd137l-sab(非靶向对照)的激动活性并不令人惊讶。然而,pd-l1靶向构建体apdl1-sccd137l-sab的激动的大量增加(比对于六价sccd137l-fc所观察到的活性高约16倍)是令人惊讶的,并强调了这些分子作为靶向表达pd-l1的肿瘤的强效共刺激分子的潜力。apdl1-sccd137l-sab的这种增加的激动活性也已经通过添加其它表达pd-l1的癌症细胞系aspc-1、ln-18和mda-mb231(未示出)得到了证明。对于共刺激激动剂经常观察到钟形浓度依赖性。事实是,在这种情况下,钟形浓度依赖性是非常明显的,这可以用高度激动来解释:由表达pd-l1的细胞交联的激动分子的数量有一个最佳值,较高数量的配体三聚体导致配体/受体复合物中受体的减少。
[0220]
类似地,在cd27荧光素酶检测中,通过添加mda-mb231细胞的apdl1-sccd27l-sab的激动活性的极大增加是明显的(参见图30)。几乎每个mda-mb231细胞表达pd-l1,然而它们对于cd95l表达为阴性的。因此,这些细胞未能增加acd95l-sccd27l-sab(非靶向对照)的激动活性并不令人惊讶。然而,pd-l1靶向构建体apdl1-sccd27l-sab的激动的大量增加(比对于六价sccd27l-fc所观察到的活性高约3倍)是令人惊讶的,并强调了这些分子作为靶向表达pd-l1的肿瘤的强效共刺激分子的潜力。apdl1-sccd27l-sab的这种增加的激动活性也
已经通过添加其它表达pd-l1的癌症细胞系ln-18和ht1080(未示出)得到了证明。
[0221]
实施例5:双特异性cd137l分子激活t细胞增殖
[0222]
使用t细胞激活检测,在图31中示出了sccd137l双特异性分子的生物活性。在存在抗cd3刺激的情况下,双特异性分子apdl1-sccd137l-sab和acd95l-sccd137l-sab导致相似的t细胞增殖。
[0223]
实施例6:apd-l1-sccd40l-sab双特异性显示出对树突状细胞的优异刺激
[0224]
使用未成熟树突状细胞激活检测,在图32和图33中示出了sccd40l双特异性分子和其它cd40激动剂的生物活性。在图32所示的实验中,将三价sccd40l和抗pd-l1抗体片段组合的双特异性分子apdl1-sccd40l-sab是树突状细胞的最有效激活剂,激活水平(cd86+/cd83+)为88.31%。因此,将两个部分组合在一个分子中远比将这些部分作为两个分别的分子添加更有效,即apd-l1抗体+cd40l(三聚体),其显示仅39.48%的激活水平。acd40单克隆抗体和cd40l(三聚体)均显示中等激活水平(40.59%和46.10%),而apd-l1单克隆抗体具有与培养基对照相同的活性。
[0225]
在图33中所示的实验中,将三价sccd40l和抗pd-l1抗体片段组合的双特异性分子是树突状细胞的非常有效的激活剂,激活水平(cd86+/cd83+)类似于sccd40l-fc的激活水平:对于apdl1-sccd40l-sab为73.00%,对于apdl1-sccd40l(三价)为87.18%和对于apdl1-sccd40l-fc为96.12%。相比之下,靶向cd95l而不是pd-l1的双特异性分子acd95l-sccd40l-sab仅具有中等激活水平,因为缺少表达pd-l1的单核细胞上的cd95l的表达。对于acd40单克隆抗体和cd40l(三聚体)也看到低激活水平。
[0226]
实施例7:gitr荧光素酶检测
[0227]
使用gitr荧光素酶检测,在图34中示出了apdl1-scgitrl双特异性分子的生物活性。通过与抗人fc(x-连接)交联,三价gitr激动剂apdl1-scgitrl的活性明显增强至对于六价gitr激动剂scgitrl-fc所观察到的水平
[0228]
本技术进一步特征为其权利要求和以下项目1-11。
[0229]
项目1:一种多特异性tnf家族融合蛋白组装体,其至少包含
[0230]
(a)单链tnf-sf受体结合结构域超家族配体,其融合至
[0231]
(b)第一肽接头,其融合至
[0232]
(c)第一异二聚化结构域,和
[0233]
(d)抗原结合或相互作用蛋白质部分,其融合至
[0234]
(e)第二肽接头,其融合至
[0235]
(f)第二异二聚化结构域。
[0236]
项目2:一种多特异性tnf家族融合蛋白组装体,其至少包含
[0237]
(a)单链tnf-sf受体结合结构域,其融合至
[0238]
(b)第一肽接头,其融合至
[0239]
(c)第一异二聚化结构域,和
[0240]
(d)和第二单链tnf-sf受体结合结构域,其融合至
[0241]
(e)第二肽接头,其融合至
[0242]
(f)第二异二聚化结构域。
[0243]
项目3:一种多特异性tnf家族融合蛋白组装体,其至少包含
[0244]
(a)抗体的功能性fab结构域,其融合至
[0245]
(b)单链tnf-sf受体结合结构域,
[0246]
其中fab片段(a)的恒定重链结构域的c-末端通过肽接头融合至单链tnf-sf受体结合。
[0247]
项目4:一种多特异性tnf家族融合蛋白组装体,其包含
[0248]
(a)由seq-id33和seq-id 46以及seq-id:47组成的组装体,
[0249]
(b)由seq-id37和seq-id46以及seq-id:47组成的组装体,
[0250]
(c)由seq-id41和seq-id 46以及seq-id:47组成的组装体。
[0251]
项目5:一种多特异性tnf家族融合蛋白组装体,其选自包括以下的列表:
[0252]
(a)由seq-id33和seq-id 54以及seq-id:55组成的组装体,
[0253]
(b)由seq-id37和seq-id 54以及seq-id:55组成的组装体,
[0254]
(c)由seq-id41和seq-id 54以及seq-id:55组成的组装体。
[0255]
项目6:一种多特异性tnf家族融合蛋白组装体,其选自包括以下的列表:
[0256]
(a)由seq-id33和seq-id50以及seq-id:51组成的组装体,
[0257]
(b)由seq-id37和seq-id50以及seq-id:51组成的组装体,
[0258]
(c)由seq-id41和seq-id50以及seq-id:51组成的组装体。
[0259]
项目7:一种核酸分子,其编码项目1部分a)-c)的蛋白质部分,以及一种核酸分子,其编码项目1部分d)-e)的蛋白质部分。
[0260]
项目8.一种核酸分子,其编码项目2部分a)-c)的蛋白质部分,以及一种核酸分子,其编码项目2部分d)-e)的蛋白质部分。
[0261]
项目9:一种核酸分子,其编码项目3中任一种蛋白质,或用于项目4-6中任一项的蛋白组装体的共表达的核酸分子。
[0262]
项目10:一种宿主细胞,其包含项目7-9中任一项的核酸。
[0263]
项目11:一种药物组合物,其至少包含权利要求1-6中任一项的多特异性蛋白组装体或7-9的核酸。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1