一种咪唑并吡啶并吲哚类化合物及其制备方法、应用
1.本发明属于医药化学领域,具体涉及一种咪唑并吡啶并吲哚类化合物及其制备方法、应用。
背景技术:
2.β-咔啉衍生物是一类生物碱,广泛存在于自然界中。β-咔啉衍生物具有广泛的生物活性,如抗肿瘤、抗病毒、抗菌、抗包虫及抗血栓等作用。β-咔啉衍生物具有潜在的应用价值。近些年来,通过人工合成得到了大量的β-咔啉衍生物,研究发现,在β-咔啉结构的2、3、9位引入适合的取代基能够增强化合物的生物活性。
3.咪唑并吡啶衍生物是一类重要的含氮杂环化合物,具有抗病毒、抗细菌、抗微生物活性和抗疲劳、抗焦虑,治疗肿瘤、高血压、胃溃疡、精神病的功效,受到药物化学研究者的广泛关注。目前已经有多种含该片段的药物进入药品市场,例如minodronic acid,alpidem,olprinone,zolpidem,zolimidine等。
4.有鉴于此,本发明提出一种新的化合物—咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚类化合物,对发现具有潜在应用前景的药物具有重要意义。
技术实现要素:
[0005]
本发明的目的在于提供一种咪唑并吡啶并吲哚类化合物,该类化合物为新结构类型化合物,具有β-咔啉环稠合咪唑环的结构特点。
[0006]
为了实现上述目的,所采用的技术方案为:
[0007]
一种咪唑并吡啶并吲哚类化合物,所述的咪唑并吡啶并吲哚类化合物为咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚类化合物,其化学结构通式为:
[0008][0009]
进一步的,所述的咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚类化合物的化学结构通式中,r2为苯基、苄基、乙基、n-已基、5-甲基呋喃-2-基中的一种;
[0010]
r9为氢、甲基、n-丁基、苄基、对氟苄基、间氯苄基中的一种。
[0011]
再进一步的,所述的咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚类化合物,为下列任一化合物:
[0012]
3-苯基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-苄基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-甲基-3-苯基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-苄基-6-甲基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-乙基-6-甲基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-己基-6-甲基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-甲基-3-((5-甲基呋喃-2-基)甲基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-苄基-6-丁基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-苄基-3-苯基-6h-咪唑并[1',
2':1,6]吡啶并[3,4-b]吲哚、3,6-二苄基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-苄基-3-乙基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-苄基-3-己基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-苄基-3-((5-甲基呋喃-2-基)甲基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-(4-氟苄基)-3-苯基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-苄基-6-(4-氟苄基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-乙基-6-(4-氟苄基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-(4-氟苄基)-3-己基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-(4-氟苄基)-3-((5-甲基呋喃-2-基)甲基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-(3-氯苄基)-3-苯基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-苄基-6-(3-氯苄基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-(3-氯苄基)-3-乙基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-(3-氯苄基)-3-己基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-(3-氯苄基)-3-((5-甲基呋喃-2-基)甲基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚。
[0013]
本发明的另一个目的在于提供上述咪唑并吡啶并吲哚类化合物在抗肿瘤中的应用。
[0014]
本发明还有一个目的在于提供上述咪唑并吡啶并吲哚类化合物的制备方法,该制备方法在保留β-咔啉环结构特点的同时,在其外部通过稠合咪唑环,获得咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚类化合物。且该制备方法具有较好的收率。
[0015]
为了实现上述目的,所采用的技术方案为:
[0016]
上述的咪唑并吡啶并吲哚类化合物的制备方法,所述的制备方法的化学反应式为:
[0017][0018]
进一步的,s10合成化合物1:
[0019]
将l-tryptophan、氢氧化钠、h2o混合均匀后,加入甲醛,在室温下搅拌3.5h,再在100℃回流搅拌至反应完全,冷却,得反应混合液;
[0020]
将所述的反应混合液缓慢倒入冰水中,调节溶液ph至酸性,再置于冰箱中,至析出大量固体;
[0021]
再抽滤,用清水、丙酮洗涤,干燥,得化合物1;
[0022]
s20合成化合物2:
[0023]
向所述的化合物1中加入无水乙醇,混合后,加入二氯亚砜,加热回流至反应完全,
冷却至室温,减压浓缩除去无水乙醇;再加入冷水,调节ph至8-9,最后经乙酸乙酯萃取、减压浓缩有机相、干燥,得化合物2;
[0024]
s30合成化合物3:
[0025]
将所述的化合物2、升华硫、无水二甲苯混匀后,加热回流至反应完全,冷却至室温,有淡黄色晶体析出;
[0026]
再抽滤,得滤饼;所述的滤饼用二甲苯和石油醚洗涤后,溶于乙醇进行加热回流,再冷却析出固体,抽滤、干燥,得化合物3;
[0027]
s40合成化合物4:
[0028]
将所述的化合物3、nah和无水dmf混合均匀后,滴加相应的卤代化合物进行反应;反应结束后,加入冰水,再用乙酸乙酯进行萃取有机相;
[0029]
所述的有机相用饱和nacl溶液洗涤后,用浓盐酸调节ph值至2-3,加入无水乙醇后进行减压浓缩;
[0030]
然后加入丙酮进行重结晶处理,再将抽滤得到的固体洗涤后,溶于水,调节ph至碱性,用乙酸乙酯萃取有机相,用饱和盐水洗涤后,干燥,得化合物4;
[0031]
s50合成化合物5:
[0032]
将所述的化合物4溶解于乙醇中,加入水合肼,然后在80℃下加热回流至反应结束,依次进行冷却、抽滤、洗涤、重结晶处理,得化合物5;
[0033]
s60合成化合物6:
[0034]
将所述的化合物5和水混匀后,在0℃以下,加入浓盐酸、亚硝酸钠,搅拌至反应结束后,调节溶液ph到8、抽滤、用水洗涤,得固体;
[0035]
将所述的固体加入到含有水和冰乙酸的混合溶液中,在110℃下回流至反应结束后,依次进行冷却、减压浓缩、调节ph到8、用乙酸乙酯萃取、饱和食盐水洗涤、无水硫酸钠干燥、减压浓缩,得化合物6;
[0036]
s70合成目标化合物:
[0037]
将所述的化合物6、相应的醛基化合物、环己烷和二甲基亚砜混合后,在120℃下加热搅拌,至反应完全后,冷却、用乙酸乙酯(ea)萃取、盐水洗涤、柱层析提纯,得所述的咪唑并吡啶并吲哚类化合物。
[0038]
再进一步的,所述的步骤s10中:l-tryptophan、氢氧化钠、h2o、甲醛的用量比例为100mmol:125mmol:200ml:103mmol。
[0039]
再进一步的,所述的步骤s20中:化合物1、无水乙醇、二氯亚砜的用量比为100mmol:300ml:20ml;
[0040]
采用饱和nahco3和naoh溶液调节ph值至8-9。
[0041]
再进一步的,所述的步骤s30中:化合物2、升华硫和无水二甲苯的用量比为100mmol:300mmol:200ml;
[0042]
所述的步骤s40中,相应的卤代化合物为溴代化合物或碘代化合物。再进一步的,所述的步骤s70中,化合物6、相应的醛基化合物、环己烷和二甲基亚砜的用量比为1mmol:2mmol:1ml:2ml。
[0043]
与现有技术相比,本发明的有益效果在于:
[0044]
1、本发明在保留β-咔啉环的结构特点的同时,在其外部通过稠合咪唑环,获得咪
唑并[1',2':1,6]吡啶并[3,4-b]吲哚类化合物。。
[0045]
2、本发明的咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚类化合物为一种新的化合物,具有较好的抗肿瘤活性,可应用于抗肿瘤药物中。
附图说明
[0046]
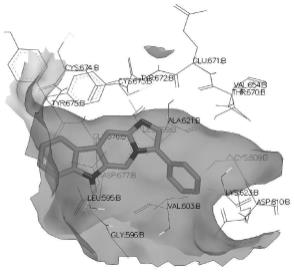
图1为化合物7a的分子对接构象图;
[0047]
图2为化合物7k的分子对接构象图;
[0048]
图3为化合物7q的分子对接构象图。
具体实施方式
[0049]
为了进一步阐述本发明一种咪唑并吡啶并吲哚类化合物及其制备方法、应用,达到预期发明目的,以下结合较佳实施例,对依据本发明提出的一种咪唑并吡啶并吲哚类化合物及其制备方法、应用,其具体实施方式、结构、特征及其功效,详细说明如后。在下述说明中,不同的“一实施例”或“实施例”指的不一定是同一实施例。此外,一或多个实施例中的特定特征、结构或特点可由任何合适形式组合。
[0050]
下面将结合具体的实施例,对本发明一种咪唑并吡啶并吲哚类化合物及其制备方法、应用做进一步的详细介绍:
[0051]
本发明的技术方案为:
[0052]
一种咪唑并吡啶并吲哚类化合物,所述的咪唑并吡啶并吲哚类化合物为咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚类化合物,其化学结构通式为:
[0053][0054]
优选的,所述的咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚类化合物的化学结构通式中,r2为苯基、苄基、乙基、n-已基、5-甲基呋喃-2-基中的一种;
[0055]
r9为氢、甲基、n-丁基、苄基、对位的氟苄基、间位的氯苄基中的一种。
[0056]
进一步优选的,所述的咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚类化合物,为下列任一化合物:
[0057]
3-苯基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-苄基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-甲基-3-苯基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-苄基-6-甲基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-乙基-6-甲基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-己基-6-甲基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-甲基-3-((5-甲基呋喃-2-基)甲基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-苄基-6-丁基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-苄基-3-苯基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3,6-二苄基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-苄基-3-乙基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-苄基-3-己基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-苄基-3-((5-甲基呋喃-2-基)甲基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-(4-氟苄基)-3-苯基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-苄基-6-(4-氟苄基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-乙基-6-(4-氟苄
基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-(4-氟苄基)-3-己基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-(4-氟苄基)-3-((5-甲基呋喃-2-基)甲基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-(3-氯苄基)-3-苯基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、3-苄基-6-(3-氯苄基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-(3-氯苄基)-3-乙基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-(3-氯苄基)-3-己基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚、6-(3-氯苄基)-3-((5-甲基呋喃-2-基)甲基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚。
[0058]
上述咪唑并吡啶并吲哚类化合物在抗肿瘤中的应用。
[0059]
上述咪唑并吡啶并吲哚类化合物的制备方法,该制备方法在保留β-咔啉环的结构特点的同时,在其外部通过稠合咪唑环,获得咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚类化合物。且该制备方法具有较好的收率。
[0060]
上述的咪唑并吡啶并吲哚类化合物的制备方法,所述的制备方法的化学反应式为:
[0061][0062]
优选的,s10合成化合物1:
[0063]
将l-tryptophan、氢氧化钠、h2o混合均匀后,加入甲醛,在室温下搅拌3.5h,再在100℃回流搅拌至反应完全,冷却,得反应混合液;
[0064]
将所述的反应混合液缓慢倒入冰水中,调节溶液ph至酸性,再置于冰箱中,至析出大量固体;
[0065]
再抽滤,用清水、丙酮洗涤,干燥,得化合物1;
[0066]
s20合成化合物2:
[0067]
向所述的化合物1中加入无水乙醇,混合后,加入二氯亚砜,加热回流至反应完全,冷却至室温,减压浓缩除去无水乙醇;再加入冷水,调节ph至8-9,最后经乙酸乙酯萃取、减压浓缩有机相、干燥,得化合物2;
[0068]
s30合成化合物3:
[0069]
将所述的化合物2、升华硫、无水二甲苯混匀后,加热回流至反应完全,冷却至室温,有淡黄色晶体析出;
[0070]
再抽滤,得滤饼;所述的滤饼用二甲苯和石油醚洗涤后,溶于乙醇进行加热回流,再冷却析出固体,抽滤、干燥,得化合物3;
[0071]
s40合成化合物4:
[0072]
将所述的化合物3、nah和无水dmf混合均匀后,滴加相应的卤代化合物进行反应;反应结束后,加入冰水,再用乙酸乙酯进行萃取有机相;
[0073]
所述的有机相用饱和nacl溶液洗涤后,用浓盐酸调节ph值至2-3,加入无水乙醇后进行减压浓缩;
[0074]
然后加入丙酮进行重结晶处理,再将抽滤得到的固体洗涤后,溶于水,调节ph至碱性,用乙酸乙酯萃取有机相,用饱和盐水洗涤后,干燥,得化合物4;
[0075]
s50合成化合物5:
[0076]
将所述的化合物4溶解于乙醇中,加入水合肼,然后在80℃下加热回流至反应结束,依次进行冷却、抽滤、洗涤、重结晶处理,得化合物5;
[0077]
s60合成化合物6:
[0078]
将所述的化合物5和水混匀后,在0℃以下,加入浓盐酸、亚硝酸钠,搅拌至反应结束后,调节溶液ph到8、抽滤、用水洗涤,得固体;
[0079]
将所述的固体加入到含有水和冰乙酸的混合溶液中,在110℃下回流至反应结束后,依次进行冷却、减压浓缩、调节ph到8、用乙酸乙酯萃取、饱和食盐水洗涤、无水硫酸钠干燥、减压浓缩,得化合物6;
[0080]
s70合成目标化合物:
[0081]
将所述的化合物6、相应的醛基化合物、环己烷和二甲基亚砜混合后,在120℃下加热搅拌,至反应完全后,冷却、用乙酸乙酯(ea)萃取、盐水洗涤、柱层析提纯,得所述的咪唑并吡啶并吲哚类化合物。
[0082]
进一步优选的,所述的步骤s10中:l-tryptophan、氢氧化钠、h2o、甲醛的用量比例为100mmol:125mmol:200ml:103mmol。
[0083]
进一步优选的,所述的步骤s20中:化合物1、无水乙醇、二氯亚砜的用量比为100mmol:300ml:20ml;
[0084]
采用饱和nahco3和naoh溶液调节ph值至8-9。
[0085]
进一步优选的,所述的步骤s30中:化合物2、升华硫和无水二甲苯的用量比为100mmol:300mmol:200ml;
[0086]
所述的步骤s40中,相应的卤代化合物为溴代化合物或碘代化合物。
[0087]
进一步优选的,所述的步骤s70中,化合物6、相应的醛基化合物、环己烷和二甲基亚砜的用量比为1mmol:2mmol:1ml:2ml。
[0088]
实施例1.
[0089]
具体操作步骤如下:
[0090]
a中间体:9-取代-3-氨基-β-咔啉的合成,采用以下反应式:
[0091][0092]
(1)化合物1的合成:在500ml的圆底烧瓶中加入l-tryptophan(100mmol)、氢氧化钠(125mmol)、h2o(200ml),使固体搅拌均匀后,然后加入甲醛(103mmol),在室温下搅拌3.5h,之后逐渐升温至100℃回流搅拌2.5h,tlc监测反应至完全。待混合液温度冷却后,缓慢倒入200ml冰水中,之后使用盐酸调节溶液ph至酸性,有白色固体析出,将溶液置于冰箱中析出大量固体,随后抽滤并用大量清水、丙酮洗涤滤饼,干燥,得化合物1。白色固体,收率89%。
[0093]
(2)化合物2的合成:称取化合物1(100mmol)置于1000ml的圆底烧瓶中,加入无水乙醇(300ml),在室温下搅拌均匀(30min左右),然后缓慢加入二氯亚砜(20ml)后,加热回流4-5h,监测反应至反应结束后,冷却至室温,随后减压浓缩除去无水乙醇。再将固体倒入到200ml冷水中,用饱和nahco3和naoh溶液调节ph值至8-9,最后经乙酸乙酯萃取,(如有必要对有机相进行脱色处理)减压浓缩有机相,干燥,得化合物2(白色固体),收率86%。
[0094]
(3)化合物3的合成:称取化合物2(100mmol)和升华硫(300mmol)于500ml的圆底烧瓶中,加入无水二甲苯(200ml),并添加尾气吸收装置(除去h2s气体),然后将混合物加热回流7-8h,tlc监测反应,待反应完成后,将反应液冷却至室温,会有淡黄色晶体析出。之后抽滤,滤饼用二甲苯和石油醚洗涤,最后将固体溶于乙醇后加热回流,冷却至室温,然后放冰箱析出更多固体,(如有必要对有机相进行脱色处理)抽滤、干燥,得化合物3,白色固体,收率87%。
[0095]
(4)化合物4a-4f的合成:以4b为例,取化合物3(10mmol)与nah(15mmol)、无水dmf(40ml)放置于100ml的圆底烧瓶中,搅拌均匀至无气泡,滴加碘甲烷(20mmol),薄层色谱法(tlc)监测反应。待反应结束后,将反应液倒入300ml冰水中,然后用乙酸乙酯进行萃取,有机相用饱和nacl溶液洗涤3次。然后用浓盐酸调节溶液ph值至2-3,加入无水乙醇200ml成盐,再将有机相减压浓缩,加入少量丙酮重结晶,放置冰箱,析出固体,抽滤,滤饼用丙酮洗涤(除去多余的卤代烷烃),然后将得到的固体溶于水,并用nahco3和naoh调节溶液ph值为8-9,用乙酸乙酯萃取,有机相用饱和盐水洗涤3次,无水硫酸钠干燥,减压浓缩去除溶剂,干燥得化合物4b,白色固体,收率83%。
[0096]
(5)化合物5a-5f的合成:以5a为例,称取化合物4a(10mmol)在乙醇(100ml)中的溶液中,加热搅拌至原料完全溶解后,加入水合肼(20ml),然后在80℃下加热回流8h左右。反应完成后(tlc监测反应),将所得混合物冷却,抽滤得到固体。滤饼先用无水乙醇洗涤,并用乙醇重结晶,得到化合物5a,收率85%。
[0097]
(6)化合物6a-6f的合成:以6a为例,称取5a(10mmol)置于1l烧杯中,加入水(200ml)搅拌均匀,之后向溶液里加入浓盐酸(20ml),亚硝酸钠水溶液(23mmol),搅拌10-30min,并将反应温度保持在0℃以下,tlc监测反应。待反应结束后,用nahco3和naoh调节溶液ph到8,抽滤得固体(固体用大量清水洗涤,且无需干燥,可直接用于下一步骤)。
[0098]
将上一步产物(10mmol)添加到含水(150ml)和冰乙酸(150ml)的混合溶液中,并在110℃下回流2-4h,(tlc监测反应)待反应完成后,冷却溶液,减压浓缩去除溶剂,用nahco3调节ph到8,溶液用乙酸乙酯萃取、饱和食盐水洗涤、无水硫酸钠干燥、减压浓缩得化合物6a,收率78%。b目标化合物(7a-7w)的合成:采用以下反应式
[0099][0100][0101]
目标化合物7a-7w的合成:以7a为例,称取6a(1mmol)、苯乙醛(2mmol)于15ml耐压反应管中,随后加入环己烷1ml和二甲基亚砜2ml,并于120℃下加热搅拌,反应液颜色逐渐加深成黑褐色,tlc监测反应完全后,将反应液冷却,用乙酸乙酯(ea)萃取,盐水洗涤3次,用柱层析方法(二氯甲烷:甲醇dcm:meoh=150:1-50:1)获得纯净化合物7a。
[0102]
合成的产物7a-7w的结构式如下所示:
[0103][0104]
具体的:
[0105]
3-苯基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7a):黄色固体,收率:37.1%。m.p.233.1~233.9℃.1h nmr(400mhz,dmso-d6)δ10.62(s,1h),8.76(d,j=0.8hz,1h),8.47(s,1h),8.26(d,j=8.0hz,1h),7.91(s,1h),7.81(d,j=7.6hz,2h),7.64(t,j=7.6hz,2h),7.53
–
7.47(m,2h),7.44(d,j=8.0hz,1h),7.18(t,j=7.2hz,1h).
13
c nmr(100mhz,dmso-d6)δ144.66,144.01,133.78,132.63,130.32,129.83,129.11,128.04,127.60,127.21,124.00,122.23,121.80,119.15,111.13,106.45,103.71.hrms(esi)m/z calcd for c
19h14n3+
(m+h)
+
284.1182,found 284.1184.
[0106]
3-苄基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7b):褐色固体,收率:39.6%。m.p.229.6~230.4℃.1h nmr(400mhz,dmso-d6)δ10.69(s,1h),8.35(s,1h),8.25
–
8.16(m,2h),7.58(s,1h),7.46
–
7.41(m,1h),7.37
–
7.28(m,5h),7.25(d,j=5.8hz,1h),7.14
–
7.09(m,1h),4.42(s,2h).
13
c nmr(100mhz,dmso-d6)δ144.06,142.31,137.39,132.03,131.56,128.60,128.50,128.37,126.52,126.25,121.68,121.61,121.28,118.62,110.53,105.32,103.60,29.57.hrms(esi)m/z calcd for c
20h16n3+
(m+h)
+
298.1339,found 298.1340.
[0107]
6-甲基-3-苯基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7c):黄色固体,收率:43.9%。m.p.118.7~119.9℃.1h nmr(400mhz,dmso-d6)δ8.72(s,1h),8.46(s,1h),8.25(d,j=7.6hz,1h),7.89(s,1h),7.83(d,j=7.6hz,2h),7.61(t,j=7.6hz,2h),7.54(t,j=7.6hz,1h),7.48
–
7.44(m,2h),7.18(t,j=7.2hz,1h),3.75(s,3h).
13
c nmr(100mhz,dmso-d6)δ145.43,134.14,133.45,133.29,129.98,129.87,129.33,128.13,127.63,126.57,124.63,122.28,121.39,119.35,109.11,106.51,102.87,29.93.hrms(esi)m/z calcd for c
20h16n3+
(m+h)
+
298.1339,found 298.1336.
[0108]
3-苄基-6-甲基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7d):黄色固体,收率:41.5%。m.p.226.9~227.8℃.1h nmr(400mhz,dmso-d6)δ8.47(s,1h),8.35(s,1h),8.20
(d,j=7.6hz,1h),7.51(t,j=7.6hz,1h),7.47
–
7.40(m,2h),7.38
–
7.30(m,4h),7.23(t,j=7.0hz,1h),7.15(t,j=7.3hz,1h),4.40(s,2h),3.72(s,3h).
13
c nmr(100mhz,dmso-d6)δ144.69,137.69,133.27,132.20,128.59,128.52,128.47,126.47,125.07,122.59,122.57,121.58,121.15,118.72,108.47,105.78,102.37,29.63,29.46.hrms(esi)m/z calcd for c
21h18n3+
(m+h)
+
312.1495,found 312.1496.
[0109]
3-乙基-6-甲基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7e):黄色固体,收率:28.4%。m.p.153.1~153.9℃.1h nmr(400mhz,dmso-d6)δ8.57(s,1h),8.38(s,1h),8.25(d,j=7.5hz,1h),7.61(s,1h),7.54(d,j=7.4hz,1h),7.47(d,j=7.6hz,1h),7.18(t,j=6.6hz,1h),3.80(s,3h),3.03
–
2.96(m,2h),1.42(t,j=6.6hz,3h).
13
c nmr(100mhz,dmso-d6)δ144.84,141.03,133.48,128.80,128.34,125.79,125.30,121.83,120.93,118.85,108.63,104.77,103.14,29.55,17.11,11.18.hrms(esi)m/z calcd for c
16h16n3+
(m+h)
+
250.1339,found 250.1333.
[0110]
3-己基-6-甲基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7f):黄色固体,收率:33.2%。m.p.154.7~155.6℃.1h nmr(400mhz,dmso-d6)δ8.50(s,1h),8.32(s,1h),8.20(d,j=7.6hz,1h),7.54
–
7.49(m,2h),7.44(d,j=8.1hz,1h),7.15(t,j=7.7hz,1h),3.78(s,3h),1.87
–
1.76(m,2h),1.50
–
1.43(m,2h),1.41
–
1.29(m,5h),1.26(d,j=15.5hz,3h),0.89(t,j=7.0hz,3h).
13
c nmr(100mhz,dmso-d6)δ144.73,133.33,130.86,128.37,124.82,123.53,123.51,121.53,121.25,118.64,108.42,105.63,102.51,31.05,29.51,28.64,26.22,23.63,22.13,13.96.hrms(esi)m/z calcd for c
20h24n3+
(m+h)
+
306.1965,found 306.1960.
[0111]
6-甲基-3-((5-甲基呋喃-2-基)甲基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7g):黄绿色固体,收率:30.8%。m.p.165.6~166.3℃.1h nmr(400mhz,dmso-d6)δ8.57(s,1h),8.37(s,1h),8.22(d,j=7.7hz,1h),7.57(s,1h),7.52(d,j=7.5hz,1h),7.45(d,j=8.1hz,1h),7.17(t,j=7.4hz,1h),6.16(d,j=2.8hz,1h),5.98(d,j=1.8hz,1h),4.41(s,2h),3.76(s,3h),2.21(s,3h).
13
c nmr(100mhz,dmso-d6)δ150.57,148.91,144.78,141.98,133.31,131.56,128.66,125.43,121.73,121.04,119.81,118.81,108.57,107.48,106.45,105.45,102.91,29.50,22.99,13.29.hrms(esi)m/z calcd for c
20h18
n3o
+
(m+h)
+
316.1444,found 316.1446.
[0112]
3-苄基-6-丁基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7h):黄色固体,收率:32.3%。m.p.218.1~219.3℃.1h nmr(400mhz,dmso-d6)δ8.39(s,1h),8.36(s,1h),8.20(d,j=7.6hz,1h),7.53(s,1h),7.52
–
7.47(m,1h),7.44(d,j=8.1hz,1h),7.37(d,j=7.5hz,2h),7.31(t,j=7.5hz,2h),7.23(t,j=7.2hz,1h),7.14(t,j=7.3hz,1h),4.43(s,2h),4.23(t,j=6.9hz,2h),1.69
–
1.59(m,2h),1.25
–
1.22(m,2h),0.83(t,j=7.4hz,3h).
13
c nmr(100mhz,dmso-d6)δ144.09,142.33,137.52,132.28,132.18,128.60,128.48,126.44,125.18,122.42,121.67,121.13,118.65,108.64,105.68,102.67,42.34,29.68,29.53,19.75,13.75.hrms(esi)m/z calcd for c
24h24n3+
(m+h)
+
354.1965,found 354.1964.
[0113]
6-苄基-3-苯基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7i):棕黄色固体,收率:33.3%。m.p.104.3~105.2℃.1h nmr(400mhz,dmso-d6)δ8.73(s,1h),8.50(s,1h),8.27
(d,j=7.6hz,1h),7.89(s,1h),7.66(d,j=7.2hz,2h),7.57(t,j=7.6hz,2h),7.53
–
7.49(m,2h),7.44(t,j=7.6hz,1h),7.32
–
7.27(m,3h),7.23
–
7.18(m,1h),7.15(t,j=8.8hz,2h),5.58(s,2h).
13
c nmr(100mhz,dmso-d6)δ144.89,140.32,133.73,133.64,133.26,131.15,129.84,129.50,128.16,127.92,127.56,127.33,126.67,126.13,124.58,122.50,121.74,119.92,109.57,106.88,103.59,45.87.hrms(esi)m/z calcd for c
26h20n3+
(m+h)
+
374.1652,found 374.1649.
[0114]
3,6-二苄基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7j):黄色固体,收率:38.5%。m.p.225.4~226.1℃.1h nmr(400mhz,dmso-d6)δ8.54(s,1h),8.38(s,1h),8.23(d,j=7.6hz,1h),7.55
–
7.48(m,2h),7.34
–
7.18(m,12h),5.50(s,2h),4.37(s,2h).
13
c nmr(100mhz,dmso-d6)δ144.05,142.49,142.47,137.56,137.08,132.48,132.43,128.56,128.50,128.48,127.34,127.19,126.40,125.09,122.52,121.72,121.43,119.03,109.01,105.99,102.96,45.94,29.59.hrms(esi)m/z calcd for c
27h22n3+
(m+h)
+
388.1808,found 388.1810.
[0115]
6-苄基-3-乙基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7k):黄褐色固体,收率:36.4%。m.p.192.1~192.9℃.1h nmr(400mhz,dmso-d6)δ8.58(s,1h),8.37(s,1h),8.23(d,j=6.2hz,1h),7.52(s,1h),7.45(d,j=9.8hz,2h),7.27(s,5h),7.17(d,j=6.9hz,1h),5.58(s,2h),2.92(d,j=6.4hz,2h),1.35(s,3h).
13
c nmr(100mhz,dmso-d6)δ144.08,142.13,137.27,132.80,130.31,128.58,128.44,127.29,126.95,125.01,124.92,121.70,121.54,119.01,109.01,105.79,102.91,45.89,17.16,11.19.hrms(esi)m/z calcd for c
22h20n3+
(m+h)
+
326.1651,found 326.1652.
[0116]
6-苄基-3-己基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7l):黄褐色固体,收率:38.6%。m.p.173.7~174.3℃.1h nmr(400mhz,dmso-d6)δ8.58(s,1h),8.36(s,1h),8.23(d,j=7.7hz,1h),7.51(s,1h),7.47
–
7.43(m,2h),7.31
–
7.23(m,5h),7.16(t,j=7.1hz,1h),5.59(s,2h),1.76
–
1.67(m,2h),1.44
–
1.36(m,2h),1.35
–
1.21(m,6h),0.86(t,j=6.9hz,3h).
13
c nmr(100mhz,dmso-d6)δ144.11,141.91,137.27,132.79,130.65,128.56,128.49,127.30,126.97,125.09,123.58,121.73,121.49,119.04,109.03,105.67,103.08,45.90,31.04,28.55,26.20,23.58,22.06,13.94.hrms(esi)m/z calcd for c
26h28n3+
(m+h)
+
382.2278,found 382.2279.
[0117]
6-苄基-3-((5-甲基呋喃-2-基)甲基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7m):黄绿色固体,收率:30.5%。m.p.114.2~115.1℃.1h nmr(400mhz,dmso-d6)δ8.62(s,1h),8.39(s,1h),8.24(d,j=7.6hz,1h),7.57(s,1h),7.52
–
7.45(m,2h),7.28
–
7.24(m,4h),6.09(d,j=2.6hz,1h),5.92(d,j=1.5hz,1h),5.54(s,2h),4.37(s,2h),3.33(s,2h),2.14(s,3h).
13
c nmr(100mhz,dmso-d6)δ150.42,148.81,144.09,142.49,137.11,132.54,132.48,128.57,128.53,127.34,127.06,125.13,121.76,121.43,119.58,119.05,109.01,107.46,106.35,105.95,103.24,45.94,22.97,13.21.hrms(esi)m/z calcd for c
26h22
n3o
+
(m+h)
+
392.1757,found 392.1760.
[0118]
6-(4-氟苄基)-3-苯基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7n):黄色固体,收率:43.6%。m.p.103.2~103.9℃.1h nmr(400mhz,dmso-d6)δ8.73(s,1h),8.50(s,1h),8.28(d,j=7.6hz,1h),7.89(s,1h),7.67(d,j=7.2hz,2h),7.57(t,j=7.6hz,2h),c26h21
fn3o
+
(m+h)
+
410.1663,found410.1666.
[0123]
6-(3-氯苄基)-3-苯基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7s):黄色固体,收率:31.7%。m.p.225.4~226.3℃.1h nmr(400mhz,dmso-d6)δ8.77(s,1h),8.52(s,1h),8.30(d,j=7.6hz,1h),7.91(s,1h),7.67(d,j=7.6hz,2h),7.61
–
7.51(m,4h),7.45(t,j=7.2hz,1h),7.40(s,1h),7.34
–
7.28(m,2h),7.25
–
7.20(m,1h),7.13(d,j=5.2hz,1h),5.62(s,2h).
13
c nmr(100mhz,dmso-d6)δ144.37,143.13,139.81,133.22,133.13,132.75,130.64,129.33,128.99,127.65,127.41,127.05,126.81,126.16,125.61,124.06,121.99,121.23,119.41,109.06,106.37,103.08,45.36.hrms(esi)m/z calcd for c
26h19
cln
3+
(m+h)
+
408.1262,found 408.1266.
[0124]
3-苄基-6-(3-氯苄基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7t):黄色固体,收率:44.6%。m.p.160.5~161.6℃.1h nmr(400mhz,dmso-d6)δ8.55(s,1h),8.40(s,1h),8.25(d,j=7.6hz,1h),7.54(s,1h),7.52
–
7.47(m,2h),7.31(d,j=7.5hz,4h),7.26(t,j=7.4hz,3h),7.19(dd,j=8.9,4.7hz,2h),7.09(d,j=7.3hz,1h),5.54(s,2h),4.36(s,2h).
13
c nmr(100mhz,dmso-d6)δ144.47,142.88,140.19,138.04,133.67,132.88,132.81,131.01,129.11,128.95,128.91,127.86,127.31,126.88,126.04,125.57,123.21,122.30,121.93,119.75,109.38,106.55,103.44,45.84,30.04.hrms(esi)m/z calcd for c
27h21
cln
3+
(m+h)
+
422.1418,found 422.1422.
[0125]
6-(3-氯苄基)-3-乙基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7u):黄色固体,收率:42.4%。m.p.214.1~214.8℃.1h nmr(400mhz,dmso-d6)δ8.66(s,1h),8.40(s,1h),8.26(d,j=7.5hz,1h),7.56(s,1h),7.52
–
7.43(m,2h),7.38(s,1h),7.31(d,j=4.6hz,2h),7.18(dd,j=14.2,6.2hz,2h),5.62(s,2h),2.95(q,j=7.3hz,2h),1.37(t,j=7.4hz,3h).
13
c nmr(100mhz,dmso-d6)δ143.95,139.88,133.17,132.72,131.52,130.57,129.95,128.65,127.31,126.87,125.51,125.18,125.15,121.84,121.51,119.28,109.00,105.71,103.15,45.32,17.15,11.17.hrms(esi)m/z calcd for c
22h19
cln
3+
(m+h)
+
360.1262,found 360.1262.
[0126]
6-(3-氯苄基)-3-己基-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7v):黄色固体,收率:32.7%。m.p.110.3~111.2℃.1h nmr(400mhz,dmso-d6)δ8.60(s,1h),8.37(s,1h),8.24(d,j=7.6hz,1h),7.53
–
7.43(m,3h),7.37(s,1h),7.30(d,j=4.5hz,2h),7.17(dd,j=12.8,5.7hz,2h),5.60(s,2h),2.92(t,j=7.4hz,2h),1.76
–
1.68(m,2h),1.38(d,j=6.9hz,2h),1.28(d,j=2.7hz,4h),0.85(t,j=6.5hz,3h).
13
c nmr(100mhz,dmso-d6)δ143.94,142.04,139.91,133.18,132.62,130.94,130.54,128.54,127.30,126.88,125.51,124.93,123.63,121.77,121.57,119.22,108.93,105.87,103.07,45.31,31.03,28.55,26.21,23.58,22.06,13.92.hrms(esi)m/z calcd for c
26h27
cln
3+
(m+h)
+
416.1888,found 416.1892.
[0127]
6-(3-氯苄基)-3-((5-甲基呋喃-2-基)甲基)-6h-咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚(7w):黄绿色固体,收率:27.3%。m.p.116.2~117.3℃.1h nmr(400mhz,dmso-d6)δ8.61(s,1h),8.40(s,1h),8.25(d,j=7.6hz,1h),7.57(s,1h),7.49(d,j=3.6hz,2h),7.31(t,j=11.1hz,3h),7.21
–
7.16(m,1h),7.12(d,j=6.5hz,1h),6.07(d,j=2.6hz,1h),5.89(d,j=1.4hz,1h),5.56(s,2h),4.36(s,2h),2.11(s,3h).
13
c nmr(100mhz,dmso-d6)δ
150.41,148.73,144.01,142.45,139.76,133.22,132.46,132.38,130.54,128.66,127.36,126.80,125.50,125.13,121.85,121.44,119.69,119.27,108.91,107.41,106.33,106.04,103.27,45.35,22.94,13.18.hrms(esi)m/z calcd for c
26h21
cln3o
+
(m+h)
+
426.1368,found 426.1370.
[0128]
实施例2.
[0129]
体外抗肿瘤活性研究
[0130]
以a549(肺癌细胞),bgc-823(胃癌细胞),ct-26(结肠癌细胞),bel-7402(肝癌细胞)和mcf-7(乳腺癌细胞)为对象,采用mtt法测试了目标化合物7a-7w对肿瘤细胞株的抑制活性。分别将生长状态良好、处于对数生长期的细胞株以1
×
104ml-1
的浓度接种于96孔板,置于37℃的co2培养箱中培养24h,弃旧液,换新鲜培养液,加入灭菌处理的待测化合物,继续培养48h后,弃去培养液,每孔加20μl含5mg
·
ml-1
mtt的rpmi1640培养液,继续培养4h,小心除去上清后,每孔加入100μl的dmso,振荡约10min溶解沉淀,随后用酶标仪检测od值,波长490nm,按作图法求出每个样品的ic
50
值。
[0131]
表1化合物7a-7w的体外抗肿瘤活性(ic
50
,μmol
·
l-1
)
[0132][0133][0134]
由表1可知,合成的咪唑并[1',2':1,6]吡啶并[3,4-b]吲哚化合物具有较好的抗肿瘤活性,可应用于抗肿瘤药物中。
[0135]
实施例3.
[0136]
我们在此进行分子对接研究对目标化合物与受体蛋白之间的结合能力进行研究以推测该化合物的生物活性。本实施例使用openeye软件对体外活性较好的化合物7a、7k、7q与kit蛋白受体(pdb code:7khj)进行分子对接。为得出这些分子与7khj结合能量大小的比较,本技术将对每个分子的低能量构象的结合能数据进行比较,三维构象图如图1-3所
示。
[0137]
结果表明,化合物7a、7k、7q能够与靶标蛋白很好的结合,这也侧面印证了该类化合物的体外抗肿瘤活性的能力大小。
[0138]
以上所述,仅是本发明实施例的较佳实施例而已,并非对本发明实施例作任何形式上的限制,依据本发明实施例的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明实施例技术方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1