一种含钌催化剂及其制备方法与用途与流程
1.本发明涉及有机合成技术领域,具体涉及一种含钌催化剂及其制备方法与用途。
背景技术:
2.高分子合成化学是高分子科学的重要分支,其最基本的任务是设计合成新单体,发展新的聚合方法和化学转化方法,实现对聚合物结构、组成和功能的控制。开环易位聚合(romp)已经成为一种非常重要的聚合手段之一,这得益于众多高效聚合催化剂的发明。相比于其他金属催化的聚合反应,钌金属催化的烯烃复分解聚合不但具有很高的聚合活性,而且也具有优良的极性官能团耐受性,且可实现聚合物末端功能化等特点,但是对于催化剂的使用效率较低,可能与配体和金属的配位能力有关。
3.而杂环卡宾(nhcs)配体具有与烷基膦配体相似的电子性质,已经在有机金属化学和催化化学方面得到广泛应用,在复分解催化剂中应用也较为广泛,且n-杂环卡宾(nhcs)配体稳定性较高,易与制备,环境友好,配位能力强,几乎可以与所有的金属元素形成稳定的配合物;并且亲核性强,可以作为有机小分子催化剂参与催化反应。
4.现有技术如公开号cn104220418a公开了一种钌基复分解催化剂以及用于其制备的前体;其是针对格拉布型的钌基复分解催化剂;且制得的新的基于二芳胺基的n-螯合钌催化剂在固态和溶液中均是稳定的并显示快速引发行为;也公开了相应的n-取代的苯乙烯前体化合物;该催化剂是在交叉复分解反应中从n-取代的苯乙烯前体开始制备的。该新的格拉布催化剂适用于催化闭环复分解(rcm)、交叉复分解(cm)以及开环复分解聚合(romp)。低催化剂负载量足以通过复分解反应转化宽范围的底物。
技术实现要素:
5.本发明的目的在于提供一种对顺丁烯二甲酸二甲酯与油酸甲酯乙烯解反应、环辛烯的开环易位聚合反应与二烯丙基丙二酸二乙酯的关环反应具有优良催化效果的含钌催化剂。
6.本发明为实现上述目的所采取的技术方案为:
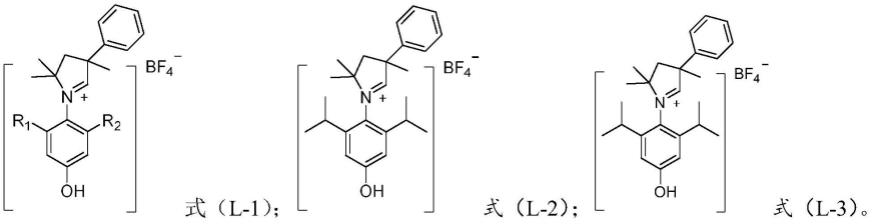
7.一种式(ⅰ)结构式的化合物:
[0008][0009]
其中,r1、r2各自独立地选自h、c1~c
10
烷基或c1~c
10
烷氧基。
[0010]
本发明采用式(i)化合物中n-杂环骨架上不同的取代基,以及对位羟基的吸电子
效应使得其展现出优秀的钌金属配位性质,所制备的含钌催化剂对顺丁烯二甲酸二甲酯与油酸甲酯乙烯解反应、环辛烯的开环易位聚合反应与二烯丙基丙二酸二乙酯的关环反应具有优良的催化效果。
[0011]
需要说明的是,根据本发明一实施方式,r1、r2选自h、甲基、乙基、异丙基;最优选为甲基、乙基、异丙基。
[0012]
进一步需要说明的是,根据本发明一实施方式,式(ⅰ)结构选自如下结构之一所示的化合物:
[0013][0014]
本发明还公开了一种式(i)结构的化合物的制备方法,包括:
[0015]
式(ii)结构的化合物和式(iii)结构的化合物反应,得到式(iv)结构的化合物;式(iv)结构的化合物通过关环反应,得到式(i)结构的化合物;
[0016][0017]
其中,r1、r2各自独立地选自h、c1~c
10
烷基或c1~c
10
烷氧基。
[0018]
本发明的另一目的是提供一种含钌催化剂。
[0019]
本发明公开了基于式(i)结构的化合物的含钌催化剂,其为如下结构之一所示的化合物:
[0020][0021]
其中,r1、r2各自独立地选自h、c1~c
10
烷基或c1~c
10
烷氧基。
[0022]
需要说明的是,根据本发明一实施方式,式(v)结构选自如下结构之一所示的化合物:
[0023][0024]
式(vi)结构选自如下结构之一所示的化合物:
[0025][0026]
本发明还公开了一种含钌催化剂的制备方法,包括:
[0027]
将式(i)结构的化合物与式(vii)结构钌前驱体反应,得到式(v)结构的钌化合物;或,
[0028]
将式(i)结构的化合物与式(viii)结构的钌前驱体反应,得到式(vi)结构的钌化合物;
[0029][0030]
本发明采用式(l-1)、(l-2)、(l-3)结构的化合物与式(vii)结构的化合物或式(viii)结构的化合物反应制得的式(v-1)、式(v-2)、式(v-3)与式(vi-1)、式(vi-2)、式(vi-3)结构所示的含钌催化剂,该含钌催化剂对烯烃复分解反应具有优良的催化效果。同时,随着催化温度的升高,式(vi-1)、式(vi-2)、式(vi-3)结构所示的含钌催化剂能够明显提高其对顺丁烯二甲酸二甲酯乙烯解反应、环辛烯的开环易位聚合反应与二烯丙基丙二酸二乙酯的关环反应的催化效果;且随着乙烯压力的增加,式(v-1)、式(v-2)、式(v-3)与式(vi-1)、式(vi-2)、式(vi-3)结构所示的含钌催化剂均能进一步提高对顺丁烯二甲酸二甲酯乙烯解的催化效果。除此之外,随着反应时间的增加,式(vi-1)、式(vi-2)、式(vi-3)结构所示的含钌催化剂对环辛烯的开环易位聚合反应与二烯丙基丙二酸二乙酯的关环反应具有更为优良的催化效果。
[0031]
本发明还公开了含钌催化剂在催化烯烃复分解反应中的用途。
[0032]
需要说明的是,式(v-1)与式(vi-3)所示的含钌催化剂共同使用在提高催化顺丁烯二甲酸二甲酯的乙烯解反应、油酸甲酯乙烯解反应、环辛烯的开环易位聚合反应和/或二烯丙基丙二酸二乙酯关环反应中的用途。
[0033]
进一步需要说明的是,式(v-1)所示的含钌催化剂与式(vi-3)所示的含钌催化剂的摩尔比为0.5~1:1。
[0034]
本发明将式(v-1)与式(vi-3)所示的含钌催化剂共同使用,其进一步提高了含钌催化剂对顺丁烯二甲酸二甲酯与油酸甲酯乙烯解反应、环辛烯的开环易位聚合反应、二烯丙基丙二酸二乙酯关环反应的催化效果。
[0035]
本发明的技术效果如下:
[0036]
(1)采用式(ⅰ)结构的化合物为反应物制得含钌催化剂,该含钌催化剂对顺丁烯二甲酸二甲酯、油酸甲酯、油酸、油醇的乙烯解反应、环辛烯的开环易位聚合反应与二烯丙基丙二酸二乙酯的关环反应具有优良的催化效果。
[0037]
(2)随着催化温度的升高,式(vi-1)、式(vi-2)、式(vi-3)结构所示的含钌催化剂能够明显提高其对顺丁烯二甲酸二甲酯乙烯解反应、环辛烯的开环易位聚合反应与二烯丙基丙二酸二乙酯的关环反应的催化效果。
[0038]
(3)随着乙烯压力的增加,式(v-1)、式(v-2)、式(v-3)与式(vi-1)、式(vi-2)、式(vi-3)结构所示的含钌催化剂均能进一步提高对顺丁烯二甲酸二甲酯乙烯解的催化效果。
[0039]
(4)随着反应时间的增加,式(vi-1)、式(vi-2)、式(vi-3)结构所示的含钌催化剂对环辛烯的开环易位聚合反应与二烯丙基丙二酸二乙酯的关环反应具有更为优良的催化效果。
[0040]
因此,本发明是一种对顺丁烯二甲酸二甲酯与油酸甲酯乙烯解反应、环辛烯的开环易位聚合反应与二烯丙基丙二酸二乙酯的关环反应具有优良催化效果的含钌催化剂。
附图说明
[0041]
图1为式(l-1)结构的化合物的1h核磁共振光谱;
[0042]
图2为式(l-1)结构的化合物的
19
f核磁共振光谱;
[0043]
图3为式(l-1)结构的化合物的
13
c核磁共振光谱;
[0044]
图4为式(l-2)结构的化合物的1h核磁共振光谱;
[0045]
图5为式(l-2)结构的化合物的
19
f核磁共振光谱;
[0046]
图6为式(l-2)结构的化合物的
13
c核磁共振光谱;
[0047]
图7为式(l-3)结构的化合物的1h核磁共振光谱;
[0048]
图8为式(l-3)结构的化合物的
19
f核磁共振光谱;
[0049]
图9为式(l-3)结构的化合物的
13
c核磁共振光谱;
[0050]
图10为ru-1含钌催化剂的1h核磁共振光谱;
[0051]
图11为ru-2含钌催化剂的1h核磁共振光谱。
具体实施方式
[0052]
本发明提供了含钌催化剂及其制备方法与用途,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都属于本发明保护的范围。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
[0053]
本发明中式(ⅰ)结构的化合物优选具有如下结构所示的化合物:
[0054][0055]
需要说明的是,本发明对于上述化合物的来源不进行限定,可以为市售,也可以按照本领域常规的方法制备,本发明对此并无限定。
[0056]
在本发明的一些实施例中,一种式(i)结构的化合物的制备方法,其步骤优选为:
[0057]
将式(ii)结构的化合物a与式(iii)结构的化合物b溶解在溶剂中,并加入催化剂和干燥剂,进行加热反应,柱层析分离得到目标产物式(iv)结构的化合物c;
[0058]
在-75~85℃下,向溶解式(iv)结构的化合物的溶剂中加入盐酸乙醚溶液,搅拌1~2h,再缓慢升至室温,待升至室温后,将反应瓶放入85~95℃的油浴锅中,反应8~12h,重结晶得到盐酸盐化合物,再加丙酮溶解,加入四氟硼化铵的水溶液,室温搅拌2~4h,重结晶得到式(i)结构的化合物d,产率为72~83%。
[0059]
需要说明的是,在式(i)结构的化合物的制备方法中,催化剂优选为对甲基苯磺酸。
[0060]
需要说明的是,在式(i)结构的化合物的制备方法中,干燥剂优选为多孔活化的分子筛。
[0061]
需要说明的是,在式(i)结构的化合物的制备方法中,加热反应温度为105~120℃,反应时间为10~14h。
[0062]
需要说明的是,在式(i)结构的化合物的制备方法中,式(ii)结构的化合物与式(iii)结构的化合物的摩尔比为1:1~2。
[0063]
需要说明的是,在式(i)结构的化合物的制备方法中,按重量份计,化合物a为2.2~3.5份,化合物b为3.2~4.5份、溶剂为90~120份、催化剂为0.25~0.55份、干燥剂为0.5~0.85份、盐酸乙醚溶液为45~65份,其中盐酸乙醚溶液的浓度为2.5~5.5mol/l、丙酮为50~80份、20~30份四氟硼化铵的水溶液,其中四氟硼化铵的水溶液的浓度为2~4mol/l。
[0064]
需要说明的是,本发明对于所述重结晶不进行限定,本领域技术人员熟知的即可。
[0065]
需要说明的是,本发明对于所述柱层析不进行限定,本领域技术人员熟知的即可。
[0066]
具体反应路线如下:
[0067][0068]
在本发明中,基于式(i)结构的化合物的含钌催化剂的制备方法优选在手套箱中
进行。
[0069]
在本发明的一些实施例中,式(v)结构化合物的含钌催化剂的制备方法,其优选步骤为:在手套箱中,向溶解式(i)结构化合物d的溶剂中加入双(三甲基硅烷基)氨基钾溶液,室温搅拌1~2h;再加入式(vii)结构的化合物e,室温搅拌3~7h,过滤得到深绿色固体式(v)化合物f,产率为75~85%。
[0070]
具体反应路线如下:
[0071][0072]
需要说明的是,在式(v)结构化合物的含钌催化剂的制备方法中,式(i)结构的化合物与式(vii)结构化合物的摩尔比为1~2:1。
[0073]
需要说明的是,在式(v)结构化合物的含钌催化剂的制备方法中,按重量份计,化合物d为0.35~0.65份、溶剂为10~30份、双(三甲基硅烷基)氨基锂溶液为0.75~1.5份,其中双(三甲基硅烷基)氨基锂溶液的浓度为4.5~6.5mol/l、化合物e为0.45~0.95份。
[0074]
在本发明的一些实施例中,式(vi)结构化合物的含钌催化剂的制备方法,其优选步骤为:向溶解式(i)结构化合物d的溶剂中加入双(三甲基硅烷基)氨基锂溶液,加热搅拌反应,再加入式(viii)结构化合物g,继续搅拌反应2~4h,过滤得到深红色固体式(vi)化合物h,产率为72~86%。
[0075]
具体反应路线如下:
[0076][0077]
需要说明的是,在式(vi)结构化合物的含钌催化剂的制备方法中,加热温度为75~90℃,反应时间为0.5~1.5h。
[0078]
需要说明的是,在式(vi)结构化合物的含钌催化剂的制备方法中,式(i)结构的化合物与式(viii)结构化合物的摩尔比为2~3:1。
[0079]
需要说明的是,在式(vi)结构化合物的含钌催化剂的制备方法中,按重量份计,化合物d为0.35~0.65份、溶剂为10~30份、双(三甲基硅烷基)氨基锂溶液为0.75~1.5份,其
中双(三甲基硅烷基)氨基锂溶液的浓度为4.5~6.5mol/l、化合物g为0.35~0.7份。
[0080]
需要说明的是,本发明实施例中所用溶剂为甲苯、二氯甲烷、四氢呋喃中的至少一种。
[0081]
以下结合具体实施方式和附图对本发明的技术方案作进一步详细描述:
[0082]
实施例1:
[0083]
式(i)结构化合物中2h-吡咯-3,4-二氢-2,2,4-三甲基-4-苯基-1-(2,6-二甲基-4-羟基苯基)-四氟硼酸盐的制备方法,包括:
[0084]
具体反应路线如下:
[0085][0086]
将化合物a(2.74g,20.0mmol)与化合物b(3.76g,20.0mmol)溶解在100ml甲苯溶剂中,并加入催化剂对甲基苯磺酸(0.1mmol,17.3mg)和干燥剂(2g,分子筛型号为sba 15),在110℃下反应12h,柱层析分离得到化合物c;在-78℃下,将化合物c(6.14g,20.0mmol)溶解在甲苯中,再向溶液中加入盐酸乙醚溶液50ml(自制,hcl气体溶解在乙醚溶剂中,5mol/l),-78℃下搅拌1h,再缓慢升至室温,待升至室温后,将反应瓶放入90℃的油浴锅中,反应10h,重结晶得到盐酸盐化合物,再加100ml丙酮溶解,加入四氟硼化铵的水溶液(50ml,1mol/l),室温搅拌3h,重结晶得到化合物l-1(6g,75%)。
[0087]1h nmr(400mhz,meod):δ9.65(s,1h),7.57-7.51(m,4h),7.45-7.43(m,1h),6.77-6.72(dd,j=4hz,2h),3.18-3.15(d,j=12hz,12hz,1h),2.84-2.81(d,j=12hz,1h),2.33(s,3h),2.14(s,3h),1.96(s,3h),1.66(s,3h),1.47(s,3h);
[0088]
13
c nmr(101mhz,meod):δ190.50,158.98,141.31,135.49,135.14,129.59,128.20,125.52,115.99,84.28,54.76,27.27,26.56,26.28,18.29;
[0089]
19
f nmr(376mhz,meod):δ:154.24;
[0090]
esi-ms(m/z):[m+h]
+
calcd for c
21h26
bf4no,396.204;found:396.215。
[0091]
实施例2:
[0092]
式(i)结构化合物中2h-吡咯-3,4-二氢-2,2,4-三甲基-4-苯基-1-(2,6-二乙基-4-羟基苯基)-四氟硼酸盐的制备方法,包括:
[0093]
具体反应路线如下:
[0094]
[0095]
步骤同上,投入2,6-二乙基-4-羟基苯胺a(3.3g,20.0mmol),得到白色固体l-2(6.4g,76%)。
[0096]1h nmr(400mhz,meod):δ9.82(s,1h),7.55-7.54(d,j=4hz,4h),7.47-7.43(q,1h),6.77-6.72(dd,j=4hz,2h),3.22-3.18(d,j=16hz,1h),2.85-2.82(d,j=12hz,1h),2.72-2.63(m,1h),2.59-2.42(m,2h),2.33-2.24(m,1h),1.95(s,3h),1.60(s,3h),1.40(s,3h),1.32-1.28(t,j=8hz,3h),1.20-1.16(t,j=8hz,3h);
[0097]
13
c nmr(101mhz,meod):δ190.42,159.72,141.50,141.36,141.19,129.58,128.28,125.46,114.21,83.89,54.80,27.16,26.06,25.96,24.84,24.61,14.53,14.26;
[0098]
19
f nmr(376mhz,meod):δ:154.12;
[0099]
esi-ms(m/z):[m+h]
+
calcd for c
23h30
bf4no,424.236;found:424.255。
[0100]
实施例3:
[0101]
式(i)结构化合物中2h-吡咯-3,4-二氢-2,2,4-三甲基-4-苯基-1-(2,6-二异丙基-4-羟基苯基)-四氟硼酸盐的制备方法,包括:
[0102]
具体反应路线如下:
[0103][0104]
步骤同上,投入2,6-二异丙基-4-羟基苯胺a(3.86g,20.0mmol),得到白色固体l-3(6.5g,72%)。
[0105]1h nmr(400mhz,meod):δ9.90(s,1h),7.55-7.54(d,j=4hz,4h),7.48-7.43(q,1h),6.88-6.83(dd,j=4hz,2h),3.26-3.22(d,j=16hz,1h),2.89-2.85(d,j=16hz,1h),2.83-2.80(m,1h),2.54-2.48(m,1h),1.94(s,3h),1.62(s,3h),1.42-1.40(t,j=8hz,3h),1.25-1.21(dd,j=8hz,8hz,6h),1.16-1.14(d,j=8hz,3h);
[0106]
13
c nmr(101mhz,meod):δ190.56,160.28,146.47,145.97,141.37,129.58,128.32,125.46,111.80,111.72,83.65,54.77,29.59,29.14,27.01,26.02,25.93,24.90,24.78,20.97,20.77;
[0107]
19
f nmr(376mhz,meod):δ:153.99;
[0108]
esi-ms(m/z):[m+h]
+
calcd for c
25h34
bf4no,452.267;found:452.278。
[0109]
实施例4:
[0110]
一种2h-吡咯-3,4-二氢-2,2,4-三甲基-4-苯基-1-(2,6-二甲基-4-羟基苯基)-钌催化剂的制备方法,包括:
[0111]
具体反应路线如下:
[0112][0113]
在手套箱中,将化合物d(395mg,1.0mmol)用10ml四氢呋喃溶解,向溶液中加入1ml khmds(双(三甲基硅烷基)氨基钾)溶液(0.5mol/l的四氢呋喃溶液),搅拌反应1h,再加入化合物e(600mg,1.0mmol)室温反应4h,浓缩反应液,加20ml正己烷重结晶得到深绿色钌配合物ru-1(500mg,80%)(即式(v-1))。
[0114]1h nmr(400mhz,c6d6):δ17.72(s,1h),8.17(s,1h),7.65-7.61(m,2h),7.46-7.44(d,j=8hz,1h),7.25-7.19(m,2h),6.69-6.65(m,1h),6.59(s,1h),6.43-6.38(m,1h),6.19(s,1h),5.25(s,0.53h),4.36-4.31(m,1.47h),2.53(s,2h),2.42(s,2h),1.92(s,6h),1.84(m,6h),1.66(s,3h),1.45(s,3h),1.18(s,3h),0.87(s,2h);
[0115]
13
c nmr(101mhz,cdcl3):δ194.50,157.98,156.21,150,16,148.33,144.56,141.31,140.52,135.49,135.14,129.59,128.20,125.52,120.23,115.99,84.28,54.76,46.24,27.27,26.56,26.28,24.66,18.29;
[0116]
maldi-tof-ms(m/z):calcd for c
31h38cl2
no2ru,628.132;found:628.155。
[0117]
实施例5:
[0118]
一种2h-吡咯-3,4-二氢-2,2,4-三甲基-4-苯基-1-(2,6-二甲基-4-羟基苯基)-钌催化剂的制备方法,包括:
[0119]
具体反应路线如下:
[0120][0121]
步骤同上,投入四氟硼酸盐化合物d(423mg,1.0mmol),重结晶得到深绿色钌配合物ru-2(540mg,82%)(即式(v-2))。
[0122]1h nmr(400mhz,c6d6):δ17.82(s,1h),8.21(s,1h),7.65-7.62(m,2h),7.48-7.46(d,j=8hz,1h),7.26-7.22(m,2h),6.69-6.65(m,1h),6.61(s,1h),6.41-6.36(m,1h),6.10(s,1h),5.32(s,0.53h),4.36-4.32(m,1.47h),3.33-3.26(m,4h),2.43(s,2h),2.41(s,2h),1.92(s,6h),1.81(m,6h),1.68(s,3h),1.44(s,3h),1.18(s,3h),0.87(s,2h);
[0123]
13
c nmr(101mhz,c6d6):δ194.50,157.98,156.21,150,16,148.33,144.56,141.31,140.52,135.49,135.14,129.59,128.20,125.52,120.23,115.99,84.28,54.76,
46.24,28.87,27.27,26.88,26.56,26.28,24.66,18.29;
[0124]
maldi-tof-ms(m/z):calcd for c
33h42
cl2no2ru,656.164;found:656.169。
[0125]
实施例6:
[0126]
一种2h-吡咯-3,4-二氢-2,2,4-三甲基-4-苯基-1-(2,6-二甲基-4-羟基苯基)-钌催化剂的制备方法,包括:
[0127]
具体反应路线如下:
[0128][0129]
步骤同上,投入四氟硼酸盐化合物d(450mg,1.0mmol),重结晶得到深绿色钌配合物ru-3(540mg,79%)(即式(v-3))。
[0130]1h nmr(400mhz,c6d6):δ17.78(s,1h),8.25(s,1h),7.68-7.65(m,2h),7.46-7.44(d,j=8hz,1h),7.27-7.24(m,2h),6.69-6.64(m,1h),6.51(s,1h),6.42-6.37(m,1h),6.30(s,1h),5.42(s,0.53h),4.38-4.34(m,1.47h),4.11(m,2h),3.34-3.25(m,4h),2.45(s,2h),2.42(s,2h),1.88(s,6h),1.81(m,6h),1.66(s,3h),1.54(s,6h),1.20(s,6h),0.89(s,2h);
[0131]
13
c nmr(101mhz,c6d6):δ194.50,157.98,156.21,150,16,148.33,144.56,141.31,140.52,135.49,135.14,129.59,128.20,125.52,120.23,115.99,84.28,54.76,46.24,28.87,27.27,26.88,26.56,26.28,24.66,22.15,18.29;
[0132]
maldi-tof-ms(m/z):calcd for c
35h46
cl2no2ru,684.195;found:684.210。
[0133]
实施例7:
[0134]
一种2h-吡咯-3,4-二氢-2,2,4-三甲基-4-苯基-1-(2,6-二甲基-4-羟基苯基)-钌催化剂的制备方法,包括:
[0135]
具体反应路线如下:
[0136][0137]
在手套箱中,将化合物d(395mg,1.0mmol)用10ml甲苯溶解,向溶液中加入1ml lihmds(双(三甲基硅烷基)氨基锂)溶液(0.5mol/l的四氢呋喃溶液),搅拌反应0.5h,再加
入化合物e(443mg,0.5mmol)80℃反应3h,浓缩反应液,加20ml正己烷重结晶得到深红色钌配合物ru-4(730mg,75%)(即式(vi-1))。
[0138]1h nmr(400mhz,c6d6):δ8.11-8.09(d,j=8hz,2h),7.77-7.75(d,j=8hz,4h),7.62-7.60(m,2h),7.55(m,5h),7.52-7.50(m,2h),6.69-6.65(m,4h),6.59(s,2h),6.43-6.38(m,1h),6.19(s,2h),5.25(s,0.53h),4.36-4.31(m,1.47h),2.53(s,2h),2.42(s,2h),1.92(s,6h),1.84(m,6h),1.72(s,6h),1.66(s,6h),1.45(s,3h),1.18(s,3h),0.87(s,2h);
[0139]
13
c nmr(101mhz,c6d6)δ195.50,157.78,154.21,154.01,153,16,151.21,149.38,143.76,142.51,141.22,138.69,137.17,126.49,126.20,125.42,120.73,117.65,104.28,84.76,66.24,57.27,28.56,24.28,18.29;
[0140]
maldi-tof-ms(m/z):calcd for c
57h62
cl2n2o2ru,978.323;found:978.355。
[0141]
实施例8:
[0142]
一种2h-吡咯-3,4-二氢-2,2,4-三甲基-4-苯基-1-(2,6-二乙基-4-羟基苯基)-钌催化剂的制备方法,包括:
[0143]
具体反应路线如下:
[0144][0145]
步骤同上,投入四氟硼酸盐化合物d(423mg,1.0mmol),加20ml正己烷重结晶得到深红色钌配合物ru-5(807mg,78%)(即式(vi-2))。
[0146]1h nmr(400mhz,c6d6):δ8.16-8.13(d,j=8hz,2h),7.75-7.73(d,j=8hz,4h),7.61-7.58(m,2h),7.53(m,5h),7.51-7.48(m,2h),6.72-6.68(m,4h),6.59(s,2h),6.46-6.42(m,1h),6.17(s,2h),5.21(s,0.53h),4.33-4.31(m,1.47h),2.89-2.86(q,j=4hz,4h),2.68-2.64(q,j=4hz,4h),2.43(s,2h),2.40(s,2h),1.93(s,6h),1.87(m,6h),1.79(s,6h),1.76(s,6h),1.55(s,3h),1.18(s,3h),0.87(s,2h);
[0147]
13
c nmr(101mhz,c6d6):δ194.50,158.48,156.61,153.41,153,10,151.71,149.88,143.46,142.74,140.22,138.27,138.13,127.29,126.27,125.32,121.73,118.65,109.18,85.76,57.24,49.37,29.36,28.18,18.29;
[0148]
maldi-tof-ms(m/z):calcd for c
61h70
cl2n2o2ru,1034.386;found:1034.399。
[0149]
实施例9:
[0150]
一种2h-吡咯-3,4-二氢-2,2,4-三甲基-4-苯基-1-(2,6-二异丙基-4-羟基苯基)-钌催化剂的制备方法,包括:
[0151]
具体反应路线如下:
[0152][0153]
步骤同上,投入四氟硼酸盐化合物d(450mg,1.0mmol),加20ml正己烷重结晶得到深红色钌配合物ru-6(870mg,80%)(即式(vi-3))。
[0154]1h nmr(400mhz,c6d6):δ8.14-8.11(d,j=8hz,2h),7.78-7.75(d,j=8hz,4h),7.65-7.59(m,2h),7.56(m,5h),7.54-7.50(m,2h),6.74-6.70(m,4h),6.61(s,2h),6.54-6.51(m,1h),6.37(s,2h),5.41(s,0.53h),4.36-4.33(m,1.47h),2.89-2.87(q,j=4hz,4h),2.80(m,4h),2.69-2.66(q,j=4hz,4h),2.45(s,2h),2.42(s,2h),1.91(s,6h),1.88(m,6h),1.79(s,6h),1.72(s,6h),1.51(s,3h),1.28(s,3h),0.87(s,2h);
[0155]
13
c nmr(101mhz,c6d6):δ192.81,159.28,157.65,155.34,153,40,152.72,149.88,144.36,141.84,140.26,138.47,138.18,127.69,126.47,125.38,121.63,118.67,109.88,85.63,60.47,58.24,48.37,27.37,22.87,18.26;
[0156]
maldi-tof-ms(m/z):calcd for c
65h78
cl2n2o2ru,1090.448;found:1090.462。
[0157]
实施例10:
[0158]
一种含钌催化剂,包括:实施例4中的式(v-1)所示的钌催化剂与实施例9中的式(vi-3)所示的钌催化剂,其中式(v-1)所示的钌催化剂与式(vi-3)所示的钌催化剂的摩尔比为0.5:1,记为ru-7。
[0159]
实施例11:
[0160]
一种含钌催化剂,包括:实施例4中的式(v-1)所示的钌催化剂与实施例9中的式(vi-3)所示的钌催化剂,其中式(v-1)所示的钌催化剂与式(vi-3)所示的钌催化剂的摩尔比为1:1,记为ru-8。
[0161]
实施例12:
[0162]
一种含钌催化剂,包括:实施例4中的式(v-1)所示的钌催化剂与实施例3中的式(vi-3)所示的钌催化剂,其中式(v-1)所示的钌催化剂与式(vi-3)所示的钌催化剂的摩尔比为1.2:1,记为ru-9。
[0163]
对比例1:
[0164]
将本发明中式(ⅰ)结构的化合物,nhcs配体芳香环为均三甲苯与实施例4中的化合物e采用现有常规技术制备的钌金属催化剂作为ru比较例。
[0165]
试验例1:
[0166]
1.催化乙烯解测试
[0167]
在手套箱中,将10微摩尔含钌催化剂、6毫摩尔烯烃单体和甲苯共3毫升,加入反应釜中,设置合适温度,调节乙烯压力,反应1h。停止反应,打开反应釜,取少许液体直接进行核磁测试进而通过计算得到转化率。其中化合物乙烯解具体实验变化条件:催化剂(cat.)、
温度(t)、乙烯压力(p)、产物中组分比例(t/i)、产率(yield)。
[0168]
测试化合物:顺丁烯二甲酸二甲酯、油酸甲酯、油酸、油醇。
[0169]
催化反应路线为如下:
[0170][0171]
表1催化顺丁烯二甲酸二甲酯乙烯解的测试结果
[0172][0173]
[0174]
由表1可以看出,ru-1~ru-3含钌催化剂催化顺丁烯二甲酸二甲酯乙烯解的产率高于55%、催化油酸甲酯乙烯解的产率高于50%,ru-2含钌催化剂催化油酸、油醇乙烯解反应的产率高于65%,对比ru-1~ru-6与ru比较例,ru-1~ru-3含钌催化剂催化顺丁烯二甲酸二甲酯与油酸甲酯乙烯解的产率高于ru-4~ru-6,与ru比较例相差不大,而ru-4~ru-6含钌催化剂催化顺丁烯二甲酸二甲酯乙烯解的产率不高于ru比较例,说明采用式(l-1)、(l-2)、(l-3)结构的化合物与式(vii)结构的化合物反应制得式(v-1)、式(v-2)、式(v-3)结构所示的含钌催化剂,其对顺丁烯二甲酸二甲酯、油酸甲酯的乙烯解具有优良的催化效果,能够达到ru比较例的催化效果。
[0175]
由表1还可以看出,在催化顺丁烯二甲酸二甲酯乙烯解反应与油酸甲酯乙烯解反应中,ru-1~ru-3的产物中组分比例(t/i)即中端烯产物和内烯产物的摩尔比高于ru-4~ru-6、ru比较例;而ru-4~ru-6的产物中组分比例(t/i)中内烯产物的含量升高;说明采用式(l-1)、(l-2)、(l-3)结构的化合物与式(vii)结构的化合物反应制得式(v-1)、式(v-2)、式(v-3)结构所示的含钌催化剂能够提高中端烯产物和内烯产物的摩尔比。
[0176]
另外,随着温度的升高与乙烯压力的增加,含钌催化剂的产物中组分比例(t/i)即中端烯产物和内烯产物的摩尔比逐渐升高,且对顺丁烯二甲酸二甲酯、油酸甲酯、油酸与油醇的乙烯解的催化效果均具有一定的提高。
[0177]
(1)催化温度对顺丁烯二甲酸二甲酯乙烯解的影响
[0178]
聚合条件同“1.催化乙烯解测试”,仅改变反应温度。
[0179]
表2催化温度对顺丁烯二甲酸二甲酯乙烯解的测试结果
[0180][0181]
由表2可以看出,催化温度从30℃升至50℃,ru-1~ru-3含钌催化剂的产率变化率高于17.5%,ru-4~ru-6含钌催化剂的产率变化率高于21%,对比ru-1~ru-6与ru比较例,ru-4~ru-6含钌催化剂的产率变化率高于ru-1~ru-3、ru比较例,说明采用式(l-1)、(l-2)、(l-3)结构的化合物与式(viii)结构的化合物反应制得式(vi-1)、式(vi-2)、式(vi-3)结构所示的含钌催化剂,随着温度的升高,能够明显提高其对顺丁烯二甲酸二甲酯乙烯解的催化效果。
[0182]
(2)乙烯压力对顺丁烯二甲酸二甲酯乙烯解的影响
[0183]
聚合条件同“1.催化乙烯解测试”,仅改变反应压力。
[0184]
表3乙烯压力对顺丁烯二甲酸二甲酯乙烯解的测试结果
[0185][0186]
由表3可以看出,乙烯压力从8atm升至20atm,ru-1~ru-6含钌催化剂的产率变化率高于9.6%,对比ru-1~ru-6与ru比较例,ru-4~ru-6含钌催化剂的产率变化率高于ru比较例,说明采用式(l-1)、(l-2)、(l-3)结构的化合物与式(viii)结构的化合物反应制得的式(vi-1)、式(vi-2)、式(vi-3)结构所示的含钌催化剂,随着乙烯压力的增加,能进一步提高对顺丁烯二甲酸二甲酯乙烯解的催化效果。
[0187]
2.催化环辛烯的开环易位聚合反应测试
[0188]
在schlenk瓶中,在氮气氛围下,加入30毫摩尔环辛烯单体和二氯甲烷60毫升,设置合适温度,注射10微摩尔含钌催化剂的二氯甲烷溶液,反应2h。停止反应,浓缩反应液,再加入甲醇,析出白色粉末聚合物。过滤,烘干,称重计算环辛烯的聚合转化率。其中环辛烯聚合的具体实验变化条件:催化剂(cat.)、温度(t)、时间(t)、产率(yield)。
[0189]
催化反应路线为如下:
[0190][0191]
表4催化环辛烯的开环易位聚合反应的测试结果
[0192]
entrycat.cat./umolt/℃t/minyield(%)1ru-1102510802ru-2102510823ru-3102510784ru-4102510815ru-5102510806ru-6102510787ru-2102520868ru-210401089
9ru-21040209110ru比较例1025108011ru比较例1025208212ru比较例1040108713ru比较例10402088
[0193]
由表4可以看出,ru-1~ru-6含钌催化剂催化环辛烯的开环易位聚合反应的产率不低于78%,对比ru-1~ru-6与ru比较例,ru-4~ru-6含钌催化剂催化环辛烯的开环易位聚合反应的产率高于ru-1~ru-3、ru比较例,而ru-4~ru-6含钌催化剂催化环辛烯的开环易位聚合反应的产率高于ru比较例,说明采用式(l-1)、(l-2)、(l-3)结构的化合物与式(viii)结构的化合物反应制得式(vi-1)、(vi-2)、(vi-3)所示的含钌催化剂,其对环辛烯的开环易位聚合反应的具有优良的催化效果。
[0194]
(1)催化温度对环辛烯的开环易位聚合反应的影响
[0195]
聚合条件同“2.催化环辛烯的开环易位聚合反应测试”,仅改变催化温度。
[0196]
表5催化温度对环辛烯的开环易位聚合反应的测试结果
[0197][0198][0199]
由表5可以看出,催化温度从25℃升至40℃,ru-1~ru-3含钌催化剂的产率变化率高于10.9%,ru-4~ru-6含钌催化剂的产率变化率高于13.2%,对比ru-1~ru-6与ru比较例,ru-4~ru-6中含钌催化剂的产率变化率高于ru-1~ru-3、ru比较例,说明采用式(l-1)、(l-2)、(l-3)结构的化合物与式(viii)结构的化合物反应制得式(vi-1)、式(vi-2)、式(vi-3)结构所示的含钌催化剂,随着温度的升高,能够明显提高其对环辛烯的开环易位聚合反应的催化效果。
[0200]
(2)反应时间对环辛烯的开环易位聚合反应的影响
[0201]
聚合条件同“2.催化环辛烯的开环易位聚合反应测试”,仅改变反应时间。
[0202]
表6反应时间对环辛烯的开环易位聚合反应的测试结果
[0203][0204]
由表6可以看出,随着反应时间的增加,ru-1~ru-3中含钌催化剂的产率变化率不低于7.5%,ru-4~ru-6中含钌催化剂的产率变化率高于10.5%,对比ru-1~ru-6与ru比较例,ru-4~ru-6含钌催化剂的产率变化率高于ru-1~ru-3、ru比较例,说明采用式(l-1)、(l-2)、(l-3)结构的化合物与式(viii)结构的化合物反应制得式(vi-1)、式(vi-2)、式(vi-3)结构所示的含钌催化剂,随着反应时间的增加,其对环辛烯的开环易位聚合反应具有更为优良的催化效果。
[0205]
3.催化二烯丙基丙二酸二乙酯的关环反应测试
[0206]
在schlenk瓶中,在氮气氛围下,加入20微摩尔催化剂、20毫摩尔二烯丙基丙二酸二乙酯单体和甲苯100毫升,设置合适温度,注射20微摩尔含钌催化剂的二氯甲烷溶液,氮气流下反应1h。停止反应,取少许液体测试核磁进而通过计算得到转化率。二烯丙基丙二酸二乙酯的关环具体实验变化条件:催化剂(cat.)、温度(t)、时间(t)、产率(yield)。
[0207]
催化反应路线为如下:
[0208][0209]
表7催化二烯丙基丙二酸二乙酯的关环反应的测试结果
[0210]
entrycat.cat./umolt/℃t/minyield/%1ru-1204010752ru-2204010803ru-3204010724ru-4204010655ru-5204010736ru-6204010617ru-2204020858ru-2204030899ru-220503094
10ru比较例2040107211ru比较例2040208212ru比较例2040308813ru比较例20503091
[0211]
由表7可以看出,ru-1~ru-6中含钌催化剂催化二烯丙基丙二酸二乙酯关环反应的产率高于75%,对比ru-1~ru-6与ru比较例,ru-1~ru-3中含钌催化剂催化二烯丙基丙二酸二乙酯关环反应的产率高于ru-4~ru-6、ru比较例,说明采用式(l-1)、(l-2)、(l-3)结构的化合物与式(vii)结构的化合物反应制得式(v-1)、式(v-2)、式(v-3)结构所示的含钌催化剂,其对二烯丙基丙二酸二乙酯关环反应具有优良的催化效果。
[0212]
(1)催化温度对二烯丙基丙二酸二乙酯关环反应的影响
[0213]
聚合条件同“3.催化二烯丙基丙二酸二乙酯的关环反应测试”,仅改变催化温度。
[0214]
表8催化温度对二烯丙基丙二酸二乙酯关环反应的测试结果
[0215][0216]
由表8可以看出,催化温度从40℃升至50℃,ru-1~ru-3含钌催化剂的产率变化率高于7.5%,ru-4~ru-6中含钌催化剂的产率变化率高于17%,对比ru-1~ru-6与ru比较例,ru-4~ru-6含钌催化剂的产率变化率高于ru-1~ru-3、ru比较例,说明采用式(l-1)、(l-2)、(l-3)结构的化合物与式(viii)结构的化合物反应制得式(vi-1)、式(vi-2)、式(vi-3)结构所示的含钌催化剂,随着温度的升高,能够明显提高其对二烯丙基丙二酸二乙酯关环反应的催化效果。
[0217]
(2)反应时间对二烯丙基丙二酸二乙酯关环反应的影响
[0218]
聚合条件同“3.催化二烯丙基丙二酸二乙酯的关环反应测试”,仅改变反应时间。
[0219]
表6反应时间对环辛烯的开环易位聚合反应的测试结果
[0220][0221]
由表6可以看出,随着反应时间的增加,ru-1~ru-3含钌催化剂的产率变化率不低于18.75%,ru-4~ru-6含钌催化剂的产率变化率高于15.05%,对比ru-1~ru-6,ru-1~ru-3含钌催化剂的产率变化率高于ru-4~ru-6,说明采用式(l-1)、(l-2)、(l-3)结构的化合物与式(vii)结构的化合物反应制得式(v-1)、式(v-2)、式(v-3)结构所示的含钌催化剂,随着反应时间的增加,其对二烯丙基丙二酸二乙酯的关环反应具有更为优良的催化效果。
[0222]
本发明的操作步骤中的常规操作为本领域技术人员所熟知,在此不进行赘述。
[0223]
以上所述的实施例对本发明的技术方案进行了详细说明,应理解的是以上所述仅为本发明的具体实施例,并不用于限制本发明,凡在本发明的原则范围内所做的任何修改、补充或类似方式替代等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1