包含7个分子标记的预测猕猴桃果实干物质含量的分子标记组及其应用和试剂盒
1.本发明属于猕猴桃遗传育种及分子标记技术领域,具体涉及包含7个分子标记的预测猕猴桃果实干物质含量的分子标记组及其应用和试剂盒,本分子标记组由7个与猕猴桃果实干物质含量qtl紧密连锁的分子标记组成。
背景技术:
2.猕猴桃隶属猕猴桃科(actinidiaceae)猕猴桃属(actinidia lindl.),为多年生雌雄异株植物,共54个种,21个变种,我国作为猕猴桃属植物的原始起源中心,种质资源极为丰富,遗传多样性高,近年来,凭借丰富的自然资源,技术人员选育了大量聚合优良性状的新品种,对猕猴桃产业的快速稳定发展起到重要的推动作用。
3.在猕猴桃果实的品质评价体系中,果实干物质含量是影响果实品质和风味的重要因素,不仅决定了果实的商业价值,同时也是评价果实品质优劣的关键指标之一。因此,增加果实干物质含量对改善猕猴桃果实品质至关重要,也是其品种选育过程中的一项重要目标。
4.然而,猕猴桃常规育种方法效率低、盲目性大,往往需要大量的杂交群体,占用大面积的土地且耗费较多的人力和财力。总体看来,传统依靠表型选择的育种方法耗时费力且难度很大,培育一个新品种需花费10~15年时间,并且多数表型性状是易受环境影响的数量性状,表现不稳定,从而降低了表型选育的准确度。现今,随着分子生物学和测序技术的快速发展,借助分子标记辅助选择育种技术,可在苗期对杂交群体进行提前选择,选择具有优良性状的植株进行培育,不仅可大大减少进入后期表型评价的植株数,也可以提高父本选择的准确性,有利于节省土地、人力和各项成本,提高育种效率。
5.目前,分子标记技术已应用于猕猴桃种质资源遗传多样性评价、遗传图谱构建、雌雄性别鉴定以及猕猴桃相关性状定位等领域。然而,与猕猴桃果实干物质含量相关以用于预测猕猴桃果实干物质含量的分子标记尚未见报道。
技术实现要素:
6.(一)发明目的
7.本发明的目的是提供一组新的且行之有效的用于预测猕猴桃果实干物质含量的分子标记,以促进猕猴桃的品种选育,增加栽培植株的果实干物质含量,改善猕猴桃产品的果实品质。
8.(二)技术方案
9.农艺性状qtl定位是在遗传分离群体的基础上,借助分子标记和遗传图谱,利用qtl作图软件对分离群体的数量性状表型数据进行分析,从而确定数量性状基因在染色体上的位置和效应。利用遗传连锁图谱结合表型数据开展数量性状位点(quantitative trait loci,qtl)扫描,已成为解析复杂数量遗传学规律、有效定位关键农艺性状、开发关
联分子标记以及对优良性状进行早期选择的有效手段。
10.本发明人在前期围绕猕猴桃进行大量遗传育种学研究的基础上,进一步开展了猕猴桃果实干物质含量的qtl研究,并准确定位了猕猴桃中控制果实干物质含量的主效qtl区间,进而基于获取到的qtl位点信息进行了分子标记(snp位点)筛选,最终获得了一组新的用于预测猕猴桃果实干物质含量的分子标记。
11.第一方面,本发明提供了包含7个分子标记的预测猕猴桃果实干物质含量的分子标记组,本分子标记组由7个与猕猴桃果实干物质含量qtl紧密连锁的分子标记组成,7个分子标记的序列如seqidno:1-7所示,7个分子标记的名称、染色体位置、上游引物序列、下游引物序列如下:
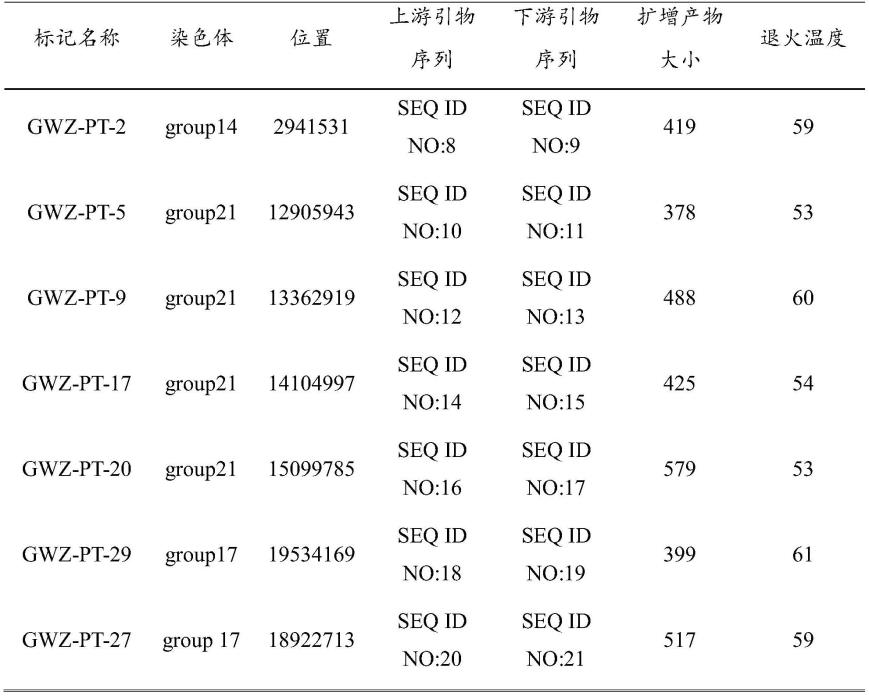
12.分子标记1,名称为gwz-pt-2,位于染色体group14的2941531处,分子标记1的上游引物序列为:5'-tcactgttattgttctgttcccttag-3'(seqidno:8),下游引物序列为:5'-tagacaatggtcgcccaaaac-3'(seqidno:9);
13.分子标记2,名称为gwz-pt-5,位于染色体group21的12905943处,分子标记2的上游引物序列为:5'-tgttacagattgatcccgtta-3'(seqidno:10),下游引物序列为:5'-aagttttctacattaggaagtcatc-3'(seqidno:11);
14.分子标记3,名称为gwz-pt-9,位于染色体group21的13362919处,分子标记3的上游引物序列为:5'-agtgcttggtgcttgcctatg-3'(seqidno:12),下游引物序列为:5'-gtagcagcaaccatcatgaaaaac-3'(seqidno:13);
15.分子标记4,名称为gwz-pt-17,位于染色体group21的14104997处,分子标记4的上游引物序列为:5'-agcctcgtaaacctgaaatag-3'(seqidno:14),下游引物序列为:5'-ttcactattatggcaagggtc-3'(seqidno:15);
16.分子标记5,名称为gwz-pt-20,位于染色体group21的15099785处,分子标记5的上游引物序列为:5'-gggacccactatacttgaaaa-3'(seqidno:16),下游引物序列为:5'-caaacacttatgtgacagcaat-3'(seqidno:17);
17.分子标记6,名称为gwz-pt-29,位于染色体group17的19534169处,分子标记6的上游引物序列为:5'-gacagagagaggatggagaggttg-3'(seqidno:18),下游引物序列为:5'-atttcccatctccgttgcttc-3'(seqidno:19);
18.分子标记7,名称为gwz-pt-27,位于染色体group17的18922713处,分子标记7的上游引物序列为:5'-gcgaatactttaggtttgagttgtt-3'(seqidno:20),下游引物序列为:5'-gccttttggtaattggacgaa-3'(seqidno:21)。
19.第二方面,本发明提供了上述预测猕猴桃果实干物质含量的分子标记组的筛选方法,包括以下步骤:
20.(1)使用两种不同中华猕猴桃杂交亲本构建f1群体,选择f1群体的子代单株为研究对象;
21.(2)采集上述f1群体的子代单株叶片,利用ctab法提取总dna,根据radseq方法构建上述中华猕猴桃杂交亲本及其子代的文库并测序;
22.(3)对测序数据进行过滤;使用比对软件bwa采用mem算法将过滤后的reads比对到参考基因组上,比对参数为-k32-m;比对完成后结果使用软件picard进行标记;然后以群体rad-tags集合为参考,使用变异检测软件gatk进行群体snp检测,统计多态性位点在群
体中的遗传类型,获得基因型列表;最后对获得的基因型列表进行过滤;
23.(4)使用lep-map3软件的ordermarkers2模块,计算上步过滤后的基因型列表中各标记间的遗传距离和各个染色体的图距,构建高密度遗传图谱,获得标记间的遗传位置和标记到各个遗传位置的lod值的矩阵;
24.(5)在果实成熟期,对上述中华猕猴桃杂交f1群体的果实进行干物质含量测定;
25.(6)将上述果实样本的干物质含量数据和标记的基因型数据导入r,使用r/qtl的scanone()函数对各个性状进行区间作图,扫描步长为1cm,使用lod=2.5作为阈值筛选qtl,最终筛选得到3个与果实干物质含量相关的qtl,分别在lachesis_group14、lachesis_group17、lachesis_group21,对该性状的贡献率分别为29.5%、9.5%和23.2%;
26.(7)分别提取上述与果实干物质含量相关的qtl在猕猴桃基因组上的物理位置,获得了7个分子标记(其序列如seqidno:1-7所示),设计上述7个分子标记的上游引物序列(其序列如seqidno:8、10、12、14、16、18、20所示)、下游引物序列(其序列如seqidno:9、11、13、15、17、19、21所示)、扩增产物大小和退火温度;
27.(8)利用pcr扩增和sanger测序技术对上述果实样品进行分型及验证;
28.(9)经上述步骤将中华猕猴桃杂交f1群体的子代分为两类基因型,对两类基因型杂交子代个体的平均果实干物质含量进行显著性检验,显示两类基因型个体的平均果实干物质含量差异极显著,验证了所获得的分子标记组可用于预测猕猴桃果实干物质含量的差异。
29.进一步地,上述筛选方法(3)步中所述对测序数据进行过滤,其过滤方法如下:
30.(a)去除低质量碱基含量大于50%的序列;
31.(b)去除有测序接头污染的reads;
32.(c)去除大量重复的reads。
33.进一步地,上述筛选方法(3)步中所述对获得的基因型列表进行过滤,其过滤方法如下:
34.(a)去除分型比例低于10%的位点;
35.(b)去除杂合比例大于75%的位点;
36.(c)按理论比对标记位点的基因型比例进行卡方检验,p值小于0.001的位点视为严重偏分离位点并去除;
37.(d)保留分离类型为lmxll、nnxnp和hkxhk的标记,去除其余标记类型。
38.进一步地,上述筛选方法(4)步中所述lep-map3软件的ordermarkers2模块的参数设置为:identicallimit=0.01,minerror=0.001,sexaveraged=0,informativemask=123,usekosambi=1,其他参数使用默认值。
39.进一步地,上述筛选方法(8)步中所述利用pcr扩增和sanger测序技术对上述果实样品进行分型及验证,包括:
40.(a)按照yeasenbiotechnology,2xhieffcanacepluspcrmastermix说明,设计反应体系,反应体系包括:5ng/μl-1
猕猴桃基因组dna模板3μl、2xhieffcanacepluspcrmastermix25μl、各分子标记的上游引物和下游引物各2μl、ddh2o补足至50μl;
41.(b)扩增程序为:
42.98℃预变性3min;
43.98℃变性10s,退火20s,72℃延伸30s,进行35个循环;
44.72℃终延伸5min,4℃保存;
45.(c)对pcr扩增产物进行1%琼脂糖凝胶电泳,针对扩增出的符合目的片段大小的条带切胶进行胶回收;
46.(d)纯化产物用sanger测序技术验证分型准确性。
47.此外,本发明还涉及了上述7个分子标记的检测试剂在猕猴桃品种选育中的应用。
48.第三方面,本发明还提供了一种预测猕猴桃果实干物质含量的检测试剂盒,该检测试剂盒中包含上述7个分子标记的检测试剂。
49.第四方面,本发明还提供了一种预测猕猴桃果实干物质含量的方法,该方法中包含对上述7个分子标记进行检测的步骤。
50.(三)有益效果
51.(1)在常规选育方法中,猕猴桃果实中干物质含量需要到结果期进行测定,浪费了大量时间和人力,且选择效率低下,而通过检测本发明中提供的与果实干物质含量相关的分子标记,可以在苗期进行选择,筛选出具有高果实干物质含量qtl的猕猴桃品种或品系用于育种,不仅节约育种成本,而且大大提高了猕猴桃优异品种的选育效率。
52.(2)本发明提供的分子标记位置明确,检测方法方便快捷,不受环境影响。
53.(3)本发明方法简便易行,通过检测相关的分子标记即可快速准确地筛选出果实干物质含量高的优良单株,有助于提高产品品质和商业价值,提升猕猴桃产业的经济效益。
54.(4)本发明为猕猴桃种质创新和品种改良提供有益的技术支撑。
具体实施方式
55.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
56.在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
57.除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
58.在本发明中,若无特别说明,所有的仪器和原料均可从商业途径得到或是本行业常用的。下述实施例中的方法,如无特别说明,均为本领域的常规方法。
59.实施例1:一组预测猕猴桃果实干物质含量的分子标记的筛选方法,包括以下步骤:
60.(1)使用中华猕猴桃
‘
红阳’和中华猕猴桃
‘
博山碧玉’雄株杂交构建f1 群体,选择173株f1群体的子代单株为研究对象。
61.(2)采集上述f1群体的173份子代单株叶片,利用ctab法提取总dna,根据radseq方
法构建中华猕猴桃
‘
红阳’和
‘
博山碧玉’雄株及173株子代的文库并测序。
62.(3)对测序数据进行过滤,去除低质量碱基含量大于50%的序列,去除有测序接头污染和大量重复的reads;使用比对软件bwa(版本0.7.12)采用mem 算法将过滤后的reads比对到参考基因组(hongyang_v3)上,比对参数为-k 32-m;比对完成后结果使用软件picard(版本1.129)进行标记;然后以群体rad-tags集合为参考,使用变异检测软件gatk进行群体snp检测,统计多态性位点在群体中的遗传类型,获得基因型列表;最后对获得的基因型列表进行过滤,过滤方法如下:
63.(a)去除分型比例低于10%的位点;
64.(b)去除杂合比例大于75%的位点;
65.(c)按理论比对标记位点的基因型比例进行卡方检验,p值小于0.001的位点视为严重偏分离位点并去除;
66.(d)保留分离类型为lmxll、nnxnp和hkxhk的标记,去除其余标记类型。
67.(4)使用lep-map3软件的ordermarkers2模块,计算上步过滤后的基因型列表中各标记间的遗传距离和各个染色体的图距,ordermarkers2模块的参数设置为identicallimit=0.01,minerror=0.001,sexaveraged=0,informativemask=123, usekosambi=1,其他参数使用默认值,构建高密度遗传图谱,获得标记间的遗传位置和标记到各个遗传位置的lod值的矩阵。
68.(5)在果实成熟期,对中华猕猴桃
‘
红阳’和
‘
博山碧玉’雄株杂交f1群体的果实进行干物质含量测定,每个样本随机采集20个果实,测量干物质含量。
69.(6)将上述果实样本的干物质含量数据和标记的基因型数据导入r,使用 r/qtl的scanone()函数对各个性状进行区间作图,扫描步长为1cm,使用lod=2.5 作为阈值筛选qtl,对猕猴桃果实干物质含量进行qtl定位分析,最终筛选得到3个与果实干物质含量相关的qtl,分别在lachesis_group14、 lachesis_group17、lachesis_group21,对该性状的贡献率分别为29.5%、9.5%和 23.2%。
70.(7)分别提取上述与果实干物质含量相关的qtl在猕猴桃基因组上的物理位置,获得了7个分子标记,其序列如seq id no:1-7所示,设计上述7个分子标记的上游引物序列、下游引物序列、扩增产物大小和退火温度,如下表1 所示:
71.表1与果实干物质含量相关的分子标记信息
[0072][0073]
(8)利用pcr扩增和sanger测序技术对上述果实样品进行分型及验证,包括:
[0074]
(a)按照yeasenbiotechnology,2xhieffcanacepluspcrmastermix说明,设计反应体系,反应体系包括:5ng/μl-1
猕猴桃基因组dna模板3μl、2xhieffcanacepluspcrmastermix25μl、各分子标记的上游引物和下游引物各2μl、ddh2o补足至50μl;
[0075]
(b)扩增程序为:
[0076]
98℃预变性3min;
[0077]
98℃变性10s,退火20s,72℃延伸30s,进行35个循环;
[0078]
72℃终延伸5min,4℃保存;
[0079]
(c)对pcr扩增产物进行1%琼脂糖凝胶电泳,针对扩增出的符合目的片段大小的条带切胶进行胶回收;
[0080]
(d)纯化产物用sanger测序技术验证分型准确性。
[0081]
(9)经上述步骤将中华猕猴桃杂交f1群体的子代分为两类基因型,对两类基因型杂交子代个体的平均果实干物质含量进行显著性检验,显示两类基因型个体的平均果实干物质含量差异极显著(p《0.05),如下表2所示,验证了所获得的分子标记组可用于预测猕猴桃果实干物质含量的差异。
[0082]
表2本发明7个分子标记在杂交群体中的基因分型
[0083][0084]
实施例2:一种预测猕猴桃果实干物质含量的检测试剂盒,包含:
[0085]
(1)7组分子标记引物:
[0086]
分子标记1:上游引物:5'-tcactgttattgttctgttcccttag-3',
[0087]
下游引物:5'-tagacaatggtcgcccaaaac-3';
[0088]
分子标记2:上游引物:5'-tgttacagattgatcccgtta-3',
[0089]
下游引物:5'-aagttttctacattaggaagtcatc-3';
[0090]
分子标记3:上游引物:5'-agtgcttggtgcttgcctatg-3',
[0091]
下游引物:5'-gtagcagcaaccatcatgaaaaac-3';
[0092]
分子标记4:上游引物:5'-agcctcgtaaacctgaaatag-3',
[0093]
下游引物:5'-ttcactattatggcaagggtc-3';
[0094]
分子标记5:上游引物:5'-gggacccactatacttgaaaa-3',
[0095]
下游引物:5'-caaacacttatgtgacagcaat-3';
[0096]
分子标记6:上游引物:5'-gacagagagaggatggagaggttg-3',
[0097]
下游引物:5'-atttcccatctccgttgcttc-3';
[0098]
分子标记7:上游引物:5'-gcgaatactttaggtttgagttgtt-3',
[0099]
下游引物:5'-gccttttggtaattggacgaa-3'。
[0100]
(2)猕猴桃基因组dna模板。
[0101]
(3)pcr反应试剂:2xhieff canace plus pcr master mix试剂、ddh2o。
[0102]
本检测试剂盒的使用方法参照实施例1筛选方法中的相关步骤。
[0103]
以上对本发明优选的具体实施方式和实施例作了详细说明,但是本发明并不限于上述实施方式和实施例,在本领域技术人员所具备的知识范围内,还可以在不脱离本发明构思的前提下作出各种变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1