一种猪成纤维细胞培养方法
1.本发明属于成纤维细胞培养技术领域,具体涉及一种猪成纤维细胞培养方法。
背景技术:
2.虽然我国有许多优秀的畜禽品种资源,但是有许多地方种产量较低,为了满足人们对优质的动物产品的需求,我国引入了外国高产的畜牧品种,与我国地方低产品种交配繁衍后代,以此提高我国的畜牧业生产水平。这一方法虽然达成了目的,提高了畜牧产品的产量,但是使某些地方品种被杂交种取代,导致地方种数量大幅度下降甚至濒临灭绝。以猪种资源为例,我国许多地方猪种由于与外来猪种杂交,导致纯种种群数量急剧下降,甚至濒临灭绝。
3.为了更好的保存优秀畜类的种质资源,可以采用体细胞保存技术。目前体细胞保存技术已经较为成熟。其方法为取优良畜类的组织细胞,通过组织培养技术,来获得成纤维细胞,然后进行保存。根据培养的组织细胞特点,可以采用酶消化法或是组织块贴壁法,这两种培养方法都能体外培养动物细胞,组织块贴壁法虽然操作简单,但是存在组织块贴附不牢的不足。在酶消化法中,细胞不仅受到机械应力,还会受到胰蛋白酶水解的影响,导致细胞产生损伤,变得不易贴壁或者贴壁时间延长,影响细胞的活力和繁殖力。
技术实现要素:
4.针对现有技术中的上述不足,本发明提供一种猪成纤维细胞培养方法。
5.为了达到上述发明目的,本发明采用的技术方案为:
6.提供一种猪成纤维细胞培养方法,包括以下步骤:
7.(1)选取猪耳部血管较少的耳边缘组织,清洗、剪取大小为1cm2的耳组织,浸泡、冲洗、保存;
8.(2)在超净工作台上刮去耳组织表面的毛及污染物,用含5%双抗的pbs清洗20-30次;
9.(3)加入1ml 0.1%胶原蛋白酶消化液将耳组织充分剪碎至匀浆,将剪碎后的耳组织匀浆转移至已加1ml 0.1%的胶原蛋白酶消化液的15ml离心管中,放入37℃水浴锅中,每隔5min震荡一次,全过程消化时间2h;
10.(4)加入9ml含2%fbs的dmem终止消化,并反复吹打数次至组织块充分散开为单细胞,过滤,离心,弃去上清液,收集细胞沉淀;
11.(5)在细胞沉淀中加入2ml培养基,吹打混匀后过滤,加入2ml培养基混匀后,离心,弃去上清液,收集细胞沉淀;
12.(6)在细胞沉淀中加入10ml培养基重悬细胞,接种至10cm的培养皿中,将培养皿放入培养箱中培养30min后,去除培养基,用含3%双抗的pbs清洗2次,加入10ml培养基,继续培养,获得猪成纤维细胞。
13.进一步地,步骤(1)的具体方法为:选取猪耳部血管较少的耳边缘组织,先用含有
5%双抗的生理盐水充分冲洗耳朵,再用酒精棉球充分擦拭3-4次去掉表面的污染物,然后用手术刀片或剪刀取下大小1cm2的耳组织,立即放入75%酒精中浸泡1分钟,然后用含有5%抗生素的生理盐水冲洗3遍,放入含5%双抗的dmem组织保存液中。
14.进一步地,步骤(3)中,0.1%胶原蛋白酶消化液的制备方法为:取100mg胶原蛋白酶粉末,加入由79ml dmem培养液、20ml pbs缓冲液和1ml双抗组成的混合溶液中,搅拌使其混合均匀,置于4℃环境内放置一夜,第二天将胶原蛋白酶溶液放在超净台内,抽滤除菌,-20℃下冻存。
15.进一步地,步骤(4)中,过滤条件为:100μm过滤筛过滤。
16.进一步地,步骤(4)和步骤(5)中的离心条件为:1500rpm,离心5min。
17.进一步地,步骤(5)中,过滤条件为:40μm过滤筛过滤。
18.进一步地,步骤(5)和步骤(6)中,培养基均为含10% fbs,3%双抗的培养基。
19.本发明的有益效果为:
20.本发明利用胶原蛋白酶分离猪耳组织,避免了现有技术中37℃条件下胰蛋白酶水解对细胞表面蛋白质的破坏,避免了细胞损伤。收获的成纤维细胞成活率高,贴壁率高,繁殖力增强,有利于猪种质资源的保存。
附图说明
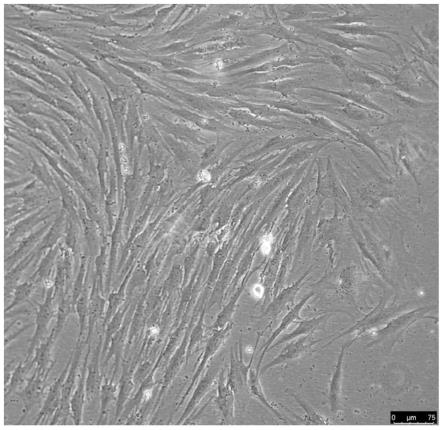
21.图1为本发明实施例细胞分离培养第1天的生长状况示意图;
22.图2为本发明实施例细胞分离培养第7天的生长状况示意图;
23.图3为本发明实施例细胞分离培养第15天的生长状况示意图;
24.图4为本发明实施例细胞分离培养第20天的生长状况示意图;
25.图5为本发明实施例细胞分离培养第20天细胞vimentin鉴定示意图;
26.图6为本发明实施例与对比例细胞分离培养第15天生长状况对比示意图。
具体实施方式
27.下面对本发明的具体实施方式进行描述,以便于本技术领域的技术人员理解本发明,但应该清楚,本发明不限于具体实施方式的范围,对本技术领域的普通技术人员来讲,只要各种变化在所附的权利要求限定和确定的本发明的精神和范围内,这些变化是显而易见的,一切利用本发明构思的发明创造均在保护之列。
28.实施例
29.本发明涉及的生物材料是普通的猪,是公众可以方便获取得到的。
30.本发明中涉及的主要实验试剂如下表所示:
[0031][0032]
一种猪成纤维细胞培养方法,包括以下步骤:
[0033]
(1)选取猪耳部血管较少的耳边缘组织,先用含有5%双抗的生理盐水充分冲洗耳朵,再用酒精棉球充分擦拭3-4次去掉表面的污染物,然后用手术刀片或剪刀取下大小约1cm2的耳组织,立即放入75%酒精中浸泡1分钟,然后用含有5%抗生素的生理盐水冲洗3遍,放入含5%双抗的dmem组织保存液中(15ml无菌离心管)。带回实验室,在2小时内进行培养。
[0034]
(2)在超净工作台上用手术剪刮去耳组织表面的毛及污染物,用含5%双抗的pbs清洗25次。
[0035]
(3)加入1ml 0.1%胶原蛋白酶将耳组织充分剪碎至匀浆,将剪碎的耳组织匀浆转移至已加1ml 0.1%的胶原蛋白酶15ml离心管中,放入37℃水浴锅中,每隔5min震荡一次,全过程消化时间约2h。
[0036]
(4)加入9ml含2%fbs的dmem终止消化,并反复吹打数次至组织块充分散开为单细胞,100μm过滤筛过滤,室温1500rpm,离心5min,弃去上清液,收集细胞沉淀。
[0037]
(5)在细胞沉淀中加入2ml培养基(含10% fbs,3%双抗),吹打混匀后过40μm过滤筛,加入2ml培养基(含10% fbs,3%双抗)混匀后,1500rpm离心5min,弃去上清液,收集细胞沉淀。
[0038]
(6)在细胞沉淀中加入10ml(含10% fbs,3%双抗)培养基重悬细胞,接种至10cm的培养皿中,将培养皿放入培养箱中培养30min后,去除培养基,用含3%双抗的pbs清洗2
次,加入10ml(含10% fbs,3%双抗)培养基,继续培养。
[0039]
具体地说,步骤(3)中,0.1%胶原蛋白酶消化液的制备方法为:取100mg胶原蛋白酶粉末,加入由79ml dmem培养液、20ml pbs缓冲液和1ml双抗组成的混合溶液中,搅拌使其混合均匀,置于4℃环境内放置一夜,第二天将胶原蛋白酶溶液放在超净台内,抽滤除菌,-20℃下冻存。
[0040]
对比例
[0041]
一种猪成纤维细胞培养方法,将上述步骤(3)中使用的0.1%胶原蛋白酶消化液替换成0.1%胰蛋白酶,其余步骤同实施例。
[0042]
在倒置显微镜下观察细胞形态和生长情况,分离培养的第1天细胞呈圆形,培养一周即可明显看到细胞形态,细胞主要呈长条梭形。随后细胞进入快速生长阶段,在第15天左右时,实施例胶原蛋白酶组细胞基本铺满培养皿。利用细胞免疫荧光染色标记成纤维细胞标记蛋白vimentin,细胞阳性率100%。在倒置显微镜下观察,可见细胞以梭形和多角形为主,细胞饱满,胞核成卵圆形,细胞向四周呈放射状生长,形成致密单层细胞,细胞数量为6.5
×
106个,细胞成活率95.7%。对比例胰蛋白酶组细胞尚未长满整个培养皿,细胞轮廓明显,细胞数量为2.2
×
106个,细胞成活率90.2%。因此,使用胶原蛋白酶分离培养猪成纤维细胞的效果更好。
[0043]
本发明利用胶原蛋白酶分离猪耳组织,避免了现有技术中37℃条件下胰蛋白酶水解对细胞表面蛋白质的破坏,避免了细胞损伤。收获的成纤维细胞成活率高,贴壁率高,繁殖力增强,有利于猪种质资源的保存。
[0044]
于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。
[0045]
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1