经修饰的T细胞、药物组合物、其制备方法,及其使用方法与流程
发明领域本公开涉及经修饰的t细胞,特别是γδt细胞,以及包含其的药物组合物。本公开还提供了鉴定所述经修饰的t细胞以及培养所述经修饰的t细胞的方法。
背景技术:
1、免疫监视在对抗癌症方面发挥关键的作用,并且代表一种非常有吸引力的治疗方式,特别是有鉴于常规手术、放射线和化学疗法在癌症管理中的许多缺点。
2、伽马德他(γδ)t细胞为“非常规”t细胞的原型,并代表了周边血中相对小的t细胞亚群。它们由γ链与δ链组成的异二聚体t细胞受体(tcr)的表达所定义。这使它们不同于表达αβtcr的典型且更广为人知的cd4+辅助t细胞与cd8+细胞毒性t细胞。
3、vγ9vδ2(也称为vγ2vδ2)t细胞为人类周边血γδt细胞亚群,其以tcr依赖性方式识别微生物(e)-4-羟基-3-甲基丁-2-烯基二磷酸酯与内源性异戊烯基二磷酸酯。识别不需要特别的辅助细胞、抗原摄取、抗原加工或mhc第i类、第ii类或第ib类表达。
4、γδt细胞被视为代表先天免疫与后天免疫之间的连结。它们表达自然杀手受体,例如nkg2d,其对vγ9vδ2t细胞的肿瘤反应性具有重要贡献。此外,它们也表达γδt细胞受体。活化的γδt细胞表达高含量的抗原呈递细胞相关的分子,并可将衍生自经破坏的细胞的肽抗原呈递至αβt细胞。利用γδt细胞的这些抗微生物与抗肿瘤性质,已进行临床前与临床试验,以开发针对感染与恶性肿瘤的新颖免疫疗法。
5、由于仍然没有满足有效治疗和/或预防癌症的需求,这些发现支持了开发针对癌细胞的基于t细胞的疗法以及产生更多用于临床应用的具有治疗能力的t细胞的培养方法的理论依据。本公开提供了具有独特表型的经修饰的t细胞,以满足这些和其他需求。所述细胞可用于自体疗法或非自体疗法。
技术实现思路
1、鉴于本领域的迫切需要,本文提供在癌症治疗中安全有效的经修饰的t细胞和包含其的药物组合物。
2、在一个具体实施例中,本公开提供了包含cd3hitcr γ9hitcr δ2hicxcr4hi表型的经修饰的t细胞。在一个优选的具体实施例中,所述经修饰的t细胞可进一步包含cd69dimcd11chicxcr3dim的表型,即所述经修饰的t细胞可包含cd3hitcr γ9hitcr δ2hicd69dimcd11chicxcr4hicxcr3dim的表型。在另一优选具体实施例中,经修饰的t细胞可进一步包含ifn-γhi的表型。
3、某些具体实施例提供药物组合物,包含本文所述的经修饰的γδt细胞以及药学上可接受的载体或赋形剂。
4、某些具体实施例提供一种治疗癌细胞的方法,包含对有此需要的受试者施用有效量的本文所述的经修饰的t细胞或药物组合物。
5、在一个优选的具体实施例中,所述有效量可以是每剂约1×103至约1×109个细胞。
6、在一个优选的具体实施例中,所述经修饰的t细胞可以是自体的或同种异体的。
7、在一个优选的具体实施例中,所述经修饰的t细胞可衍生自周边血、脐带血,或骨髓。
8、在一个优选的具体实施例中,所述方法可进一步包含体外扩增所述经修饰的t细胞。
9、其他具体实施例提供一种培养具有nk细胞功能以及抗原呈递细胞功能的经修饰的t细胞的方法,所述方法包含
10、获得包含单核细胞的体液;
11、使所述单核细胞与包含il-2与唑来膦酸(zoledronic acid)的诱导培养基接触以获得第一培养的细胞群;
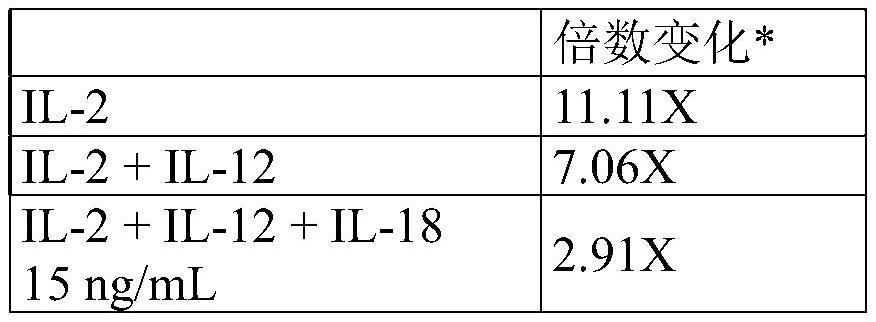
12、使所述第一培养的细胞群与包含il-2的第一培养基接触以获得第二培养的细胞群;以及
13、使所述第二培养的细胞群与包含il-2与il-12的第二培养基接触以获得第三培养的细胞群。
14、在一个优选的具体实施例中,所述单核细胞可衍生自周边血、脐带血,或骨髓。
15、在一个优选的具体实施例中,所述诱导培养基、所述第一培养基和所述第二培养基可进一步包含造血细胞培养基,优选为aim-v培养基。
16、在一个优选的具体实施例中,所述诱导培养基、所述第一培养基和所述第二培养基可进一步包含血清蛋白,优选为人类血小板裂解物。
17、在一个优选的具体实施例中,所述单核细胞可与所述诱导培养基接触约1至3天。
18、在一个优选的具体实施例中,所述第一培养的细胞群可与所述第一培养基接触约1至6天。
19、在一个优选的具体实施例中,所述第二培养的细胞群可与所述第二培养基接触约1至3天。
20、在一个优选的具体实施例中,所述方法可进一步包含在与所述第二培养基接触之后,使所述第三培养的细胞群与包含il-2、il-12和il-18的第三培养基接触以获得第四培养的细胞群。
21、在一个优选的具体实施例中,所述第三培养基可进一步包含造血细胞培养基,优选为aim-v培养基。
22、在一个优选的具体实施例中,所述第三培养基可进一步包含血清蛋白,优选为人类血小板裂解物。
23、在一个优选的具体实施例中,所述第三培养的细胞群可与所述第三培养基接触约1至3天。
24、在一个优选的具体实施例中,所述方法可进一步包含分离具有cd3hitcr γ9hitcrδ2hicxcr4hi表型的经修饰的t细胞。
25、本文所述的培养方法允许从固定量的样品(例如,10ml的血液)中分离出大量的经修饰的t细胞。
技术特征:
1.一种经修饰的t细胞,包含
2.根据权利要求1所述的经修饰的t细胞,进一步包含cd69dimcd11chicxcr3dim的表型。
3.根据权利要求1所述的经修饰的t细胞,进一步包含ifn-γhi的表型。
4.一种药物组合物,包含
5.一种治疗癌细胞的方法,包含
6.根据权利要求5所述的方法,其中所述有效量为每剂约l×103至约l×109个细胞。
7.根据权利要求5所述的方法,其中所述经修饰的t细胞为自体的或同种异体的。
8.根据权利要求5所述的方法,其中所述经修饰的t细胞衍生自周边血、脐带血,或骨髓。
9.根据权利要求5所述的方法,进一步包含体外扩增所述经修饰的t细胞。
10.一种培养经修饰的t细胞的方法,包含
11.根据权利要求10所述的方法,其中所述单核细胞衍生自周边血、脐带血,或骨髓。
12.根据权利要求10所述的方法,其中所述诱导培养基、所述第一培养基和所述第二培养基进一步包含造血细胞培养基。
13.根据权利要求12所述的方法,其中所述造血细胞培养基包含aim-v培养基。
14.根据权利要求12所述的方法,其中所述诱导培养基、所述第一培养基和所述第二培养基进一步包含血清蛋白。
15.根据权利要求14所述的方法,其中所述血清蛋白包含人类血小板裂解物。
16.根据权利要求10所述的方法,其中所述单核细胞与所述诱导培养基接触约1至3天。
17.根据权利要求10所述的方法,其中所述第一培养的细胞群与所述第一培养基接触约1至6天。
18.根据权利要求10所述的方法,其中所述第二培养的细胞群与所述第二培养基接触约1至3天。
19.根据权利要求10所述的方法,进一步包含在与所述第二培养基接触之后,使所述第三培养的细胞群与包含il-2、il-12和il-18的第三培养基接触以获得第四培养的细胞群。
20.根据权利要求19所述的方法,其中所述第三培养基进一步包含造血细胞培养基。
21.根据权利要求20所述的方法,其中所述造血细胞培养基包含aim-v培养基。
22.根据权利要求20所述的方法,其中所述第三培养基进一步包含血清蛋白。
23.根据权利要求22所述的方法,其中所述血清蛋白包含人类血小板裂解物。
24.根据权利要求19所述的方法,其中所述第三培养的细胞群与所述第三培养基接触约1至3天。
25.根据权利要求10所述的方法,进一步包含分离具有cd3hitcrγ9hitcrδ2hicxcr4hi表型的经修饰的t细胞。
技术总结
本公开提供了具有细胞杀伤功能与抗原呈递细胞功能的经修饰的T细胞及其培养方法。通过施用所述经修饰的T细胞,可通过细胞介导免疫作用有效地抑制受试者的癌细胞。
技术研发人员:李建谋,游淳惟,方志豪,郑雅方
受保护的技术使用者:富禾生医股份有限公司
技术研发日:
技术公布日:2024/1/11
- 还没有人留言评论。精彩留言会获得点赞!