鉴定扁桃种质资源的SSR分子标记引物组及其应用的制作方法
鉴定扁桃种质资源的ssr分子标记引物组及其应用
技术领域
1.本发明涉及分子检测技术领域。具体地说是鉴定扁桃种质资源的ssr分子标记引物组及其应用。
背景技术:
2.扁桃(prunus dulcis(mill.)d.a.webb,amygdalus communis l.)又名巴旦杏、巴旦木,是世界四大干果树种之一,也是我国传统木本油料树种,在我国已有1300余年的栽培历史,以其仁大、壳薄、加工特性好以及富含人体所需的多种氨基酸、维生素和多种生理活性物质而深受人们喜爱。
3.我国传统扁桃资源主要通过古丝绸之路引入,经过漫长的引种交流、实生繁育和人工选择,目前已形成了适应我国气候的特色资源类型和地方品种,包括苦味扁桃、甜味扁桃、软壳甜扁桃等变种;并依托地域优势培育出了鲜明的特色产业,带动了区域经济发展,同时也被山西、陕西、甘肃、河南等地广泛引种栽培,相继选育了80余个不同的资源类型及10余个良种(兰彦平等,2004;张倩茹等,2016)。在对传统资源开发的同时,我国也在不断的引进国外资源,先后从美国、意大利、法国、阿尔及利亚、伊朗等地引进了大量的品种资源及育种材料进行驯化试验(潘晓云,2002;韩宏伟等,2003;张文越等,2011),极大的丰富了国内扁桃种质资源。随着社会需求的增长、栽培面积的扩大和培育、引进资源的不断增加,人们对扁桃种质资源收集、保存、评价、利用工作也在不断深入;因此,扁桃种质资源鉴定、评价及多样性分析等基础工作也显得尤为重要。
4.微卫星(ssr)标记是目前广泛应用的遗传标记,因其多态性丰富,重复性好、共显性遗传,检测效率高等特点,广泛用于种质鉴定、遗传图谱构建、遗传多样性及亲缘关系分析等方面研究。但受限于开发手段,目前可供使用的标记仍相对较少,制约了其在种质资源研究中的应用。
技术实现要素:
5.为此,本发明所要解决的技术问题在于提供一种对新疆主产区扁桃种质资源的多样性进行了分析的鉴定扁桃种质资源的ssr分子标记引物组及其应用。
6.为解决上述技术问题,本发明提供如下技术方案:
7.鉴定扁桃种质资源的ssr分子标记引物组,ssr分子标记引物组由38对引物组成,这38对引物针对扁桃ssr分子标记分别为s8,s20,s22,s26,s37,s54,s56,s70,s83,s89,s97,s102,s107,s111,s116,s117,s119,s121,s123,s127,s136,s168,s178,s179,s180,s182,s184,s200,s203,s210,s213,s216,s219,s223,s225,s227,s228,s536,(1)扩增ssr分子标记s8的引物,正向引物及反向的核苷酸序列如seq idno.1~2所示;
8.(2)扩增ssr分子标记s20的引物,正向引物及反向的核苷酸序列如seq idno.3~4所示;
9.(3)扩增ssr分子标记s22的引物,正向引物及反向的核苷酸序列如seq idno.5~6
所示;
10.(4)扩增ssr分子标记s26的引物,正向引物及反向的核苷酸序列如seq idno.7~8所示;
11.(5)扩增ssr分子标记s37的引物,正向引物及反向的核苷酸序列如seq idno.9~10所示;
12.(6)扩增ssr分子标记s54的引物,正向引物及反向的核苷酸序列如seq idno.11~12所示;
13.(7)扩增ssr分子标记s56的引物:正向引物及反向的核苷酸序列如seq idno.13~14所示;
14.(8)扩增ssr分子标记s70的引物:正向引物及反向的核苷酸序列如seq idno.15~16所示;
15.(9)扩增ssr分子标记s83的引物:正向引物及反向的核苷酸序列如seq idno.17~18所示;
16.(10)扩增ssr分子标记s89的引物:正向引物及反向的核苷酸序列如seq id no.19~20所示;
17.(11)扩增ssr分子标记s97的引物:正向引物及反向的核苷酸序列如seq id no.21~22所示;
18.(12)扩增ssr分子标记s102的引物:正向引物及反向的核苷酸序列如seq id no.23~24所示;
19.(13)扩增ssr分子标记s107的引物:正向引物及反向的核苷酸序列如seq id no.25~26所示;
20.(14)扩增ssr分子标记s111的引物:正向引物及反向的核苷酸序列如seq id no.27~28所示;
21.(15)扩增ssr分子标记s116的引物:正向引物及反向的核苷酸序列如seq id no.29~30所示;
22.(16)扩增ssr分子标记s117的引物:正向引物及反向的核苷酸序列如seq id no.31~32所示;
23.(17)扩增ssr分子标记s119的引物:正向引物及反向的核苷酸序列如seq id no.33~34所示;
24.(18)扩增ssr分子标记s121的引物:正向引物及反向的核苷酸序列如seq id no.35~36所示;
25.(19)扩增ssr分子标记s123的引物:正向引物及反向的核苷酸序列如seq id no.37~38所示;
26.(20)扩增ssr分子标记s127的引物:正向引物及反向的核苷酸序列如seq id no.39~40所示;
27.(21)扩增ssr分子标记s136的引物:正向引物及反向的核苷酸序列如seq id no.41~42所示;
28.(22)扩增ssr分子标记s168的引物:正向引物及反向的核苷酸序列如seq id no.43~44所示;
29.(23)扩增ssr分子标记s178的引物:正向引物及反向的核苷酸序列如seq id no.45~46所示;
30.(24)扩增ssr分子标记s179的引物:正向引物及反向的核苷酸序列如seq id no.47~48所示;
31.(25)扩增ssr分子标记s180的引物:正向引物及反向的核苷酸序列如seq id no.49~50所示;
32.(26)扩增ssr分子标记s182的引物:正向引物及反向的核苷酸序列如seq id no.51~52所示;
33.(27)扩增ssr分子标记s184的引物:正向引物及反向的核苷酸序列如seq id no.53~54所示;
34.(28)扩增ssr分子标记s200的引物:正向引物及反向的核苷酸序列如seq id no.55~56所示;
35.(29)扩增ssr分子标记s203的引物:正向引物及反向的核苷酸序列如seq id no.57~58所示;
36.(30)扩增ssr分子标记s210的引物:正向引物及反向的核苷酸序列如seq id no.59~60所示;
37.(31)扩增ssr分子标记s213的引物:正向引物及反向的核苷酸序列如seq id no.61~62所示;
38.(32)扩增ssr分子标记s216的引物:正向引物及反向的核苷酸序列如seq id no.63~64所示;
39.(33)扩增ssr分子标记s219的引物:正向引物及反向的核苷酸序列如seq id no.65~66所示;
40.(34)扩增ssr分子标记s223的引物:正向引物及反向的核苷酸序列如seq id no.67~68所示;
41.(35)扩增ssr分子标记s225的引物:正向引物及反向的核苷酸序列如seq id no.69~70所示;
42.(36)扩增ssr分子标记s227的引物:正向引物及反向的核苷酸序列如seq id no.71~72所示;
43.(37)扩增ssr分子标记s228的引物:正向引物及反向的核苷酸序列如seq id no.73~74所示;
44.(38)扩增ssr分子标记s536的引物:正向引物及反向的核苷酸序列如seq id no.75~76所示。
45.上述鉴定扁桃种质资源的ssr分子标记引物组,38对引物的获取方法,包括如下步骤:
46.(1)获取基因数据库:转录组测序样本来源于授粉后30d的正常发育幼果,测序时共对3株果实进行取样,每株采集幼果2个,重复3次,rna-seq转录组测序试验委托联川生物技术有限公司进行;测序结果组装采用de novo的方法;组装后共得到29591条基因数据库,作为微卫星标记开发的基础数据;
47.(2)以转录组测序数据为基础,采用misa软件进行微卫星位点查找,查找标准为单
核苷酸最小重复次数10次,2-6核苷酸重复次数4次以上;用primer5.0软件进行引物批量设计;设计标准为:微卫星位点侧翼序列长度≥50bp;pcr产物大小在100~350bp;引物长度在18~26bp;引物tm值在55~70℃之间;上下游引物的tm≤2℃;gc含量在40%~60%之间;
48.(3)引物筛选:从批量设计出的5545条引物中挑选重复次数在7次以上,微卫星重复单元为2~6个核苷酸的引物536对进行合成并用于pcr扩增;初步挑选出536对具有较高重复次数的引物进行进一步的试验验证,结果表明,参试的536对引物中有358对可扩增出清晰的琼脂糖条带,进一步毛细管电泳检测表明,38对引物可扩增出多态性条带。
49.上述鉴定扁桃种质资源的ssr分子标记引物组,其中,在38对引物中,有27对引物标记为高度多态性位点,0.5≤pic,分别为s8、s22、s26、s37、s89、s102、s111、s116、s119、s121、s123、s127、s136、s168、s178、s179、s180、s182、s184、s203、s210、s213、s219、s225、s227、s228、s536。
50.鉴定扁桃种质资源的ssr分子标记引物组在扁桃遗传多样性分析中的应用,包括如下步骤:
51.(1)提取待测扁桃样品dna;
52.(2)利用上述ssr分子标记引物组进行pcr扩增,采用毛细管电泳检测;
53.(3)利用扩增出多态性条带对扁桃种质遗传多样性进行分析。
54.上述鉴定扁桃种质资源的ssr分子标记引物组在扁桃遗传多样性分析中的应用,在步骤(1)中,待测扁桃样品来自莎车县二林场,包括当地主栽品种纸皮、双仁、晚丰、双果、小软壳及资源圃收集的其他19份地方变异类型。
55.上述鉴定扁桃种质资源的ssr分子标记引物组在扁桃遗传多样性分析中的应用,在步骤(1)中,采用tiangen试剂盒dp305对扁桃叶片进行dna提取,采用琼脂糖凝胶电泳和nanodrop检测提取的dna浓度和质量,dna提取后-4℃保存备用。
56.上述鉴定扁桃种质资源的ssr分子标记引物组在扁桃遗传多样性分析中的应用,在步骤(2)中,pcr扩增体系为20μl,其中2
×
taq master mix 10μl,20-30ng
·
l-1
的dna模板1μl,10μmol
·
l-1
的正反向引物各0.5μl,dd h2o8μl;
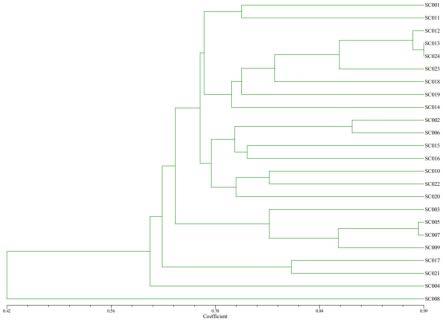
57.扩增程序为95℃预变性5min;然后进行35个循环,每个循环包括95℃变性40s,55℃退火35s,72℃延伸40s;最后72℃延伸10min。
58.上述鉴定扁桃种质资源的ssr分子标记引物组在扁桃遗传多样性分析中的应用,在步骤(3)中,使用毛细管电泳进行多态性筛选,并进行多态性分析。
59.上述鉴定扁桃种质资源的ssr分子标记引物组在扁桃遗传多样性分析中的应用,每对引物作为1对等位基因位点,统计等位基因数量并利用power marker v3.25软件计算引物多态性信息量(pic),使用popgene32软件计算群体有效等位基因数(ne)、shannon’s信息指数(i)、观测杂合度(ho)、期望杂合度(he)、nei’s期望杂合度(nei’s)多样性指数。
60.本发明的技术方案取得了如下有益的技术效果:
61.为开发扁桃微卫星(ssr)引物,向扁桃种质资源评价与辅助育种提供有效的鉴定标记。本技术以扁桃幼果为试验材料进行转录组测序和组装,采用生物信息学方法对扁桃幼果转录组ssr位点的数量、频率、分布特征进行了统计分析;对ssr位点进行了筛选和引物开发,并利用开发引物对扁桃24份种质进行了多样性评价。结果表明:扁桃幼果est-ssr的分布频率为25.8%,各基序类型重复分布在1-24次之间,优势基序为1-3核苷酸重复,分别
占总ssr的19.9%,49.1%和24.8%。通过毛细管电泳检测,536对参试引物共鉴定出38对多态性引物,其中高多态性引物27对(pic≥0.5)。38对引物在24份扁桃种质中共检测出191个等位基因位点,有效等位基因数(ne)、shannon’s信息指数(i)、观测杂合度(ho)、期望杂合度(he)、nei’s期望杂合度(nei’s)分别为2.99、1.16、0.59、0.63、0.61。upgma聚类分析表明24份种质可分为两个大的类群。本研究表明了扁桃ssr引物开发的可行性并对国内扁桃种质资源进行了多样性分析,为扁桃种质资源鉴定评价及辅助育种提供了基础。
62.本文以扁桃幼果转录组测序数据为基础,对微卫星位点进行了挖掘、分析和评价,对微卫星引物进行了批量设计和验证,并对新疆主产区扁桃种质资源的多样性进行了分析,为扁桃种质资源深度评价提供了基础。
63.目前扁桃遗传多样性相关研究仍较少,且多以聚丙烯凝胶电泳为主,制胶难度大、步骤多且操作繁琐,在不同带谱间相对位置的识别及不同批次的反应数据统一上仍存在困难。毛细管电泳以其高分辨率、自动化的优点在速度和准确度方面具有明显的优势,具有较强的可靠性。
64.多样性分析结果表明:24份扁桃品种和无性系有效等位基因数(ne)、shannon’s信息指数(i)、观测杂合度(ho)、期望杂合度(he)、nei’s期望杂合度(nei’s)平均值分别为:2.99、1.16、0.59、0.63、0.61,与近缘树种桃、杏、樱桃等多样性水平接近,表明新疆扁桃具有丰富的遗传多样性和遗传基础,在品种选育方面具有较高的潜力。
附图说明
65.图1扁桃微卫星不同基序重复类型及比例;
66.图2参试引物的琼脂糖电泳条带;
67.图3as184的引物在品种b10的毛细管电泳条带;
68.图3b s180的引物在品种f09的毛细管电泳条带;
69.图3c s184的引物在品种b02的毛细管电泳条带;
70.图3d s180的引物在品种f01的毛细管电泳条带;
71.图4扁桃种质亲缘关系聚类分析图。
72.1、材料与方法
73.1.1、试验材料
74.转录组测序样本来源于授粉后30d的正常发育幼果。测序时共对3株果实进行了取样,每株采集幼果2个,重复3次,rna-seq转录组测序试验委托联川生物技术有限公司进行。测序结果组装采用de novo的方法(grabherr et al.,2011),组装后共得到29591条unigene(基因数据库),作为微卫星标记开发的基础数据。
75.扁桃遗传多样性分析所用样本来自莎车县二林场,包括当地主栽品种纸皮、双仁、晚丰、双果、小软壳及资源圃收集的其他19份地方变异类型。
76.1.2、转录组微卫星位点挖掘和引物设计
77.以转录组测序数据为基础,采用misa软件进行微卫星位点查找,查找标准为单核苷酸最小重复次数10次,2-6核苷酸重复次数4次以上。用primer5.0软件进行引物批量设计。设计标准为:微卫星位点侧翼序列长度≥50bp;pcr产物大小在100~350bp;引物长度在18~26bp;引物tm值在55~70℃之间;上下游引物的tm≤2℃;gc含量在40%~60%之间。引
物设计过程中尽量避免错配和引物二聚体的出现,引物设计完成后在数据库中对引物进行blast验证。
78.1.3、引物筛选与pcr扩增
79.从批量设计出的5545条引物中挑选重复次数在7次以上,微卫星重复单元为2~6个核苷酸的引物536对进行合成并用于pcr扩增。
80.pcr反应体系为20μl,其中2
×
taq master mix 10μl,20-30ng
·
l-1
的dna模板1μl,10μmol
·
l-1的正反向引物各0.5μl,dd h2o 8μl。
81.扩增程序为95℃预变性5min;然后进行35个循环,每个循环包括95℃变性40s,55℃退火35s,72℃延伸40s;最后72℃延伸10min。
82.pcr产物扩增后先用2%琼脂糖凝胶电泳检测,对没有条带或扩增效果不好的引物进行筛选。
83.然后使用毛细管电泳进行多态性筛选,并进行多态性分析。
84.1.4、24种样本dna提取
85.采用tiangen试剂盒dp305对扁桃叶片进行dna提取,采用琼脂糖凝胶电泳和nanodrop检测提取的dna浓度和质量,dna提取后-4℃保存备用。
86.1.5、多态性分析(数据分析)
87.每对引物作为1对等位基因位点,统计等位基因数量并利用power marker v3.25软件计算引物多态性信息量(pic),使用popgene32软件计算群体有效等位基因数(ne)、shannon’s信息指数(i)、观测杂合度(ho)、期望杂合度(he)、nei’s期望杂合度(nei’s)等多样性指数。
88.2、结果与分析
89.2.1、微卫星位点的数量与分布
90.通过序列分析和数据挖掘,共发现扁桃ssr序列7644条,占转录组序列的25.8%。ssr重复基元长度介于1-6个核苷酸重复类型之间,主要以单核苷酸和2、3核苷酸重复类型为主,其中适合微卫星标记开发的2、3核苷酸重复占重复类型总数的73.9%。微卫星各基序重复次数主要分布在20次以下,占总重复次数的93.2%,其中,5-8次重复的比例最大,均在10%以上;各基序重复次数和重复类型均随数量的增加呈现下降趋势(表1)。
91.表1扁桃微卫星类型、数量及分布频率
[0092][0093]
在不同的重复类型中,单核苷酸重复以t、a为主,分别占总重复类型的59.1%和40.3%,2核苷酸重复类型以ag/ct和ga/tc重复较多,占总重复类型的45.2%和39.2%;3核苷酸重复类型以aag/ctt、gaa/ttc、aga/tct较多,分别占总重复次数的11.7%、11.4%和10.2%(图1)。
[0094]
2.2、微卫星引物的筛选与验证
[0095]
通过批量设计,共获得5545对符合条件的微卫星引物,从中初步挑选出536对具有较高重复次数的引物进行进一步的试验验证,结果表明,参试的536对引物中有358对可扩增出清晰的琼脂糖条带(图2),占参试引物的66.8%。进一步毛细管电泳检测表明,38对引物可扩增出多态性条带(表2、图3a-图3d)。
[0096]
图3a-图3d分别为s184和s180引物在不同样品的毛细管电泳检测结果,可以通过条带不同来区别不同的品种。
[0097]
其中27对标记为高度多态性位点(0.5≤pic),占多态性引物比例的71.1%,8对标记为中度多态性位点(0.25《pic《0.5),占多态性引物比例的21.1%,3对标记为低度多态性位点(pic《0.25),占多态性引物比例的7.9%。
[0098]
表2多态性引物信息表
[0099]
[0100][0101]
2.3、扁桃遗传多样性分析
[0102]
使用开发出的27对高多态性引物对主产区扁桃种质遗传多样性进行分析,27对微卫星引物在24份扁桃样本中共检测到191个等位基因,平均每对引物检测到7.07个等位基因。
[0103]
多样性分析表明:各引物在24份扁桃资源中的有效等位基因数(ne)、shannon’s信息指数(i)、观测杂合度(ho)、期望杂合度(he)、nei’s期望杂合度(nei’s)分别介于:1.62-6.98,0.66-2.04、0.16-0.87、0.39-0.88、0.38-0.86之间,平均值分别为2.99、1.16、0.59、0.63、0.61。亲缘关系聚类分析表明,24份种质资源在遗传距离为0.65处可分为四个大的类群,其中大部分(22份)归为1个类群,另外两份分别归为一类,如图4所示。
[0104]
3、讨论
[0105]
分子标记是形态学标记的重要补充,由于检测过程不受环境及自身生长发育周期的干扰,具有更高的检测效率,特别是对于一些栽培环境多变、杂合度高、生长周期长的林业资源,在性状早期鉴定及稳定性方面具有较大优势。根据来源的不同,微卫星可分为基因组微卫星(genomic-ssr)和表达序列标签微卫星(est-ssr)2大类。基因组微卫星开发是以基因组序列为基础,通过文库构建、重复序列筛选、克隆测序等系列步骤而成,开发过程步骤复杂、工作量大且可利用的微卫星序列较少。表达序列标签微卫星来源于基因转录区中
所含的微卫星序列;由于转录组高通量测序技术的应用,可以为表达序列标签微卫星的开发提供大量的可利用资源,具有较低的成本和较高的效率。
[0106]
扁桃幼果转录组中ssr重复类型以2、3核苷酸最多,与多数树种的研究结果相似,说明扁桃转录组数据较适合ssr分子标记的开发。分析发现,相对于属内及近缘树种,扁桃ssr各类型的重复次数在转录组中具有显著增加,尤其2核苷酸重复,重复次数超过10次的占总体的60.8%,而近缘桃(3.1%)、杏(8.5%)、中国樱桃(3.4%)等物种均低于10%。由于微卫星可通过表达调控、基因转换、染色体组织等多种机制影响基因组进化,这类二核苷酸高度重复的适应性状,有待于进一步的科研探索。
[0107]
在重复类型的碱基组成上,扁桃2核苷酸重复基序以ag/ct和ga/tc较多,3核苷酸重复基序以aag/ctt、gaa/ttc较多,这一结果也与近缘种桃、杏、李、中国樱桃及杜仲、皂荚、蜡梅等其他双子叶植物转录组开发方面的研究相似,与部分松属及单子叶植物有所差别,说明这几种碱基组合在双子叶植物体内具有较高的突变几率,与morgante(1993)等提出的“aag/ctt是双子叶植物中主要的三核苷酸重复类型”相符。
[0108]
通过对转录组中微卫星序列的挖掘和分析,本研究共设计出了5545对符合开发条件的ssr候选引物,对其中536对进行了试验验证,开发出了38对多态性引物,其中27对为高多态性引物,8对中等多态性引物,3对低多态性引物,说明利用扁桃转录组数据开发引物具有较强的可行性。通过对24份扁桃品种和无性系的多样性分析表明,27对引物可检测出191个微卫星位点,平均每对引物检测到7.07个多态性位点,开发引物具有较高的变异位点检测能力。
[0109]
目前扁桃遗传多样性相关研究仍较少,且多以聚丙烯凝胶电泳为主,制胶难度大、步骤多且操作繁琐,在不同带谱间相对位置的识别及不同批次的反应数据统一上仍存在困难。毛细管电泳以其高分辨率、自动化的优点在速度和准确度方面具有明显的优势,具有较强的可靠性。多样性分析结果表明:24份扁桃品种和无性系有效等位基因数(ne)、shannon’s信息指数(i)、观测杂合度(ho)、期望杂合度(he)、nei’s期望杂合度(nei’s)平均值分别为:2.99、1.16、0.59、0.63、0.61,检测结果与xie(2006)等对国内外扁桃品种遗传多样性的研究结果相似(xie et al,2006;曾斌等,2009),与近缘树种桃、杏、樱桃等多样性水平接近,表明新疆扁桃具有丰富的遗传多样性和遗传基础,在品种选育方面具有较高的潜力。聚类分析表明24份种质可分为三个大的类群。其中大部分具有一定的亲缘关系,可归于一个大的类群,可能归因于扁桃在国内引种栽培历史悠久,在长期的天然杂交及子代选择过程中形成了具有一定亲缘关系的栽培群体,而另外的两份具有较远的亲缘关系,推测其可能是近期从原引种区以外的区域引进。
[0110]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本专利申请权利要求的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1