高表达的新型的苯丙氨酸解氨酶的制作方法
1.本发明涉及生物技术领域,具体地涉及一种新型苯丙氨酸解氨酶及其应用。
背景技术:
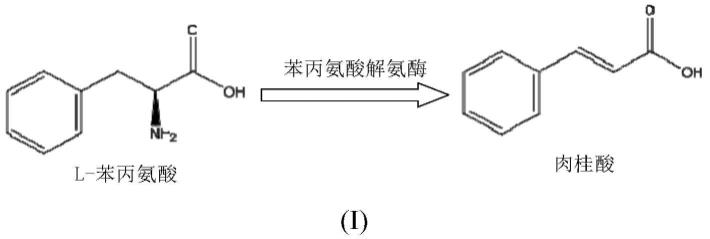
2.苯丙氨酸解氨酶(pal,ec4.3.1.5)可催化l-苯丙氨酸(l-phe)非氧化脱氨生成肉桂酸和氨(如下式i所示)。pal为非哺乳动物酶,其广泛分布于植物中,并在真菌和部分细菌中被鉴定出,在苯丙烷代谢中起关键作用。pal在医学上已被用于苯丙酮尿症(pku)的酶替代治疗。pku的病因是常染色体代谢遗传紊乱,导致血流中高水平的苯丙氨酸异常累积。在人体中,若pku未及早治疗,高水平的苯丙氨酸和其分解产物的部分可引起智力障碍、小头畸形和癫痫发作等疾病。此外,pal酶还可用于农业应用。pal在植物、真菌和细菌中的苯丙素(如类黄酮、木质素)生物合成中起着重要作用,这些物质被报道在植物抗病中起着重要作用。
[0003][0004]
在可产生pal的微生物中,酵母,特别是红酵母,因其潜在的pal生产能力而引起了极大的关注。一直以来,提高红酵母产pal的稳定性和活性是研究的重点。为了提高pal酶的稳定性,人们考虑采用固定化酶的技术;为了提高酶活性,通常选择在重组大肠杆菌中克隆和异源表达红酵母pal。
[0005]
常用的来源于红酵母属的菌株有粘红酵母(rhodotorula glutinis)、胶红酵母(rhodotorula mucilaginosa)、圆红冬孢酵母(rhodotorula toruloides)等,这些菌株的pal氨基酸序列不完全相同,其中即使是都来源于粘红酵母的pal序列,这些序列之间也存在差异,氨基酸序列的不同导致表达量和/或酶活存在较大的差异,且整体表达量和酶活偏低。
[0006]
因此,本领域迫切需要开发一种新型的表达量和酶活提高的pal,为pal的生产提供有效和可持续的来源。
技术实现要素:
[0007]
本发明的目的就是提供一种高表达、高酶活的苯丙氨酸解氨酶突变蛋白及其应用。
[0008]
本发明的另一目的在于提供一种苯丙氨酸解氨酶突变蛋白的制备方法。
[0009]
在本发明的第一方面,提供了一种苯丙氨酸解氨酶突变蛋白,所述苯丙氨酸解氨
酶突变蛋白在对应于野生型苯丙氨酸解氨酶的氨基酸序列上进行突变,突变位点至少包括选自下组的一个或多个核心氨基酸位点:
[0010]
第77位组氨酸(h);
[0011]
第95位丙氨酸(a);
[0012]
第139位半胱氨酸(c);
[0013]
第235位天冬氨酸(d);
[0014]
第362位半胱氨酸(c);
[0015]
第450位半胱氨酸(c);
[0016]
第462位半胱氨酸(c);
[0017]
第525位半胱氨酸(c);
[0018]
第540位苏氨酸(t);和
[0019]
第619位半胱氨酸(c);
[0020]
所述野生型苯丙氨酸解氨酶的氨基酸序列如seq id no:1所示。
[0021]
在另一优选例中,所述苯丙氨酸解氨酶突变蛋白包括以下至少一种核心氨基酸:
[0022]
第77位氨基酸为r、第95位氨基酸为k、第139位氨基酸为s、第235位氨基酸为k、第362位氨基酸为s、第450位氨基酸为s、第462位氨基酸为s、第525位氨基酸为s、第540位氨基酸为k,或第619位氨基酸为s。
[0023]
在另一优选例中,所述第77位组氨酸(h)突变为精氨酸(r)。
[0024]
在另一优选例中,所述第95位丙氨酸(a)突变为赖氨酸(k)。
[0025]
在另一优选例中,所述第139位半胱氨酸(c)突变为丝氨酸(s)。
[0026]
在另一优选例中,所述第235位天冬氨酸(d)突变为赖氨酸(k)。
[0027]
在另一优选例中,所述第362位半胱氨酸(c)突变为丝氨酸(s)。
[0028]
在另一优选例中,所述第450位半胱氨酸(c)突变为丝氨酸(s)。
[0029]
在另一优选例中,所述第462位半胱氨酸(c)突变为丝氨酸(s)。
[0030]
在另一优选例中,所述第525位半胱氨酸(c)突变为丝氨酸(s)。
[0031]
在另一优选例中,所述第540位苏氨酸(t)突变为赖氨酸(k)。
[0032]
在另一优选例中,所述第619位半胱氨酸(c)突变为丝氨酸(s)。
[0033]
在另一优选例中,所述突变蛋白除所述突变(如第77位、第95位、第139位、第235位、第362位、第450位、第462位、第525位、第540位,和/或第619位)外,其余的氨基酸序列与seq id no:1所示的序列相同或基本相同。
[0034]
在另一优选例中,所述基本相同是至多有50个(较佳地为1-20个,更佳地为1-10个,更佳地1-5个)氨基酸不相同,其中,所述的不相同包括氨基酸的取代、缺失或添加,且所述的突变蛋白仍具有催化生成肉桂酸的催化活性。
[0035]
在另一优选例中,所述突变蛋白与seq id no:1所示序列的同源性至少为80%,较佳地至少为85%或90%,更佳地至少为95%,最佳地至少为98%或99%。
[0036]
在另一优选例中,所述突变蛋白的氨基酸序列如seq id no:2-11中任一所示。
[0037]
在另一优选例中,所述野生型苯丙氨酸解氨酶来源于红酵母。
[0038]
在另一优选例中,所述野生型苯丙氨酸解氨酶来源于粘红酵母。
[0039]
在另一优选例中,所述苯丙氨酸解氨酶的催化底物包括苯丙氨酸。
[0040]
在另一优选例中,所述苯丙氨酸为l-苯丙氨酸。
[0041]
在另一优选例中,所述突变蛋白催化苯丙氨酸反应生成肉桂酸。
[0042]
在另一优选例中,所述肉桂酸为反式肉桂酸。
[0043]
在另一优选例中,所述反应具有选自下组的一个或多个特点:
[0044]
(i)反应体系的ph为7-11,较佳地,7.5-10;更佳地,8.0-9.0;
[0045]
(ii)反应温度为30-50℃,较佳地,35-45℃;更佳地,37-40℃;
[0046]
(iii)反应时间为5-72小时,较佳地,10-48小时,更佳地,24-36小时;
[0047]
(iv)底物浓度为5-40mg/ml,较佳地,7.5-35mg/ml;更佳地,10-30mg/ml;
[0048]
(v)底物与苯丙氨酸解氨酶的质量比为4000:1-7000:1,较佳地,4500:1-6500:1;更佳地,5000:1-6000:1。
[0049]
在另一优选例中,所述突变蛋白催化苯丙氨酸反应生成肉桂酸的活性为野生型苯丙氨酸解氨酶(seq id no:1)的100%-130%,较佳地,109%-130%。
[0050]
在另一优选例中,所述突变蛋白的有效酶表达量为野生型苯丙氨酸解氨酶(seq id no:1)的100%-450%,较佳地,110%-450%。
[0051]
在另一优选例中,所述突变蛋白的苯丙氨酸转化率为84%-99%,较佳地,90%-99%;更佳地,95%-99%。
[0052]
在本发明的第二方面,提供了一种多核苷酸,所述多核苷酸编码如本发明第一方面所述的突变蛋白。
[0053]
在另一优选例中,所述多核苷酸在苯丙氨酸解氨酶突变蛋白的orf的侧翼还额外含有选自下组的辅助元件:信号肽、分泌肽、标签序列(如6his),或其组合。
[0054]
在另一优选例中,所述多核苷酸选自下组:dna序列、rna序列,或其组合。
[0055]
在本发明的第三方面,提供了一种载体,所述载体含有如本发明第二方面所述的多核苷酸。
[0056]
在另一优选例中,所述载体包括表达载体、穿梭载体、整合载体。
[0057]
在本发明的第四方面,提供了一种宿主细胞,所述宿主细胞含有如本发明第三方面所述的载体,或其基因组中整合有如本发明第二方面所述的多核苷酸。
[0058]
在另一优选例中,所述宿主细胞为真核细胞,如酵母细胞或植物细胞。
[0059]
在另一优选例中,所述宿主细胞为原核细胞,如大肠杆菌。
[0060]
在本发明的第五方面,提供了一种产生如本发明第一方面所述的苯丙氨酸解氨酶突变蛋白的方法,包括步骤:
[0061]
(a)在适合表达的条件下,培养如本发明第四方面所述的宿主细胞,从而表达出苯丙氨酸解氨酶突变蛋白;和/或
[0062]
(b)分离表达产物,从而获得所述苯丙氨酸解氨酶突变蛋白。
[0063]
在另一优选例中,步骤(a)中所述适合表达的条件包括发酵。
[0064]
在另一优选例中,所述适合表达的条件包括:发酵温度为35(
±
5)℃,较佳地,35(
±
3)℃。
[0065]
在另一优选例中,所述适合表达的条件包括:发酵时间为22-30h,较佳地,24-28h。
[0066]
在另一优选例中,所述适合表达的条件包括:空气流量为1-8l/min,较佳地,2-7l/min。
[0067]
在另一优选例中,所述适合表达的条件包括:在发酵培养2-12h(较佳地3-10h)后,以步进速率流加含甘油和酵母蛋白胨的补料培养基。
[0068]
在另一优选例中,所述适合表达的条件包括:培养至od600达到25~80时,加入诱导剂进行诱导,诱导温度为30(
±
5)℃,较佳地,30(
±
3)℃。
[0069]
在另一优选例中,所述诱导剂为阿拉伯糖(l-ara)。
[0070]
在另一优选例中,所述诱导剂的终浓度为0.1%~0.3%。
[0071]
在本发明的第六方面,提供了一种酶制剂,所述酶制剂包含如本发明第一方面所述的苯丙氨酸解氨酶突变蛋白。
[0072]
在另一优选例中,所述的酶制剂包括注射剂和/或冻干制剂。
[0073]
在本发明的第七方面,提供了一种制备肉桂酸的方法,包括步骤:
[0074]
(i)将如本发明第一方面所述的苯丙氨酸解氨酶突变蛋白与反应底物混合,进行催化反应,从而获得所述肉桂酸;和
[0075]
(ii)任选地,分离并纯化所述肉桂酸。
[0076]
在另一优选例中,所述肉桂酸为反式肉桂酸。
[0077]
在另一优选例中,所述反应底物为苯丙氨酸。
[0078]
在另一优选例中,在步骤(i)中,所述催化反应的时间为5-72h,较佳地,10-48h,更佳地,24-36h。
[0079]
在另一优选例中,在步骤(i)中,所述催化反应的温度为30-50℃,较佳地,35-45℃;更佳地,37-40℃。
[0080]
在本发明的第八方面,提供了一种如本发明第一方面所述的突变蛋白的用途,所述的突变蛋白用于催化苯丙氨酸生成肉桂酸,或被用于制备催化苯丙氨酸生成肉桂酸的催化制剂。
[0081]
在本发明的第九方面,提供了一种如本发明第一方面所述的突变蛋白或如本发明第四方面所述的宿主细胞的用途,用于制备肉桂酸。
[0082]
在本发明的第十方面,提供了一种如本发明第一方面所述的突变蛋白的制备方法,包括步骤:
[0083]
在野生型苯丙氨酸解氨酶的对应于seq id no:1的选自下组的一个或多个核心氨基酸位点发生突变:(a)一个或多个半胱氨酸;(b)一个或多个非极性疏水性氨基酸;(c)一个或多个酸性氨基酸;(d)一个或多个极性中性氨基酸。
[0084]
在另一优选例中,所述一个或多个半胱氨酸选自下组:第139位半胱氨酸(c)、第362位半胱氨酸(c)、第450位半胱氨酸(c)、第462位半胱氨酸(c)、第525位半胱氨酸(c)、第619位半胱氨酸(c),或其组合。
[0085]
在另一优选例中,所述一个或多个非极性疏水性氨基酸为丙氨酸。
[0086]
在另一优选例中,所述一个或多个酸性氨基酸为天冬氨酸。
[0087]
在另一优选例中,所述一个或多个极性中性氨基酸为苏氨酸。
[0088]
在另一优选例中,所述一个或多个半胱氨酸突变为丝氨酸(s)。
[0089]
在另一优选例中,所述一个或多个非极性疏水性氨基酸、一个或多个酸性氨基酸、一个或多个极性中性氨基酸突变为碱性氨基酸。
[0090]
在另一优选例中,所述碱性氨基酸为赖氨酸。
[0091]
在另一优选例中,所述方法包括步骤:
[0092]
在对应于野生型苯丙氨酸解氨酶的氨基酸序列上进行突变,突变位点至少包括选自下组的一个或多个核心氨基酸位点:
[0093]
第77位组氨酸(h);
[0094]
第95位丙氨酸(a);
[0095]
第139位半胱氨酸(c);
[0096]
第235位天冬氨酸(d);
[0097]
第362位半胱氨酸(c);
[0098]
第450位半胱氨酸(c);
[0099]
第462位半胱氨酸(c);
[0100]
第525位半胱氨酸(c);
[0101]
第540位苏氨酸(t);和
[0102]
第619位半胱氨酸(c);
[0103]
所述野生型苯丙氨酸解氨酶的氨基酸序列如seq id no:1所示。
[0104]
在另一优选例中,所述第77位组氨酸(h)突变为精氨酸(r)。
[0105]
在另一优选例中,所述第95位丙氨酸(a)突变为赖氨酸(k)。
[0106]
在另一优选例中,所述第139位半胱氨酸(c)突变为丝氨酸(s)。
[0107]
在另一优选例中,所述第235位天冬氨酸(d)突变为赖氨酸(k)。
[0108]
在另一优选例中,所述第362位半胱氨酸(c)突变为丝氨酸(s)。
[0109]
在另一优选例中,所述第450位半胱氨酸(c)突变为丝氨酸(s)。
[0110]
在另一优选例中,所述第462位半胱氨酸(c)突变为丝氨酸(s)。
[0111]
在另一优选例中,所述第525位半胱氨酸(c)突变为丝氨酸(s)。
[0112]
在另一优选例中,所述第540位苏氨酸(t)突变为赖氨酸(k)。
[0113]
在另一优选例中,所述第619位半胱氨酸(c)突变为丝氨酸(s)。
[0114]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0115]
图1显示了质粒pbad-pal的图谱。
[0116]
图2显示了pbad-pal(t540k)的核酸电泳验证结果。
[0117]
图3显示了突变型苯丙氨酸解氨酶的蛋白电泳结果。
具体实施方式
[0118]
本发明人经过广泛而深入的研究,通过大量的筛选,首次意外地发现一种高表达的新型苯丙氨酸解氨酶。基于对红酵母属不同菌株来源的野生型苯丙氨酸解氨酶的序列研究,本发明人发现,对野生型苯丙氨酸解氨酶的关键位点进行改造后,可获得表达量和酶活方面多效提高的突变型苯丙氨酸解氨酶。在此基础上完成了本发明。
[0119]
术语
[0120]
为了可以更容易地理解本公开,首先定义某些术语。如本技术中所使用的,除非本文另有明确规定,否则以下术语中的每一个应具有下面给出的含义。
[0121]
术语“约”可以是指在本领域普通技术人员确定的特定值或组成的可接受误差范围内的值或组成,其将部分地取决于如何测量或测定值或组成。
[0122]
术语“给予”是指使用本领域技术人员已知的各种方法和递送系统中的任一种将本发明的产品物理引入受试者,包括静脉内、瘤内、肌内、皮下、腹膜内、脊髓或其它肠胃外给药途径,例如通过注射或输注。
[0123]
术语“苯丙氨酸解氨酶突变蛋白”、“新型苯丙氨酸解氨酶”、“突变型苯丙氨酸解氨酶”、“突变蛋白”等可互换使用,指对野生型苯丙氨酸解氨酶的关键位点进行突变后获得的本发明的苯丙氨酸解氨酶突变蛋白,其表达量和/或酶活相比野生型苯丙氨酸解氨酶得到显著提高。
[0124]
如本文所用,术语“axxb”表示第xx位的氨基酸a变为氨基酸b,例如“t540k”表示第540位的氨基酸t突变为k,以此类推。
[0125]
本发明突变蛋白及其编码核酸
[0126]
如本文所用,术语“苯丙氨酸解氨酶突变蛋白”、“新型苯丙氨酸解氨酶”、“突变型苯丙氨酸解氨酶”、“突变蛋白”、“苯丙氨酸解氨酶突变体”等可互换使用,均指非天然存在的苯丙氨酸解氨酶突变蛋白,且所述突变蛋白为基于seq id no:1所示蛋白进行人工改造的蛋白,其中,所述的突变蛋白含有与酶催化活性相关的核心氨基酸,且所述核心氨基酸中至少有一个是经过人工改造的;并且本发明突变蛋白具有催化苯丙氨酸形成肉桂酸的酶活性。
[0127]
术语“核心氨基酸”指的是基于seq id no:1,且与seq id no:1同源性达至少80%,如84%、85%、90%、92%、95%、98%的序列中,相应位点是如本文所述的特定氨基酸,例如基于seq id no:1所示的序列,核心氨基酸为:
[0128]
第77位组氨酸(h);和/或
[0129]
第95位丙氨酸(a);和/或
[0130]
第139位半胱氨酸(c);和/或
[0131]
第235位天冬氨酸(d);和/或
[0132]
第362位半胱氨酸(c);和/或
[0133]
第450位半胱氨酸(c);和/或
[0134]
第462位半胱氨酸(c);和/或
[0135]
第525位半胱氨酸(c);和/或
[0136]
第540位苏氨酸(t);和/或
[0137]
第619位半胱氨酸(c);
[0138]
且对上述核心氨基酸进行突变所得到的突变蛋白具有催化苯丙氨酸形成肉桂酸的酶活性。
[0139]
优选地,在本发明中,基于野生型苯丙氨酸解氨酶的序列进行一个或多个半胱氨酸的突变、一个或多个非极性疏水性氨基酸的突变、一个或多个酸性氨基酸的突变,和/或一个或多个极性中性氨基酸的突变。在以上突变中,优选的突变方式包括c-s类突变(即由半胱氨酸残基c突变为丝氨酸残基s)以及x-k类突变(即由其他氨基酸残基(非极性疏水性
氨基酸、酸性氨基酸、极性中性氨基酸)突变为赖氨酸残基k)。
[0140]
优选地,在本发明中,对本发明的所述核心氨基酸进行如下突变,如表1所示。
[0141]
表1
[0142]
位置野生型最优选突变体突变位点1(第77位氨基酸)hr突变位点2(第95位氨基酸)ak突变位点3(第139位氨基酸)cs突变位点4(第235位氨基酸)dk突变位点5(第362位氨基酸)cs突变位点6(第450位氨基酸)cs突变位点7(第462位氨基酸)cs突变位点8(第525位氨基酸)cs突变位点9(第540位氨基酸)tk突变位点10(第619位氨基酸)cs
[0143]
应理解,本发明突变蛋白中的氨基酸编号基于seq id no:1作出,当某一具体突变蛋白与seq id no:1所示序列的同源性达到80%或以上时,突变蛋白的氨基酸编号可能会有相对于seq id no:1的氨基酸编号的错位,如向氨基酸的n末端或c末端错位1-5位,而采用本领域常规的序列比对技术,本领域技术人员通常可以理解这样的错位是在合理范围内的,且不应当由于氨基酸编号的错位而使同源性达80%(如90%、95%、98%)的、具有相同或相似产生苯丙氨酸催化活性的突变蛋白不在本发明突变蛋白的范围内。
[0144]
本发明突变蛋白是合成蛋白或重组蛋白,即可以是化学合成的产物,或使用重组技术从原核或真核宿主(例如,细菌、酵母、植物)中产生。根据重组生产方案所用的宿主,本发明的突变蛋白可以是糖基化的,或可以是非糖基化的。本发明的突变蛋白还可包括或不包括起始的甲硫氨酸残基。
[0145]
本发明还包括所述突变蛋白的片段、衍生物和类似物。如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持所述突变蛋白相同的生物学功能或活性的蛋白。
[0146]
本发明的突变蛋白片段、衍生物或类似物可以是:(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的突变蛋白,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的,或(ii)在一个或多个氨基酸残基中具有取代基团的突变蛋白,或(iii)成熟突变蛋白与另一个化合物(比如延长突变蛋白半衰期的化合物,例如聚乙二醇)融合所形成的突变蛋白,或(iv)附加的氨基酸序列融合到此突变蛋白序列而形成的突变蛋白(如前导序列或分泌序列或用来纯化此突变蛋白的序列或蛋白原序列,或与抗原igg片段的形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。本发明中,保守性替换的氨基酸最好根据表2进行氨基酸替换而产生。
[0147]
表2
[0148]
最初的残基代表性的取代优选的取代ala(a)val;leu;ilevalarg(r)lys;gln;asnlys
asn(n)gln;his;lys;argglnasp(d)gluglucys(c)sersergln(q)asnasnglu(e)aspaspgly(g)pro;alaalahis(h)asn;gln;lys;argargile(i)leu;val;met;ala;pheleuleu(l)ile;val;met;ala;pheilelys(k)arg;gln;asnargmet(m)leu;phe;ileleuphe(f)leu;val;ile;ala;tyrleupro(p)alaalaser(s)thrthrthr(t)sersertrp(w)tyr;phetyrtyr(y)trp;phe;thr;serpheval(v)ile;leu;met;phe;alaleu
[0149]
本发明的活性突变蛋白具有催化苯丙氨酸形成肉桂酸的酶活性。
[0150]
优选地,所述的突变蛋白如seq id no:2-11所示。应理解,本发明突变蛋白与seq id no:2-11所示的序列相比,通常具有较高的同源性(相同性、同一性),优选地,所述的突变蛋白与seq id no:2-11所示序列的同源性至少为80%,较佳地至少为85%-90%,更佳地至少为95%,最佳地至少为98%,最佳地≥99%。此外,还可以对本发明突变蛋白进行修饰。修饰(通常不改变一级结构)形式包括:体内或体外的突变蛋白的化学衍生形式如乙酰化或羧基化。修饰还包括糖基化,如那些在突变蛋白的合成和加工中或进一步加工步骤中进行糖基化修饰而产生的突变蛋白。这种修饰可以通过将突变蛋白暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸、磷酸丝氨酸、磷酸苏氨酸)的序列。还包括被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的突变蛋白。
[0151]
术语“编码突变蛋白的多核苷酸”可以是包括编码本发明突变蛋白的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
[0152]
本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的多肽或突变蛋白的片段、类似物和衍生物。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码的突变蛋白的功能。
[0153]
本发明还涉及与上述的序列杂交且两个序列之间具有至少50%,较佳地至少70%,更佳地至少80%相同性的多核苷酸。本发明特别涉及在严格条件(或严紧条件)下与本发明所述多核苷酸可杂交的多核苷酸。在本发明中,“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2
×
ssc,0.1%sds,60℃;或(2)杂交时加有变性剂,如
50%(v/v)甲酰胺,0.1%小牛血清/0.1% ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。
[0154]
本发明的突变蛋白和多核苷酸优选以分离的形式提供,更佳地,被纯化至均质。
[0155]
本发明多核苷酸全长序列通常可以通过pcr扩增法、重组法或人工合成的方法获得。对于pcr扩增法,可根据本发明所公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cdna库或按本领域技术人员已知的常规方法所制备的cdna库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次pcr扩增,然后再将各次扩增出的片段按正确次序拼接在一起。
[0156]
一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。
[0157]
此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。
[0158]
目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。
[0159]
应用pcr技术扩增dna/rna的方法被优选用于获得本发明的多核苷酸。特别是很难从文库中得到全长的cdna时,可优选使用race法(race-cdna末端快速扩增法),用于pcr的引物可根据本文所公开的本发明的序列信息适当地选择,并可用常规方法合成。可用常规方法如通过凝胶电泳分离和纯化扩增的dna/rna片段。
[0160]
在本发明的一优选实施方式中,本发明所述重组苯丙氨酸解氨酶的制备方法为:培养如上所述的重组表达转化体,获得重组表达的苯丙氨酸解氨酶。其中所述的培养重组表达转化体所用的培养基为本领域任何可使转化体生长并产生本发明的苯丙氨酸解氨酶的培养基。培养方法和培养条件没有特殊的限制,可以根据宿主细胞类型和培养方法等因素的不同,按本领域常规知识进行适当的选择,只要使转化体能够生长并生产苯丙氨酸解氨酶即可。
[0161]
在本发明的一优选实施方式中,本发明的苯丙氨酸解氨酶突变体(pal突变体)的制备方法如下:大肠杆菌作为表达宿主。
[0162]
具体地,该制备方法包括以下步骤:(1)具有pal相应突变位点的基因构建到pbad表达载体上,获得带有目的酶基因的重组质粒。(2)将重组质粒转入宿主菌细胞(优选大肠杆菌top10),获得相应的工程菌株。(3)将工程菌株接种至lb培养基中,37℃培养10-16小时。(4)离心收集菌体,破菌留取上清液。
[0163]
本发明还提供了利用pal及突变体重组菌作为生物催化剂转化苯丙氨酸的方法。具体地,将苯丙氨酸底物与重组菌或者破菌液、纯酶构建反应体系,反应体系为ph为7-11(较佳地,7.5-10;更佳地,8.0-9.0)的缓冲溶液,反应温度为30-50℃(较佳地,35-45℃;更佳地,37-40℃)。
[0164]
野生型苯丙氨酸解氨酶
[0165]
如本文所用,“野生型苯丙氨酸解氨酶”是指天然存在的、未经过人工改造的苯丙氨酸解氨酶,其核苷酸可以通过基因工程技术来获得,如基因组测序、聚合酶链式反应(pcr)等,其氨基酸序列可由核苷酸序列推导而得到。所述野生型苯丙氨酸解氨酶的氨基酸
序列如seq id no:1所示。
[0166]
上述涉及的野生蛋白、本发明突变蛋白的相关信息如表1-3所示。
[0167]
载体与宿主细胞
[0168]
本发明也涉及包含本发明的多核苷酸的载体,以及用本发明的载体或本发明突变蛋白编码序列经基因工程产生的宿主细胞,以及经重组技术产生本发明所述多肽/突变蛋白的方法。
[0169]
通过常规的重组dna技术,可利用本发明的多聚核苷酸序列可用来表达或生产重组的突变蛋白。一般来说有以下步骤:
[0170]
(1)用本发明的编码本发明突变蛋白的多核苷酸(或变异体),或用含有该多核苷酸的重组表达载体转化或转导合适的宿主细胞;
[0171]
(2)在合适的培养基中培养的宿主细胞;
[0172]
(3)从培养基或细胞中分离、纯化蛋白质。
[0173]
本发明中,编码突变蛋白的多核苷酸序列可插入到重组表达载体中。术语“重组表达载体”指本领域熟知的细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒如腺病毒、逆转录病毒或其他载体。只要能在宿主体内复制和稳定,任何质粒和载体都可以用。表达载体的一个重要特征是通常含有复制起点、启动子、标记基因和翻译控制元件。
[0174]
本领域的技术人员熟知的方法能用于构建含本发明突变蛋白编码dna序列和合适的转录/翻译控制信号的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的dna序列可有效连接到表达载体中的适当启动子上,以指导mrna合成。这些启动子的代表性例子有:大肠杆菌的lac或trp启动子;λ噬菌体pl启动子;真核启动子包括cmv立即早期启动子、hsv胸苷激酶启动子、早期和晚期sv40启动子、反转录病毒的ltrs和其他一些已知的可控制基因在原核或真核细胞或其病毒中表达的启动子。表达载体还包括翻译起始用的核糖体结合位点和转录终止子。
[0175]
此外,表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如真核细胞培养用的二氢叶酸还原酶、新霉素抗性以及绿色荧光蛋白(gfp),或用于大肠杆菌的四环素或氨苄青霉素抗性。
[0176]
包含上述的适当dna序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
[0177]
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属;鼠伤寒沙门氏菌的细菌细胞;真菌细胞如酵母。
[0178]
本发明的多核苷酸在高等真核细胞中表达时,如果在载体中插入增强子序列时将会使转录得到增强。增强子是dna的顺式作用因子,通常大约有10到300个碱基对,作用于启动子以增强基因的转录。可举的例子包括在复制起始点晚期一侧的100到270个碱基对的sv40增强子、在复制起始点晚期一侧的多瘤增强子以及腺病毒增强子等。
[0179]
本领域一般技术人员都清楚如何选择适当的载体、启动子、增强子和宿主细胞。
[0180]
用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方
法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔、脂质体包装等。
[0181]
获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
[0182]
在上面的方法中的重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
[0183]
本发明的所述苯丙氨酸解氨酶基因的启动子可通过一个或多个核苷酸的替换、插入或缺失而改变,但这些改变对启动子的功能没有负面影响。而且通过改变启动子的序列或使用不同来源的更有效的启动子进行完全替换,可提高所述苯丙氨酸解氨酶的表达水平。
[0184]
本发明的所述重组表达载体可通过本领域常规方法将上述苯丙氨酸解氨酶基因克隆到各种载体上构建而成。所述的表达载体较佳地包括本领域常规的各种载体,如市售的质粒、粘粒、噬菌体或病毒载体等,所述载体对于大肠杆菌优选地为pbad质粒(卡那霉素抗性)。
[0185]
应用
[0186]
本发明涉及的苯丙氨酸解氨酶及其突变体的用途包括(但不限于):特异和高效地催化底物苯丙氨酸的转化,合成肉桂酸。
[0187]
本发明提供了一种工业催化方法,包括:在提供苯丙氨酸解氨酶存在的条件下,用本发明的苯丙氨酸解氨酶将苯丙氨酸转化为肉桂酸,其中所述的酶优选为具有基于seq id no:1所示氨基酸序列进行单点或多点突变的氨基酸序列的活性多肽。
[0188]
所述方法的ph条件为:ph为7-11,较佳地,7.5-10;更佳地,8.0-9.0。
[0189]
所述方法的温度条件为:30-50℃,较佳地,35-45℃;更佳地,37-40℃。
[0190]
所述方法的催化反应时间为5-72h,较佳地,10-48h,更佳地,24-36h。
[0191]
所述方法的底物浓度条件为:5-40mg/ml,较佳地,7.5-35mg/ml;更佳地,10-30mg/ml。
[0192]
所述方法的底物与苯丙氨酸解氨酶的质量比为4000:1-7000:1,较佳地,4500:1-6500:1;更佳地,5000:1-6000:1。
[0193]
在获得了本发明的苯丙氨酸解氨酶后,本领域人员可以方便地应用该酶来发挥体外酶法合成肉桂酸的作用,特别是对底物苯丙氨酸进行转化。
[0194]
作为本发明的优选方式,还提供了发酵培养本发明苯丙氨酸解氨酶的方法,所述发酵的条件/方法包括:优选的发酵培养基(12-16g/l酵母蛋白胨,22-30g/l酵母浸粉,1.5g/l硫酸铵,2.0-3.0g/l磷酸二氢钾,3.0~5.0g/l磷酸氢二钾,3.75g/l甘油,3.75ml/l微量元素母液,0.4
±
0.1ml/l消泡剂);发酵温度为35(
±
5)℃,较佳地,35(
±
3)℃;诱导温度为30(
±
5)℃,较佳地,30(
±
3)℃。发酵时间为22-30h,较佳地,24-28h;空气流量为1-8l/
min,较佳地,2-7l/min;在发酵培养2-12h(较佳地3-10h)后,以步进速率流加含甘油和酵母蛋白胨的补料培养基等。
[0195]
本发明的主要优点
[0196]
1.相比野生型苯丙氨酸解氨酶,本发明苯丙氨酸解氨酶突变蛋白的酶活和表达量均得到显著提高。在相同条件下,本发明的突变蛋白其有效酶表达量提升至野生型苯丙氨酸解氨酶的至多约5.44倍,突变蛋白对底物苯丙氨酸的转化率最高可达98.9%,相比野生型提高了约28.3%。
[0197]
2.本发明人经过大量筛选,发现k系列突变和s系列突变对野生型苯丙氨酸解氨酶尤为关键,是提高酶活和表达量的有效突变形式。
[0198]
3.通过构建本发明的苯丙氨酸解氨酶突变蛋白,结合本发明的发酵培养方法,本发明人首次将苯丙氨酸解氨酶的表达量提高至多达29.4g/l。
[0199]
4.本发明的苯丙氨酸解氨酶突变蛋白及其制备方法操作简单、成本低廉,为pal的生产提供了有效和可持续的来源。
[0200]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
[0201]
序列信息
[0202]
粘红酵母(rhodotorula glutinis)pal(rgpal)基因seq id no:1(706aa)
[0203]
mapsvdsiatsvanslsnglagdvrkrtsgagsllpttettqidiveriladagatdqikldgytltlgdvvgaarhgrtvkvadsprirekidasveflrtqldnsvygvttgfggsadtrtedaislqkallehqlcgvlptsmdgfalgrglenslplevvrgamtirvnsltrghsavrivvlealtnflnhgitpivplrgtisasgdlsplsyiaasitghpdskvhvdgkimsaqeaialkglqpvvlgpkeglglvngtavsasmatlaltdahvlsllaqantaltveamvghagsfhpflhdvtrphptqievarnirtllegskyavhhetevkvkddegilrqdryplrcspqwlgplvsdmihahsvlsleagqsttdnplidlenkmthhggafmassvgntmektrlavalmgkvsftqltemlnagmnralpsclaaedpslsyhckgldiaaaaytselghlanpvsthvqpaemgnqainslalisarrtaeandvlslllathlycvlqavdlramefehtkefepmvtallkqhlgalatadvedkvrksiykrlqqnnsydleqrwhdtfsvatgavvealagnevslaslnawkvacaekaialtrtvrdsfwaapsssspalkylsprtrilysfiredvgvkarrgdvylgkqevtigtnvsriyeaikdgriapvlvkmma*
[0204]
苯丙氨酸解氨酶突变蛋白(t540k)seq id no:2(706aa)
[0205]
mapsvdsiatsvanslsnglagdvrkrtsgagsllpttettqidiveriladagatdqikldgytltlgdvvgaarhgrtvkvadsprirekidasveflrtqldnsvygvttgfggsadtrtedaislqkallehqlcgvlptsmdgfalgrglenslplevvrgamtirvnsltrghsavrivvlealtnflnhgitpivplrgtisasgdlsplsyiaasitghpdskvhvdgkimsaqeaialkglqpvvlgpkeglglvngtavsasmatlaltdahvlsllaqantaltveamvghagsfhpflhdvtrphptqievarnirtllegskyavhhetevkvkddegilrqdryplrcspqwlgplvsdmihahsvlsleagqsttdnplidlenkmthhggafmassvgntmektrlavalmgkvsftqltemlnagmnralpsclaaedpslsyhckgldiaaaaytselghlanpvsthvqpaemgnqainslalisarrtaeandvlslllathlycvlqavdlramefehkkefepmvtallkqhlgalatadvedkvrksiykrlqqnnsydleqrwhdtfsvatgavve
alagnevslaslnawkvacaekaialtrtvrdsfwaapsssspalkylsprtrilysfiredvgvkarrgdvylgkqevtigtnvsriyeaikdgriapvlvkmma*
[0206]
苯丙氨酸解氨酶突变蛋白(c362s)seq id no:3(706aa)
[0207]
mapsvdsiatsvanslsnglagdvrkrtsgagsllpttettqidiveriladagatdqikldgytltlgdvvgaarhgrtvkvadsprirekidasveflrtqldnsvygvttgfggsadtrtedaislqkallehqlcgvlptsmdgfalgrglenslplevvrgamtirvnsltrghsavrivvlealtnflnhgitpivplrgtisasgdlsplsyiaasitghpdskvhvdgkimsaqeaialkglqpvvlgpkeglglvngtavsasmatlaltdahvlsllaqantaltveamvghagsfhpflhdvtrphptqievarnirtllegskyavhhetevkvkddegilrqdryplrsspqwlgplvsdmihahsvlsleagqsttdnplidlenkmthhggafmassvgntmektrlavalmgkvsftqltemlnagmnralpsclaaedpslsyhckgldiaaaaytselghlanpvsthvqpaemgnqainslalisarrtaeandvlslllathlycvlqavdlramefehtkefepmvtallkqhlgalatadvedkvrksiykrlqqnnsydleqrwhdtfsvatgavvealagnevslaslnawkvacaekaialtrtvrdsfwaapsssspalkylsprtrilysfiredvgvkarrgdvylgkqevtigtnvsriyeaikdgriapvlvkmma*
[0208]
苯丙氨酸解氨酶突变蛋白(c450s)seq id no:4(706aa)
[0209]
mapsvdsiatsvanslsnglagdvrkrtsgagsllpttettqidiveriladagatdqikldgytltlgdvvgaarhgrtvkvadsprirekidasveflrtqldnsvygvttgfggsadtrtedaislqkallehqlcgvlptsmdgfalgrglenslplevvrgamtirvnsltrghsavrivvlealtnflnhgitpivplrgtisasgdlsplsyiaasitghpdskvhvdgkimsaqeaialkglqpvvlgpkeglglvngtavsasmatlaltdahvlsllaqantaltveamvghagsfhpflhdvtrphptqievarnirtllegskyavhhetevkvkddegilrqdryplrcspqwlgplvsdmihahsvlsleagqsttdnplidlenkmthhggafmassvgntmektrlavalmgkvsftqltemlnagmnralpsslaaedpslsyhckgldiaaaaytselghlanpvsthvqpaemgnqainslalisarrtaeandvlslllathlycvlqavdlramefehtkefepmvtallkqhlgalatadvedkvrksiykrlqqnnsydleqrwhdtfsvatgavvealagnevslaslnawkvacaekaialtrtvrdsfwaapsssspalkylsprtrilysfiredvgvkarrgdvylgkqevtigtnvsriyeaikdgriapvlvkmma*
[0210]
苯丙氨酸解氨酶突变蛋白(c525s)seq id no:5(706aa)
[0211]
mapsvdsiatsvanslsnglagdvrkrtsgagsllpttettqidiveriladagatdqikldgytltlgdvvgaarhgrtvkvadsprirekidasveflrtqldnsvygvttgfggsadtrtedaislqkallehqlcgvlptsmdgfalgrglenslplevvrgamtirvnsltrghsavrivvlealtnflnhgitpivplrgtisasgdlsplsyiaasitghpdskvhvdgkimsaqeaialkglqpvvlgpkeglglvngtavsasmatlaltdahvlsllaqantaltveamvghagsfhpflhdvtrphptqievarnirtllegskyavhhetevkvkddegilrqdryplrcspqwlgplvsdmihahsvlsleagqsttdnplidlenkmthhggafmassvgntmektrlavalmgkvsftqltemlnagmnralpsclaaedpslsyhckgldiaaaaytselghlanpvsthvqpaemgnqainslalisarrtaeandvlslllathlysvlqavdlramefehtkefepmvtallkqhlgalatadvedkvrksiykrlqqnnsydleqrwhdtfsvatgavvealagnevslaslnawkvacaekaialtrtvrdsfwaapsssspalkylsprtrilysfiredvgvkarrgdvylgkqevtigtnvsriyeaikdgriapvlvkmma*
[0212]
苯丙氨酸解氨酶突变蛋白(c619s)seq id no:6(706aa)
[0213]
mapsvdsiatsvanslsnglagdvrkrtsgagsllpttettqidiveriladagatdqikldgytltlgdvvgaarhgrtvkvadsprirekidasveflrtqldnsvygvttgfggsadtrtedaislqkallehqlcgvlptsmdgfalgrglenslplevvrgamtirvnsltrghsavrivvlealtnflnhgitpivplrgtisasgdlsplsyi
aasitghpdskvhvdgkimsaqeaialkglqpvvlgpkeglglvngtavsasmatlaltdahvlsllaqantaltveamvghagsfhpflhdvtrphptqievarnirtllegskyavhhetevkvkddegilrqdryplrcspqwlgplvsdmihahsvlsleagqsttdnplidlenkmthhggafmassvgntmektrlavalmgkvsftqltemlnagmnralpsclaaedpslsyhckgldiaaaaytselghlanpvsthvqpaemgnqainslalisarrtaeandvlslllathlycvlqavdlramefehtkefepmvtallkqhlgalatadvedkvrksiykrlqqnnsydleqrwhdtfsvatgavvealagnevslaslnawkvasaekaialtrtvrdsfwaapsssspalkylsprtrilysfiredvgvkarrgdvylgkqevtigtnvsriyeaikdgriapvlvkmma*
[0214]
苯丙氨酸解氨酶突变蛋白(a95k)seq id no:7(706aa)
[0215]
mapsvdsiatsvanslsnglagdvrkrtsgagsllpttettqidiveriladagatdqikldgytltlgdvvgaarhgrtvkvadsprirekidksveflrtqldnsvygvttgfggsadtrtedaislqkallehqlcgvlptsmdgfalgrglenslplevvrgamtirvnsltrghsavrivvlealtnflnhgitpivplrgtisasgdlsplsyiaasitghpdskvhvdgkimsaqeaialkglqpvvlgpkeglglvngtavsasmatlaltdahvlsllaqantaltveamvghagsfhpflhdvtrphptqievarnirtllegskyavhhetevkvkddegilrqdryplrcspqwlgplvsdmihahsvlsleagqsttdnplidlenkmthhggafmassvgntmektrlavalmgkvsftqltemlnagmnralpsclaaedpslsyhckgldiaaaaytselghlanpvsthvqpaemgnqainslalisarrtaeandvlslllathlycvlqavdlramefehtkefepmvtallkqhlgalatadvedkvrksiykrlqqnnsydleqrwhdtfsvatgavvealagnevslaslnawkvacaekaialtrtvrdsfwaapsssspalkylsprtrilysfiredvgvkarrgdvylgkqevtigtnvsriyeaikdgriapvlvkmma*
[0216]
苯丙氨酸解氨酶突变蛋白(c462s)seq id no:8(706aa)
[0217]
mapsvdsiatsvanslsnglagdvrkrtsgagsllpttettqidiveriladagatdqikldgytltlgdvvgaarhgrtvkvadsprirekidasveflrtqldnsvygvttgfggsadtrtedaislqkallehqlcgvlptsmdgfalgrglenslplevvrgamtirvnsltrghsavrivvlealtnflnhgitpivplrgtisasgdlsplsyiaasitghpdskvhvdgkimsaqeaialkglqpvvlgpkeglglvngtavsasmatlaltdahvlsllaqantaltveamvghagsfhpflhdvtrphptqievarnirtllegskyavhhetevkvkddegilrqdryplrcspqwlgplvsdmihahsvlsleagqsttdnplidlenkmthhggafmassvgntmektrlavalmgkvsftqltemlnagmnralpsclaaedpslsyhskgldiaaaaytselghlanpvsthvqpaemgnqainslalisarrtaeandvlslllathlycvlqavdlramefehtkefepmvtallkqhlgalatadvedkvrksiykrlqqnnsydleqrwhdtfsvatgavvealagnevslaslnawkvacaekaialtrtvrdsfwaapsssspalkylsprtrilysfiredvgvkarrgdvylgkqevtigtnvsriyeaikdgriapvlvkmma*
[0218]
苯丙氨酸解氨酶突变蛋白(d235k)seq id no:9(706aa)
[0219]
mapsvdsiatsvanslsnglagdvrkrtsgagsllpttettqidiveriladagatdqikldgytltlgdvvgaarhgrtvkvadsprirekidasveflrtqldnsvygvttgfggsadtrtedaislqkallehqlcgvlptsmdgfalgrglenslplevvrgamtirvnsltrghsavrivvlealtnflnhgitpivplrgtisasgdlsplsyiaasitghpdskvhvkgkimsaqeaialkglqpvvlgpkeglglvngtavsasmatlaltdahvlsllaqantaltveamvghagsfhpflhdvtrphptqievarnirtllegskyavhhetevkvkddegilrqdryplrcspqwlgplvsdmihahsvlsleagqsttdnplidlenkmthhggafmassvgntmektrlavalmgkvsftqltemlnagmnralpsclaaedpslsyhckgldiaaaaytselghlanpvsthvqpaemgnqainslalisarrtaeandvlslllathlycvlqavdlramefehtkefepmvtallkqhlgalatadvedkvrksiykrlqqnnsydleqrwhdtfsvatgavvealagnevslaslnawkvacaekaialtrtvrdsfwaapsssspalkylsprtrilysfiredvgvkarrgdvylgk
qevtigtnvsriyeaikdgriapvlvkmma*
[0220]
苯丙氨酸解氨酶突变蛋白(c139s)seq id no:10(706aa)
[0221]
mapsvdsiatsvanslsnglagdvrkrtsgagsllpttettqidiveriladagatdqikldgytltlgdvvgaarhgrtvkvadsprirekidasveflrtqldnsvygvttgfggsadtrtedaislqkallehqlsgvlptsmdgfalgrglenslplevvrgamtirvnsltrghsavrivvlealtnflnhgitpivplrgtisasgdlsplsyiaasitghpdskvhvdgkimsaqeaialkglqpvvlgpkeglglvngtavsasmatlaltdahvlsllaqantaltveamvghagsfhpflhdvtrphptqievarnirtllegskyavhhetevkvkddegilrqdryplrcspqwlgplvsdmihahsvlsleagqsttdnplidlenkmthhggafmassvgntmektrlavalmgkvsftqltemlnagmnralpsclaaedpslsyhckgldiaaaaytselghlanpvsthvqpaemgnqainslalisarrtaeandvlslllathlycvlqavdlramefehtkefepmvtallkqhlgalatadvedkvrksiykrlqqnnsydleqrwhdtfsvatgavvealagnevslaslnawkvacaekaialtrtvrdsfwaapsssspalkylsprtrilysfiredvgvkarrgdvylgkqevtigtnvsriyeaikdgriapvlvkmma*
[0222]
苯丙氨酸解氨酶突变蛋白(h77r)seq id no:11(706aa)
[0223]
mapsvdsiatsvanslsnglagdvrkrtsgagsllpttettqidiveriladagatdqikldgytltlgdvvgaarrgrtvkvadsprirekidasveflrtqldnsvygvttgfggsadtrtedaislqkallehqlcgvlptsmdgfalgrglenslplevvrgamtirvnsltrghsavrivvlealtnflnhgitpivplrgtisasgdlsplsyiaasitghpdskvhvdgkimsaqeaialkglqpvvlgpkeglglvngtavsasmatlaltdahvlsllaqantaltveamvghagsfhpflhdvtrphptqievarnirtllegskyavhhetevkvkddegilrqdryplrcspqwlgplvsdmihahsvlsleagqsttdnplidlenkmthhggafmassvgntmektrlavalmgkvsftqltemlnagmnralpsclaaedpslsyhckgldiaaaaytselghlanpvsthvqpaemgnqainslalisarrtaeandvlslllathlycvlqavdlramefehtkefepmvtallkqhlgalatadvedkvrksiykrlqqnnsydleqrwhdtfsvatgavvealagnevslaslnawkvacaekaialtrtvrdsfwaapsssspalkylsprtrilysfiredvgvkarrgdvylgkqevtigtnvsriyeaikdgriapvlvkmma*
[0224]
实施例1野生型和单质粒突变型苯丙氨酸解氨酶的构建
[0225]
将野生型苯丙氨酸解氨酶的氨基酸序列1(seq id no:1),克隆至表达载体质粒pbad(质粒由发明人构建,卡那霉素抗性)的arabad启动子下游多克隆位点,得到质粒pbad-pal,图谱详见图1。
[0226]
以质粒pbad-pal为模板,设计引物,引入定点突变t540k。将pcr产物经dpni处理,以核酸电泳进行分离,以琼脂糖凝胶dna回收试剂盒提取,使用t4 dna ligase连接,以化学法(cacl2法)转化到e.coli top10感受态细胞中,将所述转化的细胞培养在含有卡那霉素的lb琼脂培养基(10g/l酵母蛋白胨,5g/l酵母浸粉,10g/l nacl,1.5%琼脂)上37℃培养过夜。挑取单个活菌落,在含有卡那霉素的液体lb培养基(10g/l酵母蛋白胨,5g/l酵母浸粉,10g/l nacl)中37℃、220rpm培养过夜。以质粒小量提取试剂盒提取质粒,得到的质粒命名为pbad-pal(t540k),核酸电泳图见图2。
[0227]
图2的结果显示,已成功构建引入定点突变t540k的质粒pbad-pal(t540k)。
[0228]
其他引入突变的构建方法和上述方法相同,均以质粒pbad-pal为模板,设计引物引入定点突变c362s、c450s、c525s、c619s、a95k、c462s、d235k、c139s、h77r。
[0229]
实施例2苯丙氨酸解氨酶的高密度表达
[0230]
将各质粒分别以化学法(cacl2法)转化到e.coli top10感受态细胞中,将所述转
化的细胞培养在含有50μg/ml卡那霉素的lb琼脂培养基(10g/l酵母蛋白胨,5g/l酵母浸粉,10g/l nacl,1.5%琼脂)上37℃培养过夜。挑取单个活菌落,在含有50μg/ml卡那霉素的液体lb培养基(10g/l酵母蛋白胨,5g/l酵母浸粉,10g/l nacl)中37℃、220rpm培养过夜。加入终浓度20%甘油保存菌种。
[0231]
将野生型和突变型菌株接种于液体lb培养基中37℃、220rpm培养过夜,以1%(ml/ml)接种罐发酵培养基(12~16g/l酵母蛋白胨,22~30g/l酵母浸粉,1.5g/l硫酸铵,2.0~3.0g/l磷酸二氢钾,3.0~5.0g/l磷酸氢二钾,3.75g/l甘油,3.75ml/l微量元素母液,0.4
±
0.1ml/l消泡剂),在35(
±
3)℃,200~1000rpm,空气流量2~7l/min的条件下培养,发酵时间为24-28h。培养3~10h后,以步进速率流加含甘油和酵母蛋白胨的补料培养基,持续至发酵结束。培养至od600达到25~80时,加入l-ara(终浓度为0.1%~0.3%)、30(
±
3)℃进行诱导。继续培养至od600达到150~220时,放罐。然后离心(5000rpm,30min,25℃)收集菌体。菌体水洗后,加入破碎缓冲液(50mmol/l tris,ph 8.0~9.0)重悬破碎3次,离心收集上清。以sds-聚丙烯酰胺电泳对上清中的目的蛋白表达情况进行检测,结果如图3。
[0232]
图3的结果显示,经罐发酵培养的菌株已成功诱导目的蛋白苯丙氨酸解氨酶的高密度表达。
[0233]
实施例3苯丙氨酸解氨酶的制备
[0234]
收集实施例2中获得的野生型和突变型菌株的菌体破碎液离心上清,分别进行阴离子层析(q-ff)粗提取,加入苯丙氨酸(phe)初始底物浓度为10~30mg/ml,37~40℃,ph 8.0~9.0,按苯丙氨酸与pal酶质量比分别为5000:1~6000:1加酶进行反应,催化反应时间为24-36h,hplc检测反应液中苯丙氨酸(phe)的含量,并计算相应的苯丙氨酸转化率%及有效酶表达量。
[0235]
苯丙氨酸(phe)转化率=(初始phe含量-反应液残留phe含量)/初始phe含量
×
100%;用上清表达量和苯丙氨酸转化率两者的乘积表示上清中的有效酶表达量(上清表达量
×
苯丙氨酸转化率),结果如表3所示。
[0236]
表3
[0237][0238]
根据表2的结果可知,与野生型(序号11)菌株相比,突变型(序号1-10)菌株的苯丙
氨酸解氨酶的表达量均得到显著提高,有效酶表达量最高达到了野生型的约5.44倍。此外,与野生型(序号11)菌株相比,突变型(序号1-10)菌株的苯丙氨酸解氨酶的酶活也均得到了显著的提高,最高的苯丙氨酸转化率达到约98.9%,相比野生型提高了约28.3%。
[0239]
因此,本发明的苯丙氨酸解氨酶突变蛋白能有效提高菌株的苯丙氨酸解氨酶表达量及酶活。
[0240]
讨论
[0241]
经大量筛选,本发明人发现针对野生型苯丙氨酸解氨酶的序列(如seq idno:1)进行突变后,获得的突变型苯丙氨酸解氨酶具有显著提高的表达量以及酶活。在多种突变中,本发明人意外地发现,c-s类突变(即由半胱氨酸残基c突变为丝氨酸残基s)以及x-k类突变(即由其他氨基酸残基突变为赖氨酸残基k)对于野生型苯丙氨酸解氨酶尤为有效和关键。
[0242]
例如:在seq id no:1中,对其中所有6个半胱氨酸残基(c)分别进行定点突变(包括:第139位、第362位、第450位、第462位、第525位和第619位)为丝氨酸残基(s)后,发现获得的突变蛋白均有改善的酶表达量和酶活;在seq id no:1中,对第95位的丙氨酸残基(a)、第235位的天冬氨酸残基(d)和第540位的苏氨酸残基(t)分别进行定点突变为赖氨酸残基(k)后,同样发现获得的突变蛋白均有改善的酶表达量和酶活。
[0243]
对于c-s类突变,本发明人推测其机理是:将半胱氨酸突变为丝氨酸可以减少蛋白质分子内与分子间二硫键形成,促进表达时苯丙转氨酶空间结构正确折叠,从而有利于提高酶活。
[0244]
对于x-k类突变,本发明人推测其机理是:将丙氨酸(非极性疏水性氨基酸)、天冬氨酸(酸性氨基酸)、苏氨酸(极性中性氨基酸)突变为赖氨酸(碱性氨基酸)后,能够中和这些位点的电荷,从而提高pal的稳定性和表达量。
[0245]
根据以上的筛选结果、突变结果和机理分析,本发明人认为c-s类突变及x-k类突变对野生型苯丙氨酸解氨酶的有益效果具有一定的普适性。
[0246]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明做各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1