一株灰白翅孢壳F27、菌剂及其在农业领域的应用
一株灰白翅孢壳f27、菌剂及其在农业领域的应用
技术领域
1.本发明属于微生物菌剂技术领域,具体涉及一株灰白翅孢壳f27、菌剂及其在农业领域的应用。
背景技术:
2.中国境内灰白翅孢壳首次于2012年在中国新疆分离得到(苏俊,马相如,等,中国新记录种灰白翅孢壳emericellopsis pallida,新疆大学学报自然科学版,20120815),并进一步验证了其在蔗糖和氯化铵添加以稻草浸液为原料生产胞外多糖能力(苏俊、冯新忠等,响应面法优化灰白翅孢壳发酵产胞外多糖的研究,食品工业科技,20080825)。目前关于灰白翅孢壳的研究极少,而灰白翅孢壳应用于农业领域未见报道。
技术实现要素:
3.本发明的目的提供一株灰白翅孢壳(emericellopsis pallida)f27,本发明提供的灰白翅孢壳f27及灰白翅孢壳f27制备的菌剂,能够提高小麦或玉米的生长,提高土壤环境中秸秆降解率、促进土壤团聚体形成、增加土壤中有机碳和可溶性碳氮含量、提高土壤微生物量、抵抗病原菌来促进土壤肥力提升。
4.为了解决上述技术问题,本发明提供了以下技术方案:
5.本发明提供了一株灰白翅孢壳(emericellopsis pallida)f27,保藏编号为cgmcc no.40123。
6.本发明提供了一种含有上述技术方案所述的灰白翅孢壳的菌剂,所述菌剂中灰白翅孢壳f27的活性菌丝数量为≥106cfu/g。
7.本发明提供了一种上述技术方案所述菌剂的制备方法,包括如下步骤:灰白翅孢壳f27第一发酵培养得到第一发酵混合物,所述第一发酵混合物进行第二发酵培养得到菌剂;所述第一发酵培养和第二发酵培养均在黑暗条件下进行;所述第一发酵培养的时间为7~10d,所述第二发酵培养的时间为3~6d。
8.优选的,所述第二发酵培养应用的培养基包括如下重量份的组分:麦麸65~75份、豆饼粉20~30份、蔗糖2~4份、聚γ谷氨酸0.1~0.2份和水90~110份。
9.优选的,所述聚γ谷氨酸的分子量为60~80万。
10.优选的,所述第一发酵培养应用的培养基为pd液体培养基,所述第一发酵培养的温度为25~30℃,第一发酵培养的转速为120~180rpm。
11.优选的,所述第二发酵培养的温度为25~30℃,所述第一发酵混合物与第二发酵培养基的体积比为(15~25):100。
12.本发明提供了上述技术方案所述的灰白翅孢壳f27或上述技术方案所述的菌剂或上述技术方案所述的制备方法制备得到的菌剂在如下(1)~(7)中一种或多种中的应用;
13.(1)提高土壤环境中秸秆降解率;
14.(2)促进土壤团聚体形成;
15.(3)增加土壤可溶性碳氮含量;
16.(4)提高土壤微生物量;
17.(5)抑制镰刀菌生长;
18.(6)促进植物生长;
19.(7)提高植株抗逆性。
20.优选的,所述植物包括小麦或玉米。
21.优选的,所述灰白翅孢壳f27通过分泌赤霉素和/或玉米素核苷来促进植物生长;所述灰白翅孢壳f27通过分泌脱落酸来促进植物的抗逆性。
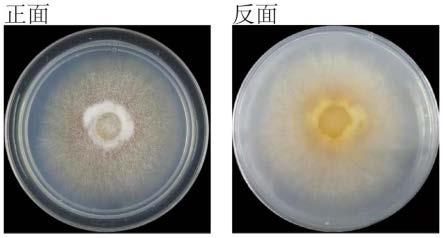
22.本发明的有益效果:本发明提供了一株灰白翅孢壳(emericellopsis pallida)f27,保藏编号为:cgmccno.40123。本发明的灰白翅孢壳具有生态环境安全性,该株灰白翅孢壳来源于长期进行秸秆还田的农田土壤,可以实现绿色生态农业,以确保食品的优质性与安全性。本发明的灰白翅孢壳具有长效性,能够在土壤中自行生长繁殖,与土著微生物群落达到生态稳定平衡,无需重复添加。本发明的灰白翅孢壳具有可操作性,该株灰白翅孢壳的扩大培养过程操作简单,成本低廉,能够制备成微生物菌剂,在农业领域推广应用。灰白翅孢壳f27主要是通过内切-β-1,4-葡聚糖酶、β-蔗糖苷酶来降解秸秆的,其酶活性分别为130mg还原糖/h/g菌丝和370mg还原糖/h/g菌丝。应用结果表明,该株灰白翅孢壳f27在7天内对玉米秸秆降解率为30.55%,培养液中还原糖浓度达25.3mg/l。土壤培养实验结果表明,灰白翅孢壳可显著提高土壤中大团聚体的组成比例。平板对峙实验结果表明,灰白翅孢壳可显著抑制多种镰刀真菌的生长。接种的灰白翅孢壳玉米生物量增加了13%,玉米叶绿素指标spda值增加了14%。接种灰白翅孢壳处理的土壤微生物量碳提高了15%,微生物氮含量提高了75%,土壤可溶性氮提高了23%,秸秆降解率提高了10%。
23.生物保藏说明
24.灰白翅孢壳(emericellopsis pallida)f27,于2022年3月31日保藏于中国普通微生物菌种保藏管理中心(cgmcc),保藏编号为cgmccno.40123,保藏单位地址:北京朝阳区北辰西路1号院3号。
附图说明
25.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。
26.图1为实施例1中pda平板上的灰白翅孢壳f27菌落形态;
27.图2为实施例2灰白翅孢壳f27和镰刀菌的平板对峙实验,图2中间为明显的拮抗线,图2中y1代指藤仓镰刀菌;y7代指层出镰刀菌;f33代指尖孢镰刀菌;
28.图3为实施例3中灰白翅孢壳f27在土壤培养的菌落形态;
29.图4为实施例4和对比例3的小麦苗期生长对比图,图4中对比例的3株小麦为对比例3,实施例的3株小麦为实施例4;
30.图5为灰白翅孢壳(emericellopsis pallida)f27系统发育树。
具体实施方式
31.本发明提供了一株灰白翅孢壳(emericellopsis pallida)f27,保藏编号为
cgmccno.40123。本发明所述灰白翅孢壳f27的its1序列基因序列如seq id no.1所示。
32.seq id no.1序列:ctagtctcgttggtgaccagcggagggatcattactgagtttacaaactcccaaacccctgtgaacatacctatgttgcttcggcgggccgtcccgcggcgcgcccacgtggcgtgacccggacccaggcgcccgccggggacccaaactcttgtcttccagtgtctcctctgagtggcataagcaaaaatagaaaaaaactttcagcaacggatctcttggttctggcatcgatgaagaacgcagcgaaatgcgataagtaatgtgaattgcagaattcagtgaatcatcgaatctttgaacgcacattgcgcccgccagtattctggcgggcatgcctgtctgagcgtcatttcaaccctcagcccccgtccgcggggcgctggcgttggggatcggccgtccttcgcggcggccggccccgaaacacagtggcggtctcctgcagactcccctgcgtagtagcactacctcgcagaagggacgagcgggctggccacgccgtaaaacccccaacttctcaaggttgacctcagatcaggtaggaatacccgctgaacttaagcatatcaaaaggggggaaggaaa。
33.本发明所述灰白翅孢壳优选从河南省原阳县的国家潮土肥力肥效试验中长期秸秆还田处理耕层土壤中分离、培养获得。菌株采用孟加拉红培养基(蛋白胨5.0g,琼脂15g,蔗糖10.0g,mgso4·
7h2o0.5g,kh2po41.0g,孟加拉红0.03g和氯霉素0.10g,ph7.0)进行分离,菌液的稀释倍数为103,在马铃薯蔗糖固体培养基上进行进一步的纯化。纯化的真菌采用takara公司生产的lysis buffer for microorganism to directpcr试剂对初筛所得到的真菌进行裂解并提取其dna,对提取到的真菌dna对其its1区进行扩增,使用its1f/its4引物进行pcr扩增。扩增体系及程序同表1-1所示。对所得到的扩增产物用2%琼脂糖凝胶电泳验证后,运用sanger测序技术进行测序。具体鉴定方法如下:
34.1)取5μl lysis buffer for microorganism to direct pcr于灭菌离心管中。
35.2)用灭菌牙签或枪头挑取单菌落,置于离心管中搅动几下后取出。
36.3)80℃热变性15分钟后,中间取出快速震荡以保证热变性充分,5000rpm离心。
37.4)取裂解后的上清液作为pcr反应的模板。使用引物为扩增真菌its1和its2区的its1/its4引物。pcr扩增体系和扩增程序见表1-1。
38.表1-1pcr扩增体系和扩增程序
[0039][0040]
5)扩增结束后,用1.2%琼脂糖凝胶电泳进行检测,检测合格的样品进行普通测序。
[0041]
6)测序得到的序列手动去掉引物序列之后,通过national center for biotechnology information数据库进行blast序列比对并采用最大可能性做系统发育树。
[0042]
系统发育树的构建方法为:
[0043]
1.将测序得到的灰白翅孢壳f27的its1序列放入ncbiblast进行比对,网址为https://blast.ncbi.nlm.nih.gov/blast.cgi?program=blastn&page_type=blastsearch&link_loc=blasthome;
[0044]
2.采用的数据为internal transcribed spacer region(its)from fungi type and reference,比对优化条件选择highly similar sequences(megablast),其余条件选用默认条件;
[0045]
3.对相似度靠前的序列进行输入,采用mega7做进化树构建,方法采用maximum likelihood,模型采用tamura-nei model。系统发育树见图5,确定所得真菌菌种名称为emericellopsis pallida,命名为灰白翅孢壳(emericellopsis pallida)f27。
[0046]
本发明的灰白翅孢壳具有生态环境安全性,该株灰白翅孢壳来源于长期进行秸秆还田的农田土壤,可以实现绿色生态农业,以确保食品的优质性与安全性。
[0047]
本发明的灰白翅孢壳具有长效性,能够在土壤中自行生长繁殖,与土著微生物群落达到生态稳定平衡,无需重复添加。本发明的灰白翅孢壳具有可操作性,该株灰白翅孢壳的扩大培养过程操作简单,成本低廉,能够制备成微生物菌剂,在农业领域推广应用。本发明的灰白翅孢壳通过促进秸秆有效降解、促进土壤团聚体的形成、抵抗病原菌来促进土壤肥力的提升,能够促进玉米或小麦的生长,提高玉米的抗逆性。
[0048]
本发明提供了一种含有上述技术方案所述的灰白翅孢壳的菌剂,所述菌剂中灰白翅孢壳f27的活性菌丝数量为≥106cfu/g。
[0049]
本发明提供了一种含有上述技术方案所述菌剂的制备方法,包括以下步骤:灰白翅孢壳f27第一发酵培养得到第一发酵混合物,所述第一发酵混合物进行第二发酵培养得到菌剂;所述第一发酵培养和第二发酵培养在黑暗条件下进行。
[0050]
在本发明中,所述灰白翅孢壳f27接种于pd液体培养基之前优选保存于pda培养基。
[0051]
本发明所述灰白翅孢壳f27优选接种于pd液体培养基进行第一发酵培养得到第一发酵混合物。本发明对所述接种量和接种方法没有特殊的限定,采用常规的接种方法和接种量即可。
[0052]
在本发明中,按质量份计,本发明所述pd液体培养基优选包括去皮马铃薯180~220份、蔗糖18~22份和水900~1100份,更优选包括去皮马铃薯200份、蔗糖20份和水1000份,ph自然。本发明对所述pd液体培养基的灭菌方法没有特殊限定,采用常规方法即可。
[0053]
在本发明中,所述第一发酵培养的时间优选为7~10d,进一步优选为7.5~9d,更优选为8d。所述第一发酵温度优选为25~30℃,进一步优选为26~29℃,更优选为28℃。所述第一发酵转速优选为120~180rpm,进一步优选为130~170rpm,更优选为150rpm。在本发明中,所述第一发酵的时间优选以灰白翅孢壳f27培养过程中出现白色黄豆大小的菌丝球为准。本发明所述第一发酵培养的作用为获得足够量的灰白翅孢壳f27活性菌体或孢子。
[0054]
得到第一发酵混合物后,本发明将所述第一发酵混合物进行第二发酵培养得到菌剂。本发明优选将所述第一发酵混合物接种于第二发酵培养基进行第二发酵培养。
[0055]
在本发明中,所述第二发酵培养基优选包括如下重量份的组分:麦麸65~75份、豆饼粉20~30份、蔗糖2~4份、聚γ谷氨酸0.1~0.2份和水90~110份,ph自然。
[0056]
本发明所述聚γ谷氨酸的分子量优选为60~80万,更优选为70万。本发明所述麦麸优选为未发霉的干燥麦麸。本发明第二发酵培养基优选采用如下方法制备获得:将所述麦麸与豆饼粉在干燥状态下混匀,蔗糖和聚γ谷氨酸溶于水后,与麦麸与豆饼粉混合30min后得到混合物,于121℃条件下灭菌20min,得到第二发酵培养基。本发明所述麦麸的作用为
提供白翅孢壳f27的生长缓效碳源,所述豆饼粉的作用为白翅孢壳f27的生长提供氮源,所述蔗糖的作用为白翅孢壳f27的生长提供速效碳源,所述聚γ谷氨酸的作用为对灰白翅孢壳f27的生长进行调节,所述第二发酵培养基的作用是为了使灰白翅孢壳f27菌丝在固体基质上定植,便于施用和活性的保持。本发明所述第二发酵培养至灰白翅孢壳f27菌丝完全覆盖发酵培养基为止。
[0057]
在本发明中,所述第一发酵混合物接种于第二发酵培养基的接种量优选为每100ml第二发酵培养基接种15~25ml第一发酵培养物,进一步优选为每100ml第二发酵培养基接种18~23ml第一发酵培养物,更优选为每100ml第二发酵培养基接种20ml第一发酵培养物。
[0058]
在本发明中,所述第二发酵培养的时间优选为3~6d,进一步优选为4~6d,更优选为4~5d。所述第二发酵培养温度优选为25~30℃,进一步优选为27~29℃,更优选为28℃。本发明所述第二发酵培养方式优选为静置培养。本发明对所述第二发酵培养的容器没有特殊限定,采用常规的容器即可。在本发明实施例中,所述第二发酵培养的容器优选为聚乙烯方形培养盒。在本发明中,所述第二发酵培养优选培养至灰白翅孢壳f27菌丝完全覆盖发酵培养基,且孢子和菌丝密度≥106cfu/g即可。本发明所述静置培养的作用为让灰白翅孢壳f27菌丝与固体基质结合紧密,本发明所述第二发酵时间、温度参数的设定是为了短时间内获得活性更强密度更高的灰白翅孢壳f27活性菌体。
[0059]
本发明提供了上述技术方案所述的灰白翅孢壳f27或上述技术方案所述的菌剂或上述技术方案所述的制备方法制备得到的菌剂在如下(1)~(6)中一种或多种中的应用;
[0060]
(1)提高土壤环境中秸秆降解率;
[0061]
(2)促进土壤团聚体形成;
[0062]
(3)增加土壤可溶性碳氮含量;
[0063]
(4)提高土壤微生物量;
[0064]
(5)抑制镰刀菌生长;
[0065]
(6)促进植物生长;
[0066]
(7)提高植株抗逆性。
[0067]
在本发明中,所述植物优选包括小麦或玉米。
[0068]
在本发明中,灰白翅孢壳f27优选通过分泌赤霉素和/或玉米素核苷来促进植物生长;灰白翅孢壳f27通过分泌脱落酸来促进植物的抗逆性。
[0069]
本发明提供的灰白翅孢壳(emericellopsis pallida)f27菌剂优选施用在土壤中,所述施用时菌剂与土壤质量比优选为1:(200~500),进一步优选为1:(300~400),更优选为1:350。在本发明实施例中,优选灰白翅孢壳(emericellopsis pallida)f27菌剂20g施用于7kg土壤中。本发明提供的灰白翅孢壳(emericellopsis pallida)f27菌剂施用之后可以提供秸秆的降解率、抑制多种镰刀菌的生长,促进小麦和玉米的生长,提高玉米的抗逆性,土壤微生物量氮、土壤微生物量碳、土壤可溶性碳、土壤可溶性氮、土壤氧含量。
[0070]
为了进一步说明本发明,下面结合附图和实施例对本发明提供的技术方案进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
[0071]
实施例1灰白翅孢壳f27与植物致病菌的平板对峙实验
[0072]
1培养基及菌块的制备
[0073]
pda培养基为马铃薯蔗糖琼脂培养基,组成为:马铃薯200g、蔗糖20g、琼脂20g和去离子水1000ml,自然ph。
[0074]
灰白翅孢壳f27的菌块制备:将保存于pda斜面的灰白翅孢壳f27接种于直径为90mm的pda培养基中进行活化,在25℃培养5d,用打孔器打孔获得直径为0.5cm的琼脂块菌种,灰白翅孢壳f27在pda平板上的菌落形态见图1。灰白翅孢壳f27的菌落形态为:淡黄色菌落,气生菌丝旺盛,生长后期会出现淡红色色素。
[0075]
致病菌镰刀菌菌块的制备:将保存于pda斜面的藤仓镰刀菌、层出镰刀菌、尖孢镰刀菌分别接种于直径为90mm的pda培养基中进行活化,在25℃培养5d,用打孔器打孔获得直径为0.5cm的菌块。
[0076]
2拮抗实验
[0077]
(1)将制备得到的灰白翅孢壳f27菌块和藤仓镰刀菌菌块接种到90mmpda平板的直径的1/4和3/4处;设置5个平行实验。
[0078]
(2)将制备得到的灰白翅孢壳f27菌块和层出镰刀菌菌块接种到90mmpda平板的直径的1/4和3/4处;设置5个平行实验。
[0079]
(3)将制备得到的灰白翅孢壳f27菌块和尖孢镰刀菌菌块接种到90mmpda平板的直径的1/4和3/4处;设置5个平行实验。
[0080]
将步骤(1)~(3)获得的接种后的pda平板放置于25℃培养箱中黑暗培养3~4天,期间观察菌落的生长速度以及是否存在明显的拮抗效应,结果见图2。
[0081]
根据图2可知,灰白翅孢壳f27与植物致病菌之间均出现了明显拮抗效应,说明灰白翅孢壳f27可以抑制藤仓镰刀菌、层出镰刀菌、尖孢镰刀菌的活性。镰刀菌是可引起农业重大损失的有害菌。藤仓镰刀菌是引起韩国野莴苣病害的主要因素(kim,b.r.,et al.,2021.fusarium fujikuroi causing fusarium wilt of lactuca serriola in korea.plant disease105,502-502.)同时已有验证显示其在我国是水稻恶苗病的主要病原微生物(chen,et al,2020.invasion and colonization pattern of fusarium fujikuroi in rice.phytopathology 110,1934-1945.)。尖孢镰刀菌可引起枯萎病且难以防治,且镰刀菌可在寄生宿主内产生镰刀菌毒素,这些毒素一方面作为致病因子与镰刀菌对宿主植物的致病力密切相关(霍莹莹等,2022尖孢镰刀菌相关致病因子与挥发油抑制尖孢镰刀菌的潜力研究进展.农药.61,79-86)。另一方面可导致家畜生产性能下降和相关病症的出现,进而影响农业生态系统并对人类健康造成威胁(张嘉城,等,2021植物病原镰刀菌产生的毒素种类及其危害.草业科学,38,1513-1524.)。层出镰孢菌侵染水稻、小麦、玉米、芦笋和洋葱等多种植物,引起枯萎病和腐烂病,该病菌除造成产量损失外,还能产生伏马毒素影响品质(李佳阳,等2022.辽宁省玉米穗腐病致病层出镰孢菌生物学特性、致病力与产伏马毒b1比较.玉米科学,30(05):163-170.)。本发明的菌株灰白翅孢壳f27对层出镰刀菌、尖孢镰刀菌、藤仓镰刀菌具有明显的拮抗作用,可以防治这些菌引起的病害,农业应用前景广阔,是具有一定的实用价值的。
[0082]
实施例2灰白翅孢壳的秸秆降解能力测定
[0083]
准备足量外观干净均一的秸秆,用剪刀剪至1立方厘米大小,用于制备测定秸秆降解的培养基。用于测定秸秆降解的培养基组成为:每升培养基中含有酵母提取物0.50g、秸秆20.0g、磷酸三钙5.0g、硫酸铵0.50g、氯化钾0.20g、七水硫酸镁0.10g、一水硫酸锰
0.0001g和七水硫酸亚铁0.0001g,采用2n的盐酸和0.2mnaoh调节ph值为7.0,121℃灭菌20min放凉后备用。
[0084]
在测定秸秆降解的培养基中接种直径为1cm的灰白翅孢壳f27菌株琼脂块2块,25℃160~180rpm摇床培养7天。此实验设置3平行。
[0085]
对比例1
[0086]
在实施例2制备的测定秸秆降解的培养基中接种与实施例2等量的空白琼脂块。25℃160~180rpm摇床培养7天。此实验设置3平行。
[0087]
培养结束后,实施例2和对比例1静置后取培养基的上清液测定还原糖的浓度。
[0088]
还原糖测定方法为dns法(二硝基水杨酸法),步骤如下:
[0089]
dns溶液配制方法:称取3.25g3,5-二硝基水杨酸溶于少量水中,移入500ml容量瓶,加入2m氢氧化钠162.5ml,再加入22.5g丙三醇,摇匀后定容到500ml,避光储存于4℃冰箱备用。
[0090]
准确实施例2和对比例1静置后取培养基的上清液2ml玻璃试管中,加入dns:1.5ml,沸水浴5min,立即冰上冷却,室温显色20min,540nm下用酶标仪进行比色。
[0091]
标准曲线的制作方法:取2g的蔗糖98℃烘干2h至恒重。准确称取1.0000g烘干后的蔗糖,定容至1l。设置不同的梯度0、0.1、0.3、0.5、0.7、0.9mg/ml。沸水浴5min后立即冰上冷却10min,室温显色20min,540nm比色即可,标准曲线的测定时的试管号和各个溶液的添加量见表1-2。标准曲线为y=0.2713x,r2=0.9935,x代表吸光度值,y代表还原糖浓度。
[0092]
表1-2标准曲线的测定时的试管号和各个溶液的添加量。
[0093][0094]
培养结束后,对实施例2和对比例1的培养基中的秸秆降解率进行计算,采用烘干差减法计算秸秆降解率:培养瓶中的秸秆在50℃下烘干至恒重,烘干时间为12-24h,烘干至恒重之后称重。计算公式(1)如下:
[0095]
秸秆降解率=(秸秆干重-降解后秸秆干重)/秸秆干重*100%(1)
[0096]
速效磷的测定方法:称取通过50ml培养液于250ml三角瓶中,再加一勺无磷活性炭,塞紧瓶塞,在震荡机上震荡30min。立即用无磷滤纸过滤,滤液承接于100ml三角瓶中,吸取滤液1ml于25ml容量瓶中,再用滴定管准确加入蒸馏水15ml,然后移液管加入钼锑抗试剂2.5ml,摇匀后定容,放置30min后,再次摇匀后于800nm波长进行比色。标准曲线为y=1.3935x,r2=0.9959,y代表对应的25ml比色管中的磷的浓度,x代表吸光度值。
[0097]
运用spss20.0统计软件分析,实验数据以“平均值
±
标准误”表示,采用tukeys-b
(k)检验数据同质性,结果见表1-3和表1-4。
[0098]
根据表1-3可知,灰白翅孢壳f27接种于含有秸秆的培养基中显著增加了秸秆降解率,显著提高了降解液中速效磷的含量,即加速了磷酸三钙的溶解。该株灰白翅孢壳7天内对玉米秸秆降解率为30.55%,培养液中还原糖浓度达25.3mg/l。
[0099]
实施例2和对比例1相比,实施例2的培养基上清液中的还原糖浓度升高,主要是由于秸秆降解率的大幅升高增加溶液中的还原糖浓度。
[0100]
表1-3实施例2和对比例1灰白翅孢壳的秸秆降解率及秸秆降解相关酶活性的测定
[0101][0102][0103]
注:n=3.*表示p<0.05水平上的显著性,**表示p<0.01水平上的显著性。
[0104]
培养结束后,取实施例2培养基中的鲜重菌丝球2g,用灭菌滤纸简单吸水后称重,研磨后,加5ml浓度为0.05mpbs的溶液溶解30min,转速为8000rpm离心10min,获得的上清液即为粗酶液,用来测定内切β-1,4-葡聚糖酶、外切β-1,4-葡聚糖酶、β-蔗糖苷酶活性。
[0105]
内切β-1,4-葡聚糖酶(endo-β-1,4-glucanaseec)酶活的测定:取底物2%(w/v)羧甲基纤维素钠(羧甲基纤维素钠是2.0g羧甲基纤维素钠溶于100ml0.1mol/lph=5的醋酸钠缓冲液中得到)1.8ml,加入0.2ml粗酶液,37℃水浴反应30min,最后加入0.5ml0.5mol/l预冷的碳酸钠溶液,终止反应,373nm处测吸光度。
[0106]
外切-β-1,4-葡聚糖酶(exo-β-1,4-glucanse)酶活的测定:取底物1.8ml0.5%(w/v)微晶纤维素溶液,加入0.2ml粗酶液,37℃水浴30min,最后加入0.5ml0.5mol/l冷的碳酸钠溶液终止反应,测373nm处的吸光度。
[0107]
微晶纤维素配制溶液的方法:称取8.2g醋酸钠溶于800ml水,用冰醋酸调ph至6.5,定容于1l,配成醋酸钠缓冲液;称取0.5g微晶纤维素溶于100ml0.1mol/l醋酸钠缓冲液(ph=6.5),得到微晶纤维素溶液。
[0108]
β-蔗糖苷酶(β-glucosidase)酶活的测定:取底物1.8ml5mmol/l4-硝基苯-β-d-吡喃蔗糖苷(β-pnpg)(配制方法:β-pnpg由0.150625g4-硝基苯-β-d-吡喃蔗糖苷溶于100ml0.1mol/ltris-hcl缓冲液(ph=8)),加入0.2ml粗酶液,37℃水浴30min,0.5ml0.5mol/l冷的碳酸钠溶液,终止反应,测373nm处的吸光度。
[0109]
内切β-1,4-葡聚糖酶、外切β-1,4-葡聚糖酶、β-蔗糖苷酶活性测定时应用的标准曲线为:y=240.86x,r2=0.9999,x代表吸光度值,y代表对硝基苯酚浓度mg/l。
[0110]
运用spss20.0统计软件分析,实验数据以“平均值
±
标准误”表示,采用tukeys-b(k)检验数据同质性,结果见表1-4。根据表1-4可知,灰白翅孢壳f27主要是通过内切-β-1,4-葡聚糖酶、β-蔗糖苷酶来降解秸秆。
[0111]
表1-4实施例2和对比例1灰白翅孢壳的秸秆降解相关酶活性的测定
[0112][0113][0114]
注:n=3.*表示p<0.05水平上的显著性,**表示p<0.01水平上的显著性。
[0115]
实施例3接种灰白翅孢壳f27对土壤团聚体形成的促进实验
[0116]
选取过100目筛的干土100g,土壤为河南封丘砂质潮土,砂粒含量70%以上,自然状态下基本无大于2mm粒级团聚体。在干土中按5mg/kg的比例加入过60目筛的秸秆粉末混匀后(实验中加入秸秆粉是为了在实验室条件下进行灰白翅孢壳f27应用秸秆还田的大田的能力评估),再装入三角瓶中透气封口膜封口后进行高温灭菌,高温灭菌的条件为121℃,20min,三角瓶放凉后再次进行高温灭菌,重复灭菌3-4次。在无菌条件下,将高温灭菌后的土壤平铺到直径为70mm的无菌培养皿中,每个培养皿中灭菌后的土壤15g,加入无菌水5ml,再将pda斜面保存的灰白翅孢壳f27接种至培养皿中,设置5个平行实验。25℃黑暗培养20天,灰白翅孢壳f27的土壤培养形态见图3。根据图3可知,灰白翅孢壳f27的菌丝可有效促进土壤团粒结构的形成,大团聚体肉眼可见。
[0117]
对比例2
[0118]
选取过100目筛的干土100g,土壤为河南封丘砂质潮土,砂粒含量70%以上,自然状态下基本无大于2mm粒级团聚体。在干土中按5mg/kg的比例加入过60目筛的秸秆粉末混匀后不灭菌直接放入无菌培养皿中,每个培养皿中灭菌后的土壤15g,加入无菌水5ml,再将pda斜面保存的灰白翅孢壳f27接种至培养皿中,25℃黑暗培养20天。设置5个平行实验。
[0119]
对实施例3和对比例2的培养皿中的土壤团聚体进行分级及测定各级团聚体胞外多聚物,测定时设定五个平行实验。土壤团聚体进行分级采用土壤湿筛法:用50g风干土,水浸泡2min,之后用筛子震荡30次/min,震荡60次,振幅5cm;筛子的孔径分别为1mm,0.25mm,0.053mm。
[0120]
胞外多聚物测定方法如下:
[0121]
测定方法为
[0122]
选取长势较好的4板,轻柔混匀,成为一个混合土样,共有5个混合土样。(1)~(5)全部在超净台中进行:
[0123]
(1)混合土样在250μm放入250μm筛子上,淹水5min;
[0124]
(2)震动2min,振幅为3cm,频率为30次min;
[0125]
(3)筛子上的土壤转移到灭菌培养皿中,>250um团聚体;
[0126]
(4)水土混合液过53μm筛子,筛子上的土壤转移到灭菌培养皿中,为>53μm并<250μm团聚体;
[0127]
(5)剩余水土混合液保留在保鲜盒中,超净台中过夜,吸取多余水分。超净台中吹风,晾到水土混合液的含水量为20%时,收集到保鲜袋中,分成2部分,-80℃保存用于测定eps含量。
[0128]
eps提取方法如下:
[0129]
(1)在50ml的聚丙烯离心管中加入0.1mcacl2溶液30ml以去除可溶性有机质,加入
3g含水量为20%的水土混合液。将离心管放在冰中,120rpm往复振动震荡1h。3200g离心30min后弃上清,从剩余的物质中提取eps。
[0130]
(2)15.98gcer与25ml缓冲液一起加入沉淀物中。120rpm往复振动震荡2h,之后4000g离心30min。
[0131]
(3)缓冲液成分为2mmna3po4·
12h2o(0.760g/l),4mm nah2po4·
h2o(0.552g/l),9mm nacl(0.526g/l),1mm kcl(0.0746g/l),最后使用1m hcl调节ph至7,并在4℃情况下预冷。cer(离子交换树脂
‘
marathon c’钠形态,强酸性,20~50目)在上述缓冲液中预清洗两次,cer的含量是根据最高有机碳土壤所要求的178mgcermg-1soc所确定的。
[0132]
(4)将含有epc的上清液转移到新的试管中,液氮速冻后,-80℃保存用于测定eps糖醛酸、eps蛋白和eps腐殖酸。
[0133]
eps uronic acid(eps糖醛酸)的测定方法:
[0134]
(1)选取200μl含有epc的上清液,加入1.2ml的sodium tertraborate四硼酸钠(0.0125m,浓硫酸作物溶剂)溶液。涡旋45s100℃水浴5min,冰上冷却3min,之后加入20μl的m-间羟基联苯溶液(cas#:580-51-8)混匀后,静置4min,520nm下测定吸光值。
[0135]
(2)标准曲线的制作方法:d-glucuronic acid(cas#:6556-12-3)曲线配制25μg/ml的d-glucuronic acid母液。分别吸取0,4,20,60,100和200ul的母液,用去离子水补充到200ul。之后重复步骤(1)得到不同母液的吸光值,制作标准曲线。标准曲线为:y=0.0053x+0.0812,r2=0.9978,其中y代表吸光度,x代表糖醛酸浓度。
[0136]
采用lowry方法测定eps蛋白和eps腐殖酸含量。
[0137]
a液:将3.5g五水硫酸铜溶于100ml水中得到溶液(1);将7.0g酒石酸钾钠(sodium potassium tartrate)溶于100ml水中溶液(2);将70g碳酸钠溶于1l0.35n的氢氧化钠溶液溶液(3)。溶液(1)、溶液(2)和溶液(3)按照1:1:100的体积比混合即可得到a液。
[0138]
b液:去离子水、溶液(2)和溶液(3)按照体积比1:1:100即可混合获得。
[0139]
1.每个样品3次重复,a板和b板每个孔分别加入50μl含有epc的上清液样品,用pbs补充到100μl。
[0140]
2.加入100μla液,并吸打混匀。对照加入b液100μl。
[0141]
3.两个板黑暗室温放置10min。
[0142]
4.立即加入100μl的folin-phenol试剂终止反应。
[0143]
5.30min后,750nm处测定吸光值。
[0144]
folin-phenol试剂:2n福林酚试剂(folinphenol)用水稀释10倍。
[0145]
eps蛋白和eps腐殖酸的计算公式如下:其中,absa代表添加a液的板的吸光度,absb代表添加b液板的吸光度。
[0146]
abs
蛋白
=1.25*(abs
a-absb);
[0147]
abs
蛋白
的标准曲线为:y=0.0009x+0.0089,r2=0.9965;x为eps蛋白浓度,y为1.25*(abs
a-absb);
[0148]
abs
腐殖酸
=abs
b-0.2abs
蛋白
;
[0149]
abs
腐殖酸
=abs
b-0.2*1.25*(abs
a-absb);
[0150]
abs腐殖酸的标准曲线为:y=0.0016x+0.0732,r2=0.9943;x为eps腐殖酸浓度,y为0.2*1.25*(abs
a-absb)。
[0151]
运用spss20.0统计软件分析,实验数据以“平均值
±
标准误”表示,采用tukeys-b(k)检验数据同质性。
[0152]
表2实施例3和对比例2的土壤团聚体分级结果
[0153][0154]
注:n=5.*表示p<0.05水平上的显著性,**表示p<0.01水平上的显著性。
[0155]
根据表2可知,实施例3接种灰白翅孢壳显著增加了砂质潮土0.25~1mm粒级团聚体含量,显著降低了<0.053mm粒级团聚体的百分含量,显著提高了团聚体的平均重量直径。从胞外多聚物eps的结果来看,f27的接种显著提高了大团聚体中eps蛋白、eps糖醛酸、eps腐殖酸的含量,对其他粒级团聚体eps组分含量也有不同程度的提升,说明土壤中接种灰白翅孢壳f27对土壤团聚化过程具有显著的促进作用,可通过分泌eps物质来促进土壤团聚,有助于改善土壤结构,促进土壤肥力提升。但在促进大团聚体形成方面作用有限。实施例3和对比例2的土壤中各粒级团聚体中eps含量见表3-1~表3-4。
[0156]
表3-1实施例3和对比例2的土壤中各粒级团聚体中eps糖醛酸含量
[0157][0158]
注:采用独立样本t测验判断对比例与实施例之间的显著性差异,大写字母代表0.01水平上的显著性差异,小写字母代表0.05水平上的显著性差异。没有字母标注表示没有达到显著性差异。下同。
[0159]
表3-2实施例3和对比例2的土壤中各粒级团聚体中eps糖醛酸含量测定时的od值
[0160][0161]
表3-3实施例3和对比例2的土壤中各粒级团聚体中eps蛋白和eps腐殖酸含量
[0162][0163]
表3-4实施例3和对比例2的土壤中各粒级团聚体中eps蛋白和eps腐殖酸含量测定时的od值
[0164][0165]
实施例4灰白翅孢壳f27对苗期小麦根系的生长实验
[0166]
市售营养土80g放入1l三角瓶中,调整到含水量到20%,透气封口膜封口后,121℃灭菌20min。放凉后,无菌条件下播种小麦种子到营养土中,播种深度为1cm。同时接种实施例1制备的大小为直径15mm灰白翅孢壳f27的琼脂块菌株3块至三角瓶中,接种深度为1cm。接种完成后三角瓶封口后在生化培养箱中培养,出苗2天后,无菌条件下剔苗,每瓶留苗1棵,25℃光照16h,15℃黑暗8h,培养15天后结束实验。此实验设置3平行。
[0167]
对比例3
[0168]
空白琼脂块的制备方法:配制好的pda培养基倒进培养皿,冷凝后即可得到空白琼脂块,厚度为0.3cm。
[0169]
对比例3接种大小为直径15mm的3个空白琼脂块,接种深度为1cm,其余条件同实施例4。此实验设置3平行。
[0170]
实施例4和对比例3拍照采用根系扫描仪扫描根系,运用spss20.0统计软件分析,实验数据以“平均值
±
标准误”表示,采用tukeys-b(k)检验数据同质性结果见表4和图4。根据图4和表4可知,实施例4的土壤中接种了灰白翅孢壳f27,实施例4的小麦根系的根冠数、交点数、总根长、总根面积和总根体积显著高于对比例3,由此可知,灰白翅孢壳f27的接种可显著促进显著小麦根系和地上部的生长。
[0171]
表4实施例4和对比例3的苗期小麦根系的生长参数结果
[0172][0173][0174]
注:n=3.*表示p<0.05水平上的显著性,**表示p<0.01水平上的显著性。
[0175]
实施例5灰白翅孢壳菌剂的制备
[0176]
(1)将在pda培养基上生长旺盛的大小为直径15mm的灰白翅孢壳f27菌丝块1个接种至pd液体培养基中,置于恒温摇床28℃、220rpm培养4~5d,出现大量白色黄豆状菌丝球,得到发酵混合物;其中,pd液体培养基组成为:去皮马铃薯200g、蔗糖20g和水1000ml。
[0177]
(2)无菌条件下取10ml步骤(1)得到的发酵混合物加入20g发酵培养基中,立即摇匀,置于28℃静置黑暗培养;待灰白翅孢壳f27菌丝长满培养基表面及内部,用玻璃棒将菌丝捣散,即得到菌剂,菌剂中的灰白翅孢壳f27活性菌丝数量为2
×
106cfu/g。
[0178]
其中,发酵培养基(麦麸-蔗糖培养基)为:麦麸70g、豆饼粉25g、蔗糖3g、聚γ谷氨酸0.15g和水100g。发酵培养基的制备方法为将麦麸与豆饼粉干燥状态下混匀,蔗糖和聚γ谷氨酸溶于水后,混合30min后得到混合物,ph自然,装入200ml保鲜盒,用透气的封口膜密封后,121℃灭菌20min,趁热摇散。
[0179]
实施例6
[0180]
准确称取实施例5制备的灰白翅孢壳f27菌剂20g,菌剂的含水量为15%,加入7kg土壤中,充分混匀后装入种植盆。在离盆口15cm处埋入烘干后准确称重的秸秆10g,秸秆装入150目双层尼龙袋中。为了保证灰白翅孢壳f27成活,装好盆后立即进行浇水。
[0181]
浇水后种植玉米登海605,每个种植盆种植5粒玉米,每个种植盆的玉米于三叶期定苗,每个种植盆留1株玉米苗。玉米于人工气候室中进行培养,培养条件为14h光照,光照条件下温度为28℃,10h黑暗,黑暗条件下温度为20℃,相对湿度70%。期间按需浇水除草。此实验设置4平行。
[0182]
对比例4
[0183]
准确称取灭菌处理的麦麸-蔗糖培养基20g,加入7kg土壤中,充分混匀后装入种植盆。种植盆充分浇水后种植玉米登海605,每个种植盆种植5粒玉米,每个种植盆的玉米于三叶期定苗,每个种植盆留1株玉米苗。玉米于人工气候室中进行培养,培养条件为光照14h,光照条件下温度为28℃,10h黑暗,黑暗条件下温度为20℃,相对湿度70%。期间按需浇水除草。此实验设置4平行。
[0184]
实施例6和对比例4的玉米抽雄期进行土壤微生物量氮、土壤微生物量碳、土壤可溶性碳、土壤可溶性氮、土壤氧含量、秸秆降解率,同时测定玉米植株生物量、叶片叶绿素以及玉米根系激素含量的测定。
[0185]
土壤微生物量碳氮采用氯仿熏蒸-硫酸钾浸提法:称量5g鲜土,两份,一份在黑暗条件下氯仿熏蒸24小时,另一份不熏蒸,加0.5m的k2so4于25℃震荡30分钟,之后采用mulit3100测量水溶性碳氮,再用差减法测出微生物量碳氮。
[0186]
叶片叶绿素采用spad值测量法,叶片spad的测定采用spad仪(aopgee mc-100)测
定。
[0187]
玉米生物量采用烘干称重法测量。
[0188]
土壤中o2和co2含量采用土壤氧气传感器so-110和eosgp公司土壤co2传感器测定。
[0189]
秸秆降解率的计算同公式(1)。
[0190]
玉米根系激素吲哚乙酸、脱落酸、赤霉素、玉米素核苷含量分别采用吲哚乙酸、脱落酸、赤霉素、玉米素核苷酶联免疫试剂盒(上海酶联生物公司)
[0191]
土壤可溶性碳氮的测定方法参考论文(wu,j.,joergensen,r.g.,pommerening,b.,chaussod,r.,brookes,p.c.,1990.measurement of soil microbial biomass c by fumigation
‑‑
extraction
‑‑
an automated procedure.soil biology&biochemistry22,1167-1169.)。
[0192]
运用spss20.0统计软件分析,实验数据以“平均值
±
标准误”表示,采用tukeys-b(k)检验数据同质性,实施例6和对比例4的测定结果见表5、表6。根据表5和表6可知,实施例6施用了灰白翅孢壳f27菌剂的玉米生物量增加了13%,玉米叶绿素指标spda值增加了14%,施用灰白翅孢壳f27菌剂显著提高了玉米根系赤霉素与玉米素核苷的浓度,说明灰白翅孢壳f27的接种对玉米生长具有较强的生物刺激作用。另外,施用灰白翅孢壳f27菌剂的玉米根系脱落酸浓度显著增加,增幅高达15%,说明灰白翅孢壳f27对玉米抗逆性提升具有很好的效果。
[0193]
实施例6施用了灰白翅孢壳f27菌剂的土壤微生物量碳提高了15%,微生物氮含量提高了75%,土壤可溶性氮提高了23%,秸秆降解率提高了10%。施用灰白翅孢壳f27菌剂的土壤微生物量碳氮、土壤可溶性碳氮含量均出现明显提升,说明该灰白翅孢壳f27菌剂的加入激活了土壤生态系统,促进土壤微生物的活动。施用灰白翅孢壳f27菌剂使得耕作层土壤氧含量显著降低0.3个百分点,氧气含量的降低可以有效降低土壤呼吸强度,促进土壤有机质累积。
[0194]
表5实施例6和对比例4的土壤指标的测定结果
[0195][0196]
注:n=4.*表示p<0.05水平上的显著性,**表示p<0.01水平上的显著性。
[0197]
表6实施例6和对比例4的玉米地上部及根系激素含量的测定结果
[0198] 实施例6对比例4地上部生物量(gdwstain-1
)43.63
±
3.28*38.57
±
2.50叶片叶绿素指标(ngg-1
fw)40.46
±
4.35**35.75
±
2.4玉米吲哚乙酸含量(ngg-1
fw)54.12
±
1.6751.03
±
2.84玉米脱落酸含量(ngg-1
fw)575.64
±
34.32**500.49
±
31.58玉米根系赤霉素含量(ngg-1
fw)231.33
±
14.45*193.74
±
16.82
玉米根系玉米素核苷含量(ngg-1
fw)39.62
±
2.18*31.97
±
3.22
[0199]
注:n=4.*表示p<0.05水平上的显著性,**表示p<0.01水平上的显著性。
[0200]
综上,本发明提供的灰白翅孢壳(emericellopsis pallida)f27,保藏编号为:cgmcc no.40123,可以提供秸秆的降解率、抑制多种镰刀菌的生长,促进小麦和玉米的生长,提高玉米的抗逆性,土壤微生物量氮、土壤微生物量碳、土壤可溶性碳、土壤可溶性氮、土壤氧含量,本发明提供的灰白翅孢壳(emericellopsis pallida)f27及其制备的菌剂在农业领域具有较广阔的应用前景。
[0201]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1