一种多效协同促进的双靶向多肽基分子及其在制备肿瘤治疗药物中的应用
本发明属于生物,具体涉及一种多效协同促进的双靶向多肽基分子及其在制备肿瘤治疗药物中的应用。
背景技术:
1、肾癌是泌尿系统三大癌症之一,据统计2020年世界范围内全年因肾癌死亡人数超过18万人。肾癌具有高血管密度及高血管通透性的特点,这一特点也造成肾癌易转移的临床结果。据统计超过30%的肾癌患者在初诊时即发生转移,而转移性肾癌的五年生存率仅为12%,中位生存期仅为6-12个月。相关研究指出肿瘤的生长和转移主要依赖于血管的生成,此后便开启了系列针对肿瘤新生血管的治疗。但随着抗血管药物的发展,临床发现单纯的抗血管治疗患者的长期获益有限,而联合应用“抗血管治疗与化疗”却展现出显著疗效。而这种联合优势与常理认知却是相悖的:抗血管治疗,相当于切断了药物的递送路线,但是却展现出更强的肿瘤杀伤效果,随着folkman教授的深入挖掘,揭示了这背后的机制,提出了“血管正常化理论”。
2、“血管正常化”理论是指:重新恢复促血管生成因子和血管抑制因子之间的平衡,在血管消退之前修复结构和功能异常的肿瘤血管系统,使肿瘤血管趋于正常。后续的研究表明,低剂量的抗血管治疗可以使未成熟的、渗漏的肿瘤血管正常化。与抑制血管生成不同,血管正常化促进肿瘤中功能性血管网络的形成,逆转缺氧并增加血液灌注,同时增强肿瘤内免疫细胞浸润,实现肿瘤的免疫杀伤。肿瘤组织内t细胞产生的干扰素增加了内皮粘附分子的表达从而进一步促进免疫细胞浸润,进而促进了t细胞介导的免疫杀伤。在多种临床前肿瘤模型中,抗血管治疗提高了免疫治疗的有效性。但这种联合药效的发挥,需要免疫检点抑制剂作用在血管正常化的窗口内。因此联合给药因两种不同药物的药代特性差异,导致虽然联合用药,但真正协同发挥作用的时间窗口极不可控;同时,现有临床上的抗血管与免疫检查点抑制药物联合主要以抗体药物为主,而抗体药物的脱靶毒性,以及抗体固有的穿透性问题是不可避免的。
3、因此,基于抗血管靶向与免疫检查点抑制的协同联合策略,设计构建新型多功能药物平台,克服临床联合给药的瓶颈问题,有效抑制肾癌进展转移已经成为临床上亟需解决的实际问题。
4、多肽因其生物相容性好,生物活性多样的特性,成为纳米生物医用材料理想的构造单元。随着超分子化学的发展,多肽的自组装行为,以及构效关系逐渐明晰。原位构建的自组装多肽纤维网络可用于肿瘤的高信噪比成像,以及长效抑制肿瘤的侵袭和转移。基于这些发现,引入自组装多肽片段,通过“单分子,双靶向,双功能,促协同”的设计策略来构筑肽基分子,有望突破现有的肿瘤治疗瓶颈。但是目前还未发现能够靶向肿瘤血管加免疫检查点,以此发挥双效协同的理想多肽分子。因此,提供一种多效协同促进的双靶向多肽基分子在肿瘤治疗中具有重要的应用价值。
技术实现思路
1、针对现有技术存在的不足,本发明的目的在于提供一种多效协同促进的双靶向多肽基分子及其在制备肿瘤治疗药物中的应用。所述多肽基分子通过自组装效应带来的长效给药窗口,在诱导血管正常化的同时,发挥免疫检查点抑制的功能。肿瘤血管正常化能促进t细胞的浸润,实现肿瘤免疫微环境从“冷”到“热”的转变,协同促进免疫检查点抑制效果,最终实现抑制肿瘤增殖和转移的作用。
2、为达到此发明目的,本发明采用以下技术方案:
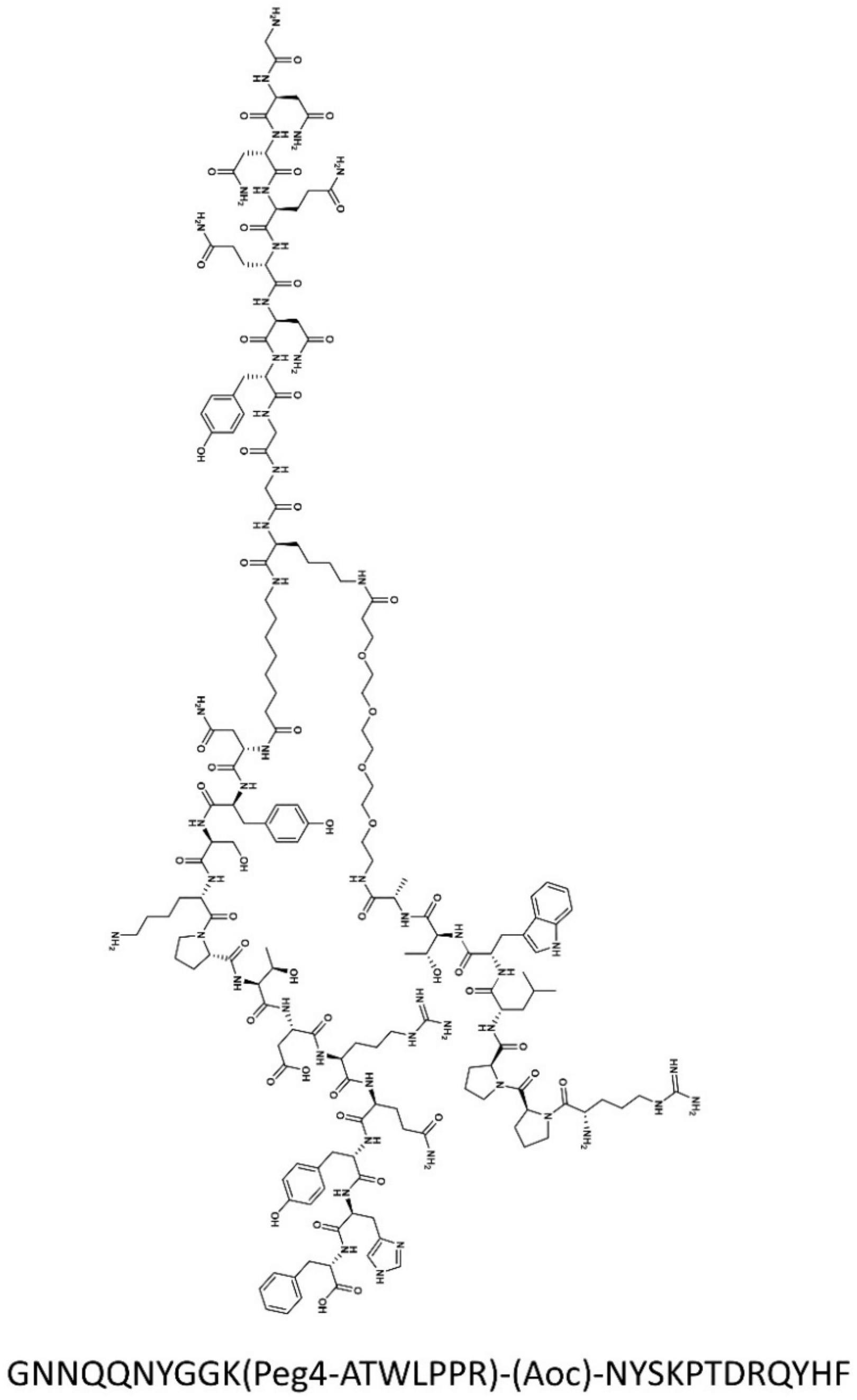
3、第一方面,本发明提供一种多效协同促进的双靶向多肽基分子,所述双靶向多肽基分子包括可自组装形成具有β-sheet二级结构纳米纤维和连接在所述具有β-sheet二级结构纳米纤维上的肿瘤新生血管靶向序列和pd-l1靶向序列。
4、优选地,所述可自组装形成具有β-sheet二级结构纳米纤维的氨基酸序列为gnnqqnyggk。
5、优选地,所述肿瘤新生血管靶向序列为可靶向识别肿瘤新生血管内皮细胞高表达的nrp-1的氨基酸序列,所述肿瘤新生血管靶向序列的氨基酸序列为rpplwta。
6、优选地,所述pd-l1靶向序列为靶向识别肿瘤表面高表达的pd-l1的氨基酸序列,所述pd-l1靶向序列的氨基酸序列为nyskptdrqyhf。
7、优选地,通过(peg)4作为linker将肿瘤新生血管靶向序列与组装序列相连接;通过辛酸作为linker将pd-l1靶向序列与组装序列相连接。
8、第二方面,本发明提供了第一方面所述的多效协同促进的双靶向多肽基分子在制备抗肿瘤药物中的应用。
9、优选地,所述肿瘤为具有高血管密度或高血管通透性的肿瘤。
10、优选地,所述肿瘤包括膀胱癌、肾癌、胶质母细胞瘤或肝癌。
11、本发明中所述多肽基分子一方面通过促进肿瘤血管正常化及增强免疫杀伤发挥抗癌作用。所述多肽基分子另一方面通过靶向nrp-1作用于肿瘤血管内皮细胞,促进血管正常化促进t细胞的浸润,实现肿瘤免疫微环境从“冷”到“热”的转变,协同促进免疫检查点抑制效果,最终实现抑制肿瘤增殖和转移的作用。
12、第三方面,本发明提供第一方面所述的多效协同促进的双靶向多肽基分子在制备抑制肿瘤新生血管形成和阻断免疫检查点增强免疫杀伤的药物中的应用。
13、第四方面,本发明提供第一方面所述的多效协同促进的双靶向多肽基分子在制备抑制肿瘤细胞增殖和抑制肿瘤细胞转移的药物中的应用。
14、第五方面,本发明提供一种药物组合物,所述组合物中包括第一方面所述的多效协同促进的双靶向多肽基分子。
15、优选地,所述组合物还包括药学上可接受的辅料。
16、相对于现有技术,本发明具有以下有益效果:
17、本发明公开了一种多效协同促进的双靶向多肽基分子(命名为sa-ai),由包括具有可自组装形成具有β-sheet二级结构纳米纤维的氨基酸序列、可靶向识别肿瘤新生血管内皮细胞高表达的nrp-1的氨基酸序列和靶向识别肿瘤表面高表达的pd-l1的氨基酸序列组合而成;sa-ai分子一端靶向肿瘤血管内皮细胞表面高表达的nrp-1靶点,配受体结合触发组装在靶点表面形成致密的纤维结构从而阻断nrp-1靶点,以促进血管结构和功能正常化随之增加t细胞浸润。与此同时双靶向序列的另一端靶向肿瘤细胞表面高表达的pd-l1免疫检查点,阻断免疫检查点,增强免疫杀伤。双靶向多肽基分子将增强免疫招募与免疫杀伤相结合,多效协同促进最大程度发挥抑制肿瘤增殖和转移的作用。
18、此外,本发明注重临床转化应用的实际问题,采用生物安全性高的多肽为材料设计并构建,因此,sa-ai具有较强的生物安全性,临床应用潜力大。
技术特征:
1.一种多效协同促进的双靶向多肽基分子,其特征在于,所述双靶向多肽基分子包括可自组装形成具有β-sheet二级结构纳米纤维和连接在所述具有β-sheet二级结构纳米纤维上的肿瘤新生血管靶向序列和pd-l1靶向序列。
2.根据权利要求1所述的多效协同促进的双靶向多肽基分子,其特征在于,所述可自组装形成具有β-sheet二级结构纳米纤维的氨基酸序列为gnnqqnyggk。
3.根据权利要求1所述的多效协同促进的双靶向多肽基分子,其特征在于,所述肿瘤新生血管靶向序列为可靶向识别肿瘤新生血管内皮细胞高表达的nrp-1的氨基酸序列,所述肿瘤新生血管靶向序列的氨基酸序列为rpplwta;
4.根据权利要求1所述的多效协同促进的双靶向多肽基分子,其特征在于,通过(peg)4作为linker将肿瘤新生血管靶向序列与组装序列相连接;通过辛酸作为linker将pd-l1靶向序列与组装序列相连接。
5.权利要求1-4中任一项所述的多效协同促进的双靶向多肽基分子在制备抗肿瘤药物中的应用。
6.根据权利要求5所述的应用,其特征在于,所述肿瘤包括具有高血管密度或高血管通透性的肿瘤。
7.根据权利要求6所述的应用,其特征在于,所述肿瘤包括膀胱癌、肾癌、胶质母细胞瘤或肝癌。
8.权利要求1-4中任一项所述的多效协同促进的双靶向多肽基分子在制备抑制肿瘤新生血管形成和阻断免疫检查点增强免疫杀伤的药物中的应用。
9.权利要求1-4中任一项所述的多效协同促进的双靶向多肽基分子在制备抑制肿瘤细胞增殖和抑制肿瘤细胞转移的药物中的应用。
10.一种药物组合物,其特征在于,所述组合物中包括权利要求1-4中任一项所述的多效协同促进的双靶向多肽基分子。
技术总结
本发明提供了一种多效协同促进的双靶向多肽基分子及其在制备肿瘤治疗药物中的应用,所述双靶向多肽基分子包括可自组装形成具有β‑sheet二级结构纳米纤维和连接在所述具有β‑sheet二级结构纳米纤维上的肿瘤新生血管靶向序列和PD‑L1靶向序列。所述多肽基分子通过自组装效应带来的长效给药窗口,在诱导血管正常化的同时,发挥免疫检查点抑制的功能。肿瘤血管正常化能促进T细胞的浸润,实现肿瘤免疫微环境从“冷”到“热”的转变,协同促进免疫检查点抑制效果,最终实现抑制肿瘤增殖和转移的作用。
技术研发人员:王浩,肖婷,徐万海,王佳起,吴秀海,王曼迪
受保护的技术使用者:郑州大学
技术研发日:
技术公布日:2024/1/12
- 还没有人留言评论。精彩留言会获得点赞!