一种卡非佐米新降解杂质及其制备方法与流程
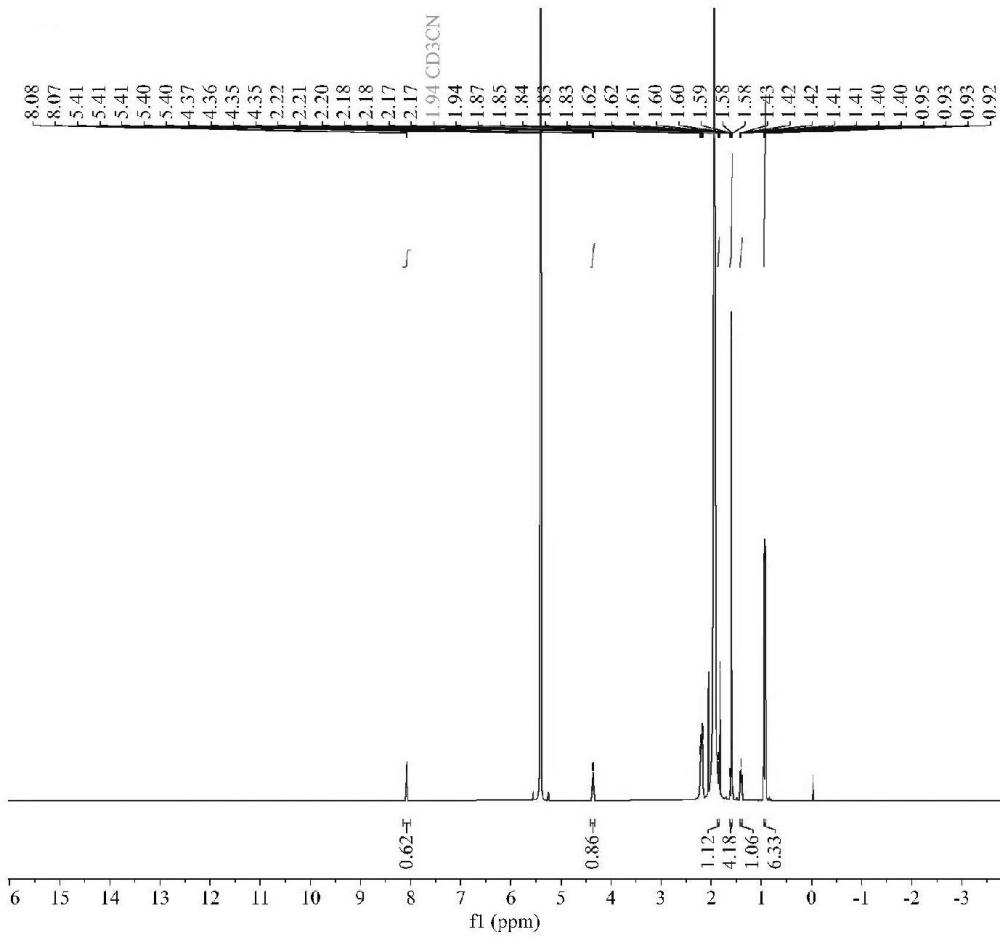
本发明属于药物合成领域,具体涉及一种卡非佐米的降解杂质、其制备及检测方法。
背景技术:
1、药品研发过程中,杂质研究既是药品质量研究的重点,也是难点。药品中的杂质直接影响药品质量、安全性以及有效性;同时,科学分析杂质也是分析方法建立和选择的基础。
2、卡非佐米是一种蛋白酶体抑制剂,可选择性、不可逆性的与结构性蛋白酶体及免疫蛋白酶体结合,适用于治疗多发性骨髓瘤,常用剂型为注射剂。2012年7月,美国fda批准了奥尼克斯(onyx)制药公司开发的卡非佐米注射剂(carfilzomib)上市。卡非佐米化学结构式见式1。
3、
4、本发明人在注射用卡非佐米的药物研发过程中,发现了一种具有全新结构的杂质,该杂质未见文献报道。该杂质在注射用卡非佐米产品中有检出,且在稳定性试验过程中,其含量呈现增长趋势。对该杂质的研究,有助于卡非佐米原料药及制剂的质量控制。因此,确定该杂质的化学结构及制备方法,建立该杂质的检测方法,对测定该杂质含量,制定合理的杂质限度及药品质量研究具有重要意义。
技术实现思路
1、本发明的目的在于提供一种全新的卡非佐米降解杂质及其用于卡非佐米杂质对照品的用途,并提供该杂质的制备方法和检测方法。
2、为了实现上述发明目的,本发明提供了如下方案。
3、本发明提供了一种卡非佐米新降解杂质,其化学结构式见式2:
4、
5、本发明人在研究过程中发现,式2杂质的沸点低,难以通过常规手段获得高纯度产品。因此,本发明还提供了所述降解杂质的制备方法,可获得该杂质的高纯度产品。包括如下步骤:
6、(1)将卡非佐米用溶剂溶解,加入酸性水溶液,混匀,在密闭条件下,置于80-85℃高温下反应,反应时间至少5小时;
7、(2)反应产物用制备色谱柱纯化两次、收集目标流分;
8、(3)将目标流分经制备色谱再次浓缩纯化洗脱,收集目标洗脱液;
9、(4)将目标洗脱液萃取,即得目标化合物。
10、优选地,所述步骤(1)中,溶剂与酸性水溶液的体积比为1:0.9~1,所述溶剂为乙腈,所述酸性水溶液中酸与水的体积比优选为1:10。
11、优选地,所述酸为磷酸。
12、优选地,所述步骤(2)中,第一次纯化的制备色谱流动相a为0.1%甲酸水溶液,流动相b为乙腈,采用梯度洗脱;第二次纯化的制备色谱流动相a为20mmol/l甲酸铵,流动相b为乙腈,采用梯度洗脱。
13、优选地,所述步骤(2)中,第一次纯化和第二次纯化时采用梯度洗脱,梯度洗脱条件如下:
14、
15、优选地,所述步骤(3)中,浓缩纯化洗脱的制备色谱流动相a为水,流动相b为乙腈,采用梯度洗脱。
16、优选地,所述步骤(3)中浓缩纯化洗脱的梯度洗脱条件如下:
17、
18、优选地,步骤(3)中,目标流分在制备色谱上样前用溶剂稀释,所述溶剂为20mmol/l甲酸铵或水。
19、优选地,步骤(4)中,所述萃取为采用乙腈-水低温萃取。
20、优选地,步骤(4)中萃取具体步骤如下:
21、a.将步骤(3)浓缩纯化洗脱得到的洗脱液加入单口瓶中,单口瓶置于-22℃冷肼中,放置20min;
22、b.将液体倒入-20℃预冷后的分液漏斗中,分液,取上层即乙腈层;
23、c.向乙腈层加入超纯水,重复该上述操作;每次加入水的量为乙腈层体积的1/5~1/3,重复操作8次,即得目标化合物溶液。
24、本发明还提供了上述降解杂质作为卡非佐米及其制剂的质量控制的对照品的用途。
25、本发明还提供了上述降解杂质在卡非佐米及其制剂中的检测方法。
26、具体检测条件如下:
27、仪器:高效液相色谱仪;
28、色谱柱:十八烷基键合硅胶柱;
29、流动相a:0.1mol/l高氯酸钠缓冲液(ph2.7)-乙腈-甲醇=60:20:20;
30、流动相b:0.1mol/l高氯酸钠缓冲液(ph2.7)-乙腈-甲醇=10:70:20;
31、流速:1.2ml/min;
32、柱温:28℃;
33、检测波长:268nm;
34、进样体积:25μl;
35、梯度程序如下:
36、
37、本发明的有益效果如下:
38、(1)本发明的新杂质是一种全新结构的卡非佐米的降解杂质,可用于卡非佐米及其注射剂的质量研究,提高卡非佐米的质量标准,特别在卡非佐米原料药及注射剂及其制备工艺的质量控制方面提供重要的参考作用。
39、(2)本发明提供了一种制备所述降解杂质的方法,该制备方法过程简单,仅一步反应,无需耗费大量试剂,经济方便;同时,由于所述杂质沸点低,难以通过常规手段获得纯度较高的固体,而通过本发明方法制备获得的杂质纯度高,纯度大于98.0%,可作为对照品用于卡非佐米及制剂的质量研究,提高注射用卡非佐米临床使用的安全性及有效性。
40、(3)本发明提供了该降解杂质在卡非佐米及其制剂中的检测方法,可准确、有效地检测该杂质在卡非佐米及其制剂中的含量,有助于注射用卡非佐米的工艺筛选、杂质限度控制,以确保制剂产品的安全性。
技术特征:
1.一种卡非佐米杂质,为式2化合物:
2.权利要求1的式2化合物作为卡非佐米质量控制的对照品的用途。
3.一种权利要求1的式2化合物的制备方法,包括以下步骤:
4.根据权利要求3所述的制备方法,步骤(1)中,溶剂与酸性水溶液的体积比为1:0.9~1,所述溶剂为乙腈,所述酸性水溶液中为酸与水的体积比为1:10。
5.根据权利要求3或4所述的制备方法,所述溶剂为乙腈,所述酸为磷酸。
6.根据权利要求3所述的制备方法,步骤(2)中,第一次纯化的制备色谱流动相a为0.1%甲酸水溶液,流动相b为乙腈,采用梯度洗脱;第二次纯化的制备色谱流动相a为20mmol/l甲酸铵,流动相b为乙腈,采用梯度洗脱;
7.根据权利要求6所述的制备方法,步骤(2)中所述第一次纯化和第二次纯化时的梯度洗脱条件如下:
8.根据权利要求3所述的制备方法,步骤(4)中,所述萃取为采用乙腈-水低温萃取。
9.根据权利要求8中所述的制备方法,所述萃取,具体操作为:
10.一种权利要求1所述杂质的检测方法,其特征在于,具体检测条件如下:
技术总结
本发明提供了一种卡非佐米的新降解杂质、其制备及检测方法。该杂质是在注射用卡非佐米储存过程中产生的降解杂质,其存在可能影响产品质量。本发明同时提供了该降解杂质的制备方法,该制备方法操作简单,无需耗费大量试剂,通过色谱纯化和低温萃取方式,可获得高纯度的杂质成品。本发明提供的杂质可用作卡非佐米及其制剂质量控制的对照品。
技术研发人员:黄凌晶,吕翔宇,何林波,王苗,徐颖
受保护的技术使用者:重庆药友制药有限责任公司
技术研发日:
技术公布日:2024/2/19
- 还没有人留言评论。精彩留言会获得点赞!