确定抗药物抗体同种型的方法与流程
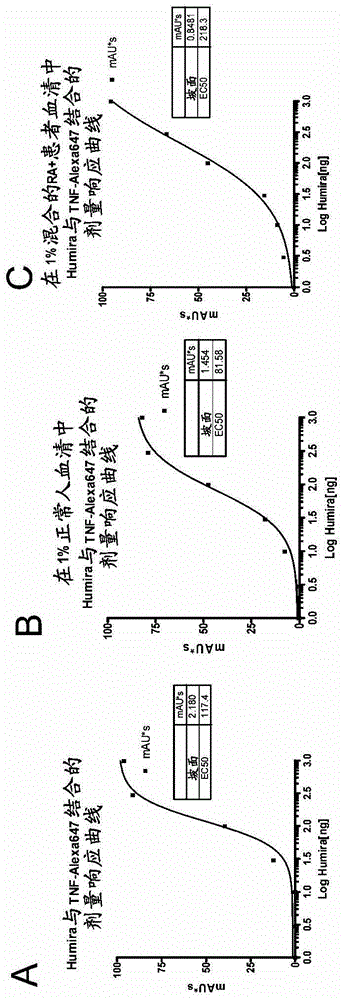
确定抗药物抗体同种型的方法与相关申请的交叉引用本申请要求2010年10月18日提交的美国临时申请号61/394,269的优先权,其公开内容出于全部目的通过引用整体并入本文。发明背景自身免疫病症是重要而普遍的医疗问题。例如,类风湿性关节炎(RA)是自身免疫疾病,在美国影响超过二百万人。RA导致关节的慢性炎症,并且通常是进行性疾病,具有导致关节破坏和功能性残疾的可能。类风湿性关节炎的病因未知,然而此疾病的病因学涉及遗传素质(predisposition)、传染剂和环境因子。在活跃的RA中,症状可包括疲劳、缺乏食欲、低烧、肌肉和关节疼痛以及僵硬。在疾病发作过程中,由于滑膜的炎症,关节常常变得发红、肿胀、疼痛和敏感。此外,由于RA是全身性疾病,炎症可影响关节外的器官和身体区域,包括眼和口的腺体、肺内壁、心包膜和血管。RA和其他自身免疫病症管理的传统治疗包括快速作用的“一线药物”和较慢作用的“二线药物”。一线药物减轻疼痛和炎症。此类一线药物的实例包括阿司匹林、甲氧萘丙酸、布洛芬依托度酸和其他非甾体抗炎性药物(NSJAID),以及皮质甾类,通过口服或直接注射到组织和关节内给药。二线药物促进疾病减轻并防止进行性关节破坏,也称为疾病改变性抗类风湿药物或DMARD。二线药物的实例包括金、hydrochloroquine、柳氮磺胺吡啶以及免疫抑制剂,例如甲氨蝶呤、硫唑嘌呤、环磷酰胺、苯丁酸氮芥和环孢霉素。然而,这些药物中许多可能具有有害的副作用。因此,一直在寻找类风湿性关节炎和其他自身免疫病症的额外疗法。肿瘤坏死因子α(TNFα)是包括单核细胞和巨噬细胞的多种细胞类型产生的细胞因子,它最初是基于其诱导某些小鼠肿瘤坏死的能力而鉴定的。随后,与恶病质相关,称为恶液质素的因子被证明与TNFα涉及多种其他人类疾病和病症,包括休克、败血症、感染、自身免疫疾病、RA、克罗恩病、移植排斥和移植物抗宿主疾病的病理生理学。由于人TNFα(hTNFα)在多种人类病症中的有害功能,设计了治疗策略以抑制或对抗hTNFα活性。特别地,结合并中和hTNFα的抗体被寻求作为抑制hTNFα活性的工具。一些最早的此类抗体是小鼠单克隆抗体(mAb),所述单克隆抗体是由从用hTNFα免疫的小鼠的淋巴细胞制备的杂交瘤细胞分泌的(参见例如美国专利号5,231,024)。尽管这些小鼠抗hTNFα抗体通常显示对hTNFα的高亲和性,并且能中和hTNFα活性,它们在体内的使用受到与向人施用小鼠抗体相关的问题的限制,例如短血清半衰期、不能引发某些人效应子功能以及引起人中对小鼠抗体的不希望的免疫应答(“人抗小鼠抗体”(HAMA)反应)。最近,生物疗法被用于治疗自身免疫病症例如类风湿性关节炎。例如,四种TNFα抑制剂,REMICADETM(英夫利昔单抗),嵌合抗TNFαmAb、ENBRELTM(依那西普),TNFR-IgFc融合蛋白、HUMIRATM(阿达木单抗),人抗TNFαmAb和(赛妥珠单抗),聚乙二醇化的Fab片段被FDA批准用于治疗类风湿性关节炎。也用于治疗中度至重度克罗恩病(CD)。尽管此类生物疗法被证明在治疗类风湿性关节炎和其他自身免疫病症例如CD中成功,并不是所有治疗对象对此类疗法响应,或响应良好。此外,施用TNFα抑制剂可诱导对药物的免疫应答,并导致产生抗药物抗体(ADA)例如人抗嵌合抗体(HACA)、人抗人源化抗体(HAHA)和人抗小鼠抗体(HAMA)。此类HACA、HAHA或HAMA免疫应答可与超敏反应以及免疫疗法的TNFα抑制剂的药物动力学和生物分布的剧烈改变相关,后者妨碍用药物进一步治疗。此外,HACA、HAHA或HAMA的特别的同种型的存在与接受抗TNFα疗法的对象的不同临床结果相关。因此,本领域存在对这样的测定的需求,所述测定检测样品中特定ADA同种型或ADA同种型的特定组合的存在或水平。本领域也存在对这样的方法的需求,所述方法选择抗TNFα疗法的适当进程、监测抗TNFα疗法和/或指导治疗决定。本发明满足这些需求,并也提供相关的优势发明概述本发明提供确定样品中一种或多种抗药物抗体(ADA)同种型的测定方法。作为非限制性实例,本发明的测定对于确定来自接受抗TNFα药物例如REMICADETM(英夫利昔单抗)或HUMIRATM(阿达木单抗)的ADA阳性患者的样品中的不同的ADA同种型是特别有用的。本发明也提供优化疗法和/或降低对象中的毒性的方法,所述对象接受用于治疗TNFα介导的疾病或病症的TNFα抑制剂。在一方面,本发明提供检测样品中抗TNFα药物的自体抗体的至少一种同种型(例如多个同种型)存在(或不存在)或水平的方法,该方法包括:用含有或怀疑含有抗TNFα药物的自体抗体的至少一种同种型的样品接触经标记的抗TNFα药物,以在经标记的抗TNFα药物和每种自体抗体同种型之间形成经标记的复合物;对标记复合物进行大小排阻色谱,以将具有不同自体抗体同种型的经标记的复合物彼此分离和/或将所述经标记的复合物与游离的经标记的抗TNFα药物分离;和检测经标记的复合物,从而检测抗TNFα药物的自体抗体的至少一种同种型的存在(或不存在)或水平。在一些实施方式中,抗TNFα药物选自REMICADETM(英夫利昔单抗)、HUMIRATM(阿达木单抗)、ENBRELTM(依那西普)、(赛妥珠单抗)及其组合。在其他实施方式中,抗TNFα药物的自体抗体(例如抗药物抗体或“ADA”)选自人抗嵌合抗体(HACA)、人抗人源化抗体(HAHA)、人抗小鼠抗体(HAMA)及其组合。在一些实施方式中,至少一种同种型包含至少两种、三种、四种、五种或更多的多种同种型。在其他实施方式中,至少一种同种型选自IgA、IgD、IgE、IgG和IgM同种型、其亚类及其组合。在一些情况下,样品是全血、血清或血浆。在一些实施方式中,抗TNFα药物的自体抗体是HACA,样品从进行REMICADETM(英夫利昔单抗)疗法的对象获得。在其他一些实施方式中,抗TNFα药物的自体抗体是HAHA,样品从进行HUMIRATM(阿达木单抗)疗法的对象获得。在一些情况下,经标记的抗TNFα药物是荧光团标记的抗TNFα药物。在特别的实施方式中,使用荧光标记检测来检测经标记的复合物。在某些实施方式中,每种自体抗体同种型通过其保留时间表征、鉴定或检测。在其他实施方式中,大小排阻色谱是大小排阻高效液相色谱(SE-HPLC)。在一个相关方面,本发明提供检测样品中抗TNFα药物的自体抗体的至少一种同种型(例如多种同种型)存在(或不存在)或水平的方法,该方法包括:将经标记的抗TNFα药物和不同抗体同种型特异性的一种或多种经标记的抗Ig抗体与具有或怀疑具有抗TNFα药物的自体抗体的至少一种同种型的样品接触,以在经标记的抗TNFα药物、经标记的抗Ig抗体和每种自体抗体同种型之间形成经标记的复合物,其中经标记的抗TNFα药物和经标记的抗Ig抗体包含不同的标记;对经标记的复合物进行大小排阻色谱,以将具有不同自体抗体同种型的经标记的复合物彼此分离,与游离的经标记的抗TNFα药物分离,和/或与游离的经标记的抗Ig抗体分离;和检测经标记的复合物,从而检测抗TNFα药物的自体抗体的至少一种同种型的存在(或不存在)或水平。在一些实施方式中,抗TNFα药物选自REMICADETM(英夫利昔单抗)、HUMIRATM(阿达木单抗)、ENBRELTM(依那西普)、(赛妥珠单抗),及其组合。在其他实施方式中,抗TNFα药物的自体抗体(例如抗药物抗体或“ADA”)选自人抗嵌合抗体(HACA)、人抗人源化抗体(HAHA)、人抗小鼠抗体(HAMA),及其组合。在特别的实施方式中,经标记的抗TNFα药物和一种或多种经标记的抗Ig抗体与至少一个种同种型的不同表位结合。作为非限制性实例,经标记的抗TNFα药物和经标记的抗Ig同种型特异性抗体结合特别的自体抗体同种型的不同表位。在某些实施方式中,至少一种同种型包含至少两种、三种、四种、五种或更多的多种同种型。在其他实施方式中,至少一种同种型选自IgA、IgD、IgE、IgG和IgM同种型、其亚类及其组合。在一些实施方式中,多种经标记的抗Ig抗体包含至少两种、三种、四种、五种或更多不同抗体同种型特异性的经标记的抗Ig抗体。在其他实施方式中,一种或多种经标记的抗Ig抗体选自IgA、IgD、IgE、IgG和IgM同种型、其亚类及其组合之中一种或多种特异性的抗体。在一些情况下,样品是全血、血清或血浆。在一些实施方式中,抗TNFα药物的自体抗体是HACA,样品从进行REMICADETM(英夫利昔单抗)疗法的对象获得。在某些其他实施方式中,抗TNFα药物的自体抗体是HAHA,样品从进行HUMIRATM(阿达木单抗)疗法的对象获得。在一些情况下,经标记的抗TNFα药物是荧光团标记的抗TNFα药物。在某些其他情况下,经标记的抗Ig抗体是荧光团标记的抗Ig抗体。不同抗体同种型特异性的多种经标记的抗Ig抗体可每种包含相同或不同的标记。在一个非限制性实例中,多种经标记的抗Ig同种型特异性的抗体每种用Alexa-532标记,并且经标记的抗TNFα药物用Alexa-488标记。在一些实施方式中,使用荧光标记检测来检测经标记的复合物。在特别的实施方式中,根据经标记的抗TNFα药物和经标记的抗Ig抗体与自体抗体同种型的临近结合产生的信号来检测经标记的复合物。在某些情况下,信号包含用荧光共振能量转移(FRET)检测的荧光信号。在其他实施方式中,大小排阻色谱是大小排阻高效液相色谱(SE-HPLC)。在一些实施方式中,每种自体抗体同种型通过其保留时间表征、鉴定或检测。在另一个方面,本发明提供优化疗法和/或降低在对象中毒性的方法,所述对象接受用于治疗TNFα介导的疾病或病症的疗程,方法包括:分析从对象获得的样品,以确定样品中一种或多种标志物的存在、水平或基因型;对步骤(a)中确定的一种或多种标志物的存在、水平或基因型使用统计算法;和根据步骤(b)中使用的统计算法,为对象确定疗程的随后剂量或是否应当向对象施用不同的疗程。作为非限制性实例,可在患者样品(例如来自进行抗TNFα药物疗法的患者的血清样品)中检测、测量或确定以下类别的生化标志物、血液学标志物和/或遗传标志物中的一种、两种、三种、四种、五种或全部六种的存在、水平或基因型:抗TNFα药物水平(例如游离的抗TNFα药物疗法抗体的水平);抗药物抗体(ADA)水平(例如抗TNFα药物的自体抗体的水平);TNFα水平;一种、两种、三种、四种、五种、六种、七种或更多种额外的细胞因子(例如IL-6、IL-1β、IFN-γ、IL-10等)和/或其他炎症机制的标志物(例如炎性标志物例如CRP、SAA、ICAM-1和/或VCAM-1)的水平;一种或多种遗传标志物(例如炎性途径基因)中一个或多个突变的存在与否,例如一种或多种炎性标志物中变体等位基因的存在与否(例如SNP),例如NOD2/CARD15(例如美国专利号7,592,437中说明的SNP8、SNP12和/或SNP13)、ATG16L1(例如Lakatos等人,DigestiveandLiverDisease,40(2008)867-873中说明的rs2241880(T300A)SNP、IL23R(例如Lakatos等人说明的rs11209026(R381Q)SNP)、在例如Gasche等人(Eur.J.Gastroenterology&Hepatology,(2003)15:599-606)中说明的人白细胞抗原(HLA)基因和/或细胞因子基因,和来自IBD5基因座的DLG5和/或OCTN基因;一种或多种上述生化标志物和/或血液学标志物在多个时间点的水平(例如28周、60周等);和其组合。在特别的实施方式中,单个统计算法或两个或更多统计算法的组合可用于在样品中检测、测量或确定一种或多种(例如两种、三种、四种、五种、六种、七种或更多的组合)标志物的存在、水平(浓度水平)或基因型,从而优化疗法,降低毒性和/或监测用抗TNF药物进行的治疗疗法的效力。如此,本发明的方法可用于通过确定患者免疫状态来确定患者管理。检测抗TNF药物(例如抗TNFα抗体)和抗药物抗体(ADA)例如HACA和HAHA的方法在PCT公开号WO2011/056590中进一步说明,其公开内容处于全部目的以引文整体并入本文。根据以下的详细说明和附图,本发明的其他目的、特征和优势对本领域技术人员是显而易见的。附图简述图1显示了本发明的测定的示例性实施方式,其中大小排阻HPLC用于检测TNFα-Alexa647和HUMIRATM之间的结合。图2显示了HUMIRATM与TNFα-Alexa647结合的剂量反应曲线。图3显示了目前基于ELISA的测量HACA水平的方法,称为桥接测定。图4显示了用于测量针对REMICADETM生成的HACA/HAHA浓度的本发明的自体抗体检测测定的示例性概要。图5显示了抗人IgG抗体结合REMICADETM-Alexa647的剂量反应分析。图6显示了抗人IgG抗体结合REMICADETM-Alexa647的第二剂量反应分析。图7显示了抗人IgG抗体结合REMICADETM-Alexa647的剂量反应曲线。图8显示了在正常人血清和HACA阳性血清中REMICADETM-Alexa647免疫复合物的形成。图9提供了使用本发明的桥接测定或迁移率变动测定进行的来自20个患者血清样品的HACA测量的总结。图10提供了测量HACA的血清浓度的现有方法和本发明的新HACA测定的总结和比较。图11显示了用正常(NHS)或HACA阳性(HPS)血清孵育的荧光团(F1)标记的IFX的SE-HPLC谱。向孵育混合物中加入增加的量的HACA阳性血清剂量依赖地向更高分子量洗脱位置C1和C2变动IFX-Fl峰。图12显示了由迁移率变动测定确定的用增加的HACA阳性血清稀释物产生的结合和游离IFX-Fl的剂量反应曲线。(A)增加的HACA阳性血清稀释物与37.5ngIFX-Fl孵育。稀释度越高(HACA越少),在SE-HPLC分析中发现的游离IFX-Fl越多。(B)增加的HACA阳性血清稀释物与37.5ngIFX-Fl孵育。稀释度越高(HACA越少),在SE-HPLC分析中发现的HACA结合的IFX-Fl越少。图13显示了用正常(NHS)或用IFX加料的血清孵育的TNFα-Fl的SE-HPLC谱。向孵育混合物中加入增加的量的IFX加料的血清剂量依赖地向更高分子量洗脱位置变动荧光TNFα峰。图14显示了由迁移率变动测定确定的用增加的IFX加料的血清稀释物产生的结合和游离TNFα的剂量反应曲线。向孵育混合物中加入的增加的浓度的IFX降低游离TNFα的比例,同时增加结合TNFα的比例。图15显示了在不同时间点用迁移率变动测定测量的用IFX治疗的IBD患者中的相对HACA水平和IFX浓度。图16显示了患者管理——在不同时间点测量用IFX治疗的IBD患者血清中的HACA水平和IFX浓度。图17显示了用于检测(A)非中和性或(B)中和性自体抗体例如HACA的存在的本发明的测定的示例性实施方式。图18显示了用于检测中和性自体抗体(例如HACA)的存在测定的本发明的备选实施方式。图19显示了在不同量的抗人IgG存在下与正常人血清(NHS)孵育的Fl标记的ADL的迁移率变动谱。向孵育混合物加入增加的量的抗人IgG剂量依赖地将游离Fl-ADL峰(FA)变动到更高分子量洗脱位置C1和C2,而内部对照(IC)没有改变。图20显示了抗人IgG对游离Fl-ADL的变动的剂量反应曲线。将增加的量的抗人IgG与37.5ngFl-ADL和内部对照孵育。向反应混合物加入的抗体越多,游离Fl-ADL比内部对照的比率越低。图21显示了在不同量的ADL存在下与正常人血清(NHS)孵育的Fl标记的TNF-α的迁移率变动谱。Ex=494nm;Em=519nm。向孵育混合物加入增加的量的ADL剂量依赖地将游离TNF-Fl峰(FT)变动到更高分子量洗脱位置,而内部对照(IC)峰没有改变。图22显示了ADL对游离TNF-α-Fl的变动的剂量反应曲线。增加的量的ADL与100ngTNF-α-Fl和内部对照孵育。向反应混合物加入的抗体ADL越多,游离TNF-α-Fl比内部对照的比率越低。图23显示了在HACA阳性患者血清中不同ADA同种型的洗脱时间。图24显示了用于实施例8所述的研究中的100个对照样品的平均值的图。图25显示了用于实施例8所述的研究中的100个HACA阳性样品的平均值的图。图26显示了实施例8所述的研究中使用的100个对照样品和100个HACA阳性样品的主要峰信号(即对应于经标记的Remicade信号强度)的并排比较。图27显示了来自图26的主要峰数据的受试者工作特征(ROC)曲线。曲线下面积(AUC)是0.986。图28显示了实施例8所述的研究中使用的100个HACA阳性样品的X轴上的非主要峰(对应于IgG、IgA和IgM峰的和)对Y轴上的主要峰的图。图29显示了实施例8所述的研究中使用的全部200个样品的IgG对IgA对IgM峰的图。图30显示了本发明的荧光共振能量转移(FRET)自体抗体同种型分型测定形式的示意图。图31显示了本发明的基于FRET的自体抗体同种型分型测定的结果。发明详述引言TNFα参与炎性疾病、自身免疫疾病、病毒、细菌和寄生虫感染、恶性肿瘤和/或神经退化性疾病,并且是诸如类风湿性关节炎(RA)和克罗恩病(CD)的疾病中特异性生物疗法的有用靶标。TNFα抑制剂例如抗TNFα抗体是重要的治疗剂类型。然而,施用TNFα抑制剂可诱导对药物的免疫应答并导致产生抗药物抗体(ADA),从而妨碍用此药物进一步治疗。此外,特定的ADA同种型的存在可与接受抗TNFα疗法的对象的不同临床结果相关。本发明部分基于以下发现,用大小排阻色谱进行的均质迁移率变动测定对测量样品中一种或多种ADA同种型的存在或水平特别有利。作为非限制性实例,本发明的测定特别用于确定来自ADA阳性患者的样品中不同的ADA同种型,所述患者接受抗TNFα药物例如REMICADETM(英夫利昔单抗)或HUMIRATM(阿达木单抗)。特别地,本发明提供“混合和读取”ADA同种型分型测定,其不需要任何洗涤步骤。因此,复合的和未复合的试剂方便地彼此分离。此外,用本发明的测定减小了来自游离抗TNFα药物的任何可能干扰。相反,直到TNFα抑制剂从身体消除才能进行用于测量自体抗体水平的典型的ELISA,所述消除可需要多达3个月。此外,除了抗TNFα抗体,本发明普遍适用于多种抗TNFα治疗剂。本发明的测定的优势还在于因为其避免了抗原附着于固体表面,消除了无关IgG的非特异性结合、检测具有弱亲和力的抗体并表现比现有检测方法例如酶免疫测定增强的灵敏性和特异性。FDA要求在临床实验期间进行药物动力学和耐受性(例如免疫应答)研究的事实表明了测量抗TNFα生物制剂(例如抗TNFα抗体)以及针对其产生的自体抗体(例如ADA同种型)的血清浓度的重要性。本发明也用于监测接受这些药物的患者,以确保患者获得正确剂量,药物未过快从身体清除以及患者未对药物产生免疫应答。此外,本发明用于指导由于起始药物的失败而在不同药物之间的切换。本发明也提供优化疗法和/或降低对象中毒性的方法,所述对象接受用于治疗TNFα介导的疾病或病症的TNFα抑制剂。此外,本发明特别有利,因为其通过提供用于指导对接受或即将接受抗TNF药物疗法的患者的治疗决定的信息,部分地克服了与施用抗TNF药物例如英夫利昔单抗或阿达木单抗相关的现有限制。定义如本文所用,除非另有说明,以下术语具有给定的含义。如本文所用的术语“TNFα”意欲包括作为17kDa分泌形式和26kDa膜结合形式存在的人细胞因子,其生物活性形式由非共价结合的17kDa分子三聚体组成。TNFα的结构在例如Jones等人.(1989)Nature,338:225-228中进一步说明。术语TNFα意欲包括人TNFα、重组人TNFα(rhTNFα)或与人TNFα蛋白具有至少约80%同一性的多肽。人TNFα由35个氨基酸(aa)的胞质结构域、21aa的穿膜区段和177aa的胞外结构域(ECD)组成(Pennica等人(1984)Nature312:724)。在ECD内,人TNFα与恒河猴具有97%的aa序列同一性,并与牛、犬、棉鼠、马、猫、小鼠、猪和大鼠TNFα具有71%至92%的序列同一性。TNFα可用标准重组表达方法制备或从市场购买(例如R&DSystems,货号210-TA,Minneapolis,Minn)。术语“TNFα抑制剂”或“TNFα药物”意欲涵盖例如通过抑制TNFα与TNFα的细胞表面受体的相互作用、抑制TNFα蛋白生产、抑制TNFα基因表达、抑制TNFα从细胞分泌、抑制TNFα受体信号传递或导致对象中TNFα活性降低的任何方法直接或间接抑制TNFα活性的活性剂,包括蛋白、抗体、抗体片段、融合蛋白(例如Ig融合蛋白或Fc融合片段)、多价结合蛋白(例如DVDIg)、小分子TNFα拮抗剂和相似的天然或非天然存在的分子和/或其重组和/或改造的形式。术语“TNFα抑制剂”或“TNFα药物”优选地包括干扰TNFα活性的活性剂。TNFα药物的实例包括依那西普(ENBRELTM,Amgen)、英夫利昔单抗(REMICADETM,JohnsonandJohnson)、人抗TNF单克隆抗体阿达木单抗(D2E7/HUMIRATM,AbbottLaboratories)、CDP571(Celltech)和CDP870(Celltech),以及抑制TNFα活性的其他化合物,使得当施用于罹患或处于罹患其中TNFα活性有害的病症(例如RA)的风险的对象中时,病症被治疗。术语“免疫球蛋白同种型”或“抗体同种型”包括在重链和/或轻链的恒定区内包含遗传变异和/或差异的相关抗体家族的任何成员。抗体同种型的非限制性实例包括(1)重链同种型例如α(例如IgA或其亚类,例如IgA1和/或IgA2);δ(例如IgD);γ(例如IgG或其亚类,例如IgG1、IgG2、IgG3和/或IgG4);ε(例如IgE);μ(例如IgM);和(2)轻链同种型例如κ和λ。术语“大小排阻色谱”(SEC)意欲包括其中溶液中的分子是基于其大小和/或流体动力学体积分离的色谱方法。它用于大分子或大分子复合物例如蛋白质及其缀合物。通常,当用水性溶液运送样品通过柱时,技术称为凝胶过滤色谱。术语“复合物”、“免疫复合物”、“缀合物”和“免疫缀合物”包括但不限于结合于(例如通过非共价方法)抗TNFα药物的TNFα、结合于(例如通过非共价方法)针对抗TNFα药物的自体抗体的抗TNFα药物、结合于(例如通过非共价方法)TNFα和针对抗TNFα药物的自体抗体的抗TNFα药物、结合于(例如通过非共价方法)针对抗TNFα药物的自体抗体同种型的抗TNFα药物,和结合于(例如通过非共价方法)针对抗TNFα药物的自体抗体同种型的抗TNFα药物和抗Ig同种型特异性抗体。如本文所用,通过术语“经标记的”修饰的实体包括与根据经验可检测的另一分子或化学实体缀合的任何实体、分子、蛋白、酶、抗体、抗体片段、细胞因子或相关种类。适于作为经标记的实体的标记的化学种类包括但不限于荧光染料(例如Alexa染料例如Alexa488、532或647);量子点;光学染料;发光染料;以及放射性核素,例如125I。短语“荧光标记检测”包括检测荧光标记的工具。检测工具包括但不限于光谱仪、荧光仪、光度计、通常并入色谱设备(例如但不限于大小排阻高效液相色谱)的检测装置,例如但不限于Agilent-1200HPLC系统。术语“优化的疗法”或“优化疗法”包括优化特别的疗法的剂量(例如有效量或水平)和/或类型。例如,优化抗TNFα药物的剂量包括增加或减少随后向对象施用的抗TNFα药物的量。在一些情况下,优化抗TNFα药物的类型包括将施用的抗TNFα药物从一种药物改变为不同的药物(例如不同的抗TNFα药物)。在某些其他情况下,优化疗法可包括共同施用抗TNFα药物剂量(例如增加的、减少的或与之前剂量相同的剂量)与免疫抑制药物的组合。术语“疗程”包括采取的减轻或防止与TNFα介导的疾病或病症相关的一种或多种症状的任何治疗方法。术语涵盖施用用于改善患有TNFα介导的疾病或病症的个体的健康的任何化合物、药物、程序和/或养生法,并且包括本文说明的任何治疗剂。本领域技术人员将意识到,使用本发明的方法,可以基于TNFα、抗TNFα药物和/或抗药物抗体的存在或浓度水平,改变疗程或现有疗程的剂量(例如增加或减少)。术语“免疫抑制剂”包括能产生免疫抑制效果,例如防止或降低免疫应答的任何物质,例如通过照射或通过施用药物例如抗代谢物、抗淋巴细胞血清、抗体等。适当的免疫抑制剂的实例包括但不限于硫代嘌呤药物例如硫唑嘌呤(azathioprine)(AZA)及其代谢物;抗代谢物例如甲氨蝶呤(MTX);西罗莫司(sirolimus)(雷帕霉素);替西罗莫司(temsirolimus);依维莫司(everolimus);他克莫司(tacrolimus)(FK-506);FK-778;抗淋巴细胞球蛋白抗体、抗胸腺细胞球蛋白抗体、抗CD3抗体、抗CD4抗体,和抗体-毒素缀合物;环孢霉素;麦考酚酯(mycophenolate);咪唑立宾单磷酸酯;滨蒿内酯(scoparone);乙酸格拉默(glatiramer);其代谢物;其可药用的盐;其衍生物;其前体药物;及其组合。术语“硫代嘌呤”包括硫唑嘌呤(AZA)、6-巯基嘌呤(6-MP)或具有治疗效力的其任何代谢物,包括但不限于6-硫代鸟嘌呤(6-TG)、6-甲基巯基嘌呤核苷、6-硫代肌苷核苷酸(例如,6-硫代肌苷单磷酸、6-硫代肌苷二磷酸、6-硫代肌苷三磷酸)、6-硫代鸟嘌呤核苷酸(例如6-硫代鸟嘌呤单磷酸、6-硫代鸟嘌呤二磷酸、6-硫代鸟嘌呤三磷酸)、6-硫代黄苷核苷酸(例如6-硫代黄苷单磷酸、6-硫代黄苷二磷酸、6-硫代黄苷三磷酸)、其衍生物、其类似物及其组合。术语“样品”包括从个体获得的任何生物样本。用于本发明的适当的样品包括但不限于全血、血浆、血清、唾液、尿液、粪便、泪液、任何其他体液、组织样品(例如活组织切片)及其细胞提取物(例如红细胞提取物)。在优选的实施方式中,样品是血清样品。本领域技术人员将认识到,样品例如血清样品可在分析前稀释。在一些情况下,术语“样品”包括但不限于血液、身体组织、血清、淋巴液、淋巴结组织、脾组织、骨髓或源自以上这些组织中的一种或多种的免疫球蛋白富集的级分。在其他一些情况下,术语“样品”包括血清或是源自血清或血液的免疫球蛋白富集的级分。在一些情况下,术语“样品”包括体液。术语“预测对TNFα抑制剂的响应性”意欲指评估用TNFα抑制剂治疗对象是否在对象中有效(例如提供可测量的益处)的可能性的能力。特别地,评估治疗是否有效的可能性的此类能力通常是在治疗已经开始后,并且在对象中已经观察到效力的指示物(例如可测量益处的指示物)后进行的。特别优选的TNFα抑制剂是被FDA批准用于在人中治疗类风湿性关节炎(RA)的生物制剂,这些活性剂在本文中说明,包括但不限于阿达木单抗(HUMIRATM)、英夫利昔单抗(REMICADETM)和依那西普(ENBRELTM)。术语“对象”、“患者”或“个体”通常指人,但也指其他动物,包括例如其他灵长类、啮齿类、犬、猫、马、羊、猪等。III.实施方式说明本发明提供用于确定样品中一种或多种抗药物抗体(ADA)同种型的测定方法。作为非限制性实例,本发明的测定特别用于确定来自接受抗TNFα药物例如REMICADETM(英夫利昔单抗)或HUMIRATM(阿达木单抗)的ADA阳性患者的样品中不同的ADA同种型。本发明也提供优化疗法和/或降低对象中毒性的方法,所述对象接受用于治疗TNFα介导的疾病或病症的TNFα抑制剂。在一方面,本发明提供检测样品中抗TNFα药物的自体抗体的至少一种同种型(例如多种同种型)存在(或不存在)或水平的方法,该方法包括:将经标记的抗TNFα药物(例如经标记的抗TNFα抗体)与含有或怀疑含有抗TNFα药物的自体抗体的至少一种同种型的(例如IgA、IgD、IgE、IgG和/或IgM)的样品接触,以在经标记的抗TNFα药物和每种抗体同种型之间形成标记复合物(即免疫复合物或缀合物)(即其中经标记的抗TNFα药物和自体抗体同种型并非彼此共价附着);对经标记的复合物进行大小排阻色谱,以将具有不同自体抗体同种型的经标记的复合物彼此分离和/或从游离的经标记的抗TNFα药物分离;和检测经标记的复合物,从而检测抗TNFα药物的自体抗体的至少一种同种型的存在(或不存在)或水平。在一个相关方面,本发明提供检测样品中抗TNFα药物的自体抗体的至少一种同种型(例如多种同种型)存在(或不存在)或水平的方法,该方法包括:将经标记的抗TNFα药物(例如,经标记的抗TNFα抗体)和不同抗体同种型(例如IgA、IgD、IgE、IgG和/或IgM)特异性的一种或多种经标记的抗Ig抗体与含有或怀疑含有抗TNFα药物的自体抗体的至少一种同种型的样品接触,以在经标记的抗TNFα药物、经标记的抗Ig抗体,和每种自体抗体同种型之间形成经标记的复合物(即,免疫复合物或缀合物)(即,其中经标记复合物的组分并非彼此共价附着),其中经标记的抗TNFα药物和经标记的抗Ig抗体包含不同标记;对经标记的复合物进行大小排阻色谱,以将具有不同自体抗体同种型的经标记的复合物彼此分离和/或从游离的经标记的抗TNFα药物分离,和/或从游离的经标记的抗Ig抗体分离;和检测经标记的复合物,从而检测抗TNFα药物的自体抗体的至少一种同种型的存在(或不存在)或水平。在一些实施方式中,抗TNFα药物选自REMICADETM(英夫利昔单抗)、HUMIRATM(阿达木单抗)、ENBRELTM(依那西普)、(塞妥珠单抗)及其组合。在某些实施方式中,方法用于测量来自接受抗TNFα药物疗法的对象的样品(例如全血、血清、或血浆样品)中至少一种、两种、三种、四种、五种或更多抗体同种型的(浓度)水平。在一些情况下,方法用于确定接受抗TNFα药物疗法例如英夫利昔单抗(IFX)的ADA阳性患者中不同抗药物抗体(ADA)同种型,例如ATI(即IFX的抗体;“HACA”)的不同同种型。在其他情况下,方法用于确定接受抗TNFα药物疗法例如阿达木单抗的ADA阳性患者中不同ADA同种型,例如ATA(即阿达木单抗的抗体;“HAHA”)的不同同种型。抗体同种型的非限制性实例包括IgA、IgD、IgE、IgG和IgM。在特别的实施方式中,本发明的方法帮助或辅助根据具体的ADA同种型或ADA同种型的特别的组合的存在或水平,关联接受抗TNFα药物疗法的患者中的不同临床结果。可用多种可检测的基团标记抗TNFα药物或抗体同种型特异性的抗Ig抗体。在特别的实施方式中,抗TNFα药物和/或抗Ig同种型特异性抗体用荧光团或荧光染料标记。可附着至本文所述的抗TNFα药物和抗Ig同种型特异性抗体的适于用作标记的荧光团的非限制性实例包括在MolecularProbesCatalogue中列出的那些荧光团,其出于全部目的以引文整体合并入本文(参见R.Haugland,TheHandbook-AGuidetoFluorescentProbesandLabelingTechnologies,第10版,Molecularprobes,Inc.(2005))。此类示例性荧光团包括但不限于Alexa染料例如Alexa350、Alexa405、Alexa430、Alexa488、Alexa514、Alexa532、Alexa546、Alexa555、Alexa568、Alexa594、Alexa610、Alexa633、Alexa635、Alexa647、Alexa660、Alexa680、Alexa700、Alexa750和/或Alexa790,以及其他荧光团,包括但不限于丹磺酰氯(DNS-Cl)、5-(碘乙酰胺基)荧光素(5-IAF)、荧光素5-异硫氰酸酯(FITC)、四甲基罗丹明-5(和6-)异硫氰酸酯(TRITC)、6-丙烯酰-2-二甲氨基萘(acrylodan)、7-硝基苯-2-氧杂-1,3,-重氮-4-基氯(NBD-Cl)、溴化乙锭、荧光黄、5-羧基罗丹明6G盐酸、丽丝胺若丹明B磺酰氯、TexasRedTM磺酰氯、BODIPYTM、萘胺磺酸(例如1-苯胺基萘-8-磺酸(ANS)、6-对甲苯胺基萘2-磺酸(TNS)等)、Anthroyl脂肪酸、DPH、十八烷四烯酸、TMA-DPH、芴基脂肪酸、荧光素-磷脂酰乙醇胺、TexasRed-磷脂酰乙醇胺、芘基磷脂酰胆碱、芴基磷脂酰胆碱、部花青540、1-(3-磺酸丙基)-4-[β-[2[(二-正-丁氨基)-6萘基]乙烯基]吡啶甜菜碱(萘基苯乙烯)、3,3二丙基硫杂二羰菁(diS-C3-(5))、4-(对二戊基氨基苯乙烯基)-l-甲基吡啶盐(di-5-ASP)、Cy-3碘代乙酰胺、Cy-5-N-羟基琥珀酰亚胺、Cy-7-异硫氰酸盐、若丹明800、IR-125、噻唑橙、天青B、尼罗蓝、Al酞菁、oxaxine1,4’,6-二脒基-2-苯基吲哚(DAPI)、Hoechst33342、TOTO、吖啶橙、乙锭同型二聚体、N(乙氧基羰甲基)-6-甲氧基喹啉盐(MQAE)、Fura-2、钙绿、羧基SNARF-6、BAPTA、香豆素、phytofluor、六苯并苯、金属-配体复合物、700DX、700、800RS、800CW、800、Cy5、Cy5.5、Cy7、DY676、DY680、DY682、DY780及其混合物。额外的适当的荧光团包括酶辅因子;镧系元素、绿色荧光蛋白、黄色荧光蛋白、红色荧光蛋白或其突变体或衍生物。在一个非限制性实例中,多种抗Ig同种型特异性的抗体每种用Alexa-532标记,并且抗TNFα药物用Alexa-488标记。通常,荧光基团是选自包含聚甲炔、酞菁、菁、呫吨、芴、若丹明、香豆素、荧光素和BODIPYTM的染料种类的荧光团。在一个实施方式中,荧光基团是近红外(NIR)荧光团,在约650至约900nm的范围内发射。使用近红外荧光技术在生物测定中是有利的,因为它基本消除或减少来自生物底物的自发荧光的背景。近IR荧光技术的另一益处是来自激发源的散射光大大减少,因为散射强度与波长的四次方倒数成比例。低背景荧光和低散射导致高信噪比,这是高灵敏性检测必需的。此外,生物组织中在近IR区(650nm至900nm)的光学透明窗口使得NIR荧光是需要光透过生物组分的体内成像和亚细胞检测应用的有价值的技术。在此实施方式的方面内,近红外(NIR)荧光团优选地选自700DX、700、800RS、800CW、800、Alexa660、Alexa680、Alexa700、Alexa750、Alexa790、Cy5、Cy5.5、Cy7、DY676、DY680、DY682和DY780。在某些实施方式中,近红外基团是800CW、800、700DX、700或DynomicDY676。荧光标记是用荧光团的化学反应性衍生物完成的。常见的反应性基团包括胺反应性异硫氰酸酯衍生物例如FITC和TRITC(荧光素和若丹明的衍生物)、胺反应性琥珀酰亚胺酯例如NHS-荧光素,和巯基反应性马来酰亚胺活化的荧光素例如荧光素-5-马来酰亚胺,其中许多可商购。这些反应性染料中的任一种与抗TNFα药物或抗Ig同种型特异性抗体的反应导致在荧光团和抗TNFα药物或抗Ig同种型特异性抗体之间形成稳定的共价键。在某些情况下,在荧光标记反应后,通常需要从经标记的靶分子移去任何未反应的荧光团。这通常是利用荧光团和经标记的蛋白之间的大小差异,用大小排阻色谱完成的。反应性荧光染料可从许多来源获得。所获得的它们具有不同的反应性基团,用于附着至靶分子内的多种功能基团。它们也可从含有进行标记反应的所有组分的试剂盒中获得。在一个特别的实施方式中,使用来自Invitrogen的Alexa647C2马来酰亚胺(货号A-20347)。可直接或间接检测抗TNFα药物与抗-TNFα药物的自体抗体同种型的特异性免疫结合,或者抗TNFα药物和抗Ig抗体与自体抗体同种型的特异性免疫结合。直接标记包括附着至抗体的荧光或发光标签、金属、染料、放射核素等。在一些情况下,用碘-125(125I)标记的抗TNFα药物或抗Ig抗体可用于确定样品中一种或多种ADA同种型的存在或浓度水平。在其他情况下,使用化学发光的抗TNFα药物或抗Ig抗体的化学发光测定适于对样品中的ADA同种型进行灵敏的、非放射性检测。在特别的情况下,用荧光染料标记的抗TNFα药物和/或抗Ig抗体也适于确定样品中一种或多种ADA同种型的浓度水平。荧光染料的实例包括但不限于Alexa染料、DAPI、荧光素、Hoechst33258、R-藻青蛋白、B-藻红蛋白、R-藻红蛋白、若丹明、Texasred和丽丝胺。可商购与荧光染料连接的二抗。作为非限制性实例,可从TagoImmunologicals(Burlingame,CA)获得山羊F(ab’)2抗人IgG-FITC。间接标记包括本领域熟知的多种酶,例如辣根过氧化物酶(HRP)、碱性磷酸酶(AP)、β-半乳糖苷酶、脲酶等。可使用辣根过氧化物酶检测系统和生色底物例如,四甲基联苯胺(TMB),它在过氧化氢存在下产生可溶性产物,所述产物可在450nm检测到。可使用碱性磷酸酶检测系统和生色底物例如,对硝基苯基磷酸酯,它产生可在405nm方便地检测的可溶性产物。类似地,可使用β-半乳糖苷酶检测系统和生色底物邻硝基苯基-β-D-吡喃半乳糖苷(ONPG),它产生可在410nm检测的可溶性产物。可使用脲酶检测系统和底物例如尿素-溴甲酚紫(SigmaImmunochemicals;St.Louis,MO)。可从多种市售来源获得与酶连接的有用的二抗,例如可从JacksonImmunoResearch(WestGrove,PA.)购买山羊F(ab’)2抗人IgG-碱性磷酸酶。可分析来自直接或间接标记的信号,例如使用分光光度计检测来自生色底物的颜色;用辐射计数器检测辐射,例如用于检测125I的γ计数器;或用荧光光度计在特定波长的光存在下检测荧光。为检测酶联抗体,可根据生产商的说明使用分光光度计例如EMAX酶标仪(MolecularDevices;MenloPark,CA)对一种或多种ADA同种型的量进行定量分析。如果需要,本发明的测定可自动化或由机器人完成,并且可同时检测来自多个样品的信号。在特别的实施方式中,在本发明的测定中使用大小排阻色谱(SEC)。SEC的基本原理是不同大小的颗粒以不同的速率洗脱(过滤)通过固定相。这导致颗粒溶液基于大小分离。如果所有颗粒同时或接近同时装载,相同大小的颗粒一同洗脱。每个大小排阻柱具有可分离的分子量范围。排阻限制限定了此范围的分子量上限,此时分子过大,不能捕获在固定相中。渗透限制限定了分离范围的分子量下限,此时分子足够小,可以完全渗透入固定相的孔中,并且所有低于此分子量的分子太小以至于他们洗脱为单一条带。在某些实施方式中,洗脱液以恒定的体积,或级分收集。颗粒大小越相似,它们越可能处在同一级分中而不能分别检测。在优选的实施方式中,用光谱技术检测收集的级分,以确定被洗脱的颗粒的浓度。通常,用于本发明的光谱学检测技术包括但不限于荧光测定发、折射指数(RI)和紫外线(UV)。在某些情况下,洗脱体积大体上随着分子流体动力学体积的对数线性地减小(即较重的部分先洗脱)。在一些情况下,存在于样品例如血清样品中的ADA同种型的(浓度)水平可与标准曲线和/或一个或多个对照比较。在某些情况下,可用已知量的抗Ig同种型特异性抗体在液相反应中孵育经标记的抗TNFα以产生标准曲线。在某些情况下,本发明的自体抗体同种型分型方法基于临近,它们依赖于经标记的抗TNFα药物和经标记的抗Ig同种型特异性抗体与自体抗体同种型临近结合所产生的信号。在特别的实施方式中,通过临近测定产生的信号是荧光信号,所述信号可用荧光共振能量转移(FRET)检测到。在其他实施方式中,信号是用如本文所述或本领域技术人员已知的其他基于临近的方法检测的。在一些情况下,多种经标记的不同抗体同种型特异性的抗Ig抗体各自包含相同的标记。在其他情况下,多种经标记的不同抗体同种型特异性的抗Ig抗体各自包含不同的标记。本领域技术人员将理解,结合特别的抗体类或亚类(例如IgA、IgD、IgE、IgG或IgM同种型,或其Ig亚类例如IgG1、IgG2、IgG3和/或IgG4)的抗IgG抗体可从供货商例如MiltenyiBiotecGmbH、JacksonImmunoResearchLaboratories,Inc.、SantaCruzBiotechnology,Inc.、Abcamplc等购得。在某些情况下,抗Ig抗体检测特别的Ig亚类(例如IgG1、IgG2、IgG3或IgG4)。在某些其他情况下,抗Ig抗体检测所有Ig亚类(例如IgG1、IgG2、IgG3和IgG4)。例如,抗IgA抗体(例如来自克隆IS11-8E10,其检测人IgA的全部两个亚类)、抗IgG抗体(例如来自克隆IS11-3B2.2.3,其检测人IgG同种型的全部亚类),和抗IgM抗体(例如来自克隆PJ2-22H3,其检测人IgM同种型)可从MiltenyiBiotecGmbH获得并通过用本文说明的和本领域技术人员已知的方法向其附着可检测标记(例如荧光团)而进行标记。在一些情况下,包含氨基反应性AlexaFluor染料(例如AlexaFluor琥珀酰(NHS)酯和/或AlexaFluor四氟苯基(TFP)酯)的来自LifeTechnologies的分子探针试剂盒,例如AlexaFluor蛋白质标记试剂盒和AlexaFluor单克隆标记试剂盒可用于选择性地将AlexaFluor染料连接到抗体上可接近的伯胺基团。如本文所用的术语“临近”指当抗TNFα药物与抗Ig同种型特异性抗体当都结合于同一自体抗体同种型(即抗药物抗体同种型例如IgAATI)时,抗TNFα药物与抗Ig同种型特异性抗体空间上的接近或靠近。在特别的实施方式中,抗TNFα药物与自体抗体同种型的结合与抗Ig同种型特异性抗体与同一自体抗体同种型的结合处于接近或靠近的距离,所述距离足以产生可检测信号。在一些实施方式中,术语“临近”包括当结合于同一自体抗体同种型,足以产生可检测信号的经标记的抗体之间的距离。在其他一些实施方式中,术语“临近”包括附着到结合于同一自体抗体同种型的抗体的可检测标记(例如荧光标记)之间的距离,所述距离足以产生可检测信号。FRET描述了两个荧光分子之间的能量转移机制。当荧光供体在其特异性荧光激发波长被激发时,此激发态通过长范围偶极子-偶极子耦合机制被非放射性地转移给第二个分子,受体。供体随后回到电子基态。参见例如Lakowicz,PrinciplesofFluorescenceSpectroscopy,PlenumPublishingCorp.,第二版(1999)。在本发明的背景下,抗TNFα药物(例如IFX)可用包含第一荧光染料的供体标记,而抗Ig同种型特异性抗体(例如抗IgA、抗IgG)可用包含具有与第一荧光染料不同的激发和发射光谱的第二荧光染料的受体标记。上文描述了适于用作可检测标记的荧光染料的非限制性实例,包括荧光团例如Alexa染料(例如Alexa350、Alexa405、Alexa430、Alexa488、Alexa514、Alexa532、Alexa546、Alexa555、Alexa568、Alexa594、Alexa610、Alexa633、Alexa635、Alexa647、Alexa660、Alexa680、Alexa700、Alexa750和/或Alexa790)和其他荧光团,例如荧光素、FITC、若丹明、TexasRed、TRITC、Cy3、Cy5、Cy5.5、Cy7、其衍生物及其组合。在一些实施方式中,将待接受检测自体抗体同种型(即抗TNFα药物的自体抗体的同种型)的存在(或不存在)或水平的样品例如血清样品与经标记的抗TNFα药物和经标记的抗Ig同种型特异性抗体孵育。如果用特定抗Ig同种型特异性抗体(例如抗IgA)检测的自体抗体同种型(例如IgAADA)不存在于样品中,在供体激发后检测到供体发射。另一方面,如果用特定抗Ig同种型特异性抗体(例如抗IgA)检测的自体抗体同种型(例如IgAADA)存在于样品中,供体和受体荧光团由于经标记的抗TNFα药物和特别的经标记的抗Ig同种型特异性抗体与自体抗体同种型(例如IgAATI)的相互作用而进入临近(例如,彼此从约1至约300nm或从约1至约200nm,例如约1、5、10、25、50、75、100、125、150、175、200、225、250、275、300nm或其任何范围,或从约1至约10nm,例如约1、2、3、4、5、6、7、8、9、或10nm或其任何范围)。从供体荧光团到受体荧光团的分子间FRET导致主要观察到受体发射。例如,在480nm激发作为抗TNFα药物上的供体荧光团的Alexa-488诱导形成单线态氧分子,其与二甲基噻吩(thioxene)衍生物反应,产生化学发光,所述化学发光转而激发抗Ig同种型特异性抗体上的受体荧光团Alexa-532以在575nm发射。实施例29描述了示例性的本发明的基于临近的同种型分型测定,用于使用FRET确定至少一种、两种、三种、四种、五种或更多种ATI同种型,例如,IgAATI、IgDATI、IgEATI、IgGATI和/或IgMATI同种型的存在(或不存在)或水平。作为非限制性实例,将用第一荧光团(“F1”)标记的IFX和用第二荧光团(“F2”)标记的抗IgA抗体与含有一种或多种ATI同种型(例如IgAATI)的样品(例如血清样品)孵育。在一些实施方式中,只有当两个荧光团处于紧密临近时,F2才被F1激发,并且F1-IFX,F2-抗-IgA和IgAATI的三元复合物的存在和/或水平指示了样品中存在的IgAATI同种型的存在和/或水平。在其他实施方式中,由自体抗体同种型分型临近测定产生的信号是荧光信号,其可用电泳技术(例如毛细管电泳(CE))检测。CE分析通常在小直径石英毛细管内在高(千伏水平)分离电压进行,分离时间为数分钟。在本发明的背景下,抗TNFα药物(例如IFX)可用可光活化酶促剪刀标记,而抗Ig同种型特异性抗体(例如抗IgA、抗IgD、抗IgE、抗IgG和/或抗IgM)可用电泳标签报告物标记。可光活化酶促剪刀和电泳标签报告物的非限制性实例是例如美国专利号6,673,550中说明的eTagTM家族小荧光报告物分子。经标记的抗TNFα药物与自体抗体同种型(例如IgAATI)结合与经标记的抗Ig同种型特异性抗体与同一自体抗体同种型的结合临近(例如,彼此从约1至约300nm或从约1至约200nm,例如约1、5、10、25、50、75、100、125、150、175、200、225、250、275、300nm或其任何范围,或从约1至约10nm,例如约1、2、3、4、5、6、7、8、9、或10nm或其任何范围)引发可光活化酶促剪刀切割电泳标签报告物。在光活性切割后,释放的电泳标签报告物分子用CE分离分析,如例如Chan-Hui等人,Clin.Immun.,111:162-174(2004)中所述。备选地,抗TNFα药物可用电泳标签报告物标记,而抗Ig同种型特异性抗体可用可光活化酶促剪刀标记。在一些实施方式中,可将多种电泳标签报告物附着至多种不同的抗Ig同种型特异性抗体,并用于多重测定以确定多种目标自体抗体同种型的存在(或不存在)或水平。还在其他实施方式中,由自体抗体同种型分型临近测定产生的信号是DNA扩增信号,其可用核酸扩增技术例如聚合酶链式反应(PCR)检测。PCR用于扩增核酸在本领域众所周知,并在例如Mullis等人,ThePolymeraseChainReaction,Boston(1994);和Innis等人,PCRApplications:ProtocolsforFunctionalGenomics,第1版,AcademicPress(1999)中说明。在本发明的背景下,抗TNFα药物(例如IFX)可用第一寡核苷酸延伸标记,而抗Ig同种型特异性抗体(例如抗IgA、抗IgD、抗IgE、抗IgG和/或抗IgM)可用第二寡核苷酸延伸标记。如果用特别的抗Ig同种型特异性抗体(例如抗IgA)检测的自体抗体同种型(例如IgAATI)不存在于样品中,连接体寡核苷酸独立地与每个寡核苷酸延伸杂交,这不促使其连接。另一方面,如果用特别的抗Ig同种型特异性抗体(例如抗IgA)检测的自体抗体同种型(例如IgAATI)存在于样品中,经标记的抗TNFα药物与自体抗体同种型(例如IgAATI)结合与经标记的抗Ig同种型特异性抗体与同一自体抗体同种型的结合临近(例如,彼此从约1至约300nm或从约1至约200nm,例如约1、5、10、25、50、75、100、125、150、175、200、225、250、275、300nm或其任何范围,或从约1至约10nm,例如约1、2、3、4、5、6、7、8、9、或10nm或其任何范围)使得连接子寡核苷酸能同时与两个寡核苷酸延伸杂交,从而引发通过DNA连接酶连接寡核苷酸延伸。本领域技术人员将认识到,抗TNFα药物与抗Ig同种型特异性抗体的临近可根据寡核苷酸延伸的长度而不同。因此,产生了之前不存在于反应中的新种类的DNA序列,它可用标准DNA扩增技术例如PCR扩增。寡核苷酸延伸和连接体寡核苷酸通常是用本领域已知的任何方法化学合成的,并独立地包含至少约10、15、20、25、30、35、40、45、50、55或60个核苷酸长度的核苷酸序列。在其他实施方式中,由自体抗体同种型分型临近测定产生的信号是化学发光信号或荧光信号,所述化学发光信号或荧光信号可用信号放大例如酪胺信号放大检测。在本发明的背景下,抗TNFα药物(例如IFX)可用葡萄糖氧化酶(GO)或催化涉及分子氧(O2)作为电子受体的氧化/还原反应的任何其他酶标记。抗Ig同种型特异性抗体(例如抗IgA、抗IgD、抗IgE、抗IgG和/或抗IgM)可用过氧化物酶例如辣根过氧化物酶(HRP),例如直接地或通过结合成对成员例如生物素/链霉亲和素间接地标记。过氧化物酶的其他实例包括但不限于过氧化氢酶、氯化物过氧化物酶、细胞色素c过氧化物酶、嗜曙红细胞过氧化物酶、谷胱甘肽过氧化物酶、乳过氧化物酶、髓过氧化物酶、甲状腺过氧化物酶、脱碘酶等。当GO与底物例如葡萄糖接触时,它产生氧化剂(即过氧化氢(H2O2))。如果用特别的抗Ig同种型特异性抗体(例如抗IgA)检测的自体抗体同种型(例如IgAATI)存在于样品中,经标记的抗TNFα药物与自体抗体同种型(例如IgAATI)结合与经标记的抗Ig同种型特异性抗体与同一自体抗体同种型的结合临近(例如,彼此从约1至约300nm或从约1至约200nm,例如约1、5、10、25、50、75、100、125、150、175、200、225、250、275、300nm或其任何范围,或从约1至约10nm,例如约1、2、3、4、5、6、7、8、9、或10nm或其任何范围)使得由GO产生的H2O2能传递到HRP并与其复合形成HRP-H2O2复合物,所述复合物在化学发光底物(例如鲁米诺、异鲁米诺)或荧光底物(例如酪胺、生物素-酪胺、高香草酸、4-羟基苯乙酸)存在下产生放大的信号。在临近测定中使用GO和HRP的方法在例如PCT专利公开号WO2008/036802中说明,其公开内容出于所有目的以引文整体合并入本文。当生物素-酪胺被用作荧光底物时,HRP-H2O2复合物氧化酪胺,产生反应性酪胺自由基,所述反应性酪胺自由基与附近的亲核残基共价结合。直接检测活化的酪胺或在加入信号检测试剂(例如经链霉亲和素标记的荧光团或经链霉亲和素标记的过氧化酶与生色试剂的组合)后间接检测。适用于本发明的荧光团的实例包括但不限于本文说明的任何荧光团,包括Alexa染料(例如Alexa350、Alexa405、Alexa430、Alexa488、Alexa514、Alexa532、Alexa546、Alexa555、Alexa568、Alexa594、Alexa610、Alexa633、Alexa635、Alexa647、Alexa660、Alexa680、Alexa700、Alexa750和/或Alexa790)、荧光素、异硫氰酸荧光素(FITC)、OregonGreenTM、若丹明、Texasred、异硫氰酸四若丹明(TRITC)、CyDyeTMfluor(例如Cy2、Cy3、Cy5)。链霉亲和素标记可用本领域众所周知的方法直接或间接偶联到荧光团或过氧化物酶。生色试剂的非限制性实例包括3,3′,5,5′-四甲基联苯胺(TMB)、3,3′-二氨基联苯胺(DAB)、2,2’-连氮基-双(3-乙基苯并噻唑啉-6-磺酸)(ABTS)、4-氯-1-萘酚(4CN)和/或卟啉原。适于本发明的自体抗体同种型分型测定方法的额外的基于临近的技术在PCT专利公开号WO2008/036802中描述,其公开内容在各方面以引文整体并入本文。检测抗TNF抗体和抗药物抗体例如HACA和HAHA的方法在PCT公开号WO2011/056590中进一步说明,其公开内容在各方面以引文整体并入本文。在另一个方面,本发明提供优化疗法和/或降低接受用于治疗TNFα介导的疾病或病症的疗程的对象中毒性的方法,此方法包括:(a)分析从对象获得的样品,以确定样品中一种或多种标志物的存在、水平或基因型;(b)对步骤(a)中一种或多种标志物的存在、水平或基因型使用统计算法;和(c)基于步骤(b)中使用的统计算法,为对象确定疗程随后的剂量或是否应当向对象使用不同的疗程。在一些实施方式中,疗程包含抗TNFα药物例如抗TNFα抗体。在某些情况下,抗TNFα药物选自REMICADETM(英夫利昔单抗)、ENBRELTM(依那西普)、HUMIRATM(阿达木单抗)、(赛妥珠单抗)及其组合。在一些实施方式中,一种或多种(例如多种)标志物包含抗TNFα药物(例如抗TNFα抗体)、抗TNFα药物例如抗TNFα抗体的自体抗体(例如HACA、HAHA、HAMA和/或其同种型)、细胞因子、遗传标志物或其组合。在某些情况下,细胞因子是选自由TNFα、IL-6、IL-1β、IFN-γ、IL-10及其组合组成的组的成员。在某些其他情况下,遗传标志物是炎性途径基因中的突变。在特别的实施方式中,遗传标志物是选自NOD2/CARD15、ATG16L1、IL23R、人白细胞抗原(HLA)基因、细胞因子基因、DLG5、OCTN及其组合的基因中的突变。在其他实施方式中,优化疗法和/或降低毒性的方法的步骤(a)包括确定所述样品中两种、三种、四种、五种、六种、七种、八种、九种、十种或更多种标志物的存在、水平或基因型。在某些实施方式中,样品选自血清、血浆、全血和粪便。在其他实施方式中,统计算法包含学习统计分类器系统。在某些情况下,学习统计分类器系统选自随机森林、分类回归树、提升树、神经网络、支持向量机、一般卡方自动相互作用检测模型、交互树、多元自适应回归样条、机器学习分类器及其组合。在一些实施方式中,统计算法包含单个学习统计分类器系统。在其他实施方式中,统计算法包含至少两个学习统计分类器系统的组合。在一些情况下,至少两个学习分类器系统串联应用。在一些实施方式中,优化疗法和/或降低毒性的方法还包括将来自步骤(c)的所述决定的结果发送给临床医生。在其他实施方式中,优化疗法和/或降低毒性的方法的步骤(b)还包括向在疗程期间的早期确定的一种或多种标志物的存在、水平或基因型应用统计算法。在其他实施方式中,基于步骤(b)中应用的统计算法增加、减少或维持疗程随后的剂量。在某些情况下,不同的疗程包含不同的抗TNFα药物(例如抗TNFα抗体)。在其他情况下,不同的疗程包含现有疗程连同免疫抑制剂。在一些实施方式中,用测定检测抗TNFα药物(例如抗TNFα抗体),所述测定包括:(a)将经标记的TNFα与样品接触,以与抗TNFα药物形成经标记的复合物;(b)对经标记的复合物进行大小排阻色谱以分离经标记的复合物;和(c)检测经标记的复合物,从而检测抗TNFα药物。在某些情况下,抗TNFα药物(例如抗TNFα抗体)是选自REMICADETM(英夫利昔单抗)、ENBRELTM(依那西普)、HUMIRATM(阿达木单抗)、(赛妥珠单抗)及其组合所组成的组的成员。在一些情况下,经标记的TNFα是荧光团标记的TNFα。在其他情况下,对检测的抗TNFα药物(例如抗TNFα抗体)进行定量。在一些实施方式中,经标记的复合物先被洗脱,然后是游离的经标记的TNFα。在其他实施方式中,大小排阻色谱是大小排阻高效液相色谱(SE-HPLC)。在其他实施方式中,用测定检测抗TNFα药物(例如抗TNFα抗体)自体抗体,所述测定包括:(a)将经标记的抗TNFα药物与样品接触,以与自体抗体形成经标记的复合物;(b)对经标记的复合物进行大小排阻色谱以分离经标记的复合物;和(c)检测经标记的复合物,从而检测自体抗体。在某些情况下,自体抗体选自人抗小鼠抗体(HAMA)、人抗嵌合抗体(HACA)、人抗人源化抗体(HAHA)及其组合。在其他一些情况下,经标记的抗TNFα药物(例如抗TNFα抗体)选自REMICADETM(英夫利昔单抗)、ENBRELTM(依那西普)、HUMIRATM(阿达木单抗)、(赛妥珠单抗)及其组合。在一些实施方式中,经标记的抗TNFα药物(例如抗TNFα抗体)是荧光团标记的抗TNFα药物(例如抗TNFα抗体)。在其他实施方式中,对检测的自体抗体进行定量。在其他实施方式中,经标记的复合物首先被洗脱,然后是游离的经标记的抗TNFα药物(例如抗TNFα抗体)。在具体实施方式中,大小排阻色谱是大小排阻高效液相色谱(SE-HPLC)。在某些实施方式中,使用本文描述的用于检测抗TNFα药物的自体抗体的至少一种同种型的存在(或不存在)或水平的任何测定检测抗TNFα药物(例如抗TNFα抗体)的自体抗体。在其他实施方式中,PCT公开号WO2011/056590(其公开内容在各方面以引文整体并入本文)中描述的用于检测抗TNFα药物(例如抗TNFα抗体)和抗TNFα药物的自体抗体(例如HACA、HAHA、HAMA等)的测定方法可用于本文描述的用于优化疗法和/或降低毒性的方法。在某些实施方式中,本发明的方法提供用于指导接受抗TNF药物疗法的患者的治疗决定的信息,例如,通过确定何时或如何调整或修改(例如增加或减少)随后的抗TNF药物的剂量、通过确定何时或如何组合抗TNF药物(例如以增加、减少或相同的剂量)与一种或多种免疫抑制剂例如甲氨蝶呤(MTX)或硫唑嘌呤(AZA),和/或通过确定何时或如何改变现有疗程(例如换用不同的抗TNF药物)。因此,本发明用于通过确定患者免疫状态,帮助或辅助患者管理。在其他实施方式中,本文描述的测定方法可用于预测对抗TNF药物,特别是对具有自身免疫病症(例如类风湿性关节炎、克罗恩病等)的对象中的抗TNFα抗体的耐受性(例如毒性)。在此方法中,通过测定对象中一种或多种ADA同种型的存在(或不存在)或水平,可预测对象是否会耐受抗TNF药物疗法(例如不发生或经历副作用例如对抗TNF药物的免疫应答)。在其他实施方式中,本文说明的测定方法可用于监测患有自身免疫病症的对象中的自身免疫病症,包括测定对象中一种或多种ADA同种型的存在(或不存在)或水平。在此方法中,可监测对象在给定的时间段中是否耐受抗TNF药物疗法。IV.统计分析在一些方面,本发明提供通过向一种或多种(例如两种、三种、四种、五种、六种、七种或更多的组合)生化标志物、血液学标志物和/或遗传标志物应用统计算法,用于优化抗TNF药物疗法、降低与抗TNF药物疗法相关的毒性和/或监测抗TNF药物疗法效力的方法。在特别的实施方式中,向一种或多种标志物的存在、水平和/或基因型应用分位数分析,以指导接受抗TNF药物疗法的患者的治疗决定。在其他实施方式中,向一种或多种标志物的存在、水平和/或基因型应用一种或两种或更多学习统计分类器系统的组合,以指导接受抗TNF药物疗法的患者的治疗决定。本发明方法的统计分析为确定何时或如何调整或修改(例如增加或减少)随后的抗TNF药物的剂量、组合抗TNF药物(例如以增加、减少或相同的剂量)与一种或多种免疫抑制剂例如甲氨蝶呤(MTX)或硫唑嘌呤(AZA)和/或改变现有疗程(例如换用不同的抗TNF药物)有利地提供改善的灵敏性、特异性、阴性预测值、阳性预测值和/或总体精确度。术语“统计分析”或“统计算法”或“统计方法”包含任何用于确定变量之间关系的多种统计方法和模型。在本发明中,变量是至少一个目标标志物的存在、水平或基因型。用本文描述的统计分析可分析任何数量的标志物。例如,可在统计分析中包括1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60或更多种标志物的存在或水平。在一个实施方式中,使用逻辑回归。在另一个实施方式中,使用线性回归。在某些优选的实施方式中,本发明的统计分析包含一种或多种标志物的分位数测量,例如在给定群体内,作为变量。分位数是将数据样品分为含有(尽可能)相等数量的观察值的组的一系列“分隔点”。例如,四分位数是将数据样品分为含有(尽可能)相等数量的观察值的四个组的值。下四分位数是排序的数据组从小到大四分之一位置的数据值;上四分位数是数据组从大到小四分之一位置的数据值。五分位数是将数据样品分为含有(尽可能)相等数量观察值的五个组的值。本发明也包含使用标志物水平的百分位数范围(例如三分位数、四分位数、五分位数等)或其累计指数(例如标志物水平的四分位数和以获得四分位数和打分(QSS)等)作为统计分析中的变量(视作连续变量)。在一些实施方式中,本发明涉及用四分位数分析检测或确定一个或多个目标标志物的存在、水平(例如数量级)和/或基因型。在此类统计分析中,相对于样品的参考数据库,目标标志物的水平被定义为处于第一四分位数(<25%)、第二四分位数(25-50%)、第三四分位数(51%-<75%)或第四四分位数(75-100%)。这些四分位数可分别被指定为1、2、3和4的四分位数得分。在一些情况下,未在样品中检测到的标志物被指定为0或1的四分位数得分,而在样品中检测到(例如存在)的标志物(例如样品是标志物阳性的)被指定为4的四分位数得分。在一些实施方式中,四分位数1代表具有最低标志物水平的样品,而四分位数4代表具有最高标志物水平的样品。在其他实施方式中,四分位数1代表具有特别的标志物基因型(例如野生型等位基因),而四分位数4代表具有另一特别的标志物基因型(例如等位基因变体)。样品的参考数据库可包含大量患有TNFα介导的疾病或病症例如IBD的患者。可从此类数据库建立四分位数截断值。适用于本发明的四分位数分析的非限制性实例在例如Mow等人,Gastroenterology,126:414-24(2004)中描述。在一些实施方式中,本发明的统计分析包含一个或多个学习统计分类器系统。如本文所用,术语“学习统计分类器系统”包含能适应复杂数据集(例如目标标志物组)并根据此类数据集作出决定的机器学习算法技术。在一些实施方式中,使用单个机器学习统计分类器系统,例如决定/分类树(例如随机森林(RF)或分类和回归树(C&RT))。在其他实施方式中,使用2、3、4、5、6、7、8、9、10或更多个学习统计分类器系统的组合,优选地串联使用。学习统计分类器系统的实例包括但不限于使用归纳学习(例如决定/分类树,如随机森林、分离和回归树(C&RT)、提升树等)、可能近似正确(PAC)学习、联结主义学习(例如神经网络(NN)、人工神经网络(ANN)、神经模糊网络(NFN)、网络结构、感知器例如多层感知器、多层前馈网络、神经网络的应用、信念网络中贝式学习等)、增强式学习(例如已知环境中被动学习例如朴素学习、适应性动态学习和时间差分学习、未知环境中被动学习、未知环境中主动学习、学习动作-值函数、增强式学习的应用等)以及遗传算法和进化规划的学习统计分类器系统。其他学习统计分类器系统包括支持向量机(例如Kernel方法)、多元适应性回归样条(MARS)、Levenberg-Marquardt算法、Gauss-Newton算法、混合高斯算法、梯度下降算法和学习向量量化(LVQ)。随机森林是用由LeoBreiman和AdeleCutler开发的算法构建的学习统计分类器系统。随机森林使用大量个体决定树,并通过选择由个体树决定的类的模(即最常见的)决定类。可用例如可从SalfordSystems(SanDiego,CA)获得的RandomForests软件进行随机森林分析。随机森林的说明参见例如Breiman,MachineLearning,45:5-32(2001);和http://stat-www.berkeley.edu/users/breiman/RandomForests/cchome.htm。分类和回归树代表拟合经典回归模型的计算机密集型替代,通常用于基于一个或多个预测值确定目标的类或连续响应的最可能模型。可用例如可从SalfordSystems获得的C&RT软件或可从StatSoft,Inc.(Tulsa,OK)获得的Statistica数据分析软件进行分类和回归树分析。分类和回归树的说明参见例如Breiman等人“ClassificationandRegressionTrees,”ChapmanandHall,NewYork(1984);和Steinberg等人,“CART:Tree-StructuredNon-ParametricDataAnalysis,”SalfordSystems,SanDiego,(1995)。神经网络是相互连接的人工神经元组,使用数学或计算模型基于联结主义方法计算进行信息处理。通常,神经网络是适应性的系统,基于流过网络的外部或内部信息改变其结构。神经网络的具体实例包括前馈神经网络,例如感知器、单层感知器、多层感知器、反向传播网络、ADALINE网络、MADALINE网络、学习矩阵网络、径向基函数(RBF)网络和自组织映射或Kohonen自组织网络;递归神经网络,例如简单递归网络和Hopfield网络;随机神经网络,例如Boltzmann机器;模块神经网络,例如委员会机器和联合神经网络;以及其他类型的网络,例如即时训练神经网络、脉冲神经网络、动态神经网络和级联神经网络。可用例如可从StatSoft,Inc.获得的Statistica数据分析软件进行神经网络分析,对神经网络的说明参见例如Freeman等人,In“NeuralNetworks:Algorithms,ApplicationsandProgrammingTechniques,”Addison-WesleyPublishingCompany(1991);Zadeh,InformationandControl,8:338-353(1965);Zadeh,“IEEETrans.onSystems,ManandCybernetics,”3:28-44(1973);Gersho等人,In“VectorQuantizationandSignalCompression,”KluywerAcademicPublishers,Boston,Dordrecht,London(1992)和Hassoun,“FundamentalsofArtificialNeuralNetworks,”MITPress,Cambridge,Massachusetts,London(1995)。支持向量机是一组相关的受监督的学习技术,用于分类和回归,并在例如Cristianini等人,“AnIntroductiontoSupportVectorMachinesandOtherKernel-BasedLearningMethods,”CambridgeUniversityPress(2000)中描述。支持向量机分析可用例如由ThorstenJoachims(CornellUniversity)开发的SVMlight软件或用由Chih-ChungChang和Chih-JenLin(NationalTaiwanUniversity)开发的LIBSVM软件进行。本文说明的多种统计方法和模型可用来自健康个体和患有TNFα介导的疾病或病症例如IBD(例如CD和/或UC)的患者的样品组(例如血液学和/或基因组样品)训练和测试。例如,来自由医生,优选地胃肠病医生使用活组织检查、结肠镜检查或如美国专利号6,218,129所述的免疫测定诊断为患有IBD或其临床亚型的患者的样品适用于训练和测试本发明的统计方法和模型。来自被诊断为患有IBD的患者的样品也可用例如美国专利号5,750,355和5,830,675中描述的免疫测定分级为克罗恩病或溃疡性结肠炎。来自健康个体的样品可包含未被鉴定为IBD样品的样品。本领域技术人员知道获得可用于训练和测试本发明的统计方法和模型的患者样品组的额外的技术和诊断标准。如本文所用,术语“灵敏性”包含当样品为阳性,例如具有预测的对抗TNF药物疗法的治疗响应或与抗TNF药物疗法相关的毒性时,本发明的用于优化抗TNF药物疗法,降低与抗TNF药物疗法相关的毒性和/或监测抗TNF药物疗法的方法给出阳性结果的概率。灵敏性是用真阳性结果数除以阳性结果和假阴性结果的总和计算的。灵敏性实质上是本发明正确鉴定具有预测的对抗TNF药物疗法的治疗响应或与抗TNF药物疗法相关的毒性的患者与没有预测的治疗响应或毒性的患者的优良度的度量。可选择统计方法和模型,使得灵敏性为至少约60%,可以是例如至少约65%、70%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。术语“特异性”包含当样品不是阳性,例如不具有预测的对抗TNF药物疗法的治疗响应或与抗TNF药物疗法相关的毒性时,本发明的用于优化抗TNF药物疗法,降低与抗TNF药物疗法相关的毒性和/或监测抗TNF药物疗法的方法给出阴性结果的概率。特异性是用真阴性结果数除以阴性结果和假阳性结果的总和计算的。特异性实质上是本发明从有预测的治疗响应或毒性的患者中正确排除不具有预测的对抗TNF药物疗法的治疗响应或与抗TNF药物疗法相关的毒性的患者的优良度的度量。可选自统计方法和模型,使得特异性为至少约60%,可以是例如至少约65%、70%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。术语“阴性预测值”或“NPV”包含被鉴定为不具有预测的对抗TNF药物疗法的治疗响应或与抗TNF药物疗法相关的毒性的个体实际上不具有预测的治疗响应或毒性的概率。阴性预测值可用真阴性结果数除以真阴性和假阴性结果的总和计算。阴性预测值是由本发明的方法的特征以及分析的群体中疾病的患病率确定的。可选择统计方法和模型,使得具有疾病患病率的群体中的阴性预测值在约70%至约99%的范围,并且可以是例如至少约70%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。术语“阳性预测值”或“PPV”包含被鉴定为具有预测的对抗TNF药物疗法的治疗响应或与抗TNF药物疗法相关的毒性的个体实际上具有预测的治疗响应或毒性的概率。阳性预测值可用真阳性结果数除以真阳性和假阳性结果的总和计算。阳性预测值是由本发明的方法的特征以及分析的群体中疾病的患病率确定的。可选择统计方法和模型,使得具有疾病患病率的群体中的阳性预测值在约70%至约99%的范围,并且可以是例如至少约70%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。预测值,包括阴性和阳性预测值受分析的群体中疾病的流行的影响。在本发明中,统计方法和模型可被选择,以对具有TNFα介导的疾病或病症例如IBD的特定的患病率的临床群体产生所需临床参数。作为非限制性实例,统计方法和模型可被选择,用于至多约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%或70%的IBD患病率,这可在例如临床医生的办公室,例如胃肠病医生的办公室,或全科医生的办公室看到。如本文所用,术语“总体一致”或“总体准确度”包含本发明的方法优化抗TNF药物疗法,降低与抗TNF药物疗法相关的毒性,和/或监测抗TNF药物疗法的效力的准确度。总体准确度是用真阳性结果和真阴性结果的总和除以样品结果总数计算的,并受分析的群体中疾病的患病率影响。例如,统计方法和模型可被选择,使得具有疾病患病率的患者群体中总体准确度为至少约40%,可以是例如至少约40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。多种炎性标志物,包括生化标志物、血液学标志物、蛋白标志物、遗传标志物和其他临床或回波描记特征,适用于本发明的优化疗法,降低毒性,和/或监测用治疗剂例如生物制剂(例如抗TNF药物)治疗的效力的方法。在一些方面,本文说明的方法利用确定一种或多种炎性标志物的存在、浓度水平和/或基因型的算法(例如统计分析)的应用帮助或辅助优化抗TNF药物疗法,降低与抗TNF药物疗法相关的毒性,或监测用抗TNF药物治疗的效力。炎性标志物的非限制性实例包括:(i)生化、血液学和蛋白标志物,例如细胞因子、急性期蛋白、细胞粘附分子及其组合;和(ii)遗传标志物,例如任何表1中列出的基因(例如NOD2)。A.细胞因子确定样品中至少一种细胞因子的存在或水平在本发明中特别有用。如本文所用,术语“细胞因子”包含由免疫细胞分泌,调控多种免疫系统功能的多种多肽或蛋白中的任一种,并涵盖小细胞因子例如趋化因子。术语“细胞因子”也包含脂肪细胞因子,其包含由脂肪细胞分泌,在例如调控体重、造血作用、血管生成、创伤愈合、胰岛素耐受、免疫应答和炎性反应中起作用的细胞因子的组。在一些方面,在样品中确定包括但不限于TNF-α、TNF相关弱凋亡诱导因子(TWEAK)、骨保护素(OPG)、IFN-α、IFN-β、IFN-γ、IL-1α、IL-1β、IL-1受体拮抗剂(IL-1ra)、IL-2、IL-4、IL-5、IL-6、可溶性IL-6受体(sIL-6R)、IL-7、IL-8、IL-9、IL-10、IL-12、IL-13、IL-15、IL-17、IL-23和IL-27的至少一种细胞因子的存在或水平。在其他一些方面,在样品中确定至少一种趋化因子,例如CXCL1/GRO1/GROα、CXCL2/GRO2、CXCL3/GRO3、CXCL4/PF-4、CXCL5/ENA-78、CXCL6/GCP-2、CXCL7/NAP-2、CXCL9/MIG、CXCL10/IP-10、CXCL11/I-TAC、CXCL12/SDF-1、CXCL13/BCA-1、CXCL14/BRAK、CXCL15、CXCL16、CXCL17/DMC、CCL1、CCL2/MCP-1、CCL3/MIP-1α、CCL4/MIP-1β、CCL5/RANTES、CCL6/C10、CCL7/MCP-3、CCL8/MCP-2、CCL9/CCL10、CCL11/Eotaxin、CCL12/MCP-5、CCL13/MCP-4、CCL14/HCC-1、CCL15/MIP-5、CCL16/LEC、CCL17/TARC、CCL18/MIP-4、CCL19/MIP-3β、CCL20/MIP-3α、CCL21/SLC、CCL22/MDC、CCL23/MPIF1、CCL24/Eotaxin-2、CCL25/TECK、CCL26/Eotaxin-3、CCL27/CTACK、CCL28/MEC、CL1、CL2和CX3CL1的存在或水平。在其他一些方面,在样品中确定包括但不限于瘦素、脂联素、抵抗素、活性或总血浆酶原活化因子抑制剂-1(PAI-1)、内脂素和视黄醇结合蛋白4(RBP4)的至少一个脂肪细胞因子的存在或水平。优选地,确定TNFα、IL-6、IL-1β、IFN-γ,和/或IL-10的存在或水平。在一些情况下,用测定,例如杂交测定或基于扩增的测定,在mRNA表达水平检测特别的细胞因子的存在或水平。在其他一些情况下,用例如免疫测定(例如ELISA)或免疫组化测定在蛋白质表达水平检测特别的细胞因子的存在或水平。确定血清、血浆、唾液或尿液样品中细胞因子例如IL-6、IL-1β或TWEAK的存在或水平的适当的ELISA试剂盒可从例如R&DSystems,Inc.(Minneapolis,MN)、NeogenCorp.(Lexington,KY)、AlpcoDiagnostics(Salem,NH)、AssayDesigns,Inc.(AnnArbor,MI)、BDBiosciencesPharmingen(SanDiego,CA)、Invitrogen(Camarillo,CA)、Calbiochem(SanDiego,CA)、CHEMICONInternational,Inc.(Temecula,CA)、AntigenixAmericaInc.(HuntingtonStation,NY)、QIAGENInc.(Valencia,CA)、Bio-RadLaboratories,Inc.(Hercules,CA)和/或BenderMedSystemsInc.(Burlingame,CA)获得。人IL-6多肽序列在例如Genbank登录号NP_000591中给出。人IL-6mRNA(编码)序列在例如Genbank登录号NM_000600中给出。本领域技术人员将认识到,IL-6也称为干扰素β2(IFNB2)、HGF、HSF和BSF2。人IL-1β多肽序列在例如Genbank登录号NP_000567中给出。人IL-1βmRNA(编码)序列在例如Genbank登录号NM_000576中给出。本领域技术人员将认识到IL-1β也称为IL1F2和IL-1β。人TWEAK多肽序列在例如Genbank登录号NP_003800和AAC51923中给出。人TWEAK多肽序列在例如Genbank登录号NM_003809和BC104420中给出。本领域技术人员将认识到,TWEAK也称为肿瘤坏死因子配体超家族成员12(TNFSF12)、APO3配体(APO3L)、CD255、DR3配体、生长因子诱导蛋白14(Fn14)配体,和UNQ181/PRO207。B.急性期蛋白确定样品中一种或多种急性期蛋白的存在或水平在本发明中特别有用。急性期蛋白是其血浆浓度响应炎症而增加(阳性急性期蛋白)或降低(阴性急性期蛋白)的一类蛋白。此响应称为急性期反应(也称为急性期响应)。阳性急性期蛋白的实例包括但不限于C反应蛋白(CRP)、D-二聚体蛋白、甘露糖结合蛋白、α1抗胰蛋白酶、α1抗胰凝乳蛋白酶、α2巨球蛋白、纤维蛋白原、凝血酶原、因子VIII、血管性血友病因子、血纤溶酶原、补体因子、铁蛋白、血清淀粉样P组分、血清淀粉样蛋白A(SAA)、血清类黏蛋白(α1-酸糖蛋白,AGP)、血浆铜蓝蛋白、结合珠蛋白及其组合。阴性急性期蛋白的非限制性实例包括白蛋白、转铁蛋白、甲状腺素运载蛋白、皮质素传递蛋白、视黄醇结合蛋白及其组合。优选地,确定CRP和/或SAA的存在或水平。在一些情况下,用测定,例如杂交测定或基于扩增的测定,在mRNA表达水平检测特别的急性期蛋白的存在或水平。在其他一些情况下,用例如免疫测定(例如ELISA)或免疫组化测定在蛋白质表达水平检测特别的急性期蛋白的存在或水平。例如,可从AlpcoDiagnostics(Salem,NH)获得的三明治比色ELISA测定可用于确定血清、血浆、尿液或粪便样品中的CRP水平。类似地,可从BiomedaCorporation(FosterCity,CA)获得的ELISA试剂盒可用于检测样品中的CRP水平。其他确定样品中CRP水平的方法在例如美国专利号6,838,250和6,406,862;以及美国专利公开号20060024682和20060019410中说明。额外的确定CRP水平的方法包括例如免疫比浊测定、快速免疫扩散测定和可视凝集测定。用于确定样品例如血清、血浆、唾液、尿液或粪便中SSA的存在或水平的适当的ELISA试剂盒可从例如AntigenixAmericaInc.(HuntingtonStation,NY)、Abazyme(Needham,MA)、USCNLife(MissouriCity,TX)和/或U.S.Biological(Swampscott,MA)获得。C反应蛋白(CRP)是存在于血液中的响应炎症的蛋白(急性期蛋白)。CRP通常由肝脏和脂肪细胞生产。它是穿透素蛋白家族的成员。人CRP多肽序列在例如Genbank登录号NP_000558中给出。人CRPmRNA(编码)序列在例如Genbank登录号NM_000567中给出。本领域技术人员将认识到,CRP也称为PTX1、MGC88244和MGC149895。血清淀粉样蛋白A(SAA)是血浆中与高密度脂蛋白结合的载脂蛋白家族。SAA的不同同种型以不同水平组成型表达(组成型SAA)或响应炎性刺激而表达(急性期SAA)。这些蛋白主要由肝脏生产。这些蛋白从无脊椎动物到脊椎动物的保守暗示SAA在所有动物中具有非常重要的功能。急性期血清淀粉样蛋白A(A-SAA)在炎症急性期分泌。人SSA多肽序列在例如Genbank登录号NP_000322中给出。人SAAmRNA(编码)序列在例如Genbank登录号NM_000331中给出。本领域技术人员将认识到,SAA也称为PIG4、TP53I4、MGC111216和SAA1。C.细胞粘附分子(IgSFCAM)确定样品中一个或多个免疫球蛋白超家族细胞粘附分子的存在或水平在本发明中也有用。如本文所用,术语“免疫球蛋白超家族细胞粘附分子”(IgSFCAM)包含任何位于细胞表面,具有一个或多个免疫球蛋白样折叠结构域,并且起细胞间粘附和/或信号转导功能的多种多肽或蛋白。在许多情况下,IgSFCAM是穿膜蛋白。IgSFCAM的非限制性实例包括神经细胞粘附分子(NCAM;例如NCAM-120、NCAM-125、NCAM-140、NCAM-145、NCAM-180、NCAM-185等)、细胞间粘附分子(ICAM,例如ICAM-1、ICAM-2、ICAM-3、ICAM-4和ICAM-5)、血管细胞粘附分子-1(VCAM-1)、血小板-内皮细胞粘附分子-1(PECAM-1)、L1细胞粘附分子(L1CAM)、与L1CAM具有同源性的细胞粘附分子(L1近同源物)(CHL1)、唾液酸结合Ig样凝集素(SIGLEC;例如SIGLEC-1、SIGLEC-2、SIGLEC-3、SIGLEC-4等)、粘连蛋白(例如粘连蛋白1、粘连蛋白2、粘连蛋白3等),和粘连蛋白样分子(例如Necl-1、Necl-2、Necl-3、Necl-4和Necl-5)。优选地,确定ICAM-1和/或VCAM-1的存在或水平。1.细胞间粘附分子-1(ICAM-1)ICAM-1是穿膜细胞粘附蛋白,在白细胞和内皮细胞的细胞膜中以低浓度持续存在。在细胞因子刺激下,浓度大大增加。ICAM-1可被IL-1和TNFα诱导,由血管内皮、巨噬细胞和淋巴细胞表达。在IBD中,促炎性细胞因子通过上调粘附分子例如ICAM-1和VCAM-1的表达导致炎症。粘附分子增加的表达将更多淋巴细胞召集至感染的组织,导致组织炎症(参见Goke等人,J.,Gastroenterol.,32:480(1997);和Rijcken等人,Gut,51:529(2002))。ICAM-1由细胞间粘附分子1基因(ICAM1;EntrezGeneID:3383;Genbank登录号NM_000201)编码,并且在细胞间粘附分子1前体多肽(Genbank登录号NP_000192)的处理后产生。2.血管细胞粘附分子-1(VCAM-1)VCAM-1是穿膜细胞粘附蛋白,其介导淋巴细胞、单核细胞、嗜曙红细胞和嗜碱性细胞粘附至血管内皮。由于增加的基因转录(例如,响应肿瘤坏死因子α(TNFα)和白介素-1(IL-1)),VCAM-1在内皮细胞中的表达被细胞因子上调。VCAM-1由血管细胞粘附分子1基因(VCAM1;EntrezGeneID:7412)编码,并且在转录物(Genbank登录号NM_001078(变体1)或NM_080682(变体2))的差异化剪接和前体多肽剪切同种型(Genbank登录号NP_001069(同种型a)或NP_542413(同种型b))处理后产生。在一些情况下,用测定,例如杂交测定或基于扩增的测定,在mRNA表达水平检测IgSFCAM的存在或水平。在其他一些情况下,用例如免疫测定(例如ELISA)或免疫组化测定在蛋白质表达水平检测IgSFCAM的存在或水平。确定样品例如组织样品、活组织切片、血清、血浆、唾液、尿液或粪便中ICAM-1和/或VCAM-1的存在或水平的适当的抗体和/或ELISA试剂盒可从例如Invitrogen(Camarillo,CA)、SantaCruzBiotechnology,Inc.(SantaCruz,CA),和/或AbcamInc.(Cambridge,MA)获得。D.遗传标志物确定样品中一种或多种遗传标志物的存在或水平在本发明中也有用。遗传标志物的非限制性实例包括但不限于任何炎性途径基因和可进行基因型分型的相应的SNP,如表1所列(例如NOD2/CARD15基因、IL12/IL23途径基因等)。优选地,确定NOD2/CARD15基因和/或IL12/IL23途径中一个或多个基因中的至少一个等位基因变体(例如单核苷酸多样性(SNP))的存在或不存在。参见例如Barrett等人,Nat.Genet.,40:955-62(2008)和Wang等人,Amer.J.Hum.Genet.,84:399-405(2009)。表1基因SNPNOD2(R702W)-SNP8rs2066844NOD2(G908R)-SNP12rs2066845NOD2(3020insC)-SNP13rs5743293ATG16L1(T300A)rs2241880IL23R(R381Q)rs11209026DLG5rs2165047NOD2/CARD15rs2066847IL23Rrs11465804ATG16L1rs3828309MST1rs3197999PTGER4rs4613763IRGMrs11747270TNFSF15rs4263839ZNF365rs10995271NKX2-3rs11190140PTPN2rs2542151PTPN22rs2476601ITLN1rs2274910IL12Brs10045431CDKAL1rs6908425CCR6rs2301436JAK2rs10758669C11orf30rs7927894LRRK2,MUC19rs11175593ORMDL3rs2872507STAT3rs744166ICOSLGrs762421GCKRrs780094BTNL2,SLC26A3,HLA-DRB1,rs3763313HLA-DQA1PUS10rs13003464CCL2,CCL7rs991804LYRM4rs12529198SLC22A23rs17309827IL18RAPrs917997IL12RB2rs7546245IL12RB1rs374326CD3Drs3212262CD3Grs3212262CD247rs704853JUNrs6661505CD3Ers7937334IL18R1rs1035127CCR5MAPK14rs2237093IL18rs11214108IFNGrs10878698MAP2K6rs2905443STAT4rs1584945IL12Ars6800657TYK2rs12720356ETV5rs9867846MAPK8rs17697885IRGMrs13361189IRGMrs4958847IRGMrs1000113IRGMrs11747270TL1A/TNFSF15rs6478109TL1A/TNFSF15rs6478108TL1A/TNFSF15rs4263839PTN22rs2476601CCR6rs1456893CCR6rs23014365p13/PTGER4rs13736925p13/PTGER4rs44952245p13/PTGER4rs77208385p13/PTGER4rs4613763ITLN1rs2274910ITLN1rs9286879ITLN1rs11584383IBD5/5q31rs2188962IBD5/5q31rs252057IBD5/5q31rs10067603GCKRrs780094TNFRSF6Brs1736135ZNF365rs224136ZNF365rs10995271C11或f30rs7927894LRRK2;MUC19rs1175593IL-27rs8049439TLR2rs4696480TLR2rs3804099TLR2rs3804100TLR2rs5743704TLR2rs2405432TLR4(D299G)rs4986790TLR4(T399I)rs4986791TLR4(S360N)rs4987233TLR9rs187084TLR9rs352140NFC4rs4821544KIF21Brs11584383IKZF1rs1456893C11或f30rs7927894CCL2,CCL7rs991804ICOSLGrs762421TNFAIP3rs7753394FLJ45139rs2836754PTGER4rs4613763ECM1rs7511649ECM1(T130M)rs3737240ECM1(G290S)rs13294GLI1(G933D)rs2228224GLI1(Q1100E)rs2228226MDR1(3435C>T)rs1045642MDR1(A893S/T)rs2032582MAGI2rs6962966MAGI2rs2160322IL26rs12815372IFNG,IL26rs1558744IFNG,IL26rs971545IL26rs2870946ARPC2rs12612347IL10,IL19rs3024493IL10,IL19rs3024505IL23Rrs1004819IL23Rrs2201841IL23Rrs11465804IL23Rrs10889677BTLN2rs9268480HLA-DRB1rs660895MEP1rs6920863MEP1rs2274658MEP1rs4714952MEP1rs1059276PUS10rs13003464PUS10rs6706689RNF186rs3806308RNF186rs1317209RNF186rs6426833FCGR2A,Crs10800309CEP72rs4957048DLD,LAMB1rs4598195CAPN10,KIF1Ars4676410IL23Rrs11805303IL23Rrs7517847IL12B/p40rs1368438IL12B/p40rs10045431IL12B/p40rs6556416IL12B/p40rs6887695IL12B/p40rs3212227STAT3rs744166JAK2rs10974914JAK2rs10758669NKX2-3rs6584283NKX2-3rs10883365NKX2-3rs11190140IL18RAPrs917997LYRM4rs12529198CDKAL1rs6908425MAGI2rs2160322TNFRSF6Brs2160322TNFRSF6Brs2315008TNFRSF6Brs4809330PSMG1rs2094871PSMG1rs2836878PTPN2rs2542151MST1/3p21rs9858542MST1/3p21rs3197999SLC22A23rs17309827MHCrs660895XBP1rs35873774ICOSLG1rs762421BTLN2rs3763313BTLN2rs2395185BTLN2rs9268480ATG5rs7746082CUL2,CREMrs17582416CARD9rs4077515ORMDL3rs2872507ORMDL3rs2305480用于本发明的额外的SNP包括例如rs2188962、rs9286879、rs11584383、rs7746082、rs1456893、rs1551398、rs17582416、rs3764147、rs1736135、rs4807569、rs7758080和rs8098673。参见例如Barrett等人,Nat.Genet.,40:955-62(2008)。1.NOD2/CARD15确定NOD2/CARD15基因中等位基因变体例如SNP的存在或不存在在本发明中特别有用。如本文所用,术语“NOD2/CARD15变体”或“NOD2变体”包括与野生型NOD2基因相比含有一个或多个改变的NOD2基因的核苷酸序列或者与野生型NOD2多肽序列相比含有一个或多个改变的NOD2多肽的氨基酸序列。NOD2,也称为CARD15,被定位于16号染色体上的IBD1基因座,并用位点克隆(Hugot等人,Nature,411:599-603(2001))和位点候选基因策略(Ogura等人,Nature,411:603-606(2001);Hampe等人,Lancet,357:1925-1928(2001))鉴定。IBD1座位对炎性肠疾病具有高多点连锁打分(MLS)(在16q13处的标志物D16S411的MLS=5.7)。参见例如Cho等人,Inflamm.BowelDis.,3:186-190(1997);Akolkar等人,Am.J.Gastroenterol.,96:1127-1132(2001);Ohmen等人,Hum.Mol.Genet.,5:1679-1683(1996);Parkes等人,Lancet,348:1588(1996);Cavanaugh等人,Ann.Hum.Genet.,62:291-8(1998);Brant等人,Gastroenterology,115:1056-1061(1998);Curran等人,Gastroenterology,115:1066-1071(1998);Hampe等人,Am.J.Hum.Genet.,64:808-816(1999)和Annese等人,Eur.J.Hum.Genet.,7:567-573(1999)。人NOD2的mRNA(编码)和多肽序列分别在例如Genbank登录号NM_022162和NP_071445中给出。此外,包括NOD2的人16号染色体克隆RP11-327F22的完整序列在例如Genbank登录号AC007728中给出。此外,来自其他物种的NOD2的序列可在GenBank数据库中找到。NOD2蛋白含有氨基末端半胱天冬酶召集结构域(CARD),所述结构域可活化NF-κB(NF-kB),以及若干羧基末端富亮氨酸重复结构域(Ogura等人,J.Biol.Chem.,276:4812-4818(2001))。NOD2与凋亡调控因子Apaf-1/CED-4以及一类植物抗病基因产物具有结构同源性(Ogura等人,见上文)。与植物疾病抗性基因产物类似,NOD2具有氨基末端效应子结构域、核苷酸结合结构域和富亮氨酸重复(LRR)。野生型NOD2活化核因子NF-κB,使其响应细菌脂多糖(LPS;Ogura等人,见上文;Inohara等人,J.Biol.Chem.,276:2551-2554(2001))。NOD2可作为LPS的细胞间受体发挥功能,响应性需要富亮氨酸重复。先前已经描述了在NOD2编码区的三个单核苷酸多态性处的变异。这三个SNP,命名为R702W(“SNP8”)、G908R(“SNP12”)和1007fs(“SNP13”)位于NOD2基因的羧基末端区(Hugot等人,同上)。SNP8、SNP12和SNP13,以及适用于本发明的NOD2基因中的额外的SNP的进一步描述可在例如美国专利号6,835,815;6,858,391和7,592,437;以及美国专利公开号20030190639、20050054021和20070072180中找到。在一些实施方式中,NOD2变体位于NOD2座位的编码区内,例如在编码NOD2多肽的羧基末端部分的若干富亮氨酸重复的区域内。位于NOD2的富亮氨酸重复区的此类NOD2变体包括但不限于,R702W(“SNP8”)和G908R(“SNP12”)。用于本发明的NOD2变体也可编码与由野生型NOD2多肽活化NF-κB相比,具有降低的活化NF-κB能力的NOD2多肽。作为非限制性实例,NOD2变体1007fs(“SNP13”)导致截短的NOD2多肽,所述截短的NOD2多肽具有降低的响应LPS刺激诱导NF-κB的能力(Orgura等人,Nature,411:603-606(2001))。用于本发明的NOD2变体可以是例如R702W、G908R或1007fs。R702W、G908R和1007fs位于NOD2的编码区内。在一个实施方式中,本发明的方法用R702WNOD2变体实施。如本文所用,术语“R702W”包括NOD2基因的4号外显子内的单核苷酸多态性,其存在于编码NOD2蛋白的702位氨基酸的三联体内。野生型NOD2等位基因在AC007728序列的138,991位点含有胞嘧啶(C)残基,它存在于编码702位氨基酸处的精氨酸的三联体内。R702WNOD2变体在AC007728序列的138,991位含有胸腺嘧啶(t)残基,导致在NOD2蛋白的702位氨基酸从精氨酸(R)替换为色氨酸(W)。因此,此NOD2变体表示为“R702W”或“702W”,也可基于Hugot等人,见上文的较早的编号系统表示为“R675W”。此外,R702W变体也称为“SNP8”等位基因或SNP8处的“2”等位基因。R702W或SNP8的NCBISNPID是rs2066844。R702WNOD2变体和其他NOD2变体的存在可用例如等位基因区分测定或序列分析方便地检测。本发明的方法也可用G908RNOD2变体实施。如本文所用,术语“G908R”包含NOD2基因的8号外显子内的单核苷酸多态性,其存在于编码NOD2蛋白的908位氨基酸的三联体内。908位氨基酸位于NOD2基因的富含亮氨酸重复区内。野生型NOD2等位基因在AC007728序列的128,377位点含有鸟嘌呤(g)残基,其存在于编码908位氨基酸处的甘氨酸的三联体内。G908RNOD2变体在AC007728序列的128,377位点含有胞嘧啶(c)残基,导致NOD2蛋白的908位氨基酸处从甘氨酸(G)替换为精氨酸(R)。因此,此NOD2变体被表示为“G908R”或“908R”,也可基于Hugot等人,见上文的较早的编号系统表示为“G881R”。此外,G908R变体也称为“SNP12”等位基因或SNP12处的“2”等位基因。G908RSNP12的NCBISNPID是rs2066845。本发明的方法也可用1007fsNOD2变体实施。此变体是单核苷酸插入,导致NOD2蛋白的第10富含亮氨酸重复中的读框移动,并随后为过早的终止密码子。导致的NOD2蛋白的截短表现出防止NF-κB响应细菌脂多糖的活化(Ogura等人,见上文)。如本文所用,术语“1007fs”包含NOD2基因的11号外显子内的单核苷酸多态性,它存在于编码NOD2蛋白的1007位氨基酸的三联体内。1007fs变体在AC007728序列的121位,139位含有添加的胞嘧啶,导致1007位氨基酸处的读框移动突变。因此,此NOD2变体被表示为“1007fs”,也可基于Hugot等人,见上文的较早的编号系统表示为“R3020insC”或“980fs”。此外,1007fsNOD2变体也称为“SNP13”等位基因或SNP13处的“2”号等位基因。1007fs或SNP13的NCBISNPID是rs2066847。本领域技术人员认识到,使用可商购(例如从PEBiosystems(FosterCity,CA)获得的参考DNA,与例如Centred’EtudeduPolymorphismeHumain(CEPH)参考个体(例如命名为1347-02(Dib等人,Nature,380:152-154(1996))的个体)比较,可以方便地定义特别的NOD2变体等位基因或其他多态性等位基因。此外,关于SNP的具体信息可从美国国家生物技术信息中心(NCBI)的dbSNP获得。NOD2变体也可位于NOD2基因座的非编码区。非编码区包括例如内含子序列以及5’和3’非翻译序列。位于NOD2基因非编码区的NOD2变体等位基因的非限制性实例是JW1变体,它在Sugimura等人,Am.J.Hum.Genet.,72:509-518(2003)和美国专利公开号20070072180中说明。位于NOD2基因3’非翻译区的NOD2变体等位基因的实例包括但不限于JW15和JW16等位基因,所述JW15和JW16等位基因在美国专利公开号20070072180中说明。位于NOD2基因的5’非翻译区(例如,启动子)的NOD2变体等位基因的实例包括但不限于,JW17和JW18变体等位基因,所述JW17和JW18变体等位基因在美国专利公开号20070072180中说明。如本文所用,术语“JW1变体等位基因”包含位于NOD2基因的8号间插序列(8号内含子)的158位核苷酸的遗传变异。相对于AC007728序列,JW1变体等位基因位于位点128,143。位于8号内含子的158位核苷酸位点的遗传变异可以是,但不限于单核苷酸替换、多核苷酸替换或一个或多个核苷酸的缺失或插入。8号内含子的野生型序列在158号位点含有胞嘧啶。作为非限制性实例,JW1变体等位基因可以在8号内含子的158位核苷酸处具有胞嘧啶(c)至腺嘌呤(a)、胞嘧啶(c)至鸟嘌呤(g)或胞嘧啶(c)至胸腺嘧啶(t)替换。在一个实施方式中,JW1变体等位基因是在NOD28号内含子158位核苷酸处从胞嘧啶(c)至胸腺嘧啶(t)的改变。术语“JW15变体等位基因”包含在NOD2的3′非翻译区内的位于AC007728序列的核苷酸位点118,790处的遗传变异。位于118,790位核苷酸处的遗传变异可以是,但不限于单核苷酸替换、多核苷酸替换或一个或多个核苷酸的缺失或插入。野生型序列在位点118,790具有腺嘌呤(a)。作为非限制性实例,JW15变体等位基因可在118,790位核苷酸处具有腺嘌呤(a)至胞嘧啶(c)、腺嘌呤(a)至鸟嘌呤(g),或腺嘌呤(a)至胸腺嘧啶(t)替换。在一个实施方式中,JW15变体等位基因是在118,790位核苷酸处从腺嘌呤(a)至胞嘧啶(c)的改变。如本文所用,术语“JW16变体等位基因”包含在NOD2的3′非翻译区中,位于AC007728序列的核苷酸位点118,031处的遗传变异。位于118,031位核苷酸处的遗传变异可以是,但不限于单核苷酸替换、多核苷酸替换或一个或多个核苷酸的缺失或插入。野生型序列在位点118,031处具有鸟嘌呤(g)。作为非限制性实例,JW16变体等位基因可在118,031位核苷酸处具有鸟嘌呤(g)至胞嘧啶(c)、鸟嘌呤(g)至腺嘌呤(a)或鸟嘌呤(g)至胸腺嘧啶(t)替换。在一个实施方式中,JW16变体等位基因是在118,031位核苷酸处从鸟嘌呤(g)至腺嘌呤(a)的改变。术语“JW17变体等位基因”包含在NOD2的5′非翻译区中,位于AC007728序列的核苷酸位点154,688处的遗传变异。位于154,688位核苷酸处的遗传变异可以是,但不限于单核苷酸替换、多核苷酸替换或一个或多个核苷酸的缺失或插入。野生型序列在位点154,688处具有胞嘧啶(c)。作为非限制性实例,JW17变体等位基因可在154,688位核苷酸处具有胞嘧啶(c)至鸟嘌呤(g)、胞嘧啶(c)至腺嘌呤(a),或胞嘧啶(c)至胸腺嘧啶(t)替换。在一个实施方式中,JW17变体等位基因是在154,688位核苷酸处从胞嘧啶(c)至胸腺嘧啶(t)的改变。术语“JW18变体等位基因”包含在NOD2的5′非翻译区中,位于AC007728序列的核苷酸位点154,471处的遗传变异。位于154,471位核苷酸处的遗传变异可以是,但不限于单核苷酸替换、多核苷酸替换或一个或多个核苷酸的缺失或插入。野生型序列在位点154,471处具有胞嘧啶(c)。作为非限制性实例,JW18变体等位基因可在154,471位核苷酸处具有胞嘧啶(c)至鸟嘌呤(g)、胞嘧啶(c)至腺嘌呤(a)或胞嘧啶(c)至胸腺嘧啶(t)替换。在一个实施方式中,JW18变体等位基因是在154,471位核苷酸处从胞嘧啶(c)至胸腺嘧啶(t)的改变。应当理解,本发明的方法可用上述或其他位于NOD2基因座的编码区或非编码区(例如内含子或启动子区)的NOD2变体等位基因实施。还应当理解,本发明的方法可涉及确定一个、两个、三个、四个或更多NOD2变体,包括但不限于SNP8、SNP12和SNP13等位基因,以及其他编码和非编码区变体。VI.实施例将通过具体实施例更详细地说明本发明。以下实施例以说明的目的提供,不意欲以任何方式限制本发明。本领域技术人员容易认识到,多种非关键参数可被改变或修改而获得本质上相同的结果。实施例1用于测量抗TNFα生物制剂的水平的新迁移率变动测定此实施例说明了用于测量患者样品(例如血清)中抗TNFα药物浓度的新的均质测定,其使用大小排阻色谱检测抗TNFα药物与经荧光标记的TNFα的结合。测定是有利的,因为它避免了对洗涤步骤的需要、使用允许在可见和/或IR光谱检测的荧光团(这降低了背景和血清干扰问题)、由于荧光标记检测的高灵敏性增加了检测患者中低滴度抗TNFα药物的能力,以及以液相反应进行,从而降低了由于附着于固体表面例如ELISA板的任何表位改变的机会。在一个示例性实施方式中,TNFα用荧光团(例如Alexa647)标记,其中荧光团可用可见或红外光谱或二者检测。经标记的TNFα与人血清在液相反应中孵育,以允许血清中存在的抗TNFα药物结合。经标记的TNFα也可与已知量的抗TNFα药物在液相反应中孵育,以产生标准曲线。在孵育后,将样品直接装载到大小排阻色谱上。抗TNFα药物与经标记的TNFα的结合导致与只有经标记的TNFα相比峰的左移。存在于血清样品中的抗TNFα药物的浓度可与标准曲线和对照比较。图1说明了本发明的测定的实例,其中大小排阻HPLC用于检测TNFα-Alexa647和HUMIRATM(阿达木单抗)之间的结合。如图1所示,HUMIRATM与TNFα-Alexa647的结合导致TNFα-Alexa647峰向左变动。图2说明了HUMIRATM与TNFα-Alexa647结合的剂量反应曲线。特别地,图2A说明了HUMIRATM以剂量依赖的方式增加大小排阻色谱测定中TNFα-Alexa647的迁移。图2B说明1%人血清的存在对大小排阻色谱测定中TNFα-Alexa647的变动没有显著影响。图2C说明混合的RF阳性血清的存在对大小排阻色谱测定中TNFα-Alexa647的变动没有显著影响。同样,此实施例证明本发明在监测接受抗TNFα药物例如HUMIRATM的患者中的用途:(1)指导确定适当的药物剂量;(2)评估药物的药物动力学,例如确定药物是否过快从体内被清除;和(3)指导治疗决定,例如是否从目前的抗TNFα药物转换至不同的TNFα抑制剂或另一类型的疗法。实施例2用于测量HACA和HAHA水平的新迁移率变动测定此实施例说明了用于测量患者样品(例如血清)中自体抗体(例如HACA和/或HAHA)浓度的新的均质测定,其使用大小排阻色谱检测这些自体抗体与经荧光标记的抗TNFα药物的结合。测定是有利的,因为它避免了对移除低亲和性HACA和HAHA的洗涤步骤的需要、使用允许在可见和/或IR光谱检测的荧光团(这降低了背景和血清干扰问题)、由于荧光标记检测的高灵敏性增加了检测患者中低滴度HACA和HAHA的能力,以及以液相反应进行,从而降低了由于附着于固体表面例如ELISA板的任何表位改变的机会。在53%、21%和7%的用1mg/kg、3mg/kg和10mg/kg英夫利昔单抗治疗的类风湿性关节炎患者中检测到HACA的事实说明了测量针对TNFα抑制剂产生的自体抗体(例如HACA、HAHA等)的临床应用。当英夫利昔单抗与甲氨蝶呤组合时,抗体的发生率较低,为15%、7%和0%,这说明同时的免疫抑制疗法在降低抗药物响应中有效,但也说明高剂量的抗TNFα抗体可导致耐受。在克罗恩病中,报告了更高的发生率:在第5次注射后,61%的患者具有HACA。当HACA存在时,临床响应缩短。参见Rutgeerts,N.Engl.J.Med.,348:601-608(2003)。对在从2005年至2008年3年的时间155位患者中测量的英夫利昔单抗和HACA水平的回顾研究证明在22.6%(N=35)的患有炎性肠病的患者中检测到HACA。参见Afif等人,“ClinicalUtilityofMeasuring英夫利昔单抗andHumanAnti-ChimericAntibodyLevelsinPatientswithInflammatoryBowelDisease”;论文在2009年5月30日-6月3日,ChicagoIL的消化系统疾病周上报道。作者总结,仅基于临床症状改变治疗可导致不适当的管理。均质迁移率变动测定优于现有方法例如图3所示的用于测量患者样品中自体抗体(例如HACA和/或HAHA)浓度的桥接测定,因为发明方法能测量自体抗体例如HACA的浓度而没有非特异性结合和来自ELISA板的固相干扰、没有来自抗TNFα药物的干扰(例如在桥接测定中,HACA测量必须在抗TNFα药物波谷水平进行)、并且没有对抗体的多价的任何依赖(例如用桥接测定检测不到IgG4抗体,因为IgG4抗体是双特异性的,并且不能交联相同抗原)。同样,本发明比现有方法具有至少以下优势:避免抗原附着到固体表面(避免了变性);消除IgG4影响;克服治疗抗体波谷问题;检测具有弱亲和力的抗体;消除无关IgG的非特异性结合;和增加检测的灵敏性和特异性。在一个示例性实施方式中,抗TNFα药物(例如,REMICADETM)用荧光团(例如Alexa647)标记,其中荧光团可用可见或红外光谱或二者检测。经标记的抗TNFα药物与人血清在液相反应中孵育,以允许血清中存在的HACA和HAHA结合。经标记的抗TNFα药物也可与已知量的抗IgG抗体在液相反应中孵育以产生标准曲线。在孵育后,将样品直接装载到大小排阻色谱上。自体抗体与经标记的抗TNFα药物的结合导致与只有经标记的药物相比峰的左移。存在于血清样品中的HACA和HAHA的浓度可与标准曲线和对照比较。图4说明了用于测量针对REMICADETM产生的HACA/HAHA的浓度的本发明的自体抗体检测测定的示例性概要。在一些情况下,高HACA/HAHA水平指示目前的REMICADETM疗法应转换为另一抗TNFα药物例如HUMIRATM。此测定的原理基于由于复合物分子量的增加,结合了抗体的Alexa647标记的Remicade复合物对比游离Alexa647标记的Remicade在大小排阻高效液相色谱(SE-HPLC)上的迁移率变动。此实施例中的色谱是在Agilent-1200HPLC系统上进行的,使用分子量分级范围为5,000-700,000的Bio-Sep300x7.8mmSEC-3000柱(Phenomenex),和1XPBS,pH7.4,流速为0.5mL/min的流动相,在650nm用UV检测。对于每个分析,将100μL样品体积装载到柱上。结合了抗体的Alexa647标记的Remicade复合物是在SE-HPLC分析前通过将已知量的抗体和Alexa647标记的Remicade在1XPBS,pH7.3洗脱缓冲液中,室温下孵育1小时形成的。图5说明了用本发明的大小排阻色谱测定检测到的结合REMICADETM-Alexa647的抗人IgG抗体的剂量响应分析。抗IgG抗体与REMICADETM-Alexa647的结合导致REMICADETM-Alexa647峰向左变动。图6说明了用本发明的大小排阻色谱测定检测到的结合REMICADETM-Alexa647的抗人IgG抗体的第二剂量响应分析。较高量的抗IgG抗体导致抗IgG/REMICADETM-Alexa647复合物形成以剂量依赖的方式增加,这由REMICADETM-Alexa647峰向左变动表明。图7说明了抗IgG抗体结合REMICADETM-Alexa647的剂量响应曲线。图8说明了用本发明的大小排阻色谱,使用100μl注射的样品检测的在正常人血清和HACA阳性血清中REMICADETM-Alexa647免疫复合物的形成。如图8所示,存在于患者样品中的HACA与REMICADETM-Alexa647的结合导致REMICADETM-Alexa647峰向左变动。同样,本发明的大小排阻色谱测定特别有利,因为它在REMICADETM存在下测量HACA,可在患者进行疗法时使用,测量弱和强HACA结合,是混合并读取(mixandread)迁移率变动测定,并且可扩展到其他使用经标记的REMICADETM以平衡HACA和REMICADETM的方法。图9提供了用桥接测定或本发明的迁移率变动测定从20个患者血清样品中进行的HACA测量的总结。此比较研究证明本方法具有比现有方法增加的灵敏性,因为用桥接测定测量为HACA阴性的3个样品在用本发明的迁移率变动测定测量时实际上是HACA阳性(参见患者#SK07070305、SK07070595和SK07110035)。同样,此实例证明本发明在监测接受抗TNFα药物(例如REMICADETM)的患者中检测针对药物的自体抗体(例如HACA和/或HAHA)的存在或水平中的用途,因为此类免疫应答可与超敏反应和抗TNFα药物的药物动力学以及生物分布的巨大变化相关,这些妨碍用此药物进一步治疗。总之,实施例1和实施例2证明TNFα和抗TNFα抗体可用Alexa647有效地标记。当经标记的TNFα-Alexa647的与抗TNFα抗体孵育时,经标记的TNFα/抗TNFα抗体复合物的保留时间变动,并且可用HPLC定量导致变动的抗TNFα抗体的量。此外,当经标记的抗TNFα抗体与抗人IgG抗体孵育时,经标记的抗TNFα抗体/抗IgG抗体复合物的保留时间变动,并且可用HPLC定量导致变动的抗IgG抗体的量。此外,测定系统中的低血清含量被证明对HPLC分析几乎没有影响。最后,可为抗TNFα抗体和HACA/HAHA测定产生标准曲线,并且所述曲线可用于定量患者血清抗TNFα抗体或HACA/HAHA水平。有利地,本发明在一些方面提供迁移率变动测定,例如开发用于测量药物和针对药物的抗体的均质混合并读取测定。为抗TNFα生物制剂Remicade和Humira以及抗RemicadeHACA抗体产生了标准曲线。与ELISA不同,迁移率变动测定形式消除了抗原包被至固体表面,并且不受无关IgG的非特异性结合的影响。此测定形式简单但非常灵敏,可用于检测患者血清中的所有抗TNFα生物制剂药物(例如Remicade、Humira、Enbrel和Cimzia)以及中和抗体(抗RemicadeTM)。实施例3用新迁移率变动测定测量患者血清中人抗嵌合抗体(HACA)和英夫利昔单抗(IFX)水平摘要背景:英夫利昔单抗(IFX)是针对TNFα的嵌合单克隆抗体治疗剂,其被证明在治疗自身免疫疾病例如类风湿性关节炎(RA)和炎性肠疾病(IBD)中有效。然而,在一些用IFX治疗的患者中通过人抗嵌合抗体(HACA)的检测发现了针对IFX的抗体,其可降低药物的效力或导致不利效果。检测个体患者中的HACA和IFX水平可帮助优化剂量和用IFX的治疗。现有检测HACA的方法基于固相测定,其受到循环中IFX的存在可遮蔽HACA的存在的事实的限制,因此,测量只能在给药IFX至少8周后进行。此外,由于高分子量免疫复合物在血液循环中快速清除,这一延时进一步使测定混淆。为克服这些缺点,我们开发并评估了测量用IFX治疗的患者中的血清IFX和HACA水平的新方法。方法:开发了新的非放射标记的液相、大小排阻(SE)-HPLC迁移率变动测定,用于测量用IFX治疗的患者的血清中的HACA和IFX水平。免疫复合物(例如TNFα/IFX或IFX/HACA)、游离TNFα或IFX以及结合/游离比率可以以高灵敏性解析和计算。用标准曲线确定IFX和HACA的血清浓度,所述标准曲线是通过用不同浓度的IFX或混合的HACA阳性血清孵育产生的。使用此新测定,我们测量了从用IFX治疗的复发的IBD患者收集的血清中的IFX和HACA水平,并将结果与用传统桥接ELISA测定获得的结果比较。结果:从新测定产生了高灵敏性的剂量响应曲线。在过量IFX存在下证明了HACA的检测。在来自用IFX治疗的117个患者的血清样品中,发现65个样品具有高于检测限的IFX水平,并且平均为11.0+6.9mg/mL。至于HACA水平,发现33个(28.2%)个样品为阳性而桥接ELISA测定只检测到24个阳性样品。我们也从用桥接测定确定的样品中鉴定了9个假阴性和9个假阳性结果。在IFX治疗期间发现11位患者中HACA水平增加,而发现IFX水平显著下降。结论:开发了新的非放射标记的液相迁移率变动测定,用于测量用IFX治疗的患者的血清中的IFX和HACA水平。此测定具有高灵敏性和准确度,获得的结果是可重复的。此新测定可有利地用于在患者接受疗法时测量HACA和IFX水平。引言肿瘤坏死因子α(TNFα)在自身免疫疾病例如克罗恩病(CD)和类风湿性关节炎(RA)的发病机制中有关键作用。有充分的文献表明用治疗抗体例如英夫利昔单抗(人-鼠嵌合单克隆IgG1κ)或阿达木单抗(全人单克隆抗体)阻断TNFα降低CD和RA的疾病活性。然而,约30-40%的患者对抗TNFα疗法没有响应,并且由于缺乏充分的响应,一些患者需要更高的剂量或给药频率调整。药物生物利用度和药物动力学在个体患者中的差异可导致治疗失败。导致患者产生HACA/HAHA的药物的免疫原性可导致从温和过敏反应到过敏性休克的多种不利反应。现在许多研究者、药物控制机构、健康保险公司和药物制造商认识到了这些问题。此外,许多对一种抗TNFα药物次级响应失败的患者受益于更换至其他抗TNFα药物,说明特异性地针对用于治疗的蛋白的中和抗体的功能(Radstake等人,Ann.Rheum.Dis.,68(11):1739-45(2009))。监测患者的药物和HACA/HAHA水平因而被保证,如此使得对个体患者调整药物施用,并且可有效且经济地给予延长的疗法并对患者几乎没有或没有风险(Bendtzen等人,Scand.J.Gastroenterol.,44(7):774-81(2009))。若干酶联免疫测定被用于评估药物和HACA/HAHA的循环水平。图10提供了测量HACA的现有方法和本发明的新HACA测定的比较的总结。现有方法的限制之一是当循环中有可测量量的药物时,抗体水平难以测量。与只能在给药IFX后至少8周才能进行测量的现有的固相HACA检测方法相反,本发明的新测定是非放射标记的液相大小排阻(SE)-HPLC测定,能测量来自正在用IFX治疗的患者的血清中的HACA和IFX水平。以下是测量患者中抗TNFα生物药物和针对TNFα生物药物的抗体的血清浓度的原理:(1)用于临床试验的PK研究;(2)FDA可在临床试验中需要它用于监测患者对生物药物的免疫应答;(3)通过测量HACA或HAHA,监测患者对生物药物的响应,以指导对每位患者的药物剂量;和(4)用于指导起始药物失败时转换为不同生物药物。方法患者血清中英夫利昔单抗(IFX)水平的SE-HPLC分析。根据制造商的说明用荧光团(“Fl”例如Alexa488)标记人重组TNFα。经标记的TNFα与不同量的IFX或患者血清在室温下孵育1小时。在HPLC系统上用大小排阻色谱分析100μL体积的样品。基于其保留时间,用FLD监测游离TNFα-Fl和结合的TNFα-Fl免疫复合物。从标准曲线计算血清IFX水平。患者血清中HACA水平的SE-HPLC分析。用Fl标记纯化的IFX。经标记的IFX与混合的HACA阳性血清的不同的稀释液或经稀释的患者血清在室温下孵育1小时。在HPLC系统上用大小排阻色谱分析100μL体积的样品。基于其保留时间,用FLD监测游离IFX-Fl和结合的IFX-Fl免疫复合物。结合和游离IFX-Fl的比率用于确定HACA水平。用于测量血清中HACA的迁移率变动测定方法。此测定的原理基于由于复合物的分子量增加,结合了HACA的经Fl标记的英夫利昔单抗(IFX)复合物相对于游离的经Fl标记的IFX在大小排阻高效液相色谱(SE-HPLC)上的迁移率变动。色谱在Agilent-1200HPLC系统上进行,使用分子量分级范围为5,000-700,000的Bio-Sep300x7.8mmSEC-3000柱(Phenomenex),流动相为1XPBS,pH7.3,流速为0.5-1.0mL/min,用FLD检测。对于每个分析将100μL样品体积装载到柱上。结合了HACA的经Fl标记的IFX复合物是在SE-HPLC分析前,通过将来自IFX治疗的患者的血清与经Fl标记的IFX在1XPBS,pH7.4洗脱缓冲液中在室温下孵育1小时形成的。测定也在不同干扰剂(例如类风湿因子和TNF-α)的存在下进行,以验证测定。结果图11说明了由于高分子量的复合物的迁移率变动,结合了HACA的IFX-Fl复合物与游离IFX-Fl的分离。如组c和d所示,荧光峰的保留时间从21.8min变动到15.5-19.0min。反应混合物中存在的HACA越多,色谱图中剩余的游离IFX-Fl越少,形成的免疫复合物越多。图12说明了由加入HACA引起的荧光峰变动的剂量响应曲线。使用HACA阳性样品,我们能用血清的1∶1000稀释液检测到峰变动。图13说明了由于高分子量的复合物的迁移率变动,结合了IFX的TNFα-Fl复合物与游离TNFα-Fl的分离。如组c和d所示,荧光峰的保留时间从24min变动到13-19.5min。反应混合物中存在的IFX越多,色谱图中剩余的游离TNFα-Fl越少,形成的免疫复合物越多。图14说明了由加入IFX引起的TNFα-Fl荧光峰变动的剂量响应曲线。基于加入的IFX,检测限制是血清中10ng/mLIFX。通过测试来自用桥接测定测量为HACA阳性和阴性患者的血清样品,验证了本发明的新迁移率变动测定(表2)。用此测定,我们分析了来自50个健康对象和117个用IFX治疗的IBD患者的血清样品。所有50个健康对象样品具有地域检测限的IFX水平,而患者样品中有65个具有11.0μg/ml的平均IFX浓度。表3说明了用桥接测定和迁移率变动测定测量的健康对照和用IFX治疗的IBD患者血清中的HACA水平。桥接测定比迁移率变动测定检测到较少的HACA阳性患者和更多的假阴性结果以及更多假阳性结果。表2来自桥接测定与SE-HPLC测定中强阳性和阴性的患者血清中相对HACA水平的相关性表3用桥接测定(截断1.69μg/ml)和HPLC迁移测定(截断0.19,结合和游离IFX的比率)分析患者样品的血清HACA水平假阴性结果由含高水平的IFX的患者血清造成,高水平IFX干扰桥接测定确定HACA,而SE-HPLC不受影响。假阳性结果由含高水平的非特异性干扰物质的患者血清造成,所述非特异性干扰物质可干扰桥接测定。图15说明了在IFX治疗期间IBD患者中HACA水平和IFX浓度的关系。HACA可早在V10(30周)检测到,并在一些患者中在IFX治疗期间持续增加。图16说明使用本发明的测定可在IFX存在下检测HACA。血清中较高水平的HACA与可检测到的较低水平的IFX(例如降低的生物可利用性)相关。同样,在用IFX治疗时早期检测HACA可指导医师和/或患者转换至其他抗TNF药物或增加IFX的剂量。在测定内和测定间精确度(基于CV参数)和对干扰剂的易感性方面验证测定。此分析在下表给出:英夫利昔单抗测定HACA测定英夫利昔单抗测定HACA测定结论抗TNFα生物药物可方便地用荧光团(“Fl”)标记,并且用于测量HACA/HAHA的迁移率变动测定形式是均质测定,没有类似ELlSA的抗原包被固体表面和多个洗脱和孵育步骤。经Fl标记的IFX与HACA阳性血清孵育导致形成免疫复合物,所述复合物与游离的经Fl标记的IFX相比,在SE-HPLC中的不同位置处洗脱,因而HACA的量可被定量。其他血清组分的存在对迁移率变动测定几乎没有影响。与ELISA不同,迁移率变动测定形式极少受无关IgG的非特异性结合的影响,并检测IgG4同种型。健康血清样品不导致经Fl标记的IFX的迁移率变动,用本发明的测定发现28.2%的用IFX治疗的患者具有HACA。同样,本文说明的测定形式非常灵敏,可用于检测患者血清中所有生物药物(例如Remicade、Humira、Enbrel和Cimzia)及其抗体(例如抗Remicade、抗Humira、抗Enbrel和抗Cimzia)。值得注意的是,由于可在IFX存在下用本发明的迁移率变动测定检测HACA,在用IFX治疗时早期检测HACA可指导医师和/或患者改用其他抗TNF药物或增加随后的IFX的剂量。我们开发了新的非放射标记的液相SE-HPLC测定,用于测量用从IFX治疗的患者获得的血清中IFX和HACA水平。新测定具有高灵敏性、准确度和精确度,结果高度可重复,使此测定适于大量人血清样品的常规测试。与ELISA不同,新测定设计消除了抗原包被固体表面,不受无关IgG的非特异性结合的影响。本文说明的测定形式的优势减少测试的假阴性和假阳性结果。有利地,本发明的测定形式非常灵敏,可用于在患者接受疗法时检测血清存在的中所用的生物药物及其抗体。实施例4用新迁移率变动测定区分患者血清中的中和性和非中和性人抗嵌合抗体(HACA)。此实施例说明了用于测量患者样品(例如血清)中自体抗体(例如,HACA)浓度和用于决定此类自体抗体是否是中和或非中和自体抗体的新的均质测定,所述均质测定使用大小排阻色谱检测在经荧光标记的TNFα存在下这些自体抗体与经荧光标记的抗TNFα药物的结合。这些测定是有利的,因为它们避免了对移除低亲和力HACA的洗脱步骤的需求、使用允许在可见和/或IR光谱检测的不同的荧光团(这降低了背景和血清干扰问题)、由于荧光标记检测的高灵敏性增加了检测患者样品中低滴度中和或非中和HACA的能力,并且以液相反应进行,从而减少通过附着于固体表面例如ELISA板的任何表位改变的机会。在一个示例性实施方式中,抗TNFα药物(例如REMICADETM)用荧光团“F1”标记(参见例如图17A),其中荧光团可用可见或红外光谱或二者检测。类似地,TNFα用荧光团“F2”标记(参见例如图17A),其中荧光团也可用可见或红外光谱或二者检测,并且其中“F1”和“F2”是不同的荧光团。经标记的抗TNFα药物与人血清在液相反应中孵育,并向反应加入经标记的TNFα以允许在经标记的抗TNFα药物、经标记的TNFα和/或血清中存在的HACA之间形成复合物(即免疫复合物)。在孵育后,样品直接装载到大小排阻柱上。自体抗体(例如HACA)和经标记的TNFα二者与经标记的抗TNFα药物结合(例如图17A中的“免疫复合物1”)导致与自体抗体和经标记的抗TNFα药物之间的二元复合物(例如图17A中的“免疫复合物2”)、单独的经标记的药物或单独的经标记的TNFα相比,峰向左变动。自体抗体(例如HACA)、经标记的TNFα和经标记的抗TNFα药物的三元复合物的存在表明存在于血清样品中的自体抗体是非中和形式的自体抗体(例如HACA),如此使得自体抗体不干扰抗TNFα抗体和TNFα的结合。在一个特别的实施方式中,如图17A所示,如果血清中存在非中和性HACA,可观察到F1-REMICADETM和F2-TNFα的变动,导致免疫复合物1和免疫复合物2峰增大和游离F1-REMICADETM和游离F2-TNFα峰的减小。然而,存在自体抗体(例如HACA)和经标记的抗TNFα药物(例如图17B中的“免疫复合物2”)之间的二元复合物,而不存在自体抗体(例如HACA)、经标记的TNFα和经标记的抗TNFα药物的三元复合物说明存在于血清样品中的自体抗体是中和形式的自体抗体(例如HACA),如此使得自体抗体干扰抗TNFα抗体和TNFα之间的结合。在一个特别的实施方式中,如图17B所示,如果血清中存在中和HACA,可观察到F1-REMICADETM的变动,导致免疫复合物2峰增大,游离F1-REMICADETM减小,游离F2-TNFα峰不改变。在一些情况下,中和HACA的存在表明使用REMICADETM的现有疗法应当转变另一抗TNFα药物例如HUMIRATM。在备选实施方式中,经标记的TNFα药物首先与人血清在液相反应中孵育,以允许在经标记的抗TNFα药物和血清中存在的HACA之间形成复合物(即免疫复合物)。在孵育后,样品直接上样到第一大小排阻柱。自体抗体(例如HACA)与经标记的抗TNFα药物的结合导致与单独的经标记的药物相比,峰向左变动(例如图18中的“免疫复合物2”)。然后向反应加入经标记的TNFα以确定它是否能取代(例如竞争)自体抗体(例如HACA)而与经标记的抗TNFα药物的结合,从而允许在经标记的抗TNFα药物和经标记的TNFα之间形成复合物(即免疫复合物)。在孵育后,将样品直接装载到第二大小排阻柱上。经标记的抗TNFα药物与经标记的TNFα的结合导致与单独的经标记的TNFα相比,峰向左变动(例如图18中的“免疫复合物3”)。通过加入经标记的TNFα扰乱自体抗体(例如HACA)与经标记的抗TNFα药物之间的结合说明存在于血清样品中的自体抗体是中和形式的自体抗体(例如HACA),如此使得自体抗体干扰抗TNFα抗体和TNFα之间的结合。在一些情况下,中和HACA的存在表明使用REMICADETM的现有疗法应转换为另一抗TNFα药物例如HUMIRATM。实施例5用新均质迁移率变动测定分析患者血清中阿达木单抗的人抗药物抗体(ADA)。背景与目的:针对TNF-α的单克隆抗体例如英夫利昔单抗(IFX)、阿达木单抗(HUMIRATM)和赛妥珠单抗被证明在治疗炎性肠疾病(IBD)和其他炎性病症中有效。抗药物抗体(ADA)可降低药物的效力和/或诱导不利效果。然而,发现ADA不仅存在于用嵌合抗体英夫利昔单抗治疗的患者中,也存在于用人源化抗体阿达木单抗治疗的患者中。监测个体患者中的ADA和药物水平可帮助优化患者的治疗和给药。我们开发了非放射性标记的液相均质迁移率变动测定,以准确地测量来自患者的血清中HACA(人抗嵌合抗体)和IFX。此测定方法克服了检测HACA的现有固相测定的主要限制,即不能在循环中存在IFX的条件下准确地检测HACA。在本研究中,我们评估了此测量用人源化抗体药物阿达木单抗治疗的患者中血清ADA和药物水平的新方法。方法:迁移率变动测定基于游离抗原对比抗原-抗体免疫复合物在大小排阻分离中的保留时间的变动。将荧光团标记的阿达木单抗或TNF-α及内部对照与血清样品混合,以测量游离阿达木单抗和TNF-α在ADA或药物存在下的迁移率变动。游离阿达木单抗或TNF-α与内部对照的比率的改变是免疫复合物形成的指标。用标准曲线确定ADA或阿达木单抗的血清浓度,所述标准曲线是通过与不同浓度的抗人IgG抗体或纯化的阿达木单抗孵育产生的。使用迁移率变动测定,我们测量了从用阿达木单抗治疗的失去响应的IBD患者收集的血清中的阿达木单抗和ADA水平。结果:用抗人IgG抗体产生了剂量响应曲线,用于测量经标记的阿达木单抗的迁移率变动。测定的检测限是1ng抗人IgG。测试了来自50个健康个体的血清的ADA,所有样品具有低于检测限的ADA水平(即没有游离的经标记的阿达木单抗的变动)。也在外源加入的阿达木单抗存在下证明了ADA的检测。为测量用阿达木单抗治疗的患者中的药物浓度,我们用不同量的阿达木单抗对经标记的TNF-α的迁移率变动产生了标准曲线,阿达木单抗的检测限是10ng。结论:本发明的非放射标记液相均质迁移率变动测定已经被用于测量来自用阿述木单抗治疗的患者的血清样品中的ADA和阿达木单抗水平。测定被证明可重复,具有高灵敏性和准确度,可用于评估来自用阿达木单抗治疗的患者的血清样品中的ADA水平。实施例6用新专利迁移率变动测定分析患者血清中抗阿达木单抗的人抗药物抗体(ADA)。摘要背景:抗TNF-α单克隆抗体例如英夫利昔单抗(IFX)和阿达木单抗(ADL)被证明在治疗炎性肠疾病(IBD)中有效。然而,在受治疗的患者中诱导ADA可降低药物的效力和/或诱导不利效果。实际上,ADA不仅见于用IFX治疗的患者中,也见于用ADL治疗的患者中。监测个体患者中的ADA和药物水平可帮助优化患者的治疗和给药。我们开发了专利迁移率变动测定,以准确地测量来自用IFX治疗的患者的血清中HACA(人抗嵌合抗体)和IFX。此测定克服了检测HACA的现有固相测定的主要限制,即不能在循环中存在IFX的条件下准确地检测HACA。在本研究中,我们评估了此新测定测量用全人抗体药物ADL治疗的患者中血清ADA和药物水平。方法:迁移率变动测定基于抗原-抗体免疫复合物对比游离抗原在大小排阻色谱中的保留时间的变动。将荧光团标记的ADL或TNF-α及内部对照与血清样品混合,以测量标记的ADL和TNF-α在ADA或药物存在下的迁移率变动。游离ADL或TNF-α与内部对照的比率的改变是免疫复合物形成的指标。用标准曲线确定ADA或ADL的血清浓度,所述标准曲线是通过与不同浓度的抗人IgG抗体或纯化的ADL孵育产生的。使用此测定,我们测量了从用ADL治疗的IBD患者收集的血清中的ADL和ADA水平。结果:用抗人IgG抗体产生了剂量响应曲线,用于测量经标记的ADL的迁移率变动。测定的检测限是10ng抗人IgG。测试了来自100个健康对照的血清的ADA,所有样品具有低于检测限的ADA水平(即没有游离的经标记的ADL的移动)。在114个用ADL治疗的IBD患者样品中的5个中证明了ADA的检测。为测量用ADL治疗的患者中的药物浓度,我们用不同量的ADL对经标记的TNF-α的变动产生了标准曲线,检测限是10ng。结论:我们已经将专利非放射性标记液相均质迁移率变动测定用于测量来自用ADL治疗的患者的血清中的ADA和ADL水平。测定可重复,具有高灵敏性和准确度,在评估用ADL治疗的患者的血清样品中的ADA水平中有用。引言抗肿瘤坏死因子α(TNF-α)生物制剂例如英夫利昔单抗(IFX)、依那西普、阿达木单抗(ADL)和赛妥珠单抗被证明在多种自身免疫疾病,包括克罗恩病(CD)和类风湿性关节炎(RA)中降低疾病活性。然而,一些患者不响应抗TNF-α疗法,而其他患者由于缺乏足够的响应或产生输注反应而需要更高或更频繁的剂量。导致患者产生针对药物的抗体的治疗抗体的免疫原性可导致治疗的失败和输注反应。嵌合抗体例如IFX比完全人源化的抗体例如ADL具有更高的诱导抗体产生的可能性。RA患者中IFX的抗体(HACA)的发生率为从12%至44%不同,并且似乎与患者血清中IFX水平和治疗响应成反比例。尽管认为完全人源化的ADL比鼠或嵌合抗体免疫原性低,一些研究已经报道了人抗人源化抗体(HAHA)的形成,并且表明在RA和CD患者中抗体产生的发生率为从1%至87%(Aikawa等人,ImmunogenicityofAnti-TNF-alphaagentsinautoimmunediseases.Clin.Rev.AllergyImmunol.,38(2-3):82-9(2010))。对一种抗TNF-α药物次级响应失败的许多患者可受益于转换为另一种抗TNF-α药物或增加剂量和/或给药频率。监测患者的药物和抗药物抗体(ADA)水平因而被保证,如此使得对个体患者调整药物给药。此方法在有保证时允许调整剂量或ADA水平存在时停止治疗。(Bendtzen等人,Individualmedicineininflammatoryboweldisease:monitoringbioavailability,pharmacokineticsandimmunogenicityofanti-tumournecrosisfactor-alphaantibodies.Scand.J.Gastroenterol.,44(7):774-81(2009);Afif等人,Clinicalutilityofmeasuringinfliximabandhumananti-chimericantibodyconcentrationsinpatientswithinflammatoryboweldisease.Am.J.Gastroenterol.,105(5):1133-9(2010))。开发了多种测定用于测量HACA和HAHA。现有方法的限制之一是当循环中有高水平的药物时,ADA水平难以可靠地测量。我们开发了专利非放射性标记的液相迁移率变动测定,用于测量来自用ADL治疗的患者的血清中的ADA和ADL水平,所述测定不受血清中药物存在的影响。方法将经荧光团(Fl)标记的ADL与患者血清孵育以形成免疫复合物。每个反应中包含经Fl标记的小肽作为内部对照。用不同量的抗人IgG产生标准曲线,以确定血清ADA水平。基于其分子量,用大小排阻色谱分离游离的经Fl标记的ADL和结合了抗体的复合物。来自每个样品的游离的经Fl标记的ADL与内部对照的比率用于从标准曲线推断HAHA浓度。类似的方法用于用Fl标记的TNF-α测量患者血清样品中ADL水平。结果图19说明了由于高分子量的复合物的迁移率变动,结合了抗人IgG的Fl-ADL复合物与游离Fl-ADL的分离。如组c至h所示,荧光峰的保留时间从10.1min变动到7.3-9.5min。加入反应混合物中的抗人IgG越多,色谱图中剩余的游离ADL越少,形成的免疫复合物越多(h至c)。内部对照的保留时间是13.5min。图20说明了由加入抗人IgG引起的荧光峰变动的剂量响应曲线。由于形成免疫复合物,增加抗人IgG浓度降低游离ADL与内部对照的比率。测定灵敏性为10ng/ml抗人IgG。内部对照“Fl-BioCyt”对应于Alexa488-biocytin(BioCyt),它组合了绿色荧光的Alexa488荧光团与生物素和可用乙醛固定的伯胺(赖氨酸)(InvitrogenCorp.;Carlsbad,CA)。图21说明了由于高分子量的复合物的迁移率变动,结合了ADL的TNFα-Fl复合物与游离TNFα-Fl的分离。如组c和j所示,荧光峰的保留时间从11.9min变动到6.5-10.5min。反应混合物中加入的ADL越多,色谱图中剩余的游离TNFα-Fl峰越少,形成的免疫复合物越多。图22说明了由加入ADL引起的TNFα-Fl荧光峰变动的剂量响应曲线。基于加入的ADL,检测限是血清中10ng/mLADL。表4说明用本发明的迁移率变动测定分析来自100个健康对象和114个用ADL治疗的IBD患者的血清样品的ADA和ADL水平。全部100个健康对象样品具有低于检测限的ADA水平(游离Fl-ADL没有变动),而114个患者样品中5个具有0.012至>20μg/ml的ADA浓度。100个健康对象样品中平均ADL水平为0.76±1.0μg/ml(在0至9.4μg/ml的范围)。来自用ADL治疗的患者的114个血清样品中平均ADL水平为10.8+17.8μg/ml(范围为0-139μg/ml)。5个ADA阳性样品中4个具有不能检测到的ADL水平。表4用迁移率变动测定测量的患者血清ADA和ADL水平结论用于测量HACA/IFX的迁移率变动测定形式是均质测定,没有抗原包被固体表面,也没有与典型ELISA类似的多个洗脱和孵育步骤。此测定可用于测量ADA和抗TNF药物。与ELISA方法(在mg/ml范围)相比,对于患者血清的ADA和ADL测量,测定的灵敏性(在μg/ml范围内)均较高。健康对照血清样品没有导致Fl标记的ADL的迁移率变动,而用此测定发现4.3%的用ADL治疗的患者具有ADA。尽管健康对照血清样品导致经Fl标记的TNF-α迁移率变动(这可能是因为存在TNF-α的可溶性游离受体),用ADL治疗的患者中的平均ADL高得多(10.8vs.0.76mg/ml)。ADA的早期检测和当患者接受ADL时监测ADL药物水平将允许医师优化ADL的给药或在适当时转换至另一种抗TNF-α药物,并从而优化患者疾病的总体管理。表5用迁移率变动测定测量的患者血清ADA和ADL水平使用此迁移率变动测定我们分析来自100个健康对象和114个用ADL治疗的IBD患者的血清样品的ADA和ADL水平。全部100个健康对象样品具有低于检测限的ADA水平(游离Fl-ADL没有变动),而42个患者样品中4个具有0.012至>20μg/ml的平均ADA浓度。100个健康对象样品中平均ADL水平为0.76+1.0μg/ml(在0至9.4μg/ml的范围)。来自用ADL治疗的患者的114个血清样品中平均ADL水平为10.8+17.8μg/ml(范围为0-139μg/ml)。4个ADA阳性样品中4个具有不能检测到的ADL水平。对于ADA的检测,将用ADL治疗的114位IBD患者分为两个类别,ADL0-4μg/ml和ADL>4μg/ml。将用较大量的ADL-F1测试具有大于4μg/ml的ADL的患者以处理循环ADL与ADL-F1的竞争。健康对照血清样品不导致经Fl标记的ADL的迁移率变动。在预研究中,在此测定中发现9.52%的具有0.4μg/mlADL的患者有ADA。将进行正常样品和具有更高浓度的ADL-FI的患者样品的进一步评估。实施例7优化抗TNF药物疗法的组合算法此实施例说明了通过向一种或多种(例如两种、三种、四种、五种、六种、七种或更多的组合)生化标志物、血液学标志物和/或遗传标志物应用统计算法,例如学习统计分类器系统,优化治疗、降低毒性和/或监测治疗效力的方法。因此,本实施例说明的方法例如,通过确定何时或如何调整或修改(例如增加或减少)随后的抗TNF药物的剂量、通过确定何时或如何组合抗TNF药物(例如以增加、减少或相同的剂量)与一种或多种免疫抑制剂例如甲氨蝶呤(MTX)或硫唑嘌呤,和/或通过确定何时或如何改变现有疗程(例如转换为不同的抗TNF药物),提供用于指导接受抗TNF药物疗法的患者的治疗决定的信息。作为非限制性实例,可在患者样品(例如来自进行抗TNFα药物疗法的患者的血清样品)中检测、测量或确定以下类型的生化标志物、血液学标志物,和/或遗传标志物中的一种、两种、三种、四种、五种或全部六种的存在、水平或基因型:(1)抗TNFα药物水平(例如,游离的抗TNFα治疗抗体的水平);(2)抗药物抗体(ADA)水平(例如抗TNFα药物的自体抗体的水平);(3)TNFα水平;(4)一种、两种、三种、四种、五种、六种、七种或更多额外的细胞因子(例如IL-6、IL-1β、IFN-γ、IL-10等)和/或其他炎症机制的标志物(例如炎性标志物例如CRP、SAA、ICAM-1和/或VCAM-1)的水平;(5)一种或多种遗传标志物例如炎性途径基因中一个或多个突变的存在或不存在,例如一个或多个炎性标志物中变体等位基因(例如,SNP)的存在或不存在,例如NOD2/CARD15(例如美国专利号7,592,437中描述的SNP8、SNP12和/或SNP13)、ATG16L1(例如Lakatos等人,DigestiveandLiverDisease,40(2008)867-873中描述的rs2241880(T300A)SNP)、IL23R(例如Lakatos等人说明的rs11209026(R381Q)SNP)、在例如Gasche等人(Eur.J.Gastroenterology&Hepatology,(2003)15:599-606)中描述的人白细胞抗原(HLA)基因和/或细胞因子基因,和来自IBD5基因座的DLG5和/或OCTN基因;(6)一种或多种上述生化标志物和/或血液学标志物在多个时间点的水平(例如28周、60周等);和(7)其组合。本文说明的单个统计算法或两个或更多统计算法的组合可用于样品中检测的、测量的或确定的标志物的存在、浓度水平或基因型,从而优化疗法、降低毒性或监测使用抗TNF药物治疗的效力。同样,本实施例描述的方法可用于通过确定患者免疫状态确定患者管理。下表6提供了正常和患者样品中细胞因子水平的总结。仅用于说明目的,以下情景提供了本发明的方法如何有利地基于一种或多种如本文说明的生化标志物、血液学标志物和/或遗传标志物的存在、水平和/或基因型,使得疗法能够被优化,毒性(例如副作用)能够被最小化或降低。在以下每个情景中,可应用一种、两种或更多统计算法以优化疗法和/或降低与抗TNF药物相关的毒性。情景#1:高水平抗TNF药物与低水平抗药物抗体(ADA)和低水平炎性细胞因子。药物水平=10-50ng/10μl;ADA水平=0.1-2ng/10μl;TNFα水平=1-8pg/ml;IL-6水平=0.1-3pg/ml;IL-1β水平=0.0-2pg/ml;IFN-γ水平=0-6pg/ml;针对IL-10的抗体未检测到。具有此标志物谱的患者样品包括来自第10次访问(“V10”)的患者BAB和JAA的样品。参见图16b。接受抗TNF药物疗法并且具有此特定标志物谱的患者应当用免疫抑制剂例如硫唑嘌呤与抗TNF药物(例如英夫利昔单抗)一起治疗。情景#2:中等水平抗TNF药物与低水平ADA和低水平炎性细胞因子。药物水平=5-20ng/10μl;ADA水平=0.1-2ng/10μl;TNFα水平=1-8pg/ml;IL-6水平=0.1-3pg/ml;IL-1β水平=0.0-2pg/ml;IFN-γ水平=0-6pg/ml;针对IL-10的抗体未检测到。具有此标志物谱的患者样品包括来自第10次访问(“V10”)的患者DGO、JAG和JJH的样品。参见图16b。接受抗TNF药物疗法并且具有此特定标志物谱的患者应当用免疫抑制剂例如硫唑嘌呤与较高剂量的抗TNF药物(例如英夫利昔单抗)一起治疗。本领域技术人员知道现有疗程可调整至的合适的较高或较低剂量,使得药物疗法被优化,例如随后的剂量比现有剂量高或低至少约1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、15、20、25、30、35、40、45、50或100倍。情景#3:中等水平抗TNF药物与中等水平ADA和低水平炎性细胞因子。药物水平=5-20ng/10μl;ADA水平=0.5-10ng/10μl;TNFα水平=1-8pg/ml;IL-6水平=0.1-3pg/ml;IL-1β水平=0.0-2pg/ml;IFN-γ水平=0-6pg/ml;针对IL-10的抗体未检测到。具有此标志物谱的患者样品包括来自第10次访问(“V10”)的患者JMM和第14次访问(“V14”)的患者J-L的样品。参见图16b。接受抗TNF药物疗法并且具有此特定标志物谱的患者应当用不同的药物治疗。作为非限制性实例,进行英夫利昔单抗(IFX)疗法并且具有中等水平的IFX和ADA(即HACA)与低水平的炎性细胞因子的患者应当转换为使用阿达木单抗(HUMIRATM)的疗法。情景#4:低水平抗TNF药物,高水平ADA和高水平炎性细胞因子。药物水平:0-5ng/10μl;ADA水平=3.0-50ng/10μl;TNFα水平=10-60pg/ml;IL-6水平=0.1-50pg/ml;IL-1β水平=0.0-366pg/ml;IFN-γ水平=0.15-100pg/ml;针对IL-10的抗体未检测到。具有此标志物谱的患者样品包括图16b中来自所有第14次访问(“V14”)的患者的样品。接受抗TNF药物疗法并且具有此特定标志物谱的患者应当用不同的药物治疗。作为非限制性实例,接受英夫利昔单抗(IFX)疗法并具有低水平的IFX与高水平的ADA(即HACA)和炎性细胞因子的患者应当转换为使用阿达木单抗(HUMIRATM)的疗法。情景#5:高水平炎性细胞因子。高TNFα水平(例如10-60pg/ml);高IL-6水平(例如0.1-50pg/ml);高IL-1β水平(例如0.0-366pg/ml);高IFN-γ水平(例如0.15-100pg/ml);高水平的其他炎性分子;+/-针对抗炎性细胞因子的抗体(例如检测到或未检测到针对IL-10的抗体)。接受抗TNF药物疗法并且具有此特定标志物谱的患者应当用不同的药物治疗或用免疫抑制药物例如甲氨蝶呤(MTX)或硫唑嘌呤(AZA)与较高计量的抗TNF药物一起治疗。特别地,来自进行英夫利昔单抗(IFX)疗法的患者的高水平炎性细胞因子的此标志物谱指示现有疗程不起作用,并且患者应转换为使用阿达木单抗(HUMIRATM)的疗法,或者应当用一种或多种免疫抑制药物和较高剂量的IFX一起治疗。实施例8确定不同抗药物抗体(ADA)同种型。此实施例说明了在接受抗TNF药物疗法的ADA阳性患者中确定不同抗药物抗体(ADA)同种型。抗体同种型的非限制性实例包括IgA、IgD、IgE、IgG和IgM。在一些方面,检测具体ADA同种型或ADA同种型的特定组合的存在或水平与不同的临床结果相关。图23说明了HACA阳性患者血清中不同ADA同种型的洗脱时间。在特定实施方式中,可基于大小和适当的稀释实验基于ADA是否是IgM同种型(保留时间:~6.5-7.5分钟)、IgA同种型(7.5-8.5分钟)或IgG同种型(8.5-9.5分钟)确定抗TNF药物疗法的治疗结果。经标记的抗TNF药物例如Humira和Remicade的保留时间是约10.8分钟,内部对照(IC)的保留时间是约13.5分钟。在一项研究中,根据用大小排阻色谱检测ADA的本发明的方法测定了200个患者样品。样品1-100是对照(例如正常对照样品),而样品101-200是从接受Remicade疗法的患者获得的并且桥测定为HACA阳性。对全部200个样品产生了未调整的信号强度(Y轴)对洗脱时间(X轴)的图线。然后对图线进行以下3个调整:(1)标准化的Y(低)到左侧的基线;(2)标准化的Y(高)到右侧的对照峰;和(3)标准化的X到右侧的对照峰。来自全部200个样品的数据分成100个对照样品和100个HACA阳性样品,然后求平均值。图24说明了对照样品平均数的图线。图25说明了阳性样品平均的图线。值得注意的是,图24和图25的图线的比较表明经标记的Remicade(“主要峰”)信号强度降低,并且出现两个不同的ADA同种型峰,对应于HACAIgA(“A峰”)和HACAIgG(“G峰”)。图26说明了100个对照样品和100个阳性样品的主要峰信号(即对应于标记的Remicade信号强度)的并列比较。给出的值是洗脱时间9.71至12.23分钟的平均值。特别地,图26说明了100个HACA阳性样品中经标记的Remicade的信号强度的降低,这与经标记的Remicade和HACA之间复合物的形成相关。图26也说明数个阳性样品具有高HACA水平,这由低主要峰信号(例如在X轴上0至0.2)证明。图27说明了来自图26的主要峰数据的受试者工作特征(ROC)曲线。曲线下面积(AUC)是0.986。接下来,绘制了主要峰的平均值对其他峰的总和(IgG、IgA和IgM)的图线。图28显示了对于100个HACA阳性样品的X轴上的非主要峰(对应于IgG、IgA和IgM峰的和)对Y轴上的主要峰的图线。此图线说明的线性关系可用作测定检验(即测定对照)。图29显示了全部200个样品的IgG对IgA对IgM峰的图线。实施例9基于接近确定不同ADA同种型。此实施例说明了本发明用于确定接受抗TNFα药物疗法例如英夫利昔单抗(IFX)的ADA阳性患者中不同抗药物抗体(ADA)同种型例如ATI(即IFX的抗体;“HACA”)的不同同种型的示例性实施方式。抗体同种型例如ATI同种型的非限制性实例包括IgA、IgD、IgE、IgG和IgM(例如IgAATI、IgDATI、IgEATI、IgGATI和IgMATI)。在一些方面,检测特别的ADA同种型或ADA同种型的特定组合的存在或水平与不同的临床结果相关。图30和图31说明了本发明的基于临近的同种型分型测定的实施方式,所述实施方式使用荧光共振能量转移(FRET)用于确定至少一种、两种、三种、四种、五种或更多ATI同种型,例如,IgAATI、IgDATI、IgEATI、IgGATI和/或IgMATI同种型的存在(或不存在)或水平。例如,图30显示了只有当两个荧光团都处在紧密临近时,Alexa-532(抗Ig抗体例如抗IgA上的“F2”标记)被Alexa-488(治疗剂例如IFX上的“F1”标记)激发,从而表明抗Ig(例如抗IgA)、HACA(例如IgAATI)和IFX的三元复合物的存在和/或水平的示意说明。在特定实施方式中,可用经相同或不同的荧光团例如Alexa-532标记的不同的抗Ig确定不同的ATI同种型和/或其亚类。图31说明了本发明的基于FRET的同种型分型测定的结果。尽管为清楚理解的目的已经通过说明和实施例详述上述发明,本领域技术人员将认识到,可在随附的权利要求书的范围内实施某些改变和修改。此外,本文提供的每个参考以其整体合并入本文作为参考,与各个引文单独合并入本文作为参考具有相同范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1