结合测定的制作方法
本申请要求申请号为201611180971.4、标题为“结合测定”、在2016年12月19日提供于中国专利局的中国专利申请的优先权,其全部内容通过引用并入本文中。本发明涉及用于测定淋巴细胞活化基因-3(lag-3)蛋白或其片段、衍生物或类似物制剂的mhcii类结合活性的方法,以及用于所述方法中的探针和试剂盒。
背景技术:
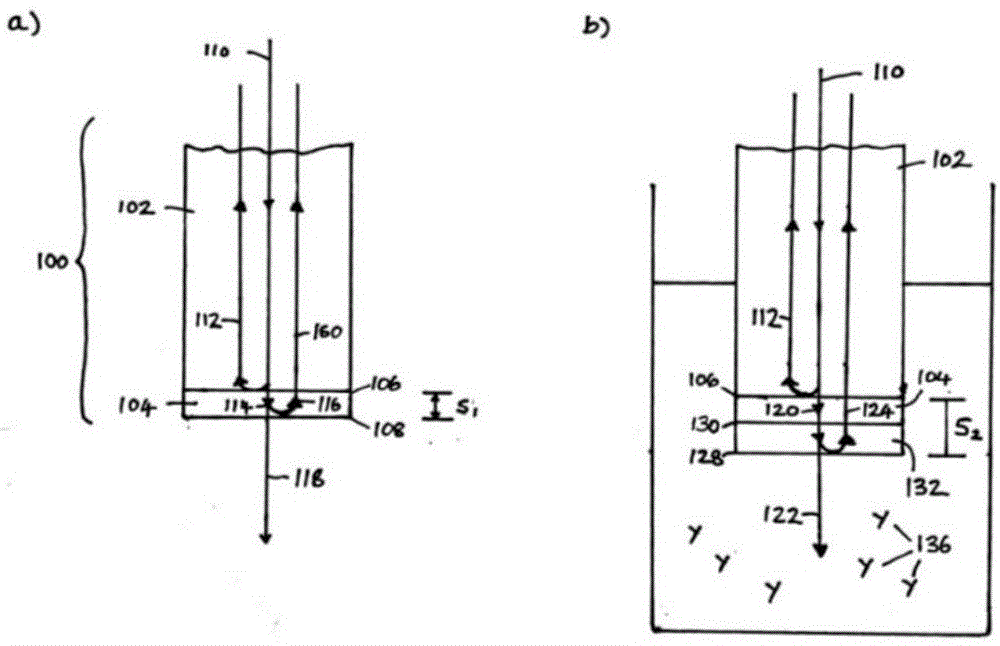
:lag-3蛋白是具有四个细胞外免疫球蛋白超家族结构域的cd4i同源型膜蛋白。与cd4相似,lag-3在t细胞的表面处低聚化,并且结合抗原递呈细胞(apc)上的mhcii类分子,但具有比cd4显著更高的亲和力。lag-3在活化的cd4+和cd8+t淋巴细胞上表达,其中它与细胞表面处的cd3/t细胞受体复合物缔合并且负向调节信号转导。因此,它负向调节t细胞增殖、功能和体内平衡。与效应或记忆t细胞相比,lag-3在耗竭的t细胞上被上调。lag-3也在肿瘤浸润淋巴细胞(til)上被上调,并且使用抗lag-3抗体阻断lag-3可以增强抗肿瘤t细胞应答。imp321是重组的、可溶性lag-3ig融合蛋白,其以高亲合力结合mhcii类。它是靶向mhcii类阳性抗原递呈细胞(apc)的第一类免疫增强剂(fougeray等:asolublelag-3proteinasanimmunopotentiatorfortherapeuticvaccines:preclinicalevaluationofimp321.vaccine2006,24:5426-5433;brignone等:imp321(slag-3)safetyandtcellresponsepotentiationusinganinfluenzavaccineasamodelantigen:asingle-blindphaseistudy.vaccine2007,25:4641-4650;brignone等:imp321(slag-3),animmunopotentiatorfortcellresponsesagainstahbsagantigeninhealthyadults:asingleblindrandomisedcontrolledphaseistudy.jimmunebasedthervaccines2007,5:5;brignone等:asolubleformoflymphocyteactivationgene-3(imp321)inducesactivationofalargerangeofhumaneffectorcytotoxiccells.jimmunol2007,179:4202-4211)。imp321已在先前治疗的晚期肾细胞癌患者中测试,已知在通过3个月之内的重复注射所治疗的所有患者中,imp321是免疫抑制性的并且显示出诱导循环活化的cd8t细胞和长寿命的效应记忆cd8t细胞的百分比增加,而没有任何可检测的毒性(brignone等:aphaseipharmacokineticandbiologicalcorrelativestudyofimp321,anovelmhcclassiiagonistinpatientswithadvancedrenalcellcarcinoma.clincancerres2009,15:6225-6231)。仅几个ng/ml浓度的imp321已显示在体外对apc是具有活性的,这显示了imp321作为免疫系统的激动剂的巨大潜力(brignone,等,2009,同上)。在转移性乳腺癌(mbc)患者的研究中,brignone等(first-linechemoimmunotherapyinmetastaticbreastcarcinoma:combinationofpaclitaxelandimp321(lag-3ig)enhancesimmuneresponsesandantitumoractivity.journaloftranslationalmedicine2010,8:71)证明imp321使imp321结合的初级靶细胞(mhcii类阳性单核细胞/树突细胞)和随后被活化的次级靶细胞(nk/cd8+效应记忆t细胞)两者扩增并且活化数个月。通过汇集来自所有30名患者的结果并且将肿瘤消退与适当的历史对照组进行比较,他们看到客观应答率加倍,这表明imp321在此临床环境中是有效的抗癌细胞免疫应答的强力激动剂。wo99/04810描述了lag-3蛋白或其片段或衍生物作为佐剂用于疫苗接种,和在癌症治疗中的用途。lag-3蛋白或其片段或衍生物用于治疗癌症和感染性疾病的用途描述于wo2009/044273中。考虑到lag-3及其片段或衍生物的医学用途,存在对提供符合优良生产规范(gmp)的所述化合物的制剂的需要。所述规范是需要的以便符合控制活性药物产品的授权和生产许可以及销售的机构所推荐的指导方针。这些指导方针提供药品制造商必须满足的最低要求,以确保产品质量高,并且不会对消费者或公众构成任何风险。作为蛋白质的gmp级制造中的质量控制程序的一部分,有必要确定所述化合物的制剂是否保持高水平的生物活性。然而,我们已发现,用于测定蛋白质-蛋白质相互作用的若干种常规方法不适于测定lag-3衍生物imp321与在免疫细胞表面上表达的mhcii类分子的特异性结合。具体地说,荧光活化细胞分选法(facs)不适于区分具有结合mhcii类表达细胞的不同能力的imp321制剂。对于使用facs获得的结合曲线,在imp321浓度增加时没有观察到上平台。这阻止了对不同制剂的相对效力的计算,所述计算需要收敛的平台(平行度)。我们还已发现,imp321非特异性结合用于mesoscalediscovery(msd)电致化学发光(ecl)测定和酶联免疫吸附测定(elisa)的板。虽然通过使用酪蛋白作为封闭试剂使imp321与用于elisa和msd测定的板的非特异性结合显著降低,但是这降低了msd测定中的绝对信号。对于使用其中表达mhcii类分子的细胞被固定到msd板的测定法所获得的结合曲线,没有观察到上平台。还测试了不同的elisa技术,其中将表达mhcii类分子的细胞在imp321结合后转移至另一个板,以便最小化imp321与板的非特异性结合的影响。然而,发现孔与孔的信号变化是不可接受的。鉴于此,结论是,在用于测试gmp级产品的质量控制测定中,msdecl测定或elisa测定均不能用于测定imp321与固定化细胞的特异性结合。因此,需要提供一种用于测定lag-3蛋白或其片段、衍生物或类似物的制剂的mhcii类结合活性的适合用作所述化合物的gmp级生产中的质量控制测定的方法。技术实现要素:根据本发明,提供了一种用于测定包含淋巴细胞活化基因-3(lag-3)蛋白或其片段、衍生物或类似物的制剂的mhcii类结合活性的方法,其中所述方法包括使用生物层干涉术(bli)测定lag-3蛋白、片段、衍生物或类似物与mhcii类分子的结合。术语“生物层干涉术(bli)”在本文中用于指基于相移干涉术的光纤测定,例如如美国专利号5,804,453(chen)中所述。对bli技术的开发,包括旨在增强分析物检测的灵敏度和准确性的开发,描述于fortebio公司的wo2005/047854和wo2006/138294中。us5,804,453描述了用于检测结合光纤端表面的分析物探针、方法和系统。分析物检测是基于由分析物分子与表面的结合产生的光纤端表面处的厚度变化的,其中更大量的分析物产生干涉信号的更大的与厚度相关的变化。干涉信号的变化归因于从光纤端部反射的光与从光纤端部上携带的结合层反射的光之间的相移,如us5,804,453的图7a和图7b中具体示出的。us5,804,453中描述的探针包括具有近端尖端和远端尖端的光纤部分以及设置在远端尖端上的试剂层。试剂层与被检测的物质(分析物)反应(或键合)。光纤部分具有第一折射率,而试剂层具有第二折射率。当任何物质键合到试剂层时,形成包括所述试剂层和所述物质的所得层。所得层可以被处理为具有均匀的折射率。所述方法允许使用光纤探针来测定样品溶液中的物质的浓度。所述方法包括以下步骤:(i)将光纤探针的远端浸入样品溶液中,(ii)使光源与光纤探针的近端光学耦合,(iii)检测从光纤部分的远端表面与试剂层之间的界面反射的至少第一光束,以及从试剂层与样品溶液之间的界面反射的、从光纤探针的远端反射的第二光束,(iv)在第一时间检测由第一光束和第二光束形成的干涉图案,(v)在第二时间检测由第一光束和第二光束形成的干涉图案,以及(vi)基于干涉图案中是否发生偏移来确定所述物质是否存在于样品溶液中。所述物质的浓度可基于干涉图案的偏移并且基于第一时间与第二时间之间的差来确定。用于检测样品溶液中的物质浓度的系统具有用于提供光束的光源、光纤探针、检测器、光纤耦合器、光纤连接器以及处理器。光纤耦合器包括:具有用于接收入射光束的近端的第一光纤部分、具有用于将反射的干涉光束递送到检测器的近端的第二光纤部分,以及具有用于连接到光纤探针的远端的第三光纤部分。光纤探针包括用于连接到光纤耦合器的近端和具有设置在其上的试剂层的远端尖端。光纤探针产生来自入射光束的至少第一反射光束和第二反射光束。检测器检测由第一反射光束和第二反射光束形成的干涉图案。耦合器使光源与光纤探针光学耦合并且使光纤探针与检测器光学耦合。处理器测定与在第一时间由检测器检测到的干涉图案相关联的相位、测定与在第二时间由检测器检测到的干涉图案相关联的相位,并且基于与在第一时间和第二时间由检测器检测到的干涉图案相关联的相位的偏移确定物质的浓度。我们已了解到,bli技术可用于测定lag-3蛋白或其片段、衍生物或类似物的制剂的mhcii类结合活性,并且所述方法尤其可用作所述化合物的gmp级生产中的质量控制测定。在特定实施方案中,本发明的方法包括测定lag-3蛋白、片段、衍生物或类似物与mhcii类表达细胞上存在的mhcii类分子的结合。在所述实施方案中,可将lag-3蛋白、片段、衍生物或类似物固定到bli探针的试剂层,并且mhcii类表达细胞是在溶液中的。根据本发明,可以使用us5,804,453中描述的探针、方法和系统来测定lag-3蛋白或其片段、衍生物或类似物的制剂的mhcii类结合活性,如以下通过重组lag-3蛋白衍生物imp321与mhcii类表达raji细胞的结合所示例的。参考下图1a,生物传感器探针100包括光纤102和在光纤102的远端尖端处的试剂层104,所述试剂层104包含封闭试剂(例如bsa)和imp321。通过将尖端浸入具有预定浓度imp321的溶液或封闭试剂中持续预定的时间段,可将封闭试剂和imp321结合到光纤102的尖端。入射光束110通过光纤102朝向其远端发送。在限定在具有第一折射率的光纤102与具有第二折射率的试剂层104之间的界面106处,入射光束110的第一部分112被反射,而入射光束110的第二部分114继续穿过试剂层104。通常,从光学角度来看,封闭试剂和imp321相对于入射光束110的波长是较小的,因此封闭试剂和imp321可以被处理为形成单一试剂层104。在限定在试剂层104的暴露表面处的界面108处,在入射光束110的第二部分114之中,第一部分116被反射,而第二部分118进入相邻介质。在入射光束110的第二部分114的第一部分116之中,第一部分160通过光纤102被传回,而第二部分(未示出)在界面106处被反射回到试剂层104中。在光纤102的近端处,检测并分析反射光束112和160。在沿着光纤102的任何给定点处(包括其近端),反射光束112和160将表现出相位差。基于此相位差,可以确定试剂层104的厚度s1。参考下图1b,将探针100浸入含有raji细胞136的溶液134中,以测定细胞与固定化imp321的结合。细胞136结合试剂层104中的固定化imp321,从而在一段时间内形成细胞层132。层的厚度s2是探针100在样品流体134中的浸渍时间和样品流体134中的细胞136的浓度的函数。样品溶液中的其他分子138(未示出)不结合试剂层104。此组合层的总厚度s2大于单独试剂层104的厚度s1。因此,类似于图1a的探针100,当入射光束110被引导朝向光纤102的远端尖端时,在光纤102与组合层之间的界面106处,入射光束110的第一部分112被反射,而入射光束110的第二部分120继续通过组合层。当第二部分120到达细胞层132的细胞时,它的第一部分(未示出)将在其遇到细胞的细胞膜和细胞骨架结构时被反射。在组合层与样品溶液134之间的第二界面128处,入射光束110的第二部分120的第二部分124被反射,而入射光束110的第二部分120的第三部分122继续通过样品溶液134。在入射光束110的第二部分120的第二部分124之中,第一部分126继续返回通过光纤102,而第二部分(未示出)在界面106处被反射回到组合层中。在光纤102的近端,检测并分析反射光束112和126。在沿着光纤102的任何给定点处(包括其近端),反射光束112和126将表现出相位差。基于此相位差,可以确定组合层的厚度s2。通过测定组合层的厚度s2与试剂层104的厚度s1之间的差值,可以测定细胞层132的厚度。在离散的时间点测定(或“采样”)组合层的厚度s2。以这种方式,可以测定组合层的厚度s2与试剂层104的厚度s1之间的差值的增长率(即,细胞层132的厚度增长率)。基于此速率,可以在非常短的孵育期内测定固定化imp321与raji细胞上的mhcii类分子的结合速率。raji细胞的直径为大约5-7μm,为光的波长的1000倍,因此可预期会影响所获得的结果。然而,信号读出为约1-2nm,这表明光在细胞表面附近被反射。我们已发现,信号变化是可重复的、与细胞结合相关,并且结合速率变化是在测量范围内的,因此可以用于测定raji细胞与固定在光纤尖端处的imp321的结合。制剂的mhcii类结合活性可被测定为lag-3蛋白、片段、衍生物或类似物与mhcii类分子的结合速率。我们已发现,使用bli测定获得的结合速率取决于溶液中mhcii类表达细胞的密度,而当非mhcii类表达细胞的密度增加时,结合速率低且相对平缓。如果mhcii类表达细胞以至少4e6/ml,优选至少6e6/ml或8e6/ml的密度存在,则获得更高的速率以及更高的结合曲线的上平台。我们已发现,当已用封闭试剂预处理bli探针的试剂层以最小化mhcii类表达细胞与试剂层的非特异性结合时,bli测定的特异性被改善。可以使用任何合适的封闭试剂,例如包括诸如白蛋白(例如牛血清白蛋白(bsa))的惰性蛋白的封闭试剂。mhcii类表达细胞可以是表达mhcii类分子的免疫细胞。合适的实例包括抗原递呈细胞或源自免疫细胞的细胞系的细胞。在特定实施方案中,mhcii类表达细胞是b细胞或b细胞系的细胞,例如raji细胞。我们已发现,用于本发明方法的mhcii类表达细胞可以是从冷冻储备溶液获得的解冻的、即用型细胞。使用所述细胞消除了在进行本发明的方法之前立即培养细胞的需求,这可以帮助确保通过本发明方法获得的结果的可靠性和再现性,并且还可以允许比较在不同时间获得的结果。本发明的方法可包括针对多种不同浓度的lag-3蛋白、片段、衍生物或类似物,测定lag-3蛋白、片段、衍生物或类似物与mhcii类分子的结合速率,以及产生针对结合速率的剂量-应答曲线,例如如以下实施例6中所述。本发明的方法还可包括在与用于测定制剂的lag-3蛋白、片段、衍生物或类似物的结合相同的条件下,通过使用bli测定参比样品的lag-3蛋白、片段、衍生物或类似物与mhcii类分子的结合来测定lag-3蛋白或其片段、衍生物或类似物的参比样品的mhcii类结合活性,以及将针对参比样品测定的mhcii类结合活性与针对制剂测定的mhcii类结合活性进行比较。在预定浓度下,参比样品的mhcii类结合活性可被设定为100%,并且稀释至各种所需浓度,例如以便允许鉴定或验证使用本发明方法进行的包含lag-3蛋白或其片段、衍生物或类似物的制剂的mhcii类结合活性的测量。在一些实施方案中,参比样品包含lag-3蛋白或其片段、衍生物或类似物,所述lag-3蛋白或其片段、衍生物或类似物已进行处理以降低其mhcii类结合活性。合适的处理包括,例如,去糖基化(例如通过用pngase处理)、在37℃下储存至少12天、氧化(例如通过用1%或0.1%过氧化氢处理)、用酸或碱处理、或暴露于光至少5天。以下实施例6详细描述了用于测定固定化imp321与溶液中raji细胞的mhcii类结合活性的bli测定。根据本发明还提供了一种用于测定lag-3蛋白或其片段、衍生物或类似物的mhcii类结合活性的bli探针,所述bli探针包括lag-3蛋白或其片段、衍生物或类似物所固定化到的试剂层。还提供了一种用于测定lag-3蛋白或其片段、衍生物或类似物的mhcii类结合活性的试剂盒,所述试剂盒包括具有lag-3蛋白或其片段、衍生物或类似物所固定化到的试剂层的bli探针,和mhcii类表达细胞。在一些实施方案中,已用封闭试剂预处理bli探针的试剂层以最小化mhcii类表达细胞与试剂层的非特异性结合。可以使用任何合适的封闭试剂,例如包括诸如白蛋白(例如牛血清白蛋白(bsa))的惰性蛋白的封闭试剂。在一些实施方案中,mhcii类表达细胞是冷冻细胞。在一些实施方案中,mhcii类表达细胞是raji细胞。mhcii类表达细胞可以至少1e6/ml,优选至少4e6/ml或8e6/ml的密度存在。本发明的试剂盒还可包括例如如上所述的参比样品,所述参比样品包含lag-3蛋白或其片段、衍生物或类似物。优选地,参比样品的mhcii类结合活性是已知的(例如,如通过ccl4释放测定法所测定的,如下所述)。本发明的探针和试剂盒可用于本发明的方法中。lag-3蛋白可以是分离的天然或重组lag-3蛋白。lag-3蛋白可包含来自任何合适物种的lag-3蛋白的氨基酸序列,所述lag-3蛋白为诸如灵长类动物或鼠类lag-3蛋白,但优选人lag-3蛋白。人和鼠类lag-3蛋白的氨基酸序列提供于huard等(proc.natl.acad.sci.usa,11:5744-5749,1997)的图1中。在下图25中人lag-3蛋白的序列是重复的(seqidno:1)。在huard等的图1中还将人lag-3的四个细胞外ig超家族结构域(d1、d2、d3和d4)的氨基酸序列鉴定为在氨基酸残基:1-149(d1);150-239(d2);240-330(d3);以及331-412(d4)处。lag-3蛋白的衍生物包括能够结合mhcii类分子的lag-3蛋白的可溶性片段、变体或突变体。能够结合mhcii类分子的lag-3蛋白的若干种衍生物是已知的。所述衍生物的许多实例描述于huard等(proc.natl.acad.sci.usa,11:5744-5749,1997)中。此文献描述了对lag-3蛋白上mhcii类结合位点的表征。描述了用于制备lag-3突变体的方法,以及用于测定lag-3突变体结合ii类阳性daudi细胞的能力的定量细胞粘附测定。测定lag-3的若干种不同突变体与mhcii类分子的结合。一些突变能够降低ii类结合,而其他突变增加lag-3对ii类分子的亲和力。对结合mhcii类蛋白所必需的许多残基聚集在lag-3d1结构域中大的30个氨基酸额外环结构的碱基处。人lag-3蛋白的d1结构域的额外环结构的氨基酸序列是gppaaapghplapgphpaapsswgprprry(seqidno:2),即图25中加下划线的序列。lag-3蛋白衍生物可包含人lag-3d1结构域的30个氨基酸的额外环序列,或具有一个或多个保守氨基酸取代的所述序列的变体。变体可包含与人lag-3d1结构域的30个氨基酸的额外环序列具有至少70%、80%、90%或95%的氨基酸同一性的氨基酸序列。lag-3蛋白的衍生物可包含lag-3蛋白(优选人lag-3蛋白)的结构域d1和任选结构域d2的氨基酸序列。lag-3蛋白的衍生物可包含与lag-3蛋白(优选人lag-3蛋白)的结构域d1或与结构域d1和d2具有至少70%、80%、90%或95%的氨基酸同一性的氨基酸序列。lag-3蛋白的衍生物可包含lag-3蛋白(优选人lag-3蛋白)的结构域d1、d2、d3和任选的d4的氨基酸序列。lag-3蛋白的衍生物可包含与lag-3蛋白(优选人lag-3)的结构域d1、d2和d3或与结构域d1、d2、d3和d4具有至少70%、80%、90%或95%的氨基酸同一性的氨基酸序列。氨基酸序列之间的序列同一性可以通过比较序列比对来确定。当所比较序列中的等同位置被相同的氨基酸占据时,则分子在那个位置上是相同的。按照同一性百分比计分比对是由比较的序列共享的位置处相同氨基酸的数目的函数。当比较序列时,最佳比对可能需要有待引入一个或多个序列的空位以考虑序列中可能的插入和缺失。序列比较方法可采用空位罚分,使得在比较的序列中相同分子的数目相同的情况下,具有尽可能少的空位、反映了两个比较序列之间的更高相关性的序列比对将比具有许多空位的序列获得更高的分数。计算最大的同一性百分比涉及考虑空位罚分而产生最佳比对。用于进行序列比较的合适的计算机程序在商业和公共部门中是广泛可获得的。实例包括matgat(campanella等,2003,bmcbioinformatics4:29;获自http://bitincka.com/ledion/matgat的程序)、gap(needleman和wunsch,1970,j.mol.biol.48:443-453)、fasta(altschul等,1990,j.mol.biol.215:403-410;获自http://www.ebi.ac.uk/fasta的程序)、clustalw2.0和x2.0(larkin等,2007,bioinformatics23:2947-2948;获自http://www.ebi.ac.uk/tools/clustalw2的程序)以及embosspairwisealignmentalgorithms(needleman和wunsch,1970,同上;kruskal,1983,in:timewarps,stringeditsandmacromolecules:thetheoryandpracticeofsequencecomparison,sankoff和kruskal(编),第1-44页,addisonwesley;获自http://www.ebi.ac.uk/tools/emboss/align的程序)。所有程序均可使用默认参数运行。例如,可使用embosspairwisealignmentalgorithms的“针”方法进行序列比较,当在它们的全长上考虑时,其所述方法测定两个序列的最佳比对(包括空位)并且提供同一性百分比得分。用于氨基酸序列比较(“蛋白质分子”选项)的默认参数可以是空位扩展罚分:0.5,空位开放罚分:10.0,矩阵:blosum62。可在参比序列的全长上进行序列比较。lag-3蛋白衍生物可任选地通过接头氨基酸序列与免疫球蛋白fc氨基酸序列(优选人igg1fc氨基酸序列)融合。lag-3蛋白的衍生物结合mhcii类分子的能力可使用如huard等(同上)中所述的定量细胞粘附测定来测定。lag-3蛋白的衍生物对mhcii类分子的亲和力可以是人lag-3蛋白对ii类分子的亲和力的至少20%、30%、40%、50%、60%、70%、80%、90%或100%。优选地,lag-3蛋白的衍生物对mhcii类分子的亲和力是人lag-3蛋白对ii类分子的亲和力的至少50%。能够结合mhcii类分子的lag-3蛋白的合适衍生物的实例包括包括以下各项的衍生物:人lag-3序列的氨基酸残基23至448;lag-3的结构域d1和d2的氨基酸序列;lag-3的结构域d1和d2的氨基酸序列,所述氨基酸序列在以下位置的一个或多个处具有氨基酸取代:位置73,其中arg被glu取代;位置75,其中arg被ala或glu取代;位置76,其中arg被glu取代;位置30,其中asp被ala取代;位置56,其中his被ala取代;位置77,其中tyr被phe取代;位置88,其中arg被ala取代;位置103,其中arg被ala取代;位置109,其中asp被glu取代;位置115,其中arg被ala取代;lag-3的结构域d1的氨基酸序列,所述氨基酸序列缺失了氨基酸残基54至66;可溶性重组人lag-3ig融合蛋白(imp321)-在用编码与人igg1fc融合的hlag-3的细胞外结构域的质粒转染的中国仓鼠卵巢细胞中产生的200-kda二聚体。imp321的序列在us2011/0008331的seqidno:17中给出。附图说明本发明的实施方案仅以举例的方式参考以下附图进行了描述,在附图中:图1示出根据本发明实施方案的用于测定lag-3蛋白或其片段、衍生物或类似物的mhcii类结合活性的探针的操作(图取自美国专利号5,804,453);图2示出用于测定imp321与raji细胞的结合的facs测定的结果;图3示意性地示出用于测定imp321与raji细胞的结合的mesoscalediscovery(msd)电致化学发光(ecl)测定;图4(a)示出在存在和不存在raji细胞下,对于在不同浓度imp321下的msd测定获得的ecl信号的曲线图;图4(b)示出在存在和不存在raji细胞下,对于在不同浓度rituxan下的msd测定获得的ecl信号的曲线图;图5(a)示出在用5%bsa或10%fbs封闭elisa板后,对于在不同浓度的imp321下的elisa获得的od信号的曲线图;图5(b)示出在用于pbs中的30%fbs封闭elisa板后,对于在不同浓度的imp321或rituxan下的elisa获得的od信号的曲线图;图5(c)示出在用于rpim1640中的5%bsa封闭elisa板后,对于在不同浓度的imp321或rituxan下的elisa获得的od信号的曲线图;图6(a)示出在用不同的封闭试剂(1%脱脂奶、3%脱脂奶、酪蛋白)封闭elisa板后,对于在不同浓度的imp321或rituxan下的elisa获得的od信号的曲线图;图6(b)示出在用不同的封闭试剂(1%明胶、3%明胶或pbs)封闭elisa板后,对于在不同浓度的imp321或rituxan下的elisa获得的od信号的曲线图;图7(a)示出针对不同接种密度的raji细胞,对于在不同浓度的imp321下的msd测定获得的原始ecl信号的曲线图;图7(b)示出针对不同接种密度的raji细胞,对于在不同浓度的imp321下的msd测定获得的特异性ecl信号的曲线图;图8示出在用酪蛋白封闭msd板后,对于针对不同浓度的imp321与raji细胞或hla-drdiml929细胞的结合的msd测定获得的ecl信号的曲线图;图9(在左侧)示意性地示出bli探针,所述bli探针具有蛋白a缀合的传感器和固定化到传感器的光纤的远端尖端的imp321,其中传感器的尖端浸没在含有raji细胞的样品溶液中。所述方法的基本步骤在图的右侧列出;图10(a)示出在bli测定中获得的结合信号的曲线图,所述bli测定是针对在缔合步骤中固定化imp321与溶液中raji细胞的剂量依赖性结合的;图10(b)示出在bli测定中imp321剂量依赖性结合raji细胞的标准曲线;图11(a)示出在bli测定中,固定化的imp321与溶液中不同浓度的raji细胞(其是mhcii类表达细胞)或jurkat细胞(其不是mhcii类表达细胞)结合的缔合与解离曲线;图11(b)示出针对不同raji细胞浓度获得的结合信号的图;图12(a)示出在bli测定中固定化imp321、humira或avastin与溶液中raji细胞结合的缔合与解离曲线;图12(b)示出针对不同的固定化蛋白获得的结合信号的图;图13示出针对imp321的不同的固定化制剂与溶液中raji细胞的结合,通过bli测定测量的百分比结合效力相对于其预期效力的曲线图;图14(a)示出针对不同浓度的固定化imp321与溶液中先前培养的raji细胞的结合,通过bli测定获得的结合信号的曲线图;图14(b)示出针对不同浓度的固定化imp321与溶液中先前冷冻的raji细胞的结合,通过bli测定获得的结合信号的曲线图;图15(a)示出针对不同浓度的固定化imp321或去糖基化imp321与raji细胞的结合,通过基于细胞的测定获得的下游ccl4释放的曲线图;图15(b)示出针对不同浓度的固定化imp321或去糖基化imp321与raji细胞的结合,通过bli测定获得的结合信号的曲线图;图16示出不同浓度的固定化imp321或不适当地储存(在37℃下持续12天)的imp321与raji细胞的结合信号的曲线图。图16(a)所示的结果通过测量ccl4释放的基于细胞的测定获得,并且图16(b)所示的结果通过bli测定获得;图17示出不同浓度的固定化imp321或不适当地储存(在37℃下持续1个月)的imp321与raji细胞的结合信号的曲线图。图17(a)所示的结果通过测量ccl4释放(relase)的基于细胞的测定获得,并且图17(b)所示的结果通过bli测定获得;图18示出针对不同浓度固定化的未处理的imp321或氧化的imp321(使用有1%过氧化氢)与raji细胞的结合,通过测量ccl4释放的基于细胞的测定(图18a)或通过bli测定(图18b)获得的信号的曲线图;图19示出针对不同浓度固定化的未处理的imp321或氧化的imp321(使用0.1%过氧化氢)与raji细胞的结合,通过测量ccl4释放的基于细胞的测定(图19a)或通过bli测定(图19b)获得的信号的曲线图;图20示出针对不同浓度的未处理或酸处理(在ph3.0下)的固定化imp321与raji细胞的结合,通过测量ccl4释放的基于细胞的测定(图20a)或通过bli测定(图20b)获得的信号的曲线图;图21示出针对不同浓度的未处理或酸处理(在ph3.1或ph3.6下)的固定化imp321与raji细胞的结合,通过测量ccl4释放的基于细胞的测定(图21a)或通过bli测定(图21b)获得的信号的曲线图;图22示出针对不同浓度的未处理或碱处理(在ph9.2或ph9.75下)的固定化imp321与raji细胞的结合,通过测量ccl4释放的基于细胞的测定(图22a)或通过bli测定(图22b)获得的信号的曲线图;图23示出针对不同浓度的未处理或暴露于光(在25℃下持续5天)的固定化imp321与raji细胞的结合,通过测量ccl4释放的基于细胞的测定(图23a)或通过bli测定(图23b)获得的信号的曲线图;图24示出针对不同浓度的未处理或暴露于光(在25℃下持续10天)的固定化imp321的结合,通过测量ccl4释放的基于细胞的测定(图24a)或通过bli测定(图24b)获得的信号的曲线图;以及图25示出成熟的人lag-3蛋白的氨基酸序列。四个细胞外ig超家族结构域在氨基酸残基:1-149(d1);150-239(d2);240-330(d3);以及331-412(d4)处。人lag-3蛋白的d1结构域的额外环结构的氨基酸序列以粗体形式的下划线显示。具体实施方式以下实施例1至5描述了对各种不同的结合测定的评价,以确定它们是否适合用作重组lag-3蛋白衍生物imp321的gmp级生产的质量控制测定。发现所述测定中没有一个是合适的。实施例6至11描述了基于细胞的bli方法,并且证明了它们适合用于测定imp321制剂的mhcii类结合活性。实施例1评价荧光活化细胞分选(facs)测定用于测定imp321与raji细胞的结合的用途进行facs测定以测定imp321与raji细胞的结合。测试具有100%、75%和50%mhcii类结合活性的imp321样品。具有100%活性的样品是在预定浓度下具有已知mhcii类结合活性的参比样品。通过稀释参比样品来制备具有75%和50%活性的样品。获得的结合曲线示出在图2中。它们显示没有达到上平台,因此在具有100%活性的参比样品与其他样品的结合曲线之间没有平行度。这阻止了不同样品的相对效力的计算。实施例2评价mesoscalediscovery(msd)测定用于测定imp321与raji细胞的结合的用途本实施例描述了对用于测定imp321与raji细胞的结合的mesoscalediscovery(msd)测定的评价。mesoscalediscovery平台(msd-ecl)使用与检测抗体缀合的电致化学发光标记。当在适当的化学环境中被电刺激时,这些标记产生光,然后可用于测量关键蛋白质和分子。通过mesoscalediscovery平台(msd-ecl)将电力施加到板电极,从而使得标记产生光发射。然后测量光强度以定量样品中的分析物。检测过程在位于mesoscalediscovery(msd-ecl)微板底部中的电极处开始,并且仅电极附近的标记被激发和检测。所述系统采用具有高浓度三丙胺的缓冲液作为催化剂用于使用钌的双重氧化还原(redux)反应,从而在620nm处发射出光。所使用的msd测定在图3中示意性示出。简单来说,将每孔大约2×104个细胞的于pbs中的raji细胞以25ul/孔接种到single-spot96孔msd板(mesoscalediscovery,gaithersburg,md)中。将板在室温下孵育1-1.5小时,然后用封闭缓冲液(25ul/孔)封闭。然后将imp321参比标准品或样品的连续稀释液以50ul/孔加载到复孔中。在室温下孵育约1小时后,使用钌缀合的抗人fc以50ul/孔来检测结合的imp321。使用没有表面活性剂的msd读数缓冲区来获得电致化学发光信号。在测定范围内,ecl计数应与结合到细胞表面上的imp321成比例。微板底部的高结合碳电极允许方便raji细胞的附着。所述测定使用与抗imp321抗体缀合的电致化学发光标记。通过msd仪器将电力施加到板电极,从而使得标记产生光发射。然后测量光强度以定量结合到固定化raji细胞表面上的mhc类分子的imp321的存在。在具有和不具有raji细胞的情况下针对含有imp321的样品获得的结果示出在图4(a)中,并且在具有和不具有raji细胞的情况下针对含有rituxan的样品获得的结果示出在图4(b)中。结果显示,在不存在raji细胞的情况下观察到imp321与msd板的非特异性结合。相比之下,观察到rituxan与raji细胞的特异性结合。raji细胞是在1963年源自11岁的尼日利亚伯基特氏淋巴瘤(nigerianburkitt'slymphoma)男性患者的b淋巴细胞的细胞系的细胞。rituxan(利妥昔单抗(rituximab))是针对蛋白质cd20的嵌合单克隆抗体,所述嵌合单克隆抗体主要发现于b细胞的表面上。实施例3评价imp321与elisa板的非特异性结合本实施例描述了对于imp321和rituxan与用于使用不同封闭试剂的酶联免疫吸附测定(elisa)的板的非特异性结合的评价。简单来说,将微板在25℃下用封闭试剂封闭2小时。用稀释缓冲液将样品和rituxan对照稀释至2μg/ml,然后通过两倍连续稀释进一步稀释。在加入稀释的样品并进行孵育之前和之后,洗涤微板并将所述微板充分排干。在与二级抗体孵育后,通过使用spectramaxm2(450-650nm)的光谱测定来测量信号。测试结果在图5中示出。图5(a)示出使用增加浓度的imp321和用5%bsa或10%fbs封闭的elisa板的elisa的结果。图5(b)示出使用增加浓度的imp321或rituxan和用于pbs中的30%fbs封闭的elisa板的elisa的结果。图5(c)示出使用增加浓度的imp321或rituxan和用于rpim1640中的5%bsa封闭的elisa板的elisa的结果。结果显示,当使用bsa或fbs作为封闭试剂时,imp321与elisa板存在严重的非特异性结合,而rituxan并不如此。然后用imp321或rituxan测试各种不同类型的封闭试剂,以看看imp321与elisa板的非特异性结合是否可以被消除。将结果在图6中示出。图6(a)示出使用1%脱脂奶、3%脱脂奶或blockercasein封闭缓冲液(thermo)作为封闭试剂的imp321或rituxan的结果。图6(b)示出使用1%明胶、3%明胶或pbs作为封闭试剂的imp321或rituxan的结果。结果显示,酪蛋白是用于imp321与elisa板的非特异性结合的最佳封闭试剂。实施例4评价使用酪蛋白封闭缓冲液的mesoscalediscovery(msd)测定用于测定imp321与raji细胞的结合的用途本实施例描述了对使用酪蛋白封闭缓冲液测定imp321与不同接种密度下的raji细胞的结合的msd测定的评价。类似于实施例2中所述,进行msd测定,以评价在本实施例中观察到的imp321与msd板的非特异性结合是否可以使用酪蛋白封闭缓冲液而最小化。将结果在图7中示出。图7(a)示出在不同浓度的imp321下imp321与不同接种密度的raji细胞(0-5×104个细胞/孔)的结合的结果。结果显示出最大imp321结合的细胞密度依赖性增加。图7(b)示出imp321与不同接种密度的raji细胞(1×103-5×104个细胞/孔)的特异性结合的结果。结果显示出特异性imp321结合的细胞密度依赖性增加。使用用酪蛋白封闭缓冲液的msd测定,在不同浓度的imp321下,将imp321与raji细胞的结合与imp321与hla-drdiml929细胞(这些细胞不表达mhcii类)的结合进行比较。l929是从品系l克隆的成纤维细胞样细胞系。将结果在图8中示出。结果显示,在酪蛋白封闭剂的存在下imp321与msd板的非特异性结合显著降低。然而,特异性结合信号是低的,并且没有观察到imp321剂量-结合曲线的上平台。结论是,使用酪蛋白封闭缓冲液的msd测定不能用于证明imp321与板固定化raji细胞的特异性结合。实施例5评价elisa测定用于测定imp321与raji细胞的结合的用途本实施例描述了对基于细胞的直接elisa和基于细胞的转移elisa用于测定imp321与raji细胞的结合的能力的评价。在不同封闭试剂(5%bsa、10%fbs、0.5%酪蛋白或3%明胶)的存在下进行直接elisa(类似于实施例3中所述的测定),其中使用了不同量的板固定化raji细胞(10,000、5,000或2,500个细胞)和不同浓度的imp321或用肽-n-糖苷酶f(pngasef,一种在来自n-连接糖蛋白的高甘露糖、杂合和复合寡糖的最内部glcnac与天冬酰胺残基之间进行裂解的酰胺酶)处理的imp321。用于直接elisa测定的条件总结在下表中:培养板孔imp321浓度(ng/ml)a1-121000b1-12500c1-12250d1-12125e1-1262.5f1-1231.25g1-1215.625h1-120结果在下表中示出。结果显示结合板固定化raji细胞的imp321是剂量依赖性的。为了检查imp321是否非特异性地结合elisa板,在不存在raji细胞的情况下,在下表中所总结的条件下进行直接elisa:培养板孔条件1a-g5%bsa、pngaseimp3212a-g10%fbs、pngaseimp3213a-g0.5%酪蛋白、imp3214a-g3%明胶、imp321h1-4无封闭试剂(nsb)结果在下表中示出:结果显示在不存在板固定化raji细胞的情况下,imp321与elisa板的非特异性结合是强的。酪蛋白和明胶封闭试剂以及imp321的pngase处理均未去除非特异性结合。结论是,基于细胞的直接elisa不能用于证明imp321与板固定化raji细胞的特异性结合。进行转移细胞elisa以测定不同浓度的imp321或用pngase处理的imp321与固定化raji细胞的结合。raji细胞在结合imp321或处理的imp321后被转移至另一个板。用于所述测定的条件总结在下表中:培养板孔wt或处理的imp321浓度(ng/ml)1b-d、f-h10002b-d、f-h5003b-d、f-h2504b-d、f-h1255b-d、f-h62.56b-d、f-h31.257b-d、f-h15.638b-d、f-h7.8139b-d、f-h3.90610b-d、f-h1.95311b-d、f-h0.97712b-d、f-h0结果在下表中示出:结果显示,孔与孔的信号变化对于质量控制方法是不可接受的。所述方法也是劳动密集型的。结论是,基于细胞的转移elisa不能用于证明imp321与板固定化raji细胞的特异性结合。实施例6用于使用生物层干涉术(bli)测量lag-3蛋白衍生物imp321的制剂的结合活性的基于细胞的测定imp321是对mhcii类分子具有高亲和力的lag-3蛋白的可溶性重组衍生物。本实施例描述了一种用于使用bli测量imp321与mhcii类表达raji细胞的结合活性的基于细胞的测定。所述测定简单快速,并且允许参比标准品与样品之间的比较。图9(在左侧)示意性地示出bli探针,所述bli探针具有蛋白a缀合的传感器和固定化到传感器的光纤的远端尖端的imp321,其中传感器的尖端浸没在含有raji细胞的样品溶液中。所述方法的基本步骤在图的右侧列出。在以下更详细地描述所述测定。材料:1)raji细胞:atcc/ccl-862)rpmi1640:invitrogen/22400-0893)hi-fbs:invitrogen/101001474)dpbs:hyclone/sh30028.01b5)bsa:sigma/a30326)imp321参比物7)raji细胞生长培养基:rpmi1640、10%hi-fbs8)结合测定稀释剂:dpbs、0.5%bsa9)蛋白质a托盘(fortebio-18-5010)10)96-平底孔黑色板(greiner-655209)11)单通道和多通道移液管:sartorius和eppendorf/各种12)细胞计数器:roche/cedexhires和beckman/vicell13)生物层干涉仪:fortebio/octetred,具有软件版本7.0或更高版本方法:1.即用型raji细胞的制备1)从液氮冷冻机中取出n小瓶raji细胞,并且在37℃水浴中迅速解冻。2)将小瓶内容物无菌转移到含有大约nx9mlraji细胞生长培养基的无菌离心管中。通过轻轻吹打混合均匀。3)在300xg下将细胞离心5分钟。将细胞重悬在结合测定稀释剂中,并且用细胞计数器或血细胞计数器对它们进行计数。4)将一定体积的细胞原液悬浮液添加到足够体积的结合测定稀释剂以将细胞密度调节至4.0e6-8.0e6细胞/ml,并且保存在冰上以备使用。2.imp321参比标准品、对照品和样品的制备注意:1)使用反向移液以确保准确性。2)轻轻涡旋以避免产生泡沫和气泡或使所述产生最小化1)参比标准品制备:1.1)根据需要解冻一瓶imp321参比物。在2-8℃下储存。到期日为从解冻日期开始的第7天1.2)将imp321参比物在制剂缓冲液中稀释至大约1.0mg/ml。新鲜制备并且新鲜使用。使用制剂缓冲液作为空白,以分光光度法测定蛋白质浓度。1.3)基于测量的蛋白质浓度,稀释rm以制备针对如下所述的适当浓度的标准曲线。通过涡旋混合稀释液。管imp321浓度imp321稀释液的体积测定稀释液的体积a~30mg/ml--b~1.0mg/ml40μla1160μlc62.5μg/ml40μlbxxxmld12.5μg/ml400μlc1600μle3125ng/ml400μld1200μlf1562.5ng/ml200μld1400μlg781.25ng/ml100μld1500μlh390.625ng/ml50μld1550μli78.125ng/ml400μlh1600μlj0-1000μl1.4)使用稀释液c-j作为标准曲线。如果需要,可使用另外的浓度,以包括曲线的线性部分以及上平台和下平台。2)对照的制备2.1)对照是来自在以上步骤1.3中制备的管c的参比物的独立稀释液。如上表中所述进行进一步稀释。通过涡旋混合稀释液。2.2)将稀释液c-j用于对照。3)样品的制备3.1)基于蛋白质浓度,将imp321样品在测定稀释剂中稀释至大约1.0mg/ml。新鲜制备并且新鲜使用。3.2)进行进一步稀释以制备针对如上表所述的适当浓度的标准曲线。通过涡旋混合稀释液。3.3)将稀释液c-j用于样品。如果需要,可使用另外的浓度,以包括曲线的线性部分以及上平台和下平台。3.octet系统中的检测步骤1)在pbs中将生物传感器水合至少10分钟2)准备测定板。在黑色聚丙烯微板中,根据以下样品板图,将每孔200μl的pbs、测定稀释剂、于ad中的imp321滴定液或raji细胞分别转移到适当的孔中:样品板图123456789101112ablblbsbeeeeebblblbsbeeeeecblblbsbeeeeedblblbsbeeeeeeblblbsbeeeeefblblbsbeeeeegblblbsbeeeeehblbbbsbeeeees=样品l=加载e=空3)使用下述参数设置来建立动力学测定。4)输入用于保存数据的位置和文件名。5)点击go来运行测定。4.分析数据1)在octet数据分析软件中,加载待分析的数据文件夹。2)在处理选项卡(tab)中,选择关联步骤。然后点击“定量所选步骤”。3)输入相应的浓度信息。4)在结果选项卡中,选择r平衡(req)作为结合速率方程。此方程符合在实验过程中产生的结合曲线,并且计算平衡时的应答以作为输出信号。5)单击计算结合速率。结果将自动显示在表中。6)点击保存报告按钮以生成msexcel报告文件。7)使用softmaxpro(一个4参数对数曲线拟合程序)来通过针对以ug/ml表示的imp321浓度的结合速率(nm)生成标准曲线或样品曲线。实例在图10中示出。8)使用参比标准品和样品的ec50比率来计算样品的相对结合效力。5.系统适用性和测定验收标准。如果测定符合所有以下标准,则所述测定是有效的:1)即用型raji细胞活力>=60%2)对照的相对活性在80%-120%内3)对照的信号与背景比(参数d/参数a)>=2。4)平行度(可比性):与标准的斜率比在0.8与1.4之间。5)如果测定对照的结果不满足上面列出的标准,则所述测定被认为是无效的。6.可报告值:1)对于临床样品,样品的可报告值定义为两个或三个有效且独立的测定结果的平均值,详述如下:%差值计算如下:绝对值(测定1结果-测定2结果)/平均值(测定1结果,测定2结果)x100%2)如果两个测定结果的%差值<=20%,则报告所述两个测定的平均结果。3)如果两个测定结果的%差值>20%,则执行1个另外的有效测定。4)如果三个样品测定结果的cv<=25%,则报告三个测定的平均结果。5)如果三个样品测定结果的cv>25%,则不存在可报告值。使用重新测试计划初始化不符值。6)如果样品的可报告值不满足coa中列出的规范,则使用重新测试计划初始不符值。7.重新测试计划如下进行样品的重新测试:1)用三个有效且独立的测定重新测试样品2)如果三个样品测定结果的cv<=25%,则报告三个测定的平均结果。3)如果三个样品测定结果的cv>25%,则不存在可报告值。4)如果重新测试结果不在coa中列出的规范(oos)之内,则结论是失败的。实施例7在bli测定中测定固定化imp321与溶液中raji细胞的特异性结合将如实施例6中所述的bli测定用于测定固定化imp321与溶液中不同浓度(8e6/ml、4e6/ml、2e6/ml、1e6/ml)的raji细胞的结合。将jurket细胞用作阴性对照。获得的缔合与解离曲线示出在图11(a)中。图11(b)示出针对不同raji细胞浓度获得的结合信号的图。结果显示结合信号依赖于raji细胞的浓度,即raji细胞的浓度越高,获得的结合速率和上平台越高。在相同测定中没有观察到jurket细胞的特异性结合。如实施例6中所述进行进一步的bli测定,但是对固定化imp321与raji细胞的结合与固定化humira或avastin的结合进行了比较。获得的缔合与解离曲线示出在图12(a)中。图12(b)示出针对不同固定化蛋白质获得的结合信号的图。结果显示imp321结合raji细胞,而humira或avastin并不如此。从这些结果得出结论,bli测定能够测定固定化imp321与溶液中的raji细胞的特异性结合。实施例8通过bli测定测量的imp321结合活性与已知结合效力的相关性将由具有不同raji细胞结合效力水平的参比标准品稀释的imp321样品用于bli测定中以确定通过所述测定测量的结合活性是否与样品的已知结合效力相关。结果在下表中示出。图13示出通过bli测定测量的结合效力百分比相对于其预期效力的曲线图;样品结合效力通过bli测定测定的效力回收率百分比50%55%110%75%80%107%100%98%98%125%135%108%150%150%100%结果显示出通过bli测定测量的结合效力与预期的结合效力之间的良好相关性。每个样品的平均回收率为90%至110%,具有良好的结合曲线平行度(即可接受的斜率比和收敛的平台)。实施例9在bli测定中使用冷冻细胞来测定mhcii类结合活性进行如实施例6中所述的bli测定来比较固定化imp321与从培养物或从冷冻储备溶液获得的溶液中的raji细胞的结合。将针对不同浓度的固定化imp321与溶液中培养的raji细胞的结合所获得的结合信号的曲线图示出在图14(a)中。将针对不同浓度的固定化imp321与溶液中先前冷冻的raji细胞的结合所获得的结合信号的曲线图示出在图14(b)中。结果显示冷冻的raji细胞与培养的raji细胞表现非常相似,并且因此冷冻储备溶液可以用于代替新鲜培养溶液,从而提供改进的测定稳定性和可转移性。实施例10在线样品测试进行如实施例6中所述的bli测定来测定imp321的各种不同制剂的mhcii类结合活性,并且通过ccl4释放测定比较所测定制剂的生物活性。thp-1是人单核白血病细胞系。当用lag-3蛋白或应激样品诱导时,thp-1细胞分泌细胞因子ccl4,其可以用ccl4elisa试剂盒来定量。ccl4释放的水平可以用于测量lag-3蛋白或其片段、衍生物或类似物的制剂的生物活性。imp321样品生物活性(ccl4释放)生物活性(结合)sd140817k01102%92%20140801-t0101%89%20140802-t0102%91%20140801-t0-pc98%102%20140802-t0-pc97%91%20140801-d-25-5d104%93%20140802-d-25-5d96%87%20140803-t0110%86%20140804-t0104%100%结论是,不同imp321样品的生物活性与通过ccl4释放测定所测定的生物活性相关。实施例11应激imp321样品的bli测定测试以及与基于细胞的ccl4释放测定的相关性使用如实施例6中所述的bli测定来测定已暴露于不同处理(通过用pngase处理进行去糖基化、在37℃下储存、通过用1%或0.1%过氧化氢处理进行氧化、在ph3.0、3.6或3.1下用酸处理、在ph9.2、9.75下用碱处理,或暴露于光下)的imp321样品的mhcii类结合活性。结果在图15-24中示出。图15(a)示出针对不同浓度的固定化imp321或去糖基化imp321与raji细胞的结合,通过基于细胞的测定获得的下游ccl4释放的曲线图;图15(b)示出针对不同浓度的固定化imp321或去糖基化imp321与raji细胞的结合,通过bli测定获得的结合信号的曲线图;图16示出不同浓度的固定化imp321或不适当地储存(在37℃下持续12天)的imp321与raji细胞的结合信号的曲线图。图16(a)所示的结果通过测量ccl4释放的基于细胞的测定获得,并且图16(b)所示的结果通过bli测定获得;图17示出不同浓度的固定化imp321或不适当地储存(在37℃下持续1个月)的imp321与raji细胞的结合信号的曲线图。图17(a)所示的结果通过测量ccl4释放(relase)的基于细胞的测定获得,并且图17(b)所示的结果通过bli测定获得;图18示出针对不同浓度固定化的未处理的imp321或氧化的imp321(使用有1%过氧化氢)与raji细胞的结合,通过测量ccl4释放的基于细胞的测定(图18a)或通过bli测定(图18b)获得的信号的曲线图;图19示出针对不同浓度固定化的未处理的imp321或氧化的imp321(使用0.1%过氧化氢)与raji细胞的结合,通过测量ccl4释放的基于细胞的测定(图19a)或通过bli测定(图19b)获得的信号的曲线图;图20示出针对不同浓度的未处理或酸处理(在ph3.0下)的固定化imp321与raji细胞的结合,通过测量ccl4释放的基于细胞的测定(图20a)或通过bli测定(图20b)获得的信号的曲线图;图21示出针对不同浓度的未处理或酸处理(在ph3.1或ph3.6下)的固定化imp321与raji细胞的结合,通过测量ccl4释放的基于细胞的测定(图21a)或通过bli测定(图21b)获得的信号的曲线图;图22示出针对不同浓度的未处理或碱处理(在ph9.2或ph9.75下)的固定化imp321与raji细胞的结合,通过测量ccl4释放的基于细胞的测定(图22a)或通过bli测定(图22b)获得的信号的曲线图;图23示出针对不同浓度的未处理或暴露于光(在25℃下持续5天)的固定化imp321与raji细胞的结合,通过测量ccl4释放的基于细胞的测定(图23a)或通过bli测定(图23b)获得的信号的曲线图;并且图24示出针对不同浓度的未处理或暴露于光(在25℃下持续10天)的固定化imp321的结合,通过测量ccl4释放的基于细胞的测定(图24a)或通过bli测定(图24b)获得的信号的曲线图。生物活性(如通过不同imp321样品的ccl4释放测定、与其mhcii类结合活性(通过如实施例6中所述的方法测定)进行比较)示出在下表中:结果显示出如通过ccl4释放测定的每个处理的imp321样品的生物活性与如通过根据本发明bli测定测定的其mhcii类结合活性之间的良好相关性。结论是,通过bli测定测定mhcii类结合活性可以用于测定imp321制剂的生物活性。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1