用于预测多肽免疫原性的基于细胞的方法与流程
用于预测多肽免疫原性的基于细胞的方法
1.相关申请的交叉引用
2.本技术要求2020年7月13日所申请的美国临时申请第63/051,157号以及2020年8月28日所申请的美国临时申请第63/071,535号的优先权,其各自内容通过引用以其全文并入本文,并要求其各自的优先权。
技术领域
3.本公开涉及用于确定多肽诱发产生抗药物抗体(ada)的倾向的方法以及进行此类方法的试剂盒。
背景技术:
4.基于多肽的治疗剂(例如抗体)极大地改善了对越来越多的严重且难治疾病的治疗。遗憾的是,此类治疗剂当施用患者时可能会诱发抗药物抗体(ada)的产生。ada可对治疗剂具有中和作用。这些中和作用可包括限制治疗剂的活性、增加治疗剂的清除率以及可能降低归因于治疗剂施用的总体临床反应。在某些情况下,ada的产生也与患者严重不良事件(包括超敏反应和过敏反应)的发生一致。
5.在药物开发的临床前阶段了解基于多肽的治疗剂的免疫原性,可改善治疗剂在后续临床阶段成功的可能性。虽然免疫原性表位通常使用计算机模拟工具来预测,但已开发了数种基于细胞的技术,以确定临床前治疗候选药物的免疫原性潜力。一种此类技术称为第ii类主要组织相容性复合体(mhc)相关肽蛋白体学(mapp)。mapp涉及将例如树突状细胞的抗原呈递细胞(apc)群与基于多肽的所关注治疗剂一起培育。apc会将治疗剂内化并加工成短肽。肽被加载到第ii类mhc分子上并呈递在apc的表面上。经由液相色谱-质谱法(lc/ms)对这些mhc-肽复合物进行免疫沉淀和分析,可鉴别基于多肽的治疗剂中潜在的免疫原性表位。另一种用于确定临床前治疗候选药物的免疫原性潜力的技术是t细胞增殖测定。t细胞增殖测定涉及在与apc(例如树突状细胞)共培养后检测t细胞增殖,这些apc已与所关注的基于多肽的治疗剂一起培育。然而,这些技术是人力密集、耗时、并且需要许多高成本设备。因此,本领域中需要一种用于确定基于多肽的治疗剂诱发ada产生的倾向的更省时且更具成本效益的方法。
技术实现要素:
6.本公开提供了用于确定多肽或其片段相对于已知参考物诱发产生抗药物抗体(ada)的倾向的方法。在某些实施例中,本文所公开的方法可包括(a)使抗原呈递细胞(apc)与多肽或其片段接触;(b)测量存在于apc的外表面上的多肽或其片段的量;(c)测量与apc缔合的多肽或其片段的总量;(d)通过从(c)中所测量的与apc缔合的多肽或其片段的总量减去(b)中所测量的与apc的外表面上结合的多肽或其片段的量来计算内化指数值;以及将(d)中的内化指数与参考内化指数比较,该参考内化指数指示已知的诱发ada产生的倾向。在某些实施例中,与该apc缔合的多肽或其片段的总量,包括存在于该apc的外表面上的多
肽或其片段的量和存在于该apc内的多肽或其片段的量。在某些实施例中,当(d)中的内化指数值大于该参考内化指数时,该多肽或其片段具有比该参考物更大的引起ada的倾向。在某些实施例中,当(d)中的内化指数值小于该参考内化指数时,该多肽或其片段具有比该参考物更小的诱发ada的倾向。
7.在某些实施例中,该多肽或其片段是肽。在某些实施例中,该多肽或其片段是重组蛋白。在某些实施例中,该多肽或其片段是抗体或其片段,例如,人抗体、人源化抗体或嵌合抗体。在某些实施例中,该多肽或其片段,例如,抗体或其片段,是单结构域抗体。在某些实施例中,该多肽或其片段,例如,抗体或其片段,是抗体-药物缀合物(adc)。
8.在某些实施例中,该apc是选自由以下组成的群组:树突状细胞、巨噬细胞、单核细胞和b细胞。在某些实施例中,该apc是树突状细胞。例如但不限于,该树突状细胞是未成熟树突状细胞。在某些实施例中,该未成熟树突状细胞通过分化从供体(例如人供体)所分离的单核细胞而生成。在某些实施例中,该经分离的单核细胞是在介白素-4(il-4)和粒细胞-巨噬细胞集落刺激因子(gm-csf)中的一者或多者存在下分化以生成未成熟树突状细胞。
9.在某些实施例中,该apc是在试剂的存在下与该多肽或其片段接触。例如,但不作为限制,该试剂是选自由以下组成的组:炎性细胞因子、前列腺素e2(pge2)、脂多糖(lps)和其组合。炎性细胞因子的非限制性实例包括tnfα、il-6、il-1β和其组合。在某些实施例中,该试剂是lps。
10.在某些实施例中,测量与该apc缔合的多肽或其片段的总量可包括(i)透化该apc,(ii)使该apc与检测剂接触,该检测剂与该多肽或其片段结合,和(iii)确定与存在于该apc的外表面上和该apc内的多肽或其片段结合的检测剂的量,以测量与该apc缔合的多肽或其片段的总量。在某些实施例中,测量存在于该apc的外表面上的多肽或其片段的量可包括(i)使该apc与检测剂接触,该检测剂与该多肽或其片段结合和(ii)确定与存在于该apc的外表面上的多肽或其片段结合的检测剂的量,以测量存在于该apc的外表面上的多肽或其片段的量,其中在使该apc与该检测剂接触之前,该apc是未经透化的。在某些实施例中,该检测剂是抗体,例如,缀合至荧光团的抗体。在某些实施例中,该抗体是抗igg抗体。在某些实施例中,确定与该多肽或其片段结合的检测剂的通过流式细胞术来进行。
11.本公开进一步提供用于进行本文所公开的任何一种方法的试剂盒。在某些实施例中,该试剂盒包括以下中的一者或多者:apc;剂;检测剂;和透化剂。在某些实施例中,该剂是选自由以下组成的组:炎性细胞因子、前列腺素e2(pge2)、脂多糖(lps)和其组合。在某些实施例中,该炎性细胞因子是选自由以下组成的组:tnfα、il-6、il-1β和其组合。在某些实施例中,该试剂是lps。在某些实施例中,该检测剂是抗体,例如,缀合至荧光团的抗体。在某些实施例中,该检测剂是抗igg抗体。在某些实施例中,该透化剂是皂素。
附图说明
12.图1示出了一种用于确定多肽诱发ada产生的倾向的方法的非限制性实施例的示意图。
13.图2示出了检测与抗原呈递细胞(apc)的表面结合的抗体的量和与该apc缔合的总抗体的量的示意图。
14.图3示出了用于确定与apc的表面结合的抗体的量和与该apc缔合的总抗体的量的
流式细胞术门控策略。
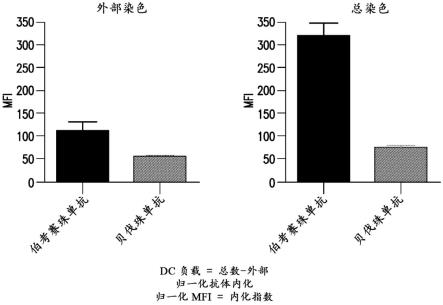
15.图4示出了显示相对于抗体伯考赛珠单抗(bococizumab)和的apc总染色的apc外部染色的图。
16.图5示出了在临床环境下具有不同免疫原性程度的不同抗pcsk9抗体的内化指数值。
17.图6示出了在临床环境下具有高免疫原性的抗体和具有低免疫原性的抗体的内化指数值,包括(依那西普(etanercept))、(阿达木单抗(adalimumab))和(英夫利昔单抗(infliximab)),以及抗体聚集体的内化指数值。
18.图7a示出了抗体伯考赛珠单抗、阿达木单抗和贝伐珠单抗(bevacizumab)在72小时的期间的内化指数值。
19.图7b示出了使用未成熟树突状细胞(idc)和用lps刺激而成熟树突状细胞(mdc)对抗体伯考赛珠单抗、阿达木单抗和贝伐珠单抗的内化指数值。
20.图8示出了在细胞松弛素、fc受体阻断剂或两者的组合存在下的伯考赛珠单抗的内化率。
具体实施方式
21.为了清楚,但不作为限制,将本公开的主题的具体实施方式分为以下小节:
22.i.定义;
23.ii.方法;
24.iii.多肽;
25.iv.试剂盒;和
26.v.示例性实施例。
27.i.定义
28.除非另有定义,否则本文所用的全部技术和科学术语具有与本领域技术人员通常所了解的含义相同的含义。下列参考文献提供本发明中技术人员所使用的许多术语的一般定义:singleton等人,dictionary of microbiology and molecular biology(第2版,1994);the cambridge dictionary of science and technology(walker ed.,1988);the glossary of genetics,5th ed.,r.rieger等人(编),springer verlag(1991);以及hale&marham,the harper collins dictionary of biology(1991)。如本文所用,除非另有说明,否则以下术语具有赋予它们的含义。
29.如本文所用,当“一”或“一种”一词的使用与权利要求和/或说明书中的术语“包含”结合使用时,其可意指“一个”,但也与“一个或多个”、“至少一个”和“一个或大于一个”的含义一致。更进一步,术语“具有”、“包括”、“含有”和“包含”是可互换的,并且本领域中技术人员认识到这些术语是开放式术语。
30.如本文所使用,术语“约”或“大约”可意指特定值处于本领域中普通技术人员所确定的可接受的误差范围内,其部分地取决于如何测量或确定该值,例如,取决于测量系统的局限性。例如,按照给定值的实践,“约”可以意指在1倍或1倍以上的标准偏差内。在本技术和权利要求中描述特定值的情况下,除非另有说明,否则术语“约”可表示特定值的可接受误差范围,诸如由术语“约”修饰的值的
±
10%。
31.本文的术语“抗体”以最广义使用并且涵盖多种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们示出了预期抗原结合活性。
[0032]“抗体片段”是指除完整抗体以外的分子,其包含结合完整抗体所结合抗原的完整抗体的一部分。抗体片段的实例包括但不限于fv、fab、fab'、fab'-sh、f(ab')2;双体;线性抗体;单链抗体分子(例如,scfv);以及由抗体片段形成的多特异性抗体。
[0033]“结合”所关注抗原的抗体是以足够的亲和力结合抗原的抗体,使得该抗体可用作测定试剂,例如用作检测抗体。通常,此种抗体不会与其他多肽发生显著的交叉反应。关于多肽与靶分子的结合,术语“特异性结合”或“与...特异性结合”或“特异于”特定多肽或特定多肽靶上的表位,意指可测量地不同于非特异性交互作用的结合。可以例如通过相比于对照分子的结合确定分子的结合来测量特异性结合,该对照分子通常是不具有结合活性的相似结构的分子。
[0034]“亲和力”指分子(例如,抗体)的单一结合位点与其结合配偶体(例如,抗原)之间的非共价交互作用总和的强度。除非另有说明,否则如本文中所使用的“结合亲和力(binding affinity)”是指反映结合配偶体成员(例如抗体和抗原)之间1:1交互作用的内在结合亲和力。分子x对于其配偶体y的亲和力通常可通过解离常数(kd)来表示。可以通过本领域已知的常规方法测量亲和力,包括本文所述的那些方法。下文描述了用于测量结合亲和力的具体的说明性和示例性实施例。
[0035]
术语“嵌合”抗体是指其中重链和/或轻链的一部分源自特定来源或物种,而重链和/或轻链的其余部分源自不同来源或物种。
[0036]
抗体的“类别(class)”是指其重链所具有的恒定结构域或恒定区的类型。有五大类抗体:iga、igd、ige、igg和igm,并且它们中的几种可进一步分为亚类(同型(isotype)),例如igg1、igg2、igg3、igg4、iga1和iga2。对应于不同类别的免疫球蛋白的重链恒定结构域分别称为α、δ、ε、γ和μ。
[0037]
如本文所使用的术语“细胞毒性剂”是指抑制或阻止细胞功能和/或引起细胞死亡或破坏的物质。细胞毒性剂包括但不限于放射性同位素(例如,at
211
、i
131
、i
125
、y
90
、re
186
、re
188
、sm
153
、bi
212
、p
32
、pb
212
和lu的放射性同位素);化学治疗剂或药物(例如,甲氨蝶呤、多柔比星、长春花属生物碱(长春新碱、长春碱、依托泊苷(etoposide)),多柔比星(doxorubicin)、霉法兰、丝裂霉素c、苯丁酸氮芥、柔红霉素或其他嵌入剂);生长抑制剂;酶及其片段,诸如核酸酶;抗生素;毒素,诸如小分子毒素或细菌、真菌、植物或动物来源的酶活性毒素,包括其片段和/或变体;以及下文所公开的各种抗肿瘤或抗癌剂。
[0038]
如本文所用,“检测抗体”是指特异性结合样品中的靶分子的抗体。在一定条件下,检测抗体与靶分子形成复合物。检测抗体能够直接通过可被检测的标记或间接检测,例如通过使用被标记以及结合检测抗体的另一种抗体。对于直接标记,检测抗体通常与可通过某些方式检测的部分缀合,例如,包括但不限于荧光团。
[0039]
术语“检测”在本文中用于包括靶分子或其加工形式的定性和定量测量。在某些实施例中,检测包括鉴定靶分子的单纯的存在情况以及确定靶分子是否以可检测的量存在。
[0040]“效用子功能(effector function)”,是指归因于抗体的fc区的那些生物活性,其随抗体同型而变化。抗体效用子功能的实例包括:c1q结合和补体依赖性细胞毒性(cdc);fc
受体结合;抗体依赖性细胞介导的细胞毒性(adcc);吞噬作用;细胞表面受体(例根据b细胞受体)的下调;以及b细胞活化。
[0041]
本文中的术语“fc区”,用于定义包含至少一部分恒定区的免疫球蛋白重链的c端区。该术语包括天然序列fc区和变体fc区。在某些实施例中,人igg重链fc区域从cys226或pro230延伸至重链的羧基端。然而,fc区的c端离胺酸(lys447)可以存在或可以不存在。除非本文另有说明,否则fc区或恒定区中氨基酸残基的编号根据eu编号系统(也称为eu指数)进行,如kabat等人所述(sequences of proteins of immunological interest,5th ed.public health service,national institutes of health,bethesda,md,1991)(另见上文)。
[0042]“骨架(framework)”或“fr”是指除高变区(hypervariable region)(cdr)残基之外的可变结构域残基。可变结构域的fr通常由四个fr结构域组成:fr1、fr2、fr3、和fr4。因此,cdr和fr序列通常以如下顺序出现在vh(或vl)中:fr1-h1(l1)-fr2-h2(l2)-fr3-h3(l3)-fr4。
[0043]
术语“全长抗体”、“完整抗体”和“全抗体”在本文中可互换使用,是指具有与天然抗体结构基本上类似的结构的抗体或具有含有本文定义的fc区域的重链的抗体。
[0044]“人抗体(human antibody)”是具有氨基酸序列的抗体,该氨基酸序列对应于由人或人体细胞产生或衍生自利用人抗体谱(antibody repertoire)或其他人抗体编码序列的非人来源衍生的抗体的氨基酸序列。人抗体的该定义特定地排除包含非人抗原结合残基的人源化抗体。
[0045]“人共有骨架”是代表一系列人免疫球蛋白vl或vh骨架序列中最常见的氨基酸残基的骨架。通常,人免疫球蛋白vl或vh序列的选择来自可变结构域序列的亚组。通常,序列的亚组是如kabat等人在sequences of proteins of immunological interest(第五版,nih publication 91-3242,bethesda md(1991),第1-3卷)中所述的亚组。在某些实施例中,对于vl,亚组为如上述kabat等人的文献中的亚组κi。在某些实施例中,对于vh,亚组为如上述kabat等人的文献中的亚组iii。
[0046]“人源化(humanized)”抗体是指包含来自非人cdr的氨基酸残基以及来自人fr的氨基酸残基的嵌合抗体。在某些实施例中,人源化抗体将包含基本上所有至少一个(并且通常两个)可变结构域,其中所有或基本上所有cdr(例如cdr)对应于非人抗体的那些,以及所有或基本上所有fr对应对于人抗体的那些。人源化抗体视情况任选地可包含衍生自人抗体的抗体恒定区的至少一部分。抗体(例如非人抗体)的“人源化形式(humanized form)”是指已经历人源化的抗体。
[0047]
如本技术所用,术语“高变区”或“cdr”是指抗体可变机构域的每个区,该区在序列中是个高变的(本文也称为“互补性决定区”或“cdr”)和/或形成结构上定义的环(“高度可变环”)和/或包含抗原接触残基(“抗原接触处”)。除非另有说明,否则可变结构域中的cdr残基和其他残基(例如,fr残基)在本文中是根据前述kabat等人编号。通常,抗体包含六个cdr:vh(h1、h2、h3)中三个以及vl(l1、l2、l3)中三个。在本文中,示例性cdr包括:
[0048]
(a)高变环存在于氨基酸残基26-32(l1)、50-52(l2)、91-96(l3)、26-32(h1)、53-55(h2)、和96-101(h3)处(chothia和lesk,j.mol.biol.196:901-917(1987));
[0049]
(b)cdr存在于氨基酸残基24-34(l1)、50-56(l2)、89-97(l3)、31-35b(h1)、50-65
(h2)和95-102(h3)(kabat等人,sequences of proteins of immunological interest,第5版,public health service,national institutes of health,bethesda,md(1991));
[0050]
(c)抗原接触处存在于氨基酸残基27c-36(l1)、46-55(l2)、89-96(l3)、30-35b(h1)、47-58(h2)和93-101(h3)(maccallum等人,j.mol.biol.262:732-745(1996));以及
[0051]
(d)(a)、(b)和/或(c)的组合,包括cdr氨基酸残基46-56(l2)、47-56(l2)、48-56(l2)、49-56(l2)、26-35(h1)、26-35b(h1)、49-65(h2)、93-102(h3)和94-102(h3)。
[0052]“免疫缀合物”是指与一个或多个异源分子缀合的抗体,包括但不限于细胞毒性剂。
[0053]
本文的“个体”、“受试者”或“供体”是脊椎动物,诸如人或非人动物,例如哺乳动物。哺乳动物包括但不限于人、非人灵长类动物、农场动物、竞赛动物、啮齿动物和宠物。非人动物受试者的非限制性实例包括啮齿动物,诸如小鼠、大鼠、仓鼠和豚鼠;兔;犬;猫;绵羊;猪;山羊;牛;马;以及非人灵长类动物,诸如猿和猴。在某些实施例中,该个体、受试者或供体是人。
[0054]
如本文所用,术语“体外”是指人工环境以及在人工环境内发生的过程或反应。体外环境示例为,但不限于试管和细胞培养物。
[0055]
如本文所用,术语“体内”是指自然环境(例如,动物或细胞)以及在自然环境中发生的过程或反应,诸如胚胎发育、细胞分化、神经管形成等。
[0056]“分离的”抗体是从其自然环境的组分中分离出来的抗体。在某些实施例中,将抗体纯化至大于95%或99%纯度,通过,例如,电泳(例如,sds-page、等电聚焦(ief)、毛细管电泳)或层析(例如,离子交换或反相hplc)来测定。关于评估抗体纯度的方法的综述,参见例如flatman等人,j.chromatogr.b 848:79-87(2007)。
[0057]
如本文所用,术语“标记”或“可检测标记”是指可与待检测或定量的物质例如抗体连接的任何化学基团或部分。标记是可检测标记,适用于对物质进行灵敏检测或定量。可检测标记的非限制性实例包括但不限于发光标记,例如荧光、磷光、化学发光、生物发光和电化学发光标记、放射性标记、酶、颗粒、磁性物质、电活性物质等。或者,可检测标记可以通过参与特异性结合反应来发出信号表示其存在。此类标记的非限制性实例包括半抗原、抗体、生物素、链霉亲和素、his-标签、亚硝基三乙酸、麸胱甘肽s-转移酶、麸胱甘肽等。
[0058]
如本文所用的术语“单克隆抗体”是指从基本上同质的抗体群体获得的抗体,即,除了可能的变体抗体(例如,含有天然存在的突变或在单克隆抗体制剂的生产过程中产生,此类变体通常以少量形式存在)之外,包括该群体的单个抗体具有一致性和/或结合相同表位。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相反,单克隆抗体制剂的每个单克隆抗体针对于抗原上的单一决定簇。因此,修饰词“单株”表示抗体的特征从基本上同质的抗体群体获得,并且不应解释为需要通过任何特定方法产生抗体。例如,待根据本发明所使用的单克隆抗体可通过多种技术来制造,其包括但不限于杂交瘤方法、重组dna方法、噬菌体展示方法、以及利用含有全部或部分人免疫球蛋白基因座的转基因动物的方法,在本文中描述了用于制备单克隆抗体的此类方法和其他示例性方法。
[0059]“天然抗体”是指具有不同结构的天然生成的免疫球蛋白分子。例如,天然igg类抗体为约150,000道尔顿的异四聚体糖蛋白,由二硫键键合的两条轻链和两条重链组成。从n端至c端,每条重链具有可变区(vh),也称为可变重链结构域或重链可变结构域,接着是三
个恒定结构域(ch1、ch2和ch3)。类似地,从n端至c端,每条轻链具有可变区(vl),也称为可变轻链结构域或轻链可变结构域,接着是轻链恒定(cl)结构域。基于其恒定结构域的氨基酸序列,抗体的轻链可被归类为两种类型中的一种,称为卡帕(κ)和兰姆达(λ)。
[0060]
术语“核酸分子”或“多核苷酸”包括包含核苷酸聚合物的任何化合物和/或物质。每个核苷酸由碱基具体地嘌呤或嘧啶碱基(即,胞嘧啶(c)、鸟嘌呤(g)、腺嘌呤(a)、胸腺嘧啶(t)或尿嘧啶(u))、糖(即,脱氧核糖或核糖)和磷酸基团构成。通常,核酸分子通过碱基序列进行描述,其中所述碱基代表核酸分子的一级结构(线性结构)。碱基序列通常由5'至3'表示。在本文中,术语核酸分子涵盖脱氧核糖核酸(dna)(包括例如互补dna(cdna)和基因组dna)、核糖核酸(rna)(特别是信使rna(mrna))、dna或rna的合成形式,以及包含这些分子中的两种或更多种的混合聚合物。核酸分子可以是线性的或环状的。此外,术语核酸分子包括有义链和反义链,以及单链和双链形式。此外,本文所描述的核酸分子可含有天然存在的或非天然存在的核苷酸。非天然存在的核苷酸的示例包括具有衍生化的糖或磷酸主链键或经化学修饰的残基的经修饰的核苷酸碱基。核酸分子还涵盖适合作为用于本发明的抗体的体外和/或体内(例如,在宿主或患者体内)直接表达的载体的dna和rna分子。此类dna(例如cdna)或rna(例如mrna)载体可以是未修饰的或经修饰的。例如,可以对mrna进行化学修饰以增强rna载体的稳定性和/或编码分子的表达,使得可以将mrna注射到受试者体内以产生体内抗体(参见例如stadler等人,nature medicine 2017,在线发表于2017年6月12日,doi:10.1038/nm.4356或ep 2 101 823 b1)。
[0061]
如本文所用,“纯化的”蛋白或多肽(例如抗体)是指已经提高纯度的多肽,使得其以比存在于自身天然环境中和/或在实验室条件下初始合成和/或扩增时更纯的形式存在。纯度是相对术语并且不一定意指绝对纯度。
[0062]
如本文所,术语“包装插页”是指通常包含在商业包装中的说明书,其包含关于包装组件使用的信息。
[0063]
相对于参照多肽序列的“氨基酸序列一致性百分比”被定义为在比对候选序列与参考多肽序列并引入空位(如果必要的话)以实现最大的序列一致性百分比之后,并且出于比对的目的在不考虑将任何保守取代作为序列一致性的组成部分的情况下,候选序列中的氨基酸残基与参考多肽序列中的氨基酸残基相同的百分比。用于确定氨基酸序列一致性百分比的比对可以通过本领域技术范围内的各种方式实现,例如使用公众可获得的计算机软件,诸如blast、blast-2、align或megalign(dnastar)程序包。本领域技术人员可确定用于比对序列的适当参数,包括在所比较的序列的全长上实现最大比对所需的任何算法。然而,为了本文的目的,使用序列比较计算机程序align-2来生成氨基酸序列一致性%的值。align-2序列比较计算机程序由genentech,inc.编写,并且源代码已经与用户文档一起提交到u.s.copyright office,washington d.c.,20559,在那里以美国版权登记号txu510087注册。align-2程序可从genentech,inc.,south san francisco,california公开获得,或者可以从所述源代码编译。align-2程序应经编译以在unix操作系统上使用,所述unix操作系统包括数字unix v4.0d。所有序列比较参数均由align-2程序设置并且不变。
[0064]
在采用align-2进行氨基酸序列比较的情况下,给定氨基酸序列a与给定氨基酸序列b的氨基酸序列一致性%(其可以替代地表达为给定氨基酸序列a具有或包含与给定氨基酸序列b的某一氨基酸序列一致性%)计算如下:
[0065]
100乘以分数x/y
[0066]
其中x是序列比对程序align-2在a与b程序比对中评分为同一匹配的氨基酸残基数,y是b中氨基酸残基的总数。应当理解的是,在氨基酸序列a的长度不等于氨基酸序列b的长度的情况下,a与b的氨基酸序列一致性%将不等于b与a的氨基酸序列一致性%。除非另有特别说明,否则如前一段所述,使用align-2计算机程序获得本文使用的所有氨基酸序列一致性%。
[0067]
术语“多肽”和“蛋白”在本文中可互换使用以指代任何长度的氨基酸聚合物。聚合物可以是线性或分支的,其可以包含经修饰的氨基酸,并且其可间插有非氨基酸。这些术语还涵盖已被天然修饰或通过介入修饰(例如,二硫键形成、糖基化、脂质化、乙酰化、磷酸化或任何其它操作或修饰,诸如与标记组分缀合)的氨基酸聚合物。在定义内还包括例如含有氨基酸(包括例如非天然氨基酸等)的一种或多种类似物以及本领域中已知的其它修饰的多肽。如本文所用,术语“多肽”和“蛋白”特定地涵盖抗体。
[0068]
如本文所用,术语“重组蛋白”通常是指已经基因操作的肽和蛋白质。在某些实施方案中,此类重组蛋白是“异源的”,即对于所利用的细胞是外来的。
[0069]
如本文所用,“样品”是指大量材料的一小部分。在某些实施例中,样品包括但不限于培养中的细胞、细胞上清液、细胞裂解物、血清、血浆、生物流体(例如血液、血浆、血清、粪便、尿液、淋巴液、腹水、导管冲洗液、唾液和脑脊液)和组织样品。样品的来源可以是固体组织(例如,来自新鲜、冷冻和/或保存的器官、组织样品、活体组织切片或抽吸物)、血液或任何血液成分、体液(例如尿液、淋巴液、脑脊髓液、羊水、腹膜液或间质液)或来自个体的细胞,包括循环细胞。
[0070]
术语“可变区”或“可变结构域”是指抗体重链或轻链的参与抗体与抗原结合的结构域。天然抗体的重链和轻链的可变结构域(分别为vh和vl)通常具有相似的结构,其中每个结构域包含四个保守框架区(fr)和三个高变区(cdr)。(参见,例如,kindt等人,kuby immunology,第6版,w.h.freeman and co.,第91页,2007年。)单个vh或vl结构域可能足以赋予抗原结合特异性。此外,结合特定抗原的抗体可分别使用来自结合该抗原的抗体的vh或vl结构域来进行分离,以筛选互补vl或vh结构域的文库。参见,例如,portolano等人,j.immunol.150:880-887(1993);clarkson等人,nature 352:624-628(1991)。
[0071]
ii.方法
[0072]
本文所公开的主题提供了用于确定治疗剂(例如多肽或其片段)诱发产生抗药物抗体(ada)的倾向的方法。在某些实施例中,本文所公开的方法可用于确定抗体或其片段或抗体-药物缀合物(adc)诱发ada产生的倾向。本公开基于以下发现:抗原呈递细胞(apc)对抗体的内化与先前报道的抗体的临床ada率相关。本公开还提供了用于执行本文所公开的方法的试剂盒。
[0073]
在某些实施例中,本公开的方法可用于鉴定与亲代多肽例如亲代抗体相比具有降低的诱发ada产生的倾向的多肽变体,例如抗体变体。在某些实施例中,本文公开的方法可用于分析新开发的多肽,例如抗体。例如,但不作为限制,本文公开的方法可用于鉴定具有从与相同抗原特异性结合的较大多肽库中诱发ada的较低倾向的多肽,例如抗体。可替代地和/或另外地,本文公开的方法可用于鉴定与结合至相同抗原的可商购的或临床测试的多肽(例如抗体)相比具有较低的诱发ada的倾向的多肽(例如抗体)。在某些实施例中,本公开
的方法可用于在临床研究之前确定新开发的多肽例如抗体的免疫原性潜力。在某些实施例中,本文所公开的方法可用于确定多肽(例如抗体)的聚集体的免疫原性潜力。在某些实施例中,本文所公开的方法可用于分析抗体的序列变体的免疫原性,例如,在抗体的制造和/或生产过程中可能出现的那些。
[0074]
在某些实施例中,本公开的方法可以包括使apc与多肽或包含该多肽的组成物接触。在某些实施例中,将apc与多肽一起培养足以使多肽内化的时间的量。例如,但不作为限制,apc可以在多肽存在下培养,例如约1至约72小时。在某些实施例中,apc可以在多肽存在下培养约12至约72小时、约12至约60小时、约12小时至约48小时、约12小时至约24小时、约24小时至约72小时、约24小时至约60小时、约24小时至约48小时、约48小时至约72小时或约48小时至约60小时。在某些实施例中,apc可以在多肽存在下培养约24至约48小时。在某些实施例中,apc可以在多肽存在下培养约72小时或更短时间。在某些实施例中,apc可以在多肽存在下培养约60小时或更短时间。在某些实施例中,apc可以在多肽存在下培养约48小时或更短时间。在某些实施例中,apc可以在多肽存在下培养约36小时或更短时间。在某些实施例中,apc可以在多肽存在下培养约24小时或更短时间。
[0075]
在某些实施例中,本文所公开的方法中使用的apc的数量可以是从约1x105至约1x107个细胞,例如约1x106个细胞。例如,但不作为限制,使用的apc的数量可以是从约2x105至约9x106个细胞、从约3x105至约8x106个细胞、从约3x105至约7x106个细胞、从约4x105至约6x106个细胞、从约5x105至约5x6个细胞、从约6x105至约4x106个细胞、从约7x105至约3x106个细胞、从约8x105至约2x106个细胞、从约9x105至约2x106个细胞或从约9x105至约1x106个细胞。在某些实施例中,使用约1x106个细胞的apc。
[0076]
在某些实施例中,多肽可以以从约25μg/ml至约200μg/ml,例如从约25μg/ml至约100μg/ml的浓度使用。例如,但不作为限制,多肽可以以从约30μg/ml至约100μg/ml、从约35μg/ml至约100μg/ml、从约40μg/ml至约100μg/ml、从约45μg/ml至约100μg/ml、从约50μg/ml至约100μg/ml、从约55μg/ml至约100μg/ml、从约60μg/ml至约100μg/ml、从约65μg/ml至约100μg/ml、从约70μg/ml至约100μg/ml、从约75μg/ml至约100μg/ml、从约80μg/ml至约100μg/ml、从约85μg/ml至约100μg/ml、从约90μg/ml至约100μg/ml、从约95μg/ml至约100μg/ml、从约25μg/ml至约95μg/ml、从约25μg/ml至约90μg/ml、从约25μg/ml至约85μg/ml、从约25μg/ml至约80μg/ml、从约25μg/ml至约75μg/ml、从约25μg/ml至约70μg/ml、从约25μg/ml至约65μg/ml、从约25μg/ml至约60μg/ml、从约25μg/ml至约55μg/ml、从约25μg/ml至约50μg/ml、从约25μg/ml至约45μg/ml、从约25μg/ml至约40μg/ml、从约25μg/ml至约35μg/ml、从约25μg/ml至约30μg/ml、从约30μg/ml至约90μg/ml、从约40μg/ml至约80μg/ml或从约50μg/ml至约70μg/ml的浓度使用。
[0077]
用于本公开的方法中的apc包括可以在其表面上显示与主要组织相容性复合体(mhc)复合的抗原的任何细胞。例如,但不作为限制,apc可以是树突状细胞、巨噬细胞、单核细胞、嗜中性粒细胞和b细胞。在某些实施例中,apc为树突状细胞。在某些实施例中,树突状细胞可以是未成熟树突状细胞。在某些实施例中,未成熟树突状细胞可以是从单核细胞分化的。单核细胞的非限制性来源包括单核细胞系和从供体分离的原代单核细胞。在某些实施例中,单核细胞从供体的样品中分离,例如,从供体的血液样品中分离。可以通过本领域已知的任何方法,例如通过密度梯度,例如ficoll密度梯度,从供体的样品中分离单核细
胞。在某些实施例中,外周血单个核细胞(pbmc)最初从供体的样品中分离,然后进行cd14+选择来分离单核细胞。在某些实施例中,分离的单核细胞是在分化因子例如白介素-4(il-4)和/或粒细胞-巨噬细胞集落刺激因子(gm-csf)的存在下分化,以产生用于本文所公开的方法的未成熟树突状细胞。例如,但不作为限制,经分离的单核细胞可以是在约0.1ng/ml至约10ng/ml的il-4,例如约3ng/ml的il-4,和/或在约1ng/ml至约100ng/ml的gm-csf,例如约50ng/ml的gm-csf的存在下分化的。可替代地,用于本文所公开方法的树突状细胞,例如未成熟树突状细胞,可以从干细胞或ipsc细胞分化。参见,例如,li等人,world j.stem cells 6(1):1-10(2014),其内容全文以引用方式并入本文。
[0078]
在某些实施例中,apc在试剂的存在下与多肽接触。在某些实施例中,可以在诱导未成熟apc成熟为成熟apc的试剂的存在下使apc与多肽接触。例如,但不作为限制,可以在诱导未成熟树突状细胞成熟为成熟树突状细胞的试剂的存在下使未成熟树突状细胞与多肽接触。在某些实施例中,该试剂为细胞因子,例如炎性细胞因子。炎性细胞因子的非限制性实例包括tnfα、il-6和il-1β。turner等人,biochimica et biophysica acta 1843(11):2563-2582(2014)中提供了炎性细胞因子的其他非限制性实例,其全文以引用方式并入本文。可替代地或另外地,该试剂是由炎性细胞因子例如前列腺素e2(pge2)诱导的,或诱导炎性细胞因子例如脂多糖(lps)表达的蛋白质和/或化合物。在某些实施例中,该试剂为脂多糖。在某些实施例中,该试剂可以以约0.001ng/ml至约1,000ng/ml,例如约0.01ng/ml至约1,000ng/ml、约0.1ng/ml至约1,000ng/ml、约1ng/ml至约1,000ng/ml、约10ng/ml至约1,000ng/ml、约100ng/ml至约1,000ng/ml、约0.001ng/ml至约100ng/ml、约0.001ng/ml至约10ng/ml、约0.001ng/ml至约1ng/ml、约0.001ng/ml至约0.1ng/ml或约0.001ng/ml至约0.01ng/ml的浓度使用。在某些实施例中,试剂,例如lps,可以以约1μg/ml的浓度使用。在某些实施例中,在多肽存在下,apc不与试剂例如lps接触。在某些实施例中,apc是尚未在试剂例如lps存在下培养的未成熟树突状细胞。
[0079]
在某些实施例中,该方法可进一步包括测量存在于apc的外表面上的多肽的量。例如,但不作为限制,该方法可以包括测量与apc的表面例如质膜结合的多肽的量。在某些实施例中,多肽可以与apc的表面上的主要组织相容性复合体(mhc)分子缔合,例如结合。在某些实施例中,多肽可以与apc的表面上的mhc ii类(mhcii)分子缔合,例如结合。在某些实施例中,测量存在于apc的外表面上的多肽的量可以包括(i)使apc与结合至多肽的检测剂接触以及(ii)确定与存在于apc的外表面上的多肽结合的检测剂的量。在某些实施例中,在使apc与检测剂接触之前apc未经透化,以防止检测apc内的多肽,例如存在于apc内的细胞内结构内的多肽。
[0080]
在某些实施例中,该方法可进一步包括测量与apc缔合的多肽的总量。在某些实施例中,与apc缔合的多肽总量包括存在于apc的外表面上的多肽的量和存在于apc内的多肽的量。在某些实施例中,测量与apc缔合的多肽的总量包括(i)透化apc,(ii)使apc与结合至多肽的检测剂接触,以及(iii)确定与存在于apc的外表面上的和apc内的多肽结合的检测剂的量。透化apc允许检测存在于apc内例如存在于apc内的胞内结构内的多肽。在某些实施例中,透化允许检测存在于apc内的内体和溶酶体结构内的多肽。在某些实施例中,apc可以使用本领域已知的任何技术进行透化,包括但不限于使用清洁剂或有机溶剂。透化技术的非限制性实例公开于jamur和oliver,methods mol.biol.588:63-66(2010)中,其内容通过
引用以其全文并入本文。在某些实施例中,通过使apc与透化剂接触而透化apc。例如,但不作为限制,透化剂可以是清洁剂,例如皂素。
[0081]
在某些实施例中,可在apc与多肽初始接触后的约4小时至约72小时之间测量存在于apc的外表面上的多肽的量和/或与apc缔合的多肽的总量。例如,但不作为限制,可在apc与多肽初始接触后的约4小时至约48小时之间、约4小时至约24小时之间、约4小时至约12小时之间或约4小时至约8小时之间测量存在于apc的外表面上的多肽的量和/或与apc缔合的多肽的总量。在某些实施例中,可在apc与多肽初始接触后的约4小时测量存在于apc的外表面上的多肽的量和/或与apc缔合的多肽的总量。
[0082]
在某些实施例中,用于本文公开的方法中的检测剂是抗体(本文也称为“检测抗体”)。在某些实施例中,检测剂与通过所公开的方法分析的多肽特异性结合,例如,检测剂与多肽或其片段上存在的表位特异性结合。在某些实施例中,检测剂是与抗体的特定类别或亚类结合的抗体。例如,但不作为限制,如果通过本文公开的方法分析igg抗体,则检测抗体可以是抗igg抗体。在某些实施例中,本文公开的测定方法中使用的检测剂可以以从约1μg/ml至约50μg/ml、从约1μg/ml至约40μg/ml、从约1μg/ml至约30μg/ml、从约1μg/ml至约20μg/ml或约1μg/ml至约10μg/ml的浓度使用。在某些实施例中,检测剂以约1μg/ml至约10μg/ml,例如约6μg/ml的浓度使用。
[0083]
在某些实施例中,可标记用于所公开的方法中的检测剂,例如检测抗体。标记包括但不限于直接检测的标记或部分(诸如荧光、发色、电子致密、化学发光和放射性标记),以及间接检测(例如,通过酶促反应或分子交互作用)的部分,诸如酶或配体。标记的示例性实例包括:放射性同位素
32
p、
14
c、
125
i、3h和
131
i;荧光团,诸如稀土螯合物或荧光素及其衍生物;罗丹明及其衍生物;丹酰;伞形酮;萤光素酶,例如萤火虫萤光素酶和细菌萤光素酶(参见美国专利第4,737,456号);萤光素;2,3-二氢二氮杂萘二酮(2,3-dihydrophthalazinedione);辣根过氧化物酶(hrp);碱性磷酸酶;β-半乳糖苷酶;葡糖淀粉酶;溶菌酶;糖类氧化酶,例如葡萄糖氧化酶、半乳糖氧化酶和葡萄糖6-磷酸脱氢酶;杂环氧化酶,诸如尿酸氧化酶和黄嘌呤氧化酶,与采用过氧化氢来氧化染料前体的酶(诸如hrp、乳过氧化物酶,或微过氧化物酶)偶联;生物素/抗生物素蛋白;纺丝标记;噬菌体标记;稳定自由基等。在某些实施例中,检测剂,例如抗体,用荧光团来标记。
[0084]
在某些实施例中,通过能够检测检测剂的任何方法来确定与多肽结合的检测剂的量。在某些实施例中,可以通过监测检测剂的标记例如荧光标记对检测剂进行检测。例如,但不作为限制,与多肽或其片段结合的检测剂的量通过对检测剂的荧光进行检测来确定。在某些实施例中,通过流式细胞术来执行对与多肽或其片段结合的检测剂的量的确定。
[0085]
在某些实施例中,该方法进一步包括确定通过apc内化的多肽的量。例如,但不作为限制,该方法可以包括计算内化指数值(本文也称为“归一化mfi”),其与通过apc内化的多肽或其片段的量相关。在某些实施例中,通过从与apc缔合的多肽的总量中减去与apc的外表面结合的多肽的量来确定内化指数值。
[0086]
在某些实施例中,该方法可以进一步包括将多肽的内化指数与指示诱发ada产生的已知倾向的参考内化指数进行比较,例如在临床环境中。在某些实施例中,当多肽的内化指数值大于参考内化指数时,该多肽比参考物具有更大的诱发ada产生的倾向,例如在临床环境中。可替代地,当多肽的内化指数值小于参考内化指数时,与参考相比,多肽具有比参
考物更小的诱发ada产生的倾向,例如在临床环境中。
[0087]
在某些实施例中,参考内化指数可以是已显示诱发ada产生的多肽(例如,参考多肽)的内化指数。例如,但不作为限制,参考多肽可以是已显示在临床环境中诱发ada产生的抗体。在某些实施例中,具有较高内化指数值的参考多肽在临床环境中具有较高水平的ada/免疫原性。在某些实施例中,具有较低内化指数值的参考多肽在临床环境中具有降低的ada/免疫原性。在某些实施例中,参考多肽可以是图3至图8中任一项所公开的抗体。在某些实施例中,参考多肽可以是已显示在临床环境中以低水平诱发ada产生的抗体,例如依洛尤单抗(evolocumab)、rg7652和在某些实施例中,参考多肽可以是已显示在临床环境中以高水平诱发ada产生的抗体,例如伯考赛珠单抗。可替代地或另外地,在抗体变体的情况下,参考内化指数可以是亲代抗体的内化指数。在某些实施例中,在聚集体的情况下,参考内化指数可以是未聚集的相同抗体的内化指数。在某些实施例中,参考内化指数可以是与使用本文公开的方法分析的抗体结合相同抗原的抗体的内化指数。
[0088]
在某些实施例中,该方法可以包括用从多于一个供体获得的树突状细胞来分析多肽。在某些实施例中,本公开的方法可包括通过将来自单独供体的树突状细胞,例如未成熟树突状细胞,单独地与所关注多肽一起培养来分析多肽诱发ada产生的倾向,并分析每个单独供体的树突状细胞的内化指数。在某些实施例中,可以确定和分析单独供体中的各自的内化指数值以确定多肽诱发ada产生的倾向。在某些实施例中,内化指数值可以是每个供体的内化指数值的平均值。在某些实施例中,可以将来源于至少2个或更多个、至少3个或更多个、至少4个或更多个、至少5个或更多个、至少6个或更多个、至少7个或更多个、至少8个或更多个、至少9个或更多个、至少10个或更多个、至少15个或更多个、至少20个或更多个、至少25个或更多个、至少30个或更多个、至少35个或更多个、或至少40个或更多个单独供体的树突状细胞单独地与所关注多肽一起培养。在某些实施例中,可将来自约10个至约50个单独供体的树突状细胞单独地与所关注多肽一起培养。例如,但不作为限制,可以将来自约15个至约45个单独供体、来自约20个至约40个单独供体、来自约25个至约35个单独供体或来自约30个单独供体的树突状细胞单独地与所关注多肽一起培养。
[0089]
iii.多肽
[0090]
本公开提供了确定多肽诱发ada产生的倾向的方法。下文提供可以通过所公开的方法分析的此类多肽的非限制性实例。例如,但不作为限制,使用本文公开的任何方法测定的多肽可以是多肽例如肽的片段。在某些实施例中,多肽可以是重组蛋白。在某些实施例中,多肽是抗体或其片段,例如人抗体、人源化抗体或嵌合抗体。在某些实施例中,抗体可以是抗体-药物缀合物(adc)。在某些实施例中,抗体可以是单结构域抗体。
[0091]
1.抗体或其片段
[0092]
在某些实施例中,通过本文公开的方法分析的多肽是抗体或其片段,例如单克隆抗体和其片段。例如,但不作为限制,本公开的方法可用于确定新开发和/或鉴定的抗体或其片段的免疫学潜力。
[0093]
抗体片段包括但不限于fab、fab'、fab'-sh、f(ab')2、fv和scfv片段以及下文所述的其他片段。关于某些抗体片段的综述,参见hudson等人,nat.med.9:129-134(2003)。关于scfv片段的综述,参见例如pluckth
ü
n,the pharmacology of monoclonal antibodies,第113卷,rosenburg和moore编,springer-verlag,new york,第269-315页(1994);还可参见
wo93/16185;以及美国专利第5,571,894号和第5,587,458号。关于对包含补救受体结合表位残基并具有增加的体内半衰期的fab和f(ab')2片段的讨论,参见美国专利号5,869,046。抗体片段可通过多种技术制造,包括但不限于如本文所述的完整抗体的蛋白水解消化以及重组宿主细胞(例如,大肠杆菌或噬菌体)的产生。
[0094]
在某些实施例中,通过本文所公开的方法分析的多肽可以是双体抗体。双体抗体为包含两个抗原结合位点(其可是二价或双特异性的)抗体片段。参见例如ep 404097;wo 1993/01161;hudson等人,nat.med.9:129-134(2003);和hollinger等人,proc.natl.acad.sci.usa 90:6444-6448(1993)。hudson等人,nat.med.9:129-134(2003)中还描述了三体抗体和四体抗体,其可由所公开的方法分析。
[0095]
在某些实施例中,通过所公开的方法分析的抗体可以是单结构域抗体。单结构域抗体为包含抗体的重链可变结构域的全部或部分或抗体的轻链可变结构域的全部或部分的抗体片段。在某些实施例中,单结构域抗体为人单结构域抗体(domantis,inc.,waltham,ma;参见例如美国专利第6,248,516b1号)。单结构域抗体的其他非限制性实例公开于iezzi等人,front immunol.9:273(2018),其内容通过引用以其全文并入本文。在某些实施例中,抗体是杂交体(hybrigenics services,cambridge,ma)。
[0096]
2.嵌合抗体、人源化抗体和人抗体
[0097]
在某些实施例中,通过本文所公开的方法分析的多肽为嵌合抗体,例如人源化抗体。例如,但不作为限制,本文所公开的方法可用于鉴定抗体的嵌合形式,其与亲代抗体或抗体的其他嵌合形式相比,具有低的或较低的诱发ada产生的倾向。可替代地或另外地,本公开的方法可用于鉴定具有低的诱发ada产生的倾向的嵌合抗体。
[0098]
本领域的某些嵌合抗体描述于例如美国专利第4,816,567号;和morrison等人,proc.natl.acad.sci.usa,81:6851-6855(1984)中。在某些实施例中,嵌合抗体包括非人可变区(例如,来源于小鼠、大鼠、仓鼠、兔或非人灵长类动物(诸如猴)的可变区)和人恒定区。在又一个实例中,嵌合抗体可以是“类别转换”抗体,其中类别或亚类相比于其亲代抗体已发生变化。嵌合抗体包括其抗原结合片段。
[0099]
在某些实施例中,嵌合抗体可以是人源化抗体。通常,非人抗体为人源化抗体以降低对人的免疫原性,同时保留亲代非人抗体的特异性和亲和力。一般而言,人源化抗体包含一个或多个可变结构域,其中cdr,例如cdr(或其部分)来源于非人抗体,并且fr(或其部分)来源于人抗体序列。人源化抗体任选地还将包含人恒定区的至少一部分。在某些实施例中,人源化抗体中的一些fr残基经来自非人抗体(例如衍生cdr残基的抗体)的对应残基取代,例如以恢复或提高抗体特异性或亲和性。
[0100]
在某些实施例中,通过本文所公开的方法分析的多肽可以是人抗体。例如,但不作为限制,本文所公开的方法可用于鉴定具有低的或较低的诱发产生人抗体的倾向的抗体的嵌合形式,其具有低的或较低的诱发ada产生的倾向。
[0101]
3.来源于文库的抗体
[0102]
在某些实施例中,通过本文所公开的方法分析的多肽可以是通过筛选具有所需活性的抗体的组合文库而分离的抗体或其片段。例如,但不作为限制,本公开的方法可用于鉴定例如与具有所需结合特性和/或与相同抗原结合的其他来源于文库的抗体相比具有低的或较低的诱发ada产生的倾向的来源于文库的抗体。
[0103]
从人抗体库分离的抗体或抗体片段在本文中被视作人抗体或人抗体片段。
[0104]
4.多特异性抗体
[0105]
在某些实施例中,通过本文所公开的方法分析的多肽可以是多特异性抗体,例如双特异性抗体。多特异性抗体是对至少两个不同表位具有结合特异性的单克隆抗体。双特异性抗体可制成全长抗体或抗体片段。例如,但不作为限制,本文所公开的方法可用于鉴定例如与结合相同表位的其他多特异性抗体相比具有低的或更低的诱发ada产生的倾向的多特异性抗体。可替代地或另外地,本公开的方法可用于鉴定具有低的诱发ada产生的倾向的多特异性抗体。
[0106]
还可由公开的方法分析具有三个或更多个功能性抗原结合位点的改造抗体,包括“章鱼抗体”(octopus antibodies)(参见例如us2006/0025576a1)。
[0107]
5.免疫缀合物
[0108]
在某些实施例中,通过本文所公开的方法分析的多肽可以是免疫缀合物,例如,包含与一种或多种细胞毒性剂结合的抗体的免疫缀合物,诸如化学治疗剂或药物、生长抑制剂、毒素(例如蛋白质毒素、细菌、真菌、植物或动物来源的酶活性毒素,或其片段)或放射性同位素。例如,抗体或抗原结合部分可以功能性连接(例如,通过化学偶联、基因融合、非共价缔合或其他方式)至一个或多个其他结合分子,诸如另一抗体、抗体片段、肽或结合模拟物。
[0109]
在某些实施例中,免疫缀合物是一种抗体-药物缀合物(adc),其中抗体与一种或多种药物缀合,该一种或多种药物包括但不限于美登木素生物碱(maytansinoid)(参见美国专利号5,208,020和5,416,064及欧洲专利ep 0425 235);澳瑞他汀(auristatin)诸如单甲基澳瑞他汀药物部分de和df(mmae和mmaf)(参见美国专利号5,635,483、5,780,588和7,498,298);多拉司他汀(dolastatin);卡奇霉素(calicheamicin)或其衍生物(参见美国专利号5,712,374、5,714,586、5,739,116、5,767,285、5,770,701、5,770,710、5,773,001和5,877,296;hinman等人,cancer res.53:3336-3342(1993);及lode等人,cancer res.58:2925-2928(1998));蒽环类药物,诸如柔红霉素(daunomycin)或多柔比星(doxorubicin)(参见kratz等人,current med.chem.13:477-523(2006);jeffrey等人,bioorganic&med.chem.letters16:358-362(2006);torgov等人,bioconj.chem.16:717-721(2005);nagy等人,proc.natl.acad.sci.usa 97:829-834(2000);dubowchik等人,bioorg.&med.chem.letters 12:1529-1532(2002);king等人,j.med.chem.45:4336-4343(2002);和美国专利号6,630,579);甲氨蝶呤(methotrexate);长春地辛(vindesine);紫杉烷类,诸如多西紫杉醇(docetaxel)、紫杉醇(paclitaxel)、拉罗他赛(larotaxel)、替塞他赛(tesetaxel)和奥他他赛(ortataxel);单端孢菌素(trichothecene);和cc1065。
[0110]
在某些实施例中,免疫缀合物包含与酶活性毒素或其片段缀合的本文所述的抗体,该酶活性毒素或其片段包括但不限于白喉a链、白喉毒素的非结合活性片段、外毒素a链(来自铜绿假单胞菌)、蓖麻毒蛋白a链、相思豆毒蛋白a链、蒴莲根毒素a链、α-次黄嘌呤、油桐蛋白、石竹蛋白(dianthin protein)、美洲商陆蛋白(phytolaca americana protein)(papi、papii和pap-s)、苦瓜抑制剂、姜黄素、巴豆毒素、肥皂草抑制剂、明胶、丝林霉素(mitogellin)、局限曲霉素、酚霉素、依诺霉素和单端孢菌素。
[0111]
在某些实施例中,免疫缀合物包含与放射性原子缀合以形成放射性缀合物的抗
体。在另一个实施例中,多种放射性同位素可用于产生放射性缀合物。非限制性实例包括at
211
、i
131
、i
125
、y
90
、re
186
、re
188
、sm
153
、bi
212
、p
32
、pb
212
和lu的放射性同位素。当放射性缀合物用于检测时,它可能包含用于闪烁显像研究的放射性原子,例如,tc99m或i123,或用于核磁共振(nmr)成像(也称为磁共振成像,mri)的自旋标记物,诸如碘-123、碘-131、铟-111、氟-19、碳-13、氮-15、氧-17、钆、锰或铁。
[0112]
可使用多种双功能蛋白偶联剂,诸如n-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(spdp)、4-(n-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯(smcc)、亚氨基硫杂环戊烷(it)、亚氨基酯的双官能衍生物(诸如己二酸二甲酯盐酸盐)、活性酯(诸如辛二酸二琥珀酰亚胺基酯)、醛(诸如戊二醛)、双叠氮基化合物(诸如双(对叠氮基苯甲酰基)己二胺)、双重氮衍生物(诸如双-(对重氮苯甲酰基)-乙二胺)、二异氰酸酯(诸如甲苯2,6-二异氰酸酯)和双活性氟化合物(诸如1,5-二氟-2,4-二硝基苯)制备抗体和细胞毒性剂的缀合物。例如,可以如vitetta等人,science 238:1098(1987)中所述制备蓖麻毒蛋白免疫毒素。碳-14标记的1-异硫氰基苄基-3-甲基二亚乙基三胺五乙酸(mx-dtpa)为一种示例性螯合剂,用于将放射性核苷酸缀合至抗体。参见wo94/11026。接头可以为促进细胞中细胞毒性药物释放的“可切割接头”。例如,可以使用对酸不稳定的接头、肽酶敏感的接头、对光不稳定的接头、二甲基接头或含二硫键的接头(chari等人,cancer res.52:127-131(1992);美国专利号5,208,020)。
[0113]
在某些实施例中,免疫缀合物包括但不限于此类用交联剂制得的缀合物,该交联剂包括但不限于可商购获得(例如从pierce biotechnology,inc.(rockford,il.,u.s.a)商购获得)的bmps、emcs、gmbs、hbvs、lc-smcc、mbs、mpbh、sbap、sia、siab、smcc、smpb、smph、磺基-emcs、磺基-gmbs、磺基-kmus、磺基-mbs、磺基-siab、磺基-smcc和磺基-smpb以及svsb(琥珀酰亚胺基-(4-乙烯基砜)苯甲酸酯)。
[0114]
6.抗体变体
[0115]
在某些实施例中,通过本文所公开的方法分析的多肽可以是先前公开的抗体的抗体变体。例如,本公开的方法可用于鉴定作为先前公开的抗体的变体的抗体,其体具有比亲代抗体更低的诱发ada产生的倾向。在某些实施例中,可以将氨基酸取代引入所关注抗体中,并且可以通过使用所公开的方法筛选抗体变体的免疫原性。
[0116]
在某些实施例中,抗体变体可以是例如通过将适当的修饰导入编码抗体的核苷酸序列中,或通过肽合成来制备的抗体的氨基酸序列变体。此类修饰包括但不限于抗体的氨基酸序列内的残基的缺失和/或插入和/或取代。此种变异的所关注位点包括但不限于cdr和fr。可进行缺失、插入和取代的任意组合以实现最终构建体,前提条件是最终抗体(即经修饰的抗体)具有所需的特性,例如抗原结合特性。
[0117]
在某些实施例中,抗体变体可以是已被改变以增加或减少抗体发生糖基化的程度的抗体。例如,但不作为限制,可通过改变氨基酸序列从而产生或移除一个或多个糖基化位点来达成抗体糖基化位点的添加或缺失。
[0118]
在某些实施例中,通过本文所公开的方法分析的抗体是fc区变体。fc区变体可包含人fc区序列(例如,人igg1、igg2、igg3或igg4 fc区),其在一个或多个氨基酸位置包含氨基酸修饰(例如,取代)。
[0119]
在某些实施例中,抗体变体可以是半胱胺酸改造抗体,例如“thiomab”,其中抗体
的一个或多个残基被半胱胺酸残基取代。在某些实施例中,经取代的残基出现在抗体的可进入位点。通过用半胱氨酸取代那些残基,反应性硫醇基团由此定位于抗体的可接近位点,并且可用于将抗体与其他部分,诸如药物部分或接头-药物部分缀合,以产生免疫缀合物,如本文进一步所述。在某些实施例中,以下残基的任何一个或多个可被半胱胺酸取代:轻链的v205(kabat编号);重链的a118(eu编号);以及重链fc区的s400(eu编号)。可如例如美国专利号7,521,541中所述形成半胱氨酸改造的抗体。
[0120]
iv.试剂盒
[0121]
本公开的主题进一步提供含有可用于进行本文公开的方法的材料的试剂盒。在某些实施例中,本公开的试剂盒包括含有apc或单核细胞的容器和/或含有一种或多种检测剂的容器。合适容器的非限制性实例包括瓶子、试管、小瓶和微量滴定盘。容器可由各种材料诸如玻璃或塑料形成。
[0122]
在某些实施例中,试剂盒可包括一个或多个含有一个或多个apc或单核细胞的容器。apc的非限制性实例包括树突状细胞、巨噬细胞、单核细胞和b细胞。在某些实施例中,试剂盒可包括至少一个含有树突状细胞的容器。例如,但不作为限制,试剂盒可包括至少一个含有未成熟树突状细胞的容器。在某些实施例中,本公开的试剂盒在一个或多个容器中包括来源于一个或多个供体的apc。例如,但不作为限制,来源于每个单独供体的apc被提供在单独的容器中。在某些实施例中,本公开的试剂盒可包括来自约10至约40个单独供体的apc。在某些实施例中,本公开的试剂盒可进一步包括一种或多种检测剂。例如,但不作为限制,检测剂可以是与被分析的多肽特异性结合的抗体,例如,如果正在分析igg抗体,则为抗igg抗体。
[0123]
在某些实施例中,本公开的试剂盒可进一步在一个或多个容器中包括一种或多种用于诱导未成熟树突状细胞成熟的剂。在某些实施例中,一种或多种试剂可包括炎性细胞因子、pge2和脂多糖。
[0124]
在某些实施例中,试剂盒进一步包括提供使用该试剂盒中提供的组分的说明的包装插页。例如,本公开的试剂盒可以包括包装插页,其提供在所公开的方法中使用apc、单核细胞和/或检测剂的说明。
[0125]
可替代地或另外地,该试剂盒可以包括从商业和使用者的角度期望的其他材料,包括其他缓冲剂、稀释剂和过滤剂。在某些实施例中,试剂盒可包括用于收集和/或处理血液样品,例如,以从血液样品中分离pbmc和/或单核细胞的材料。在某些实施例中,试剂盒可包括用于将单核细胞分化成未成熟树突状细胞的试剂。在某些实施例中,用于将单核细胞分化成未成熟树突状细胞的一种或多种试剂可以是il-4和/或gm-csf。在某些实施例中,试剂盒可进一步包括能够透化apc的试剂,例如皂素。
[0126]
v.示例性实施例
[0127]
a.在某些非限制性实施例中,本公开的主题提供了用于确定多肽或其片段相对于已知参考物诱发产生抗药物抗体(ada)的倾向的方法,其包含:
[0128]
(a)使抗原呈递细胞(apc)与该多肽或其片段接触;
[0129]
(b)测量存在于该apc的外表面上的多肽或其片段的量;
[0130]
(c)测量与该apc缔合的多肽或其片段的总量,其中与apc缔合的多肽或其片段的总量包含存在于该apc的外表面上的多肽或其片段的量和存在于该apc内的多肽或其片段
的量;
[0131]
(d)通过从(c)中所测量的与该apc缔合的多肽或其片段的总量减去(b)中所测量的与该apc的外表面结合的多肽或其片段的量来计算内化指数值;以及
[0132]
(e)将(d)中的内化指数与参考内化指数比较;
[0133]
其中,当(d)中的内化指数值大于参考内化指数时,多肽或其片段具有比参考物更大的诱发ada的倾向,而当(d)中的内化指数值小于参考内化指数时,该多肽或其片段具有比该参考物更小的诱发ada的倾向。
[0134]
a1.根据a所述的方法,其中该多肽或其片段是肽。
[0135]
a2.根据a所述的方法,其中该多肽或其片段是重组蛋白。
[0136]
a3.根据a所述的方法,其中该多肽或其片段是抗体或其片段。
[0137]
a4.根据a3所述的方法,其中该抗体或其片段为人抗体、人源化抗体或嵌合抗体。
[0138]
a5.根据a3或a4所述的方法,其中该抗体或其片段是单结构域抗体。
[0139]
a6.根据a所述的方法,其中该多肽是抗体-药物缀合物(adc)。
[0140]
a7.根据a至a6中任一项所述的方法,其中该apc选自由以下组成的组:树突状细胞、巨噬细胞、单核细胞和b细胞。
[0141]
a8.根据a7所述的方法,其中该apc是树突状细胞。
[0142]
a9.根据a8所述的方法,其中该树突状细胞是未成熟树突状细胞。
[0143]
a10.根据a9所述的方法,其中该未成熟树突状细胞是通过分化从供体所分离之单核细胞而产生的。
[0144]
a11.根据a10所述的方法,其中经分离的单核细胞是在介白素-4(il-4)和粒细胞-巨噬细胞集落刺激因子(gm-csf)中的一者或多者的存在下分化以生成该未成熟树突状细胞。
[0145]
a12.根据a至a11中任一项所述的方法,其中该apc是在试剂的存在下与多肽或其片段接触。
[0146]
a13.根据a12所述的方法,其中该试剂选自由以下组成的组:炎性细胞因子、前列腺素e2(pge2)、脂多糖(lps)和其组合。
[0147]
a14.根据a13所述的方法,其中该炎性细胞因子系选自由tnfα、il-6、il-1β和其组合所组成之群组。
[0148]
a15.根据a13所述的方法,其中该试剂是lps。
[0149]
a16.根据a至a15中任一项所述的方法,其中(c)测量与该apc缔合的多肽或其片段的总量包含:
[0150]
(i)透化该apc;
[0151]
(ii)使该apc与检测剂接触,该检测剂与多肽或其片段结合;以及
[0152]
(iii)确定与存在于apc的外表面上和apc内的多肽或其片段结合的检测剂的量,以测量与apc缔合的多肽或其片段之总量。
[0153]
a17.根据a至a16中任一项所述的方法,其中(b)测量存在于apc的外表面上的多肽或其片段的量包含:
[0154]
(i)使该apc与检测剂接触,该检测剂与多肽或其片段结合;以及
[0155]
(ii)确定与存在于apc的外表面上的多肽或其片段结合的检测剂的量,以测量存
在于apc的外表面上的多肽或其片段的量,
[0156]
其中在使apc与检测剂接触之前,apc是未经透化的。
[0157]
a18.根据a16或a17所述的方法,其中该检测剂是抗体。
[0158]
a19.根据a16至a18中任一项所述的方法,其中该检测剂是缀合至荧光团的抗体。
[0159]
a20.根据a18或a19所述的方法,其中该抗体是抗igg抗体。
[0160]
a21.根据a16至a20中任一项所述的方法,其中确定与该多肽或其片段结合的检测剂的量通过流式细胞术来进行。
[0161]
b.在某些非限制性实施例中,本公开的主题提供了一种用于进行a至a21中任一项所述的方法的试剂盒。
[0162]
b1.根据b所述的试剂盒,其中该试剂盒包含以下中的一者或多者:
[0163]
(a)apc;
[0164]
(b)试剂;
[0165]
(c)检测剂;和
[0166]
(d)透化剂。
[0167]
b2.根据b1所述的试剂盒,其中该剂选自由以下所组成的组:炎性细胞因子、前列腺素e2(pge2)、脂多糖(lps)和其组合。
[0168]
b3.根据b1所述的试剂盒,其中该炎性细胞因子选自由以下所组成的组:tnfα、il-6、il-1β和其组合。
[0169]
b4.根据b1或b2所述的试剂盒,其中该剂是lps。
[0170]
b5.根据b1至b4中任一项所述的试剂盒,其中该检测剂是抗体。
[0171]
b6.根据b1至b5中任一项所述的试剂盒,其中该检测剂是缀合至荧光团的抗体。
[0172]
b7.根据b5或b6所述的试剂盒,其中该抗体是抗igg抗体。
[0173]
b8.根据b1至b7中任一项所述的试剂盒,其中该透化剂是皂素。
[0174]
以下实例仅为对本公开的主题的说明,不应被视为以任何方式进行限制。
[0175]
实例1:基于抗原呈递细胞的测定
[0176]
基于多肽的治疗剂具有诱发ada产生的免疫原性潜力。特别地,此类基于多肽的治疗剂可以被抗原呈递细胞诸如树突状细胞吸收和加工以呈现与其表面上的第ii类mhc分子复合的基于多肽的治疗剂的片段。t细胞随后与抗原呈递细胞表面上呈现的片段相互作用,以诱发免疫反应,使b细胞产生ada。
[0177]
本文已经开发了一种用于确定抗体诱发ada产生的倾向的方法。此种方法在药物开发过程中是非常有价值的工具,因为它可用于预测新开发药物在临床前开发阶段的免疫原性潜力。图1提供该方法的实验细节的示意图。如图1所示,使用ficoll梯度从供体的血液中分离出pbmc。经由cd14+珠(miltenyi biotec,按照制造商的说明)从pbmc中分离单核细胞,随后通过将单核细胞与3ng/ml il-4和50ng/ml gm-csf(r&dsystems)一起培养,分化成未成熟树突状细胞。在分离的单核细胞初始植入和随后的单核细胞分化后的第5天,在1μg/ml脂多糖(lps)的存在下,使未成熟树突状细胞与100μg/ml的所关注抗体接触,以促进未成熟树突状细胞的成熟。在第6天,根据图2至图4中提供的细节对成熟树突状细胞进行染色和分析。图2示出了用于确定与apc的表面结合的抗体的量和与apc缔合的总抗体的量的技术。为了确定与apc的表面结合的抗体的量,用6μg/ml的抗人igg抗体对apc进行染色,该抗体与
alexafluor 647缀合(图2)。为了确定与apc缔合的总抗体的量,在使用与alexafluor 647缀合的抗人igg抗体染色之前,将apc固定和透化(becton dickinson固定和透化缓冲剂,依照制造商的说明)(图2)。apc的透化允许荧光团缀合的抗体进入细胞并与存在于胞内结构(例如内体)内的抗体结合。通过流式细胞术确定与apc缔合的总抗体的量相比的与apc的表面结合的抗体的量。图3公开了用于流式细胞术的门控策略。为了确定内化指数(本文也称为“归一化mfi”),从与apc缔合的所关注抗体的总量中减去与apc结合的所关注抗体的量(图4)。如图4所示,与已显示出具有较低临床ada率的相比,已显示出具有高临床ada率的抗体伯考赛珠单抗产生了更多量的与apc缔合的总抗体。这些结果表明伯考赛珠单抗将具有比更高的内化指数。
[0178]
许多抗pcsk9抗体的分析证实内化指数与临床ada率相关(图5)。通过上述方法分析了抗pcsk9抗体,阿利西尤单抗、伯考赛珠单抗、依洛尤单抗和rg7652。这4种不同的抗pcsk9抗体在临床中显示出不同水平的免疫原性。具体地,伯考赛珠单抗已显示出具有46%的临床ada率,依洛尤单抗已显示出具有0.1%的临床ada率,阿利西尤单抗具有5.1%的临床ada率,并且rg7652具有3.3%的临床ada率。如图5所示,伯考赛珠单抗的内化指数显著高于任何其他抗pcsk9抗体,这与观察到的不同抗体的临床ada率有关。
[0179]
许多抗tnf抗体的分析显示了类似的结果(图6)。分析了抗tnf抗体(依那西普)、(阿达木单抗)和(英夫利昔单抗)。和具有的临床ada率分别为8.7%、26%和10%。如图6所示,与和相比,具有最高临床ada的也具有最高的内化指数(即归一化mfi)。
[0180]
对一些其他抗体的进一步分析表明,该方法可以区分具有高免疫原性的抗体和具有较低免疫原性的抗体。如图6所示,与具有低内化指数的相比,具有高ada率的伯考赛珠单抗、ha33和布雷努单抗(briakinumab)产生高内化指数。罗利珠单抗(rontalizumab)和的ada率分别为0.6%和10-15%。还分析了均靶向il-17a的司库奇尤单抗和依奇珠单抗(ixekizumab)。在临床上,司库奇尤单抗的免疫原性率低(低于1%),而依奇珠单抗的免疫原性率较高,为5-22%。如图6所示,依奇珠单抗的内化程度高于司库奇尤单抗。这些数据表明,在临床中表现出高免疫原性(即较高临床ada率)的分子的内化指数较高,而在临床中表现出低免疫原性(即较低临床ada率)的分子的内化指数较低。此外,可以通过所公开的方法测量已知影响抗体的免疫原性的抗体聚集。如图6所示,抗体罗利珠单抗的聚集体(称为“罗利珠单抗”和“罗利珠单抗聚集体”)比罗利珠单抗具有更高的内化指数。
[0181]
进行了其他实验以确定伯考赛珠单抗、阿达木单抗和贝伐珠单抗的内化指数如何随时间变化。伯考赛珠单抗和阿达木单抗的ada率如上文所述,贝伐珠单抗的ada率为0.6%。如图7a所示,在未成熟树突状细胞与抗体接触后4小时,最大量的抗体被内化。48或72小时后,未观察到抗体内化的进一步增加(图7a)。进行了进一步分析以确定内化抗体的量是否取决于树突状细胞是未成熟的还是成熟的。如图7b所示,与用lps刺激成熟树突状细胞(mdc)相比,在未成熟树突状细胞(idc)中观察到抗体内化的最小差异。
[0182]
树突状细胞内化抗体的机制是通过在细胞松弛素、阻断所有fcγr的抗体混合物(也称为fc受体阻断剂)、或两者存在下分析伯考赛珠单抗的内化指数来确定的,该抗体混
合物由抗fcγria抗体、抗fcγriia抗体和抗fcγriiia抗体构成。如图8所示,与对照或单独使用fc受体阻断剂相比,单独使用细胞松弛素或与fc受体阻断剂组合使用,抑制伯考赛珠单抗的内化。这些数据表示,通过树突状细胞的抗体内化是由巨胞饮、而不是通过fc受体介导的内化所驱动。
[0183]
数据显示,所公开的方法可用于确定抗体的免疫原性,因为它可再现地区分具有高临床免疫原性的抗体和具有低临床免疫原性的抗体。所公开的方法还具有成本效益并且不需要太多设备来进行。
[0184]
除所描绘和要求保护的各种实施例之外,本公开的主题还涉及具有本文所公开和要求保护的特征的其他组合的其他实施例。因此,本文所呈现的特定特征可在本公开的主题的范围内以其他方式彼此组合,使得本公开的主题包括本文所公开的特征的任何合适的组合。出于说明和描述的目的,已经提供了本公开的主题的特定实施例的前述描述。其并非旨在穷举或将本公开的主题限制为所公开的那些实施例。
[0185]
对于本领域技术人员显而易见的是,在不脱离本公开的主题的精神或范围的情况下,可以对本公开的主题的组成和方法进行各种修改和变化。因此,本公开的主题旨在包括在所附申请专利范围以及其等同形式的范围内的修改和变型。
[0186]
本文引用了各种出版物、专利和专利申请,其内容通过引用以其全文并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1