基于生物膜干涉技术检测病原生物凝集素与唾液酸乳糖亲和力方法的建立
1.本发明实施例涉及分子生物学技术领域,具体涉及一种基于生物膜干涉技术检测病原生物凝集素与唾液酸乳糖亲和力方法的建立。
背景技术:
2.唾液酸(sailicacid,sa)是一种9-碳结构的酸性单糖,主要通过α2-3、α2-6、α2-8糖苷键与乳糖分子相连接,其中,α2-3唾液酸与半乳糖残基的连接是脊椎动物体内最常见的一种方式,其次就是α2-6唾液酸与半乳糖或n-乙酰氨基半乳糖之间的连接。唾液酸广泛存在于宿主细胞表面糖蛋白或糖脂末端,具有重要的生理功能,同时,唾液酸也是多种病原生物的受体分子,可有效介导寄生虫、病毒等病原体的黏附与入侵过程。流感病毒ha蛋白质能够识别宿主细胞表面唾液酸分子,禽流感病毒倾向结合α2-3唾液酸乳糖,而人流感病毒易于结合α2-6唾液酸乳糖;疟原虫eba-175/eba-140、弓形虫mic1\sabp1蛋白质在虫体依赖唾液酸途径入侵宿主细胞过程中发挥重要作用。因此,病原生物的凝集蛋白质与唾液受体亲和力的高低和偏好性,对于病原生物学研究十分重要。但是,传统的研究方法(包括elisa、ifa等)主要是定性研究,不能准确的反映出亲和力数值。
3.生物膜干涉技术(bio-layerinterferometry,bli)可实时监控整个分子间的结合过程,并计算出分子之间的亲和力(kd)、结合速率(ka)、解离速率(kd)等重要数据,已广泛用于生物大分子相互作用力的分析。已有相关研究通过此技术建立了多糖与病原凝集素蛋白质的亲和力大小的检测方法并取得了一定的研究进展。
技术实现要素:
4.为此,本发明实施例提供一种基于生物膜干涉技术检测病原生物凝集素与唾液酸乳糖亲和力方法的建立,有效解决了传统病原生物凝集素结合唾液酸乳糖的亲和力检测方法中步骤多、操作繁琐以及耗时长、游离配体摩尔浓度难以表征等问题。
5.为了实现上述目的,本发明实施例提供如下技术方案:
6.一种基于生物膜干涉技术检测病原生物凝集素与唾液酸乳糖亲和力方法的建立,包括:
7.his-sabp1重组蛋白质纯化;
8.bli再生条件的优化;
9.bli检测his-sabp1重组蛋白质结合唾液酸乳糖的亲和力。
10.在一些优选的实施例中,所述bli检测his-sabp1重组蛋白质结合唾液酸乳糖的亲和力的方法包括:
11.传感器活化:将链霉亲和素(sa)生物传感器浸入pbs缓冲液中预湿至少10分钟;
12.唾液酸乳糖固化:将sa生物传感器浸入用pbs缓冲溶液稀释成浓度为2.4μm的唾液酸乳糖溶液中,固化180-900秒;
13.封闭:将固化完成的sa生物传感器浸入pbst-bsa溶液中封闭90-120秒;
14.样品检测及结果判断:将已封闭的sa生物传感器浸入待测样品中进行his-sabp1重组蛋白质结合唾液酸乳糖的亲和力检测,检测过程中实时读取结合信号。
15.在一些优选的实施例中,所述唾液酸乳糖为3
′‑
唾液酸半乳糖聚丙烯酰胺生物素结合物或6
′‑
唾液酸半乳糖聚丙烯酰胺生物素结合物。
16.在一些优选的实施例中,所述his-sabp1重组蛋白质纯化的方法包括:
17.将his-sabp1重组蛋白质表达菌复摇,在0.1miptg,22℃条件下诱导表达,收集菌体破碎后上清与亲和层析镍柱进行感作,后使用250mm咪唑洗脱液进行洗脱,获得可溶性表达的his-sabp1重组蛋白质。
18.在一些优选的实施例中,所述bli再生条件的优化的方法包括:
19.将唾液酸乳糖固定在链霉亲和素生物传感器上,结合相同浓度靶蛋白后,使用不同的生物传感器再生试剂,重复结合、解离、再生步骤,确定最适再生试剂。
20.在一些优选的实施例中,所述最适再生试剂为ph=0.5的盐酸溶液。
21.本发明实施例具有如下优点:
22.本研究着眼于人工寡糖——唾液酸乳糖与病原生物凝集素蛋白质间相互作用力的大小,能够更好的反映出病原生物与宿主细胞表面唾液酸受体的相互作用关系,同时本研究选择的关键试剂——唾液酸化乳糖为商品化试剂,纯度高、结构清晰,更有利于研究者分析试验结果。不仅如此,本研究建立的基于bli检测方法仅需要1个小时就能完成检测,同时制备的探针可以重复使用5次以上,极大的节约了检测时间和检测成本。因此,本方法可以用于多种病原生物凝集素与唾液酸乳糖亲和力的分析,值得推广。
23.本项目选取的病原凝集素蛋白质是源于本实验室前期研究成果,本实验已经证明弓形虫tgme49-225940基因编码的蛋白质(sabp1)可特异性识别宿主细胞表面唾液酸而介导虫体入侵,因此本项目以该蛋白质为研究对象,建立检测方法。
附图说明
24.为了更清楚地说明本发明的实施方式或现有技术中的技术方案,下面将对实施方式或现有技术描述中所需要使用的附图作简单地介绍。显而易见地,下面描述中的附图仅仅是示例性的,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图引伸获得其它的实施附图。
25.图1为本发明实施例提供的his-sabp1重组蛋白质大量纯化鉴定结果;
26.图2为本发明实施例提供的盐酸(ph=0.5)再生试剂再生情况结果;
27.图3为本发明实施例提供的bli检测his-sabp1重组蛋白质结合(3
′‑
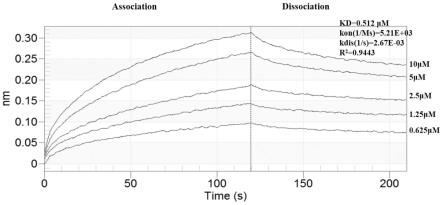
sl)唾液酸乳糖的亲和力数据结果(processeddata);
28.图4为本发明实施例提供的bli检测his-sabp1重组蛋白质结合(6
′‑
sl)唾液酸乳糖的亲和力数据结果(processeddata)。
具体实施方式
29.以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效,显然,所描述的实施例是本发明一
部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
30.以下实施例中用到的主要试剂耗材信息见表1;主要仪器信息见表2。
31.表1主要试剂耗材信息表
[0032][0033]
表2主要仪器信息表
[0034][0035]
实施例1亲和层析方法大量纯化,得到sabp1重组蛋白质
[0036]
将his-sabp1重组蛋白质表达菌复摇,0.1miptg,22℃条件下诱导表达,收集菌体破碎后上清与亲和层析镍柱进行感作,后使用250mm咪唑洗脱液进行洗脱,获得可溶性表达的his-sabp1重组蛋白质。将纯化后的重组蛋白质进行sds-page验证,纯化结果如图1所示。
[0037]
实施例2bli再生条件的优化
[0038]
在“dataacquisition”软件中,设置相应程序。其中,唾液酸乳糖固化样本布板见表3,唾液酸乳糖固化方法见表4,再生条件实验样本布板见表5,再生条件实验测定方法见表6。
[0039]
(1)传感器预湿:将sa生物传感器浸入pbs缓冲液(140mmnacl,2.7mmkcl,10mmna2hpo4,1.8mmkh2po4)中预湿10分钟;
[0040]
(2)唾液酸固化:将sa生物传感器浸入2.4μm的唾液酸乳糖溶液中,(稀释液为pbs缓冲液),固化600秒;
[0041]
(3)封闭:将固化完成的sa生物传感器浸入pbst-bsa溶液(20mlpbs缓冲液中加入0.1gbsa和10μl吐温20)封闭90秒;
[0042]
(4)结合(association):his-sabp1蛋白质稀释至5μm(蛋白稀释液为pbst-bsa),将sa传感器浸入蛋白样品中,结合90秒;
[0043]
(5)解离(dissociation):将sa生物传感器再浸入pbst-bsa溶液中,解离60秒;
[0044]
(6)再生(regeneration):将sa生物传感器分别浸入不同的生物传感器再生试剂:
柠檬酸钠(ph=3)、甘氨酸(ph=1)、盐酸(ph=0.5)中,再生900秒;
[0045]
(7)结果判断:检测过程中实时读取结合信号,再生后检测同一个分析物的结合信号衰减≤10%即可判断该生物传感器再生成功。利用“data analysis”软件进行拟合曲线分析,盐酸(ph=0.5)试剂在整个测定过程中具有高水平的蛋白结合再现性,结合信号衰减≤1%。因此确定使用盐酸(ph=0.5)试剂再生该生物传感器,检测结果如图2所示。
[0046]
表3唾液酸乳糖固化样本布板表
[0047]
ꢀꢀ
12gpbs3
′‑
sl或6
′‑
slhpbs3
′‑
sl或6
′‑
sl
[0048]
表4唾液酸乳糖固化方法表
[0049]
step(sa)biosensorsreagenttime(sec)steptype1g1、h1pbs60baseline2g2、h23
′‑
sl或6
′‑
sl600loading3g1、h1pbs60baseline
[0050]
表5再生条件实验样本布板表
[0051] 3456gpbst-bsa5μm-sabp1再生试剂pbshpbst-bsapbst-bsa再生试剂pbs
[0052]
表6再生条件实验测定方法表
[0053][0054]
实施例3bli检测his-sabp1重组蛋白质结合唾液酸糖的亲和力
[0055]
在“dataacquisition”软件中,设置相应程序,输入蛋白质相应浓度。其中,唾液酸固化样本布板见表3,唾液酸固化方法见表4,重组蛋白质结合唾液酸样本布板见表7,重组蛋白质结合唾液酸测定方法见表8。
[0056]
(1)传感器预湿:将sa生物传感器浸入pbs缓冲液中预湿10分钟;
[0057]
(2)唾液酸固化:将sa生物传感器浸入2.4μm的唾液酸乳糖溶液中,(稀释液为pbs缓冲液),固化600秒;
[0058]
(3)封闭:将固化完成的sa生物传感器浸入含有pbst-bsa溶液中封闭90秒;
[0059]
(4)结合(association):his-sabp1蛋白质分别稀释至0.625μm、1.25μm、2.5μm、5μm、10μm(蛋白质稀释液为pbst-bsa),将sa传感器按稀释浓度顺序浸入蛋白样品中,结合90
秒;
[0060]
(5)解离(dissociation):将sa生物传感器再浸入含有pbst-bsa溶液中,解离60秒。
[0061]
(6)再生(regeneration):将sa传感器浸入盐酸(ph=0.5)再生试剂中,进行传感器再生,再生900s。根据不同稀释浓度,重复本实施例中(3)(4)(5)(6)步骤;
[0062]
(7)样品检测及结果判断:检测过程中实时读取结合信号,根据结合信号分析检测结果。his-sabp1重组蛋白质结合唾液酸糖的亲和力检测结果如图3、4和表9所示。利用“dataanalysis”软件进行拟合分析,得到弓形虫his-sabp1重组蛋白质与3
′‑
sl的结合亲和力(kd)为1.68μm,拟合度达到0.9639;弓形虫his-sabp1重组蛋白质与6
′‑
sl的结合亲和力(kd)为0.512μm,拟合度达到0.9443。
[0063]
表7重组蛋白质结合唾液酸样本布板表
[0064][0065]
表8重组蛋白质结合唾液酸测定方法表
[0066]
[0067][0068]
虽然,上文中已经用一般性说明及具体实施例对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1