达格列净原料药的粒径测定方法与流程
本发明涉及药物分析或制剂,具体而言,涉及一种达格列净原料药的粒径测定方法。
背景技术:
1、达格列净(dapagliflozin)由美国bristol-myers squibb公司和瑞典astrazeneca公司联合开发的钠-葡萄糖协同转运蛋白2(sgl-2)抑制剂,用于改善ii糖尿病成人患者的血糖控制,用于治疗2型糖尿病。2012年11月获得欧洲ema批准上市,2014年1月获美国fda批准上市,2017年3月在中国nmpa批准上市。
2、达格列净原料为达格列净丙二醇一水合物,其分子式为c21h25clo6·c3h8o2·h2o,分子量502.89,分子结构:
3、
4、达格列净原料药水溶性差,粒径控制是提高体外溶解或溶出的一种方法,对体内的吸收至关重要,可见达格列净原料药的粒径是影响其药效产生的重要因素。达格列净原料药易聚集,难以实现粒径的稳定精准测定,故如何精准测定粒径也随之成为药品质量控制中一项重要课题。
5、cn 115343198采用激光粒度仪干法测试,经过多次试验发现,该技术方案对于测定达格列净原料,中间精密度不高,无法满足要求(usp429粒度测定方法)。采用激光粒度仪湿法测定,以水为分散介质,但达格列净原料药在水中有一定溶解,并且在水中易失去结晶水。cn116481885采用湿法进行测定,分散介质采用异构烷烃isoparg和液体石蜡,测定d90>100μm的达格列净原料药取得良好的效果,但测定d90<50μm的原料药效果较差。鉴于此,本领域亟需一种重复性良好、精密度高的达格列净原料药粒径测定方法。
技术实现思路
1、基于此,本发明的目的在于提供一种重复性好、精密度高的达格列净原料药粒径的测定方法。
2、具体的,提供一种达格列净原料药的粒径测定方法,包括如下步骤:
3、(1)取达格列净原料药分散于分散介质中,并在超声仪中进行第一超声;
4、(2)将步骤(1)所得原料药物料,在进样器超声设备中进行第二超声之后,再进行湿法激光粒度测试;
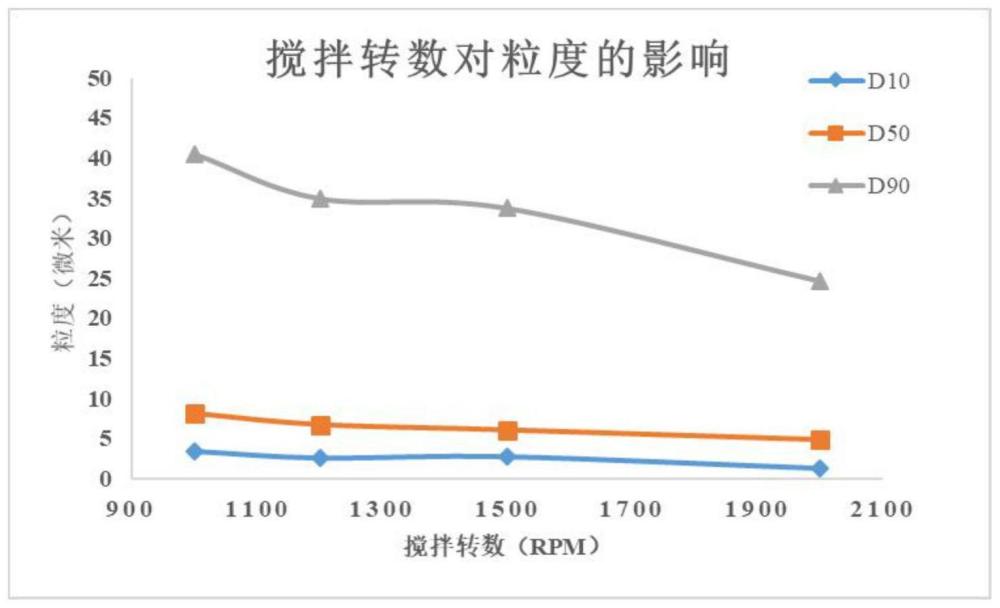
5、其中,步骤(2)中,第二超声的时间为30s-180s,搅拌转速(步骤(2)在搅拌下进行)为1000-2000rpm。
6、本发明的发明人在研究中特别发现,当采用如上所述的方法进行测定时,方法的重复性和精密度良好,结果稳定性好,波动小,特别是相对于现有技术方案的方案,本发明提供的方法波动性小,结果更可靠。
7、进一步的,步骤(1)中所述分散介质为含有0.02wt%-1wt%磷脂的烷烃溶液,优选为含有0.04wt%-0.06wt%磷脂的烷烃溶液。本发明的发明人在研究中特别发现,当采用如上所述的分散介质时,进一步保证方法的重复性和精密度。
8、进一步的,相对于100mg的达格列净原料药,分散介质的体积为80ml。
9、进一步的,步骤(1)中,所述第一超声的时间为10min-15min;第一超声的频率为40khz。
10、进一步的,第二超声频率为20khz。
11、进一步的,所述烷烃选自正戊烷、正己烷、正庚烷或石油醚,优选为正戊烷。
12、进一步的,所述磷脂选自大豆卵磷脂、菜籽卵磷脂或蛋黄卵磷脂,优选为大豆卵磷脂。如此能够进一步保证方法的重复性和精密度。
13、进一步的,步骤(2)中,所述搅拌转速为1200-1500rpm,优选为1200rpm。从物料进入激光粒度仪设备到测试完成离开激光粒度仪设备的过程中,进行搅拌,如此能够进一步保证得到较为准确的结果。如此能够进一步保证方法的重复性和精密度。
14、进一步的,所述步骤(2)中在湿法激光粒度测试过程中不对物料进行超声。样品进入激光粒度仪设备后,通过激光粒度仪的超声设备进行超声处理,待开启激光,以测定粒度时,不再超声。也即在湿法激光粒度测试进行之前进行第二超声,而在湿法激光粒度测试中不再超声。当然在湿法激光粒度测试结束后,此时已经获得粒度结果,没有必要再进行超声处理。
15、进一步的,所述第二超声的时间为60s-120s。
16、进一步的,所述第二超声的时间为60s。
17、本发明的发明人在研究中特别发现,在如上的第二超声的条件下,能够进一步保证结果的重复性和精密度。其中,第二超声发生在湿法激光粒度测试之前,本文中也将第二超声称为“测试前超声”。
18、在激光粒度仪中,一般都需要对遮光度进行设定。进一步的,在本发明所述的湿法激光粒度测试中,遮光度设定为5%-20%。
19、进一步的,步骤(2)中,所述湿法激光粒度测试在激光粒度仪中进行。其中,激光粒度仪中可以带有进样器超声设备(如mastersizer3000激光粒度仪),步骤(2)中的进样器超声设备也即激光粒度仪中的进样器超声设备,第二超声在激光粒度仪进样器超声设备中进行。
20、进一步的,所述激光粒度仪为mastersizer3000激光粒度仪。
21、进一步的,步骤(1)中所述超声仪为kq-500de型数控超声波清洗器。
22、配合以上设备,能够进一步保证方法的重复性和精密度。
23、进一步的,所述达格列净原料药为达格列净丙二醇一水合物,所述达格列净原料药粒径范围d90为20-50μm。在上述范围内,本发明提供的方法能够获得更好的结果。
24、本申请的有益效果:
25、1、本申请采用烷烃作为分散介质的溶剂,测定结果具有更好的重复性与精密度。与六偏磷酸钠,硅酸钠,十二烷基苯磺酸钠相比,磷脂可更好的溶解散在烷烃中,促进待测颗粒均匀分散在分散介质中。
26、2、本申请提供的达格列净原料药的粒径测定方法,对分散介质的筛选,以及对搅拌速度,超声时间,分散介质的种类、其中磷脂的浓度等参数进行了综合优化,方法的重复性好,中间精密度高,尤其是测定d90数值较小的原料药时效果突出。同时为达格列净原料药粒径的控制提供了一种可靠的测试方法。
技术特征:
1.一种达格列净原料药的粒径测定方法,其特征在于,包括如下步骤:
2.根据权利要求1所述的达格列净原料药的粒径测定方法,其特征在于,步骤(1)中所述分散介质为含有0.02wt%-1wt%磷脂的烷烃溶液,优选为含有0.04wt%-0.06wt%磷脂的烷烃溶液;相对于100mg的达格列净原料药,分散介质的体积为80ml。
3.根据权利要求1所述的达格列净原料药的粒径测定方法,其特征在于,步骤(1)中,所述达格列净原料药的重量为100-300mg。
4.根据权利要求1所述的达格列净原料药的粒径测定方法,其特征在于,步骤(1)中,所述第一超声的时间为10min-15min;第一超声的频率为40khz。
5.根据权利要求1所述的达格列净原料药的粒径测定方法,所述第二超声频率为20khz。
6.根据权利要求2所述的达格列净原料药的粒径测定方法,其特征在于,所述烷烃选自正戊烷、正己烷、正庚烷或石油醚,优选为正戊烷。
7.根据权利要求2所述的达格列净原料药的粒径测定方法,其特征在于,所述磷脂选自大豆卵磷脂、菜籽卵磷脂或蛋黄卵磷脂,优选为大豆卵磷脂。
8.根据权利要求1所述的达格列净原料药的粒径测定方法,其特征在于,步骤(2)中,所述搅拌转速为1200-1500rpm,优选为1200rpm。
9.根据权利要求1所述的达格列净原料药的粒径测定方法,其特征在于,所述步骤(2)中,在湿法激光粒度测试过程中不对物料进行超声。
10.根据权利要求1-8中任意一项所述的达格列净原料药的粒径测定方法,其特征在于,所述第二超声的时间为60s-120s。
11.根据权利要求10所述的达格列净原料药的粒径测定方法,其特征在于,所述第二超声的时间为60s。
12.根据权利要求1所述的达格列净原料药的粒径测定方法,其特征在于,所述湿法激光粒度测试中,遮光度设定为5%-20%。
13.根据权利要求1-8中任意一项所述的达格列净原料药的粒径测定方法,其特征在于,步骤(2)中,所述湿法激光粒度测试在激光粒度仪中进行。
14.根据权利要求13中所述的达格列净原料药的粒径测定方法,其特征在于,所述激光粒度仪为mastersizer3000激光粒度仪。
15.根据权利要求1-8中任意一项所述的达格列净原料药的粒径测定方法,其特征在于,步骤(1)中所述超声仪为kq-500de型数控超声波清洗器。
16.根据权利要求1-8中任意一项所述的达格列净原料药的粒径测定方法,其特征在于,所述达格列净原料药为达格列净丙二醇一水合物,所述达格列净原料药粒径范围d90为20-50μm。
技术总结
本发明涉及药物分析或制剂技术领域,公开了达格列净原料药粒径测定的方法,测定步骤如下:(1)取达格列净原料药分散于分散介质中,并在超声仪中进行第一超声;(2)将步骤(1)所得原料药物料,在进样器超声设备中进行第二超声之后,再进行湿法激光粒度测试。上述达格列净原料药的粒径测定方法,通过对搅拌速度,超声时间等参数的优化,建立了一种重复性良好、精密度高的测定方法,符合药典对于粒径测定的控制要求。
技术研发人员:李庆燕,宋更申,王传旭,梁千南,邵芳
受保护的技术使用者:北京悦康科创医药科技股份有限公司
技术研发日:
技术公布日:2024/6/26
- 还没有人留言评论。精彩留言会获得点赞!