一种在钇靶上分离
一种在钇靶上分离
89
zr的方法及应用
技术领域
1.本发明涉及放射性同位素提纯的技术领域,尤其是涉及一种在钇靶上分离
89
zr的方法及应用。
背景技术:
2.医用放射性核素zr-89(锆-89,
89
zr)常被用来对单克隆抗体(mab)的摄取进行可视化和量化,是因为锆-89的半衰期为3.3天,非常适合作为pet显像的生物标志物来评价目标蛋白的表达以及单克隆抗体肿瘤的靶向性。因此,zr-89是许多对蛋白质显像或治疗感兴趣的科研机构、研究型医院和制药公司的重要研究工具。比如,有研究人员将
89
zr标记帕博利珠单抗(pembrolizumab),之后进行正电子发射断层扫描(pet)成像研究,了解pet扫描的最佳时间点和帕博利珠单抗的摄取情况。
3.可见,在药物开发的不同阶段中,基于
89
zr放射性核素的免疫pet显像,一直是一种很有吸引力的显像方式,具体包括先导化合物的筛选,临床前显像以及将小鼠模型结果进行人体转化等。
4.89
zr一般在钇靶中分离得到,之后用于临床应用中,这需要保证
89
zr有合适的数量以产生足够的活性。传统的用于同位素分离的方法有化学分离法、离子交换色谱法、气体扩散法、激光法和离心法。比如,化学分离法是利用待分离物质的物化性质的不同进行分离,在实际应用过程中通常选择性不好,只能作为粗提纯操作,还需要与其他分离方法配合使用才能得到目标产物,对于具有衰变特性的
89
zr并不适用。而且,上述提到的分离方法普遍存在工艺流程长、产物难以洗脱以及洗脱酸度过高等问题。
5.由于
89
zr生产过程的复杂性以及其随时间衰变的特性,从钇靶中分离出高丰度可用于医学使用的
89
zr比较困难。因此,为了将
89
zr从钇靶中分离并富集,本领域的技术人员需要开发了一种快速,分离性能高,且最终产物丰度高的分离方法。
技术实现要素:
6.为了解决现有技术存在的上述问题,本发明提供了一种在钇靶上分离
89
zr的方法,通过使用浸渍树脂法和溶剂萃取法对
89
zr进行分离;其中,浸渍树脂法在使用过程中可以很好地实现自动化,减少人工的辐射剂量;溶剂萃取法则可以大幅度的缩短分离处理的时间,最大限度的保证
89
zr活度,也减少了工作人员在环境中的辐射暴露。本发明还提供了采用该方法在钇靶上分离得到的
89
zr在放射性免疫治疗药物的应用,用于标记单克隆抗体等药物。
7.为了实现上述目的,本发明提供了如下技术方案
8.一种在钇靶上分离
89
zr的方法,包括以下步骤:
9.(1)将含有
89
zr的钇靶冷却后溶解过滤;
10.(2)使用萃取剂将步骤(1)得到的溶液分离,使用盐酸进行洗涤和解析,并收集第一解析液;
11.(3)采用柱色谱法或溶液萃取法,将步骤(2)中得到的解析液再次分离,然后使用
盐酸进行洗涤和解析,并收集第二解析液,得到纯化的
89
zr。
12.作为本发明技术方案的进一步描述,在步骤(1)中,所述冷却时间为20-30h。
13.作为本发明技术方案的进一步描述,在步骤(1)中,所述冷却时间为24h。
14.作为本发明技术方案的进一步描述,在步骤(1)中,溶解钇靶的溶液为0.1~1mol/l的hcl溶液。
15.作为本发明技术方案的进一步描述,在步骤(1)中,溶解钇靶的溶液为0.5mol/l的hcl溶液。
16.作为本发明技术方案的进一步描述,在步骤(2)中,所述萃取剂为浸渍萃取剂,其包括三正辛胺toa、三辛基氧膦topo、n,n-二异辛基二甘醇酰胺酸d2ehdgaa或n,n-二辛基二甘醇酰胺酸dodgaa的至少一种。
17.作为本发明技术方案的进一步描述,在步骤(2)和步骤(3)中,所述盐酸的浓度为0.1-4mol/l。
18.优选地,在步骤(2)和步骤(3)中,所述盐酸的浓度为3.5mol/l。
19.作为本发明技术方案的进一步描述,在步骤(3)中,所述柱色谱法采用浸渍树脂柱;所述浸渍树脂柱的型号为xad-16型,平均粒径为0.56-0.71mm。
20.在分离过程中,所采用浸渍树脂法在可以很好地实现自动化,减少人工的辐射剂量。
21.本发明的另一个目的,在于提供了一种在钇靶上分离
89
zr的方法在放射性免疫治疗药物的应用,上述在钇靶上分离
89
zr的方法,浓缩富集得到
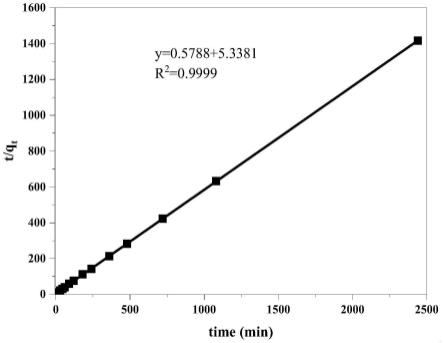
89
zr,并应用于制备生物体内放射性免疫治疗药物。
22.基于上述的技术方案,本发明取得的技术效果为:
23.(1)本发明提供的在钇靶上分离
89
zr的方法,具有分离流程操作简单、萃取剂制备工艺简单、分离效能好、产物丰度(纯度)高的优点,通过模拟不同梯度浓度的钇锆分离条件,成功得到冷实验条件下钇锆分离的最佳条件,在此条件下分离得到的
89
zr纯度在99%以上。在进行热室实验时,在浸渍树脂柱上进行自动化分离,不仅容错性高,而且可以最大限度的降低放射性对人体的伤害。
24.(2)本发明的在钇靶上分离
89
zr的方法,所使用到的溶剂萃取法则可以大幅度的缩短分离处理的时间,最大限度的保证
89
zr活度,也减少了工作人员在环境中的辐射暴露。采用该方法在钇靶上分离得到
89
zr后,应用于放射性免疫治疗药物的制备,用于标记单克隆抗体等药物。
附图说明
25.图1为本发明的实施例2中的不同盐酸浓度下萃取剂萃取性能测试图。
26.图2为本发明的实施例2中的不同萃取剂浓度下萃取剂萃取性能测试图。
27.图3为本发明的实施例2中的不同酸条件下萃取剂反萃效果测试图。
28.图4为本发明的实施例2中的扩大钇锆浓度差萃取剂萃取测试图。
29.图5为本发明的实施例2的萃取剂等温线吸附测试图。
30.图6为本发明的实施例2的langmuir模型图。
31.图7为本发明的实施例2的freundlich模型图。
32.图8为本发明的实施例2的萃取剂动力学吸附测试图。
33.图9为本发明的实施例2的伪一阶动力学测试图。
34.图10为本发明的实施例2的伪二阶动力学测试图。
具体实施方式
35.为了便于理解本发明,下面将结合附图和具体的实施例对本发明进行更全面的描述。附图中给出了本发明的较佳实施方式。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式。相反地,提供这些实施方式的目的是使对本发明的公开内容理解的更加透彻全面。
36.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施方式的目的,不是旨在于限制本发明。
37.实施例1
38.本实施例提供了一种在钇靶上分离
89
zr的方法,包括以下步骤:
39.(1)将含有
89
zr的钇靶冷却后溶解过滤,其中,冷却时间为20-30h,经过优选,冷却时间为24h;溶解钇靶的溶液为0.1~1mol/l的hcl溶液,经过优选,hcl溶液的浓度为0.5mol/l。
40.(2)使用萃取剂将步骤(1)得到的溶液分离,使用盐酸进行洗涤和解析,并收集第一解析液;其中,萃取剂为浸渍萃取剂,其包括三正辛胺toa、三辛基氧膦topo、n,n-二异辛基二甘醇酰胺酸d2ehdgaa或n,n-二辛基二甘醇酰胺酸dodgaa的至少一种;经过优选,萃取剂为d2ehdgaa萃取剂。
41.(3)采用溶液萃取法或者柱色谱法进行分离。
42.a.将步骤(2)中得到的解析液再次分离,然后使用盐酸进行洗涤和解析,并收集第二解析液,得到纯化的
89
zr。其中,盐酸的浓度为0.1-4mol/l,经过优选,盐酸的浓度为3.5mol/l。
43.b.在采用柱色谱法将步骤(2)中得到的解析液进行分离时,采用的色谱柱为浸渍树脂柱,该浸渍树脂柱的型号为xad-16型,平均粒径为0.56-0.71mm。
44.实施例2
45.本实施例采用溶液萃取方法,将
89
zr从钇靶中分离。以下为探究在该溶液萃取方法下,钇锆分离的最优条件。
46.2.1不同盐酸浓度下萃取性能测试
47.按照实施例1提供的在钇靶上分离
89
zr的方法,将萃取剂d2ehdgaa稀释至10mm/l,配制盐酸浓度梯度为0.5-4共八个点、钇锆浓度为10mg/l的混合金属离子水溶液,将稀释过后的4mld2ehdgaa与4ml钇锆金属离子溶液混合,在室温200rpm的摇床中振荡24h保证达到吸附平衡,通过电感耦合等离子体原子发射光谱检测萃取剂对锆的吸附效果。
48.图1为本实施例的不同盐酸浓度下萃取剂萃取性能测试图,如图1所示,萃取剂d2ehdgaa在盐酸浓度为0.5m(0.5mol/l)的条件下,表现出对zr的高选择性分离效果,其萃取率为93.55%。
49.2.2不同萃取剂浓度下萃取性能测试
50.按照实施例1提供的在钇靶上分离
89
zr的方法,分别配制萃取剂d2ehdgaa的浓度为10mm/l、15mm/l、20mm/l、25mm/l以及30mm/l的梯度溶液,钇浓度为5000mg/l、锆浓度为5mg/l的混合金属离子水溶液。
51.将不同浓度的4ml萃取剂分别与4ml金属离子溶液混合震荡24h保证吸附达到平衡。
52.图2为本实施例的不同萃取剂浓度下萃取剂萃取性能测试图,如图2所示,在萃取剂浓度为10mm时,萃取率为93.55%,随着萃取剂浓度的增加,萃取率逐渐上升,并逐渐稳定在99%左右。萃取剂浓度对萃取效果至关重要,一般来说,萃取剂浓度越高,萃取效果越好,但浓度过高会影响反萃的效果,因此萃取剂d2ehdgaa的浓度为15mm/l时,萃取和反萃效果最好。
53.2.3不同酸条件下反萃效果测试
54.按照实施例1提供的在钇靶上分离89zr的方法,分别配制盐酸浓度为1m/l、1.5m/l、2m/l、2.5m/l、3m/l、3.5m/l、4m/l、4.5m/l和5m/l,硫酸浓度为0.1m/l、0.2m/l、0.4m/l、0.6m/l、0.8m/l、1m/l、2m/l、3m/l和4m/l,硝酸浓度为0.1m/l、0.2m/l、0.4m/l、0.6m/l、0.8m/l、1m/l、2m/l、3m/l和4m/l。
55.在2.1和2.2的实验条件下配制200ml吸附后的萃取相,分别取4ml与配制的酸溶液等体积混合震荡8h以上,保证反萃完全。
56.图3为本实施例的不同酸条件下萃取剂反萃效果测试图,如图3所示,在盐酸条件下,浓度在3.5m时达到最大反萃效率55.89%。在硝酸条件下,没有反萃效果,硫酸条件反萃效果最好,在浓度为0.4m时,反萃率达到了96.57%,可以实现在低浓度下单级高效反萃的效果。
57.针对锆不同的使用效果可以选择性的使用盐酸或者硫酸进行反萃,本实施例制备的锆(
89
zr)主要用于肿瘤的放射性免疫治疗,需要适应人体环境,选择浓度在3.5m(3.5mol/l)盐酸条件下进行反萃。
58.2.4扩大钇锆浓度差吸附测试
59.由于
89
zr是通过回旋加速器束流对钇靶的轰击得到的,因此,在分离钇锆时需要考虑钇锆的高浓度差对锆分离的影响。分别配制钇锆浓度比为1:1、1000:1、10000:1以及100000:1的混合金属离子溶液,稀释萃取剂d2ehdgaa至15mm/l,混合金属离子溶液和萃取剂溶液分别取4ml混合震荡24h保证达到吸附平衡。
60.图4为本实施例的扩大钇锆浓度差萃取剂萃取测试图,如图4所示,在钇锆浓度差一万倍时仍可保持钇锆的完全分离,可在实际分离时实现单级完全能分离。
61.2.5等温线吸附测试
62.分别配制浓度为5mg/l、10mg/l、20mg/l、40mg/l、60mg/l、80mg/l、100mg/l、150mg/l、200mg/l、250mg/l、300mg/l、350mg/l、400mg/l、450mg/l和500mg/l各4ml的锆金属离子水溶液,其中盐酸浓度为0.5m(0.5mol/l)。分别与4ml15mm/l的d2ehdgaa萃取剂混合充分震荡。得到吸附等温线、langmuir模型和freundlich模型。
63.图5为本实施例的萃取剂等温线吸附测试图,图6为本实施例的langmuir模型图,图7为本实施例的freundlich模型图。如图5~图7所示,其中freundlich模型拟合相关系数大于0.99,freundlich模型是基于非均相表面吸附的经验模型,通常呈现指数趋势。
64.freundlich模型的1/n小于1,证明了锆的萃取过程是单层的,吸附均匀。根据拟合数据,该萃取剂的最大萃取容量为309.5mg/g,可以有效实现锆的浓缩富集利用,在后期生物体内放射性免疫治疗的应用十分有前景。
65.2.6动力学吸附测试
66.配制浓度为5mg/l、盐酸浓度为0.5m(0.5mol/l)的锆金属离子溶液,与15mm/l的d2ehdgaa萃取剂混合充分震荡。分别在15min、30min、45min、60min、90min、120min、180min、240min、360min、480min、720min、1080min和2440min进行测试,得到动力学吸附模型。
67.图8为本实施例的萃取剂动力学吸附测试图,图9为本实施例的伪一阶动力学测试图,图10为本实施例的伪二阶动力学测试图。如图8~图10所示,萃取过程可以用准二级模型很好地拟合,得到r2=0.9999,说明吸附过程受化学吸附控制。萃取过程在15min迅速达到70%以上萃取效率,240min达到萃取平衡,整个萃取过程相对较快,可以实现单级萃取。由于
89
zr的活度会随着时间下降,而分离
89
zr的时间越短,活度影响越小。本实施例使用到的溶剂萃取法则可以缩短分离处理的时间,以最大限度的保证
89
zr活度。
68.此外,本实施例采用了溶剂萃取法分离纯化
89
zr,得到了纯度在99%以上的高丰度
89
zr。可通过简单的自动化工艺步骤,减少了人工的辐射剂量,提高了产物纯度。
69.实施例3
70.钇靶上
89
zr自动化分离方法
71.(1)将溶解液转移至浸渍树脂上,待溶液完全通过树脂后,用3.5m(3.5mol/l)盐酸淋洗树脂柱,收集流出液,其中浸渍树脂选择xad-16型,平均粒径为0.56-0.71mm。
72.(2)将上述流出液继续通过另一个树脂柱,用3.5m(3.5mol/l)盐酸淋洗树脂柱,收集流出液,得到高丰度的
89
zr。
73.采用此方法制备的
89
zr纯度可达到99%以上。
74.实施例4
75.将实施例2或实施例3分离得到
89
zr应用在制备放射性免疫治疗药物上,具体来说,通过浓缩富集得到
89
zr,用于标记放射性免疫治疗药物。
76.可将单抗或多肽通过螯合剂如dfo、dtpa、dota等进行位点特异性偶联,并用
89
zr进行放射性标记,有选择性得到放射性诊断/治疗分子探针。
77.也可使用89zr标记帕博利珠单抗单抗(pembrolizumab),或者阿替利珠单抗(atezolizumab)。
78.实施例5
79.本实施例提供了一种在钇靶上分离
89
zr的方法,包括以下步骤:
80.(1)将含有
89
zr的钇靶冷却后溶解过滤,其中,冷却时间为24h;溶解钇靶的溶液为0.5mol/l的hcl溶液。
81.(2)使用萃取剂将步骤(1)得到的溶液分离,使用盐酸进行洗涤和解析,并收集第一解析液;其中,萃取剂为d2ehdgaa浸渍萃取剂。
82.(3)采用溶液萃取法将步骤(2)中得到的解析液再次分离,然后使用盐酸进行洗涤和解析,并收集第二解析液,得到纯化的
89
zr。其中,盐酸的浓度为3.5mol/l。
83.实施例6
84.本实施例提供了一种在钇靶上分离
89
zr的方法,包括以下步骤:
85.(1)将含有
89
zr的钇靶冷却后溶解过滤,其中,冷却时间为20h;溶解钇靶的溶液为0.1mol/l的hcl溶液。
86.(2)使用萃取剂将步骤(1)得到的溶液分离,使用盐酸进行洗涤和解析,并收集第一解析液;其中,萃取剂为三正辛胺toa。
87.(3)采用柱色谱法进行分离,采用的色谱柱为浸渍树脂柱,该浸渍树脂柱的型号为xad-16型,平均粒径为0.56-0.71mm。
88.实施例7
89.本实施例提供了一种在钇靶上分离
89
zr的方法,包括以下步骤:
90.(1)将含有
89
zr的钇靶冷却后溶解过滤,其中,冷却时间为20h;溶解钇靶的溶液为0.1mol/l的hcl溶液。
91.(2)使用萃取剂将步骤(1)得到的溶液分离,使用盐酸进行洗涤和解析,并收集第一解析液;其中,萃取剂为三正辛胺toa。
92.(3)采用溶液萃取法将步骤(2)中得到的解析液再次分离,然后使用盐酸进行洗涤和解析,并收集第二解析液,得到纯化的
89
zr。其中,盐酸的浓度为0.1mol/l。
93.实施例8
94.本实施例提供了一种在钇靶上分离
89
zr的方法,包括以下步骤:
95.(1)将含有
89
zr的钇靶冷却后溶解过滤,其中,冷却时间为30h;溶解钇靶的溶液为1mol/l的hcl溶液。
96.(2)使用萃取剂将步骤(1)得到的溶液分离,使用盐酸进行洗涤和解析,并收集第一解析液;其中,萃取剂为d2ehdgaa浸渍萃取剂。
97.(3)采用溶液萃取法将步骤(2)中得到的解析液再次分离,然后使用盐酸进行洗涤和解析,并收集第二解析液,得到纯化的
89
zr。其中,盐酸的浓度为4.0mol/l。
98.实施例9
99.89
zr的制备来源。由于
89
y和
89
zr在结构上只有一个质子的差别,通过回旋加速器作用钇靶直接得到产物
89
zr,通过控制束流的强度控制产物
89
zr的产量和活度,适合于满足不断增长的临床要求。
100.在钇靶上制备
89
zr的方法,具体实施步骤如下:
101.(1)将裁剪成固定尺寸的钇靶固定在靶托(cu、al或石墨材质)上,将靶体移动到生产的热室中,通过遥控机械手将样品移动到工作位置,接受质子辐照,束流辐照能量在10mev-20mev之间,累积到一定剂量的辐照。
102.(2)将靶体取下,由于刚接受过辐照的样品已经被活化,靶材的放射性活度较高,因此将靶材收集在热室里冷却24h后进行溶解。
103.(3)将钇靶溶解在0.5mol/l的盐酸溶液中,直到完全溶解,然后将溶解后的溶液通过微孔过滤器(0.25μm)备用。
104.本实施例提供的高丰度
89
zr制备方法,具有方法简单、分离流程合理、耗时短且
89
zr丰度高的有益效果。
105.以上内容仅仅为本发明的结构所作的举例和说明,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些显而易见的替换形
式均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1