影响水稻叶、根际N2O排放的方法及装置与流程
本发明涉及农业生产的水稻种植领域,特别是涉及一种影响水稻叶、根际n2o排放的方法及装置。
背景技术:
稻田生态系统是n2o的重要排放源,且其排放与施氮量、稻田水分状况密切相关。土壤产生并释放的n2o约占生物圈排放到大气中n2o总量的53%,农业土壤是n2o的主要排放源。施用氮肥排放的n2o占土壤n2o总排放量的25%-82%。增加氮肥用量,n2o排放随之增加。长期大量施用氮肥及其所导致的土壤酸化均会促进n2o的释放,但氮肥施用量水平较低时对n2o排放的影响并不显著。而且,作物及其氮素利用对土壤n2o排放也有重要影响。有研究表明,作物生长能显著降低土壤n2o排放量,但也有植物生长会大幅增加土壤n2o排放的研究报道。另外,植物本身也能产生和排放n2o,随着施氮量增加,植物排放n2o明显增加,且植物排放n2o还受光强和土壤n、p供给水平等因素影响。
现有的研究结果显示,在2008年中国稻田水稻生长季n2o排放量均值为22.48gg,稻田n2o排放随施氮量增加而增加。但在稻田淹水造成厌氧环境的条件下,n2o进一步被还原为n2,此时氮肥对n2o排放的影响并不明显。在0-180kgnhm-2范围内,增施尿素对稻田n2o排放的影响不显著,只有施用尿素量达到270和360kgnhm-2时,n2o排放通量才会明显升高。研究表明,水稻植株也会影响稻田n2o的排放,水稻植株的参与使土壤n2o排放减少了81%。但也有相反的研究报道,如有报道,种植水稻的土壤n2o排放量比相同条件下裸土n2o排放量增加了37%。
因此如何来探讨利用光照和施氮量对水稻叶际及根际n2o排放的影响和机制。从而旨在控制稻田n2o减排的及在水稻生产上合理的供氮提供现实可行的方案与依据。为水稻生产环境保护,及可持续发展提供保障。
从前人现有的的研究成果看,无论是土壤还是植物n2o排放均与施氮量、农田水分状况等因素密切相关。此外,植物水稻根际n2o排放也会影响到叶际n2o排放,光照、氮源对农田n2o排放作用应与其对作物根、叶界面n2o排放的效应密切相关。但迄今为止,对光照和施氮量调控水稻根际、叶际界面n2o排放的作用未有该方面的系统报道。因此,如可在水培控氮、同步测定条件下,探讨如何在光照和施氮量对水稻叶际及根际n2o排放的影响及机制,旨在为稻田的水稻的n2o减排的及水稻生产上合理的供氮技术提供理论与现实依据。从而实现科学种田,并对大气环境形成有力保护,并降低水稻的种植成本,同时为农民实现增产增收。
技术实现要素:
本发明就是要提供一种影响水稻叶、根际n2o排放的方法及装置。对供试水稻采用光控培养系统,将水稻地上部和地下部严格分隔在试验装置内室和外室,对光照和施氮量调控水稻根际、叶际界面n2o的排放。为稻田的水稻的n2o的减排及水稻生产上合理的供氮技术提供理论与现实依据;为水稻生产实现可持续发展。
本发明公开一种影响水稻叶、根际n2o排放的方法,对供试水稻采用光控培养,其包括如下方法步骤,1)利用室内弱光控制水稻叶际及根际n2o排放通量试验;
2)于不同光照条件下不同施氮量对水稻叶际及根际n2o排放通量试验;和,3)对水稻叶际及根际n2o排放通量进行的计算及统计;
步骤1)所述利用室内弱光控制水稻叶际及根际n2o排放通量试验是包括水稻植株处理及气样n2o的收集与检测。
优选的,是步骤1)所述利用室内弱光控制水稻叶际及根际n2o排放通量试验,是对供试水稻先采用土培法育苗,以水培法培养,通过控制对水稻的不同光照强度与不同施氮量来确定水稻叶、根际的n2o排放。
优选的,是步骤2)所述于不同光照条件下不同施氮量对水稻叶际及根际n2o排放通量试验;是于水稻开花结实期室内弱光、室内强光、和室外自然光下条件实施;所述室内弱光是指光照强度为0lux-4000lux,室内强光是指光照强度为0lux-8000lux;所述不同施氮量是用nh4no3作为控制氮源,于水稻开花结实期实施脱氮、低氮、高氮三个处理,所述脱氮、低氮、高氮是分别控制含氮量为0n,0mg/l、1n,30mg/l、3n,90mg/l;每个处理重复2-4次,收集水稻处于开花结实阶段的水稻叶际及根际n2o的排放。
进一步的,所述水稻植株处理是选择水稻苗均匀一致,并控制每一水稻苗的鲜株重差在0-2g,用去离子水洗净、吹干,置于按不同施氮量的培养液的培养装置中;并在不伤害水稻植株条件下,对水稻地上的叶际部和水稻地下部的根际部进行分隔培植。
进一步的,是步骤3)水稻叶际及根际n2o排放通量的计算及统计,是对水稻叶、根际n2o排放量,按如下计算公式计算:f=ρ×v/a×dc/dt×273/(273+t)
式中:f表示n2o排放通量,μgm-2h-1;
ρ是标准状态下气体密度,n2o,1.98kgm-3;
v为内、外室有效体积m3;
a为静态箱底面积m2;
dc/dt为封箱单位时间1h,采样箱内气体n2o浓度的变化nll-1h-1;
t为采样箱气温℃;
以试验装置内、外室所采气样检测n2o数据计算的结果,分别表示水稻叶际及根际n2o的排放通量;负数表示吸收,正数表示排放;所有处理的平均数和标准误差均是重复统计的结果。
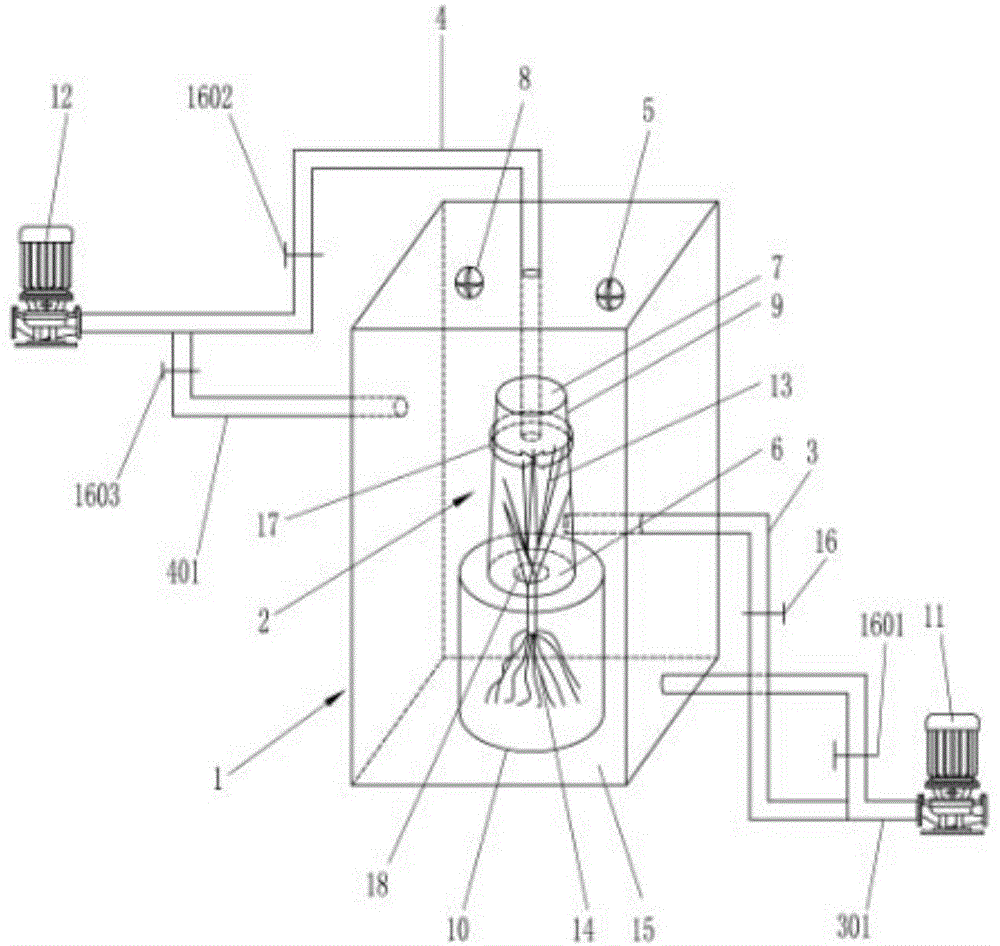
本发明的另一目的是实现上面所述的影响水稻叶、根际n2o排放的方法的装置,包括光控培养箱系统,其所述光控培养箱系统包括主试验装置和辅助装置,所述主试验装置包括内室部和外室部,叶际室和根际室;内室部设于外室部内;叶际室设于内室部内腔,根际室设于外室部内腔,叶际室对应设于根际室上方;所述辅助装置包括输气装置和抽气装置;输气装置包括输气泵和内、外输气管;所述抽气装置包括抽气泵和内、外抽气管。
本发明所述的装置,所述主试验装置的内室部和外室部为透明材料制成的箱体结构,所述外室部包括外室罩体、根际室组成,于外室罩体的顶部设有排气扇和光照灯,内室部和根际室均设于外室部内腔,内室部通过内室固定装置对应的设于根际室上部,而根际室与外室部的内腔相通;水稻叶部位于叶际室内,而水稻根部位于根际室内。
所述的装置,其所述内室部下端部设有通孔,水稻叶部置于内室部内腔的叶际室,而水稻根部则经内室部下端通孔进入并置于根际室内腔;于内室部的顶端上连接内抽气管一端,内抽气管另一端连接于抽气泵出口端上;叶际室与根际室之间的通孔设有密封圈。
优选的,所述辅助装置的内输气管的一端连接于内室部的叶际室下端,另一端连接于输气泵出口端;外输气管的一端连通于外室部的下端,另一端同样连接于输气泵出口端上;而内抽气管的一端连通于内室部的叶际室的顶端,另一端连接于抽气泵的出口端;外抽气管的一端连接于外室部的上端,另一端则同样连接于抽气泵的出口端上。
本发明所述的影响水稻叶、根际n2o排放的方法及装置,其方法试验采用的是水培方法,在小型光控培养箱内进行,供试作物水稻(oryzasatival.)品种为培杂泰丰。将水稻地上部和地下部严格分隔在试验装置内室部和外室部,用气相色谱法测定水稻根、叶界面排放的n2o量。强光、自然光照下脱氮与低氮处理间水稻根际n2o排放差异亦不显著(p>0.05)。
本发明公开的一种影响水稻叶、根际n2o排放的方法及装置,通过利用室内弱光控制水稻叶际及根际n2o排放通量试验;和不同光照条件下不同施氮量对水稻叶际及根际n2o排放通量试验;对对水稻叶际及根际n2o排放通量进行的计算及统计,系统的计算出水稻在不同条件下的n2o排放量进行系统科学的分析和计算。从本发明的试验供氮范围内随着施氮量的增加,水稻根、叶界面n2o排放通量随之增加;不同供氮水平条件下(1n,3n),对比弱光,强光、自然光有抑制水稻根际n2o排放作用,但强光、自然光条件下脱氮(0n)处理的水稻根际n2o排放仍有所增加,而不同供氮水平(1n,3n)及脱氮(0n)条件下,强光、自然光条件下均有增强水稻叶际n2o排放的作用。为稻田的水稻的n2o减排及水稻生产上合理的供氮即合理的施用氮肥提供理论与现实依据,从而实现科学种田,并对大气环境形成有力保护,降低水稻的种植成本,同时可为农民实现增产增收。
附图说明:
图1,为本发明影响水稻叶、根际n2o排放的方法的装置结构示意图;
图2,为本发明光照强度为强光照条件下即8000lux时的施氮量处理的开花结实期水稻叶际n2o排放通量;
图3,为本发明光照强度为弱光照条件下即4000lux时的施氮量处理的开花结实期水稻叶际n2o排放通量;
图4,为本发明光照强度为在自然光照条件下的施氮量处理的开花结实期水稻叶际n2o排放通量;
图5,为本发明光照强度为强光照条件下即8000lux时的施氮量处理的开花结实期水稻根际n2o排放通量;
图6,为本发明光照强度为弱光照条件下即4000lux时的施氮量处理的开花结实期水稻根际n2o排放通量;
图7,为本发明光照强度为在自然光照条件下的施氮量处理的开花结实期水稻根际n2o排放通量。
图1中,1、外室部,2、内室部,3、内输气管,301、外输气管,4、内抽气管,401、外抽气管,5、排气扇,6、内室下密封圈,7、内室上密封圈,8、光照灯,9、叶际室,10、根际室,11、输气泵,12、抽气泵,13、水稻叶部,14、水稻根部,15、外室罩体,16、1601、1602、1603、控制阀,17、内室固定装置,18、通孔。
具体实施方式:
为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现结合具体实例对本发明的技术方案进行以下详细说明,本发明未描述的技术手段按本领域内常规方式进行,应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。
本发明的一种影响水稻叶、根际n2o排放的方法,对供试水稻采用光控培养系统,其包括如下方法步骤,1)利用室内弱光控制水稻叶际及根际n2o排放通量试验;
2)于不同光照条件下不同施氮量对水稻叶际及根际n2o排放通量试验;和,3)对水稻叶际及根际n2o排放通量进行的计算及统计;
步骤1)所述利用室内弱光控制水稻叶际及根际n2o排放通量试验包括水稻植株处理及气样n2o的收集与检测。
步骤1)所述利用室内弱光控制水稻叶际及根际n2o排放通量试验,是对供试水稻先采用土培法育苗,以水培法培养,通过控制对水稻的不同光照强度与不同施氮量来确定水稻叶、根际的n2o排放。
步骤2)所述于不同光照条件下不同施氮量对水稻叶际及根际n2o排放通量试验;是于水稻开花结实期室内弱光、室内强光、和室外自然光下条件实施;所述室内弱光是指光照强度为0lux-4000lux,室内强光是指光照强度为0lux-8000lux;所述不同施氮量是用nh4no3作为控制氮源,于水稻开花结实期实施脱氮、低氮、高氮三个处理,所述脱氮、低氮、高氮是分别控制含氮量为0n,0mg/l、1n,30mg/l、3n,90mg/l;每个处理重复2-4次,收集水稻处于开花结实阶段的水稻叶际及根际n2o的排放。
如图1所示,本发明影响水稻叶、根际n2o排放的方法的装置,内室部2设于外室部1的由外室罩体15构成的外室内腔内,于外室罩体15的顶部壁面上设有排气扇5及光照灯8,所述外室罩体15及内室部2的构成材料均是采用透明的有玻璃材料制成,设于外室部1内腔的根际室10位于外室部1内腔的底部座上,内室部2由内室固定装置17固定于外室部1内腔的根际室10的上部,叶际室9设于内室部内腔内并相对应的设于根际室10的上方,叶际室9与根际室10之间通过通孔18相连通,当水稻叶部13置于叶际室9内时,水稻根部14则通过通孔18置于根际室10内,然后通孔18则用内室下密封圈6的密封圈相密封,这样叶际室9和根际室10则相对应的密封隔离开。输气泵11的出口端经内输气管3一端连接于内室部2的叶际室9的下端,内输气管3上设控制阀16,外输气管301一端连通于外室部1的下部,另一端经设于其上的控制阀1601连接于输气泵11的出口端上。抽气泵12的出口端经内抽气管4一端连接于内室部2的叶际室9的顶端,内抽气管4上设控制阀1602,外抽气管401一端连通于外室部1的上部另一端经设于其上的控制阀1603连接于抽气泵12的出口端上。内抽气管4与内室部2的叶际室9的顶端连接处用内室上密封圈7密封。
本发明具体实施例的试验装置及工作原理,材料与方法;
土壤产生并释放的n2o约占生物圈排放到大气中n2o总量的53%,农业土壤是n2o的主要排放源。施用氮肥排放的n2o占土壤n2o总排放量的25%-82%。增加氮肥用量,n2o排放随之增加。长期大量施用氮肥及其所导致的土壤酸化均会促进n2o的释放,但氮肥施用量水平较低时对n2o排放的影响并不显著。而且,作物及其氮素利用对土壤n2o排放也有重要影响。有研究指出,作物生长能显著降低土壤n2o排放量,但也有植物生长会大幅增加土壤n2o排放的研究报道。另外,植物本身也能产生和排放n2o,随着施氮量增加,植物排放n2o明显增加,且植物排放n2o还受光强和土壤n、p供给水平等因素影响。
本发明的试验制备的光控培养箱装置,如图1所示。主体试验装置外室部1和内室部2,内室室2套装在外室部1的内腔之中,均为有机玻璃制作。外室部1规格30cm×30cm×100cm,主要由外室罩体15和根际室10组成,于外室罩体15的顶壁面装有1-2只小型电排气扇5来混匀内、外室内的空气,外室罩体15的外壁上还可设置有可以临时均匀安装白光光管的装置,其光强可通过控制开闭光管数量来调节。内室部2的直径25cm,高50cm,下底面保留内径10cm圆孔即通孔18可通入内室部2的内腔。内室部2顶盖可根据试验需要随时拆装,顶盖上安装有1只微型电扇来混匀内室空气。内、外室均安装有输气管和抽气管,可通过内、外室输、抽气管连接气泵来实施输气和抽气试验。试验时,将水稻地上部和地下部严密分隔在内室和外室即叶际室9和根际室10,并通过内、外室抽气管采集气样的n2o检测与数据分析,确定水稻根、叶界面n2o排放。本发明的试验装置实现可同步精确定量水稻叶际和根际n2o排放。
本发明具体试验方法,
室内弱光控制水稻叶际及根际n2o排放通量试验供试水稻(oryzasatival.)品种为培杂泰丰,由某农业大学提供。水稻用土培法育苗,水培法培养,7d换一次营养液(6l)。水稻培养试验用桶、培养液配方均参照现有技术方案等确定,采用的方法进行。试验光源通过紧贴试验装置外室的外壁临时安装白光光管的方法获得,并用控制开闭不同光管数量的方法,来控制试验光强,用黑布套法遮挡外界光。前期通过测定,不同类型水稻土有效氮(碱解氮)平均含量33.06mgkg-1,标准差±8.07,高有效氮含量的水稻土可达60.79mgkg-1。本试验设低氮1n,30mgl-1、中氮为2n,60mgl-1、高氮为3n,90mgl-1的不同施氮量处理,每个处理重复3次。培养液氮浓度采用nh4no3来控制,同时做试验装置的空白试验,空白试验重复3次。试验用glz-c型光量子计录仪测定离外室罩内壁5cm处的光强。在日间8:00-18:00时段,日间光照设置为4000lux;晚上18:00-8:00为暗处理时段,所有处理光强均为0lux。
水稻植株处理方法:精选均匀一致的水稻培杂泰丰试验用苗,控制鲜重株误差在0-2g,用去离子水洗净、吹干,放入重新按不同施氮量设计并更换培养液的pvc桶装置中。试验时,先将水稻植株地上部穿过4cm厚泡沫板,再经由内室下底面圆口装入内室部2,待泡沫板与内室部2圆孔紧贴之后,用涂有n0-704固化硅橡胶为密封圈的棉花堵塞空隙,再向水稻植株茎基部与泡沫板结合部位、泡沫板与内室圆孔紧贴部位灌注硅橡胶密封。待硅橡胶自然风干、固化后,装上内室部顶盖,用透明胶带密封,然后内室整套装置套装在试验装置外室底座,再安装外室罩体15。外室底座和罩体的结合部位用封箱胶布密封。这样,试验通过内、外室严密的分隔作用,在基本不伤害水稻植株条件下,实现了水稻地上部和地下部的严密分隔。水稻根际界面产生、经由液气界面扩散释放的n2o,被分隔集聚在外室部1的空气中;水稻地上部排放的n2o被分隔集聚在内室部2的空气中。
气样n2o检测:本发明的本实施例的试验装置内、外室输、抽气管均用三通阀控制,用流量计控制气流流量。试验前先用气泵以400l/h的高流量气流快速置换试验装置内、外室部空气1.5h,换气时间分别为上午8:00-9:30,下午12:30-14:00,晚上17:00-18:30。置换空气后立即封箱3h,封箱时间分别为:上午,9:30~12:30;下午,14:00~17:00;晚上,18:30-21:30。封箱时立即用注射器采集气样40ml,测定内、外室部的初始空气n2o浓度。封箱3h内每隔1h采样测定一次,同时实施试验装置的空气空白试验。在22:00-8:00时段,用气泵使内外室部空气保持持续流通、交换状态,流量控制在40l/h。不同处理水稻植物装箱后,试验连续实施6d。n2o的测定用气相色谱法,具体按现技术的方法进行,于采样当天用某公司生产的7890agcsystem气相色谱仪分析气体样品中n2o浓度。
试验于2013年某日用土培法育苗,然后移栽至pvc桶,每盆装6.0l营养液,种3株苗,每周更换一次营养液。分蘖期、开花结实期、成熟衰老期n2o排放观测试验分别于当年的近4个月内实施。实施试验时,分蘖期、开花结实期、成熟衰老期水稻生育期分别为64d、93d和136d,平均水稻植株鲜重分别为140g、346g和290g。
不同光照条件下不同施氮量对水稻叶际及根际n2o排放通量试验经研究表明,开花结实期是植物叶际n2o排放的关键时期。因此,2014年试验在室内弱光8:00-18:00,4000lux;18:00-22:00,0lux)、室内强光8:00-18:00,8000lux;18:00-22:00,0lux和室外自然光下实施,用nh4no3,分析纯,控制氮源,于水稻开花结实期实施脱氮,0n,0mg/l、低氮,1n,30mg/l、高氮,3n,90mg/l)三个处理,每个处理重复3次。除室外自然光外,室内光控试验的光源通过紧贴试验装置外室的外壁临时安装白光光管的方法获得,并用控制开闭不同光管数量的方法调节光强,用黑布套法遮挡外界光。试验于2014年某日用土培法育苗,按时移栽至pvc桶。试验时间同为2014内年实施。实施试验时,水稻生育期95d,平均鲜重380g,水稻处于开花结实阶段。水稻n2o排放试验及观测方法同上。
水稻叶际及根际n2o排放通量的计算及统计方法,
n2o排放通量均参照按如下计算公式:
f=ρ×v/a×dc/dt×273/(273+n
式中:f表示n2o排放通量(μgm-2h-1);
ρ、是标准状态下气体密度(n2o,1.98kgm-3);
v、为内、外室有效体积(m3);
a、为静态箱底面积(m2);
dc/dt、为封箱单位时间(1h)采样箱内气体n2o浓度的变化(nll-1h-1);
t、为采样箱气温(℃)。
按上式计算方法,本发明的以试验装置内、外室部所采气样检测n2o数据计算的结果,分别表示水稻叶际及根际n2o的排放通量。负数表示吸收,正数表示排放。在数据分析中,不同处理均重复3次,所有处理的平均数和标准误均是3次重复统计的结果。所得数据资料经excel2003初步整理、作图,并用spss19.0进行方差统计分析,处理间差异显著性检验用duncan多重比较法。
结果与分析
室内弱光条件下施氮量对水稻分蘖期叶际及根际n2o排放的影响;
由下表1可知,在上午8:00-12:00、下午(13:00-17:00)和晚上18:00-22:00不同时间均观测到水稻分蘖期叶际及根际n2o净排放效应,2013年试验,处理间n2o排放差异达显著水平(p<0.05)。室内严密光氮控制条件下,高氮,3n,nh4no3-n,90mgl-1)处理的水稻分蘖期叶际及根际平均n2o排放通量为98.3和246.1μgm-2h-1(上午、下午、晚上平均),分别相当于低氮,1n,nh4no3-n,30mgl-1、中氮处理,2n,nh4no3-n,60mgl-1,的2.82、2.32倍和8.31、3.09倍,这表明室内严密光氮控制条件下,高氮处理具有促进水稻根、叶界面n2o排放的显著作用(p<0.05)。而且,在试验供氮范围内随着施氮量增加,水稻根、叶界面n2o排放均明显增加,但低氮与中氮处理间水稻叶际n2o排放差异不显著。因此,室内弱光条件下,提高施氮量具有同步促进水稻分蘖期根、叶界面n2o排放的明显作用。
表1室内弱光条件下不同施氮量处理的分蘖期水稻叶际及根际n2o的排放通量
说明:1n、2n和3n不同施氮量处理的培养液供氮浓度分别为30、60、90mgl-1(nh4no3-n);同一列中标明数据的不同小写字母表示不同施氮量处理间差异达显著水平(duncan多重比较,p<0.05)下同。
室内弱光条件下施氮量对水稻开花结实期叶际及根际n2o排放的影响,
由下表2可以看出,开花结实期水稻根、叶界面n2o的排放对施氮量的响应大致表现和分蘖期相似的规律,即低氮处理(1n)及高氮处理(3n)亦有促进水稻根、叶界面n2oo排放的作用(p<0.05)。在弱光控试验条件下,氮(2n)、高氮(3n)处理的水稻叶际及根际n2o排放通量分别为87.6、105.6μgm-2h-1和273.5、256.7μgm-2h-1,上午、下午、晚上平均),分别相当于分蘖期中氮(2n)、高氮(3n)处理的207.09%、107.4%和342.7%、104.3%。显然,室内弱光4000lux,条件下对比分蘖期,中氮水平2n,处理的开花结实期水稻根、叶界面n2o排放成倍增加,但高氮(3n)处理的开花结实期水稻根、叶界面n2o排放增加比例不大。而且,同期中(2n)、高氮(3n)处理间水稻根、叶界面n2o排放差异均不显著(p>0.05),由此说明弱光控条件下,水稻根、叶界面n2o排放对中、高氮(3n)水平的响应基本一致。但是,进一步提高施氮量未有显著提升同期水稻根、叶界面n2o排放的明显作用。
表2室内弱光条件下不同施氮量处理的开花结实期水稻叶际及根际n2o的排放通量。
室内弱光下施氮量对水稻成熟衰老期叶际及根际n2o排放的影响。
表3室内弱光下不同施氮量处理的成熟衰老期水稻叶际及根际n2o的排放通量。
说明,水稻成熟衰老期室内弱光下施氮量对水稻成熟衰老期叶际及根际n2o排放的影响试验结果,见表3;由表3可知,施氮量对水稻根、叶界面n2o排放的作用大致表现和中前期相似的规律。在水稻成熟衰老期,弱光控试验条件下中氮(2n)、高氮(3n)处理的水稻叶际及根际平均n2o排放通量分别为83.3、121.3μgm-2h-1和270.9、279.2μgm-2h-1(上午、下午、晚上平均),对比水稻开花结实期,中、高氮处理的水稻成熟衰老期根、叶界面n2o排放均无明显下降的趋势。但在低氮(1n)条件下,水稻成熟衰老期叶际及根际平均n2o排放通量分别相当于开花结实期的134.78%和191.02%,显然,在成熟衰老期水稻氮同化能力下降的条件下,低氮水平下水稻根、叶界面仍有较大量的n2o排放。因此,进一步控制施氮量对抑制成熟衰老期水稻根、叶界面n2o排放显得尤为重要。
不同光照条件下不同施氮量对水稻开花结实期叶际n2o排放的影响;
弱光(4000lux)、强光(8000lux)和自然光条件下,不同光照条件下不同施氮量对水稻开花结实期叶际n2o排放的影响试验结果见图2。图2表明,脱氮(0mgl-1)、低氮(30mgl-1)、高氮(90mgl-1)处理的水稻开花结实期叶际n2o排放通量分别为2.9、29.1、116.3μgm-2h-1,23.6、40.1、120.1μgm-2h-1和10.9、26.2、131.3μgm-2h-1。与2013年度试验比较,弱光控试验条件下低氮、高氮处理叶际n2o排放通量差别不大(2013年分别为36.8、105.6μgm-2h-1)。随着施氮量增加,水稻叶际n2o排放亦明显增加。有研究指出,水稻叶际n2o排放与光照也密切相关。高氮水平条件下,室内弱光、室内强光、自然强光,平均26500lux,处理的水稻叶际n2o排放通量依次上升,随着日间光照增强,水稻叶际n2o排放明显增强。在脱氮、低氮水平条件下,室内强光、自然光处理的水稻叶际n2o排放仍高于弱光处理(p<0.05)。此外,在弱光控试验条件下,低氮施肥水稻叶际n2o排放通量较低,但脱氮处理水稻叶际n2o排放更低,因此,相对于脱氮处理,低氮(1n)处理有促进水稻叶际n2o排放的显著作用(p<0.05)。相反,强光、自然光条件下的低氮处理的水稻叶际n2o排放较高,但脱氮处理在此条件下也有相对较高水稻叶际n2o排放通量。与对比脱氮处理比较,低氮施肥能够控制水稻叶际n2o的排放。
不同光照条件下不同施氮量对水稻开花结实期根际n2o排放的影响由图3可知,同步试验弱、强光及自然光条件下,脱氮、低氮、高氮处理的水稻开花结实期根际n2o排放通量分别为3.3、77.1、308.4μgm-2h-1,14.1、45.6、182.4μgm-2h-1和19.3、44.9、224.6μgm-2h-1,表明增施氮具有增强水稻根际n2o排放的作用。但水稻根际n2o排放亦与光照密切相关。在低氮、高氮不同水平条件下,室内强光、自然光处理的水稻根际平均n2o排放通量分别相当于弱光处理的59.14%、58.24%和59.1%、72.8%,强光、自然光处理在不同供氮水平下(1n,3n),对比弱光兼有抑制水稻根际n2o排放效应。但在脱氮条件下,室内强光、自然强光处理的水稻根际平均n2o排放通量分别相当于弱光处理的4.23和5.8倍,由此可知水稻根际n2o的排放仍有所增加。另外,弱光、强光及自然光不同条件下,低氮处理(1n)的水稻根际n2o排放分别相当于脱氮处理的23.21、3.23、2.33倍,但室内强光、自然光下低氮、脱氮处理间水稻根际n2o排放差异并不显著(p>0.05)。显然,弱光条件下,供氮的水稻根际n2o排放效应显著。与脱氮比,低氮施肥有效增强了水稻根际n2o排放。但是,强光下供氮促进水稻根际n2o排放效应明显减弱,而脱氮条件下水稻根际n2o排放反而相对较高。由此得到结论,在脱氮处理下,低氮施肥明显增强了水稻根际n2o的排放。
讨论水稻叶际n2o排放通量及其与光照、施氮量的关系据统计,在全球范围内,农作物的n2o排放量占人类活动导致n2o排放总量的60%。有些植物其n2o释放量不容忽视,在玉米、大豆植物对土壤(砂)-植物系统中n2o的贡献率达79.1%~100%。林木排放的n2o约为林下土壤排放n2o的86.7%。有研究表明,水稻植株通气组织对稻田n2o排放的贡献率为75%-86%。
本发明试验采用的装置,如图1所示,可在基本不伤害水稻植株、非离体试验条件下,同步精确定量测定水稻叶际及根际n2o的排放。同时,培养液均匀一致也提高了试验结果的可靠性。试验结果表明,高氮水平、弱光处理的水稻分蘖期、开花结实期、成熟衰老期平均叶际n2o排放通量分别为98.3、105.6μgm-2h-1和121.3μgm-2h-1,分别占水稻根、叶界面n2o总排放的29.30%、30.16%和31.33%,且控氮施肥未降低水稻叶际对n2o排放的贡献(表1-3)。在弱光(4000lux)、强光(8000lux)和自然光(平均26500lux)不同条件下,水稻开花结实期叶际n2o排放贡献比例分别为:脱氮,46.84%、62.61%、36.12%;低氮,27.39%、46.75%、36.90%;高氮,27.61%、39.71%、36.90%。显然,强光、自然光下不同施氮(1n、3n)处理的叶际n2o排放贡献比例更高,而减少施氮仍未降低水稻叶际n2o排放的贡献比例。综合本试验结果可以看出,不同生育期水稻叶际n2o排放的贡献比例在27%-60%之间变化;与弱光处理对比,提高日间光强会相应提高水稻叶际的n2o排放贡献比例,控氮施肥不能有效降低水稻叶际的n2o排放贡献比例。
光照和施氮量对水稻根际n2o排放的调控机制,
农田土壤n2o的排放源,其产生机制主要是土壤微生物的硝化和反硝化过程。从本发明的试验结果看,nh4no3为氮源条件下,随着施氮量增加,水稻根际n2o排放明显增加。但高nh4+-n的培养液仅观测到极微量的水稻根际n2o净排放效应(试验结果未列出),故水稻根际n2o排放应主要源自以no3--n为底物的生物反硝化过程。硝化细菌的反硝化作用对厌氧环境的要求不是很严格,在土壤有较低有机质的环境下就能发生。本发明水培条件下o2分压自然相对较低,作物根系分泌物及其残留物的降解可为微生物(尤其是根际微生物)提供碳源和能源,并进一步消耗培养液中的o2,从而构成了水稻根际生物反硝化作用的基本条件。显然,这是增施nh4no3有效促进水稻根际n2o排放的主要原因。由此可以推断,相同条件下增施no3--n仍会有促进水稻根际n2o产生和排放效应,提高nh4+-n供应水平则没有相应促进水稻根际n2o排放的作用效果。
此外,作物通过根系吸收与硝化反硝化过程竞争利用有效氮,可减少n2o的生成。与弱光比较,强光、自然光在不同供氮水平(1n,3n)下兼有抑制水稻根际n2o排放效应,其原因可能与适度范围内高光强有利于水稻吸收有效氮而抑制根际n2o排放效应密切向关。另外,弱光条件下低氮(1n)处理的水稻根际n2o排放相当于脱氮处理的23.21倍(p<0.05),而强光、自然光照下脱氮与低氮处理间水稻根际n2o排放差异不显著(p>0.05),。由此可见,高光强促进水稻植物氮吸收而抑制根际n2o排放作用,在低氮供应条件下尤为突出,相比较脱氮处理而言,低氮施肥同样有控制水稻根际n2o排放的作用效果。相反,弱光不利于水稻根系对氮素的吸收利用,供氮(1n,3n)对水稻根际n2o的生成和排放效应明显增强。相对于脱氮处理,低氮施肥有效促进了水稻根际n2o的排放。
光照和施氮量对水稻叶际n2o排放的调控机制,
对于植物地上部n2o的挥发机制,现有技术的植物光调控机理模式,认为光合作用强度低时植物体内c、n不平衡,造成no3-、n2o-累积,植物通过异化还原n2o-内源形成n2o。但试验表明即使在弱光、高nh4+-n供应水平下水稻叶际仅能挥发极微量的n2o,而在本试验培养介质有no3--n条件下,水稻叶际n2o排才放明显受光、氮作用的调节,c、n不平衡可能不是影响水稻叶际n2o排放的唯一要素。有学者将水稻叶际n2o排放归结为水稻植株通气组织通道效应机制。从本试验结果看,不同光控试验条件下增施nh4no3兼有促进水稻根、叶界面n2o排放的明显作用。这说明水稻叶际n2o排放的确与根际n2o排放密切相关,通道效应应该就是水稻叶际n2o排放的主要来源。但也应指出,本发明在不同供氮水平甚至在脱氮条件下(图2、图3),对比弱光,强光、自然光均有增强水稻叶际n2o排放效应;同时在不同供氮水平(1n,3n)条件下,对比弱光,强光、自然光明显抑制了水稻根际n2o的排放。显然,通道效应机制不能完全合理地解释水稻叶际n2o排放对光、氮的响应,将水稻叶际n2o排放完全归结为通道效应是一个值得商榷的问题。
植物体排放n2o来源的另一种途径是植物体内源形成和释放n2o。smart和bloom用15n标记研究表明,亚硝酸还原酶(nir)催化还原n2o-n内源形成n2o,是植物体内内源形成和排放n2o的主要机制。按照这一理论,弱光照、低co2浓度,有利于植物内源n2o-n形成和积累,n2o排放多;相反强光照、高co2浓度,n2o排放少,甚至吸收n2o,但植物n2o的排放量并不总是与光合作用强度相关。实际上,no3-的nr还原是植物体内源no2-主要来源。故nr作为光诱导酶,no3-的nr还原对植物体n2o排放也有作用。从本研究结果看,强光在不同供氮水平(1n、3n)甚至脱氮(0n)条件下均有促进水稻叶际n2o释放效应,显示强光诱导水稻nr活性增强的效应,一定程度上也有利于水稻内源n2o形成和排放。综合结果可以看出,绝大部分水稻叶际n2o排放应主要源于通道效应机制,但水稻植物体no3--n还原转化亦可能产生和排放一定数量n2o,对水稻叶际n2o的排放也有一定影响。显然,这可能就是在不同供氮水平(1n,3n)条件下,强光抑制水稻根际n2o的排放的同时,同步促进水稻叶际n2o排放的重要原因。
由于水稻根、叶界面n2o主要源于no3--n而非nh4+-n,故肥料氮以no3--n为主的条件下,控制施氮量对于控制水稻根、叶界面n2o的排放尤为重要。另外,试验表明提高日间光强并不能有效降低水稻叶际n2o的释放,但明显抑制了不同供氮水平(1n、3n)水稻根际的n2o排放。而从本试验结果看,水稻根、叶界面n2o排放仍然主要以根际n2o排放为主,这意味着抑制根际n2o排放会减少n2o总的排放数量。低氮供应水平(30mgl-1,nh4no3)、高光强处理的水稻根、叶界面n2o排放与对应脱氮处理间差异均不显著,这证明调整水稻氮素形态供应组成,在控制施氮量的同时适度增加铵态氮比例,本发明1:1,来降低培养介质no3--n底物供应,并结合改善水稻植物光照条件进一步控制水稻根际n2o排放,为水稻根、叶界面n2o减排的根本所在。
结论,从本发明的试验结果看,试验供氮范围内随着施氮量的增加,水稻根、叶界面n2o排放通量随之增加;不同供氮水平条件下(1n,3n),对比弱光,强光、自然光有抑制水稻根际n2o排放作用。
需要说明的是:以上本发明所公开的上述的技术方案,非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围,其均应涵盖在本发明的权利要求和说明书的范围当中。
- 还没有人留言评论。精彩留言会获得点赞!