组织容器系统的制作方法
相关申请的交叉引用
本申请要求2017年1月27日提交的美国临时申请号62/451,379的权益,所述申请以引用的方式整体并入本文。
本发明总体涉及可用于组织的运输中的组织容器系统和使用组织容器系统的方法。特别地,本发明涉及支持冷冻保存的人皮肤等同物的运输、解冻和使用的系统,以及其供医疗保健提供者使用的方法。
背景技术:
由执业医师、医疗保健提供者和第二方支付者接受工程化组织的主要障碍是缺乏有效且高效地保存和储存工程化组织的装置。活细胞和组织产品的性质使得发展长期储存具有挑战性。当前的工程化组织通常必须在精细控制条件下储存和装运以维持活力和功能。通常,工程化组织产品耗费数周或数月来生产,但是必须在制造之后的数小时或数天内使用。因此,组织工程化公司必须连续利用其生产设施以最大产能运营,并且承受必须丢弃的未售出产品的成本。作为一个具体实例,apligraf需要大约四周来制造,只能用15天,并且在使用之前必须维持在20℃与23℃之间。作为另一个实例,由护士用便携式孵育器将epicel从ma的cambridge的genzymebiosurgery的生产设施运输到使用点,并且在抵达时立即使用。这类约束对于开发便利且成本有效的产品提出了重大挑战。
已将冷冻保存作为储存问题的解决方案进行了探索,但是已经了解到会因为冻结成冰、冷却损伤和渗透失衡而引发组织损坏。除了apligraf之外,唯一的另外一个被批准的全层式活皮肤等同物orcel已被评估为冷冻产品,但是其缺点是其在使用之前必须维持在低于-100℃的温度。这需要专门的产品输送和储存条件,包括使用液氮来储存,这是高成本的并且在乡村诊所和野战医院中是不容易获得的。
因此,本领域需要冷冻保存有活力的工程化组织和细胞以在使用点常规可获得的条件下进行储存的改进方法。
技术实现要素:
本发明总体涉及可用于组织的运输中的组织容器系统,以及其随后供医疗保健提供者的使用,并且特别涉及支持冷冻保存的人皮肤等同物的运输、解冻和使用的系统。
因此,在一些实施方案中,本发明提供了组织容器,所述组织容器包括:限定盘状物的周边壁和基本上平坦的底表面,所述周边壁具有凸出端和凹入端,周边壁的所述凸出端具有由其突出的脊,所述脊具有长度和宽度,其中周边壁的所述凹入端限定对应于脊的长度和宽度的空间,使得当相同的组织容器放置在组织容器的顶部上时,组织容器的凹入端可释放地接纳从相同的组织容器的凸出端延伸的脊,并且所述底表面具有周边并且包括围绕所述周边延伸的周边凸部以提供由周边凸部和底表面限定的贮存部。在一些实施方案中,周边壁具有由其延伸的凸缘。在一些实施方案中,所述凸缘包括从周边壁的凸出端延伸的一个或多个突片。在一些实施方案中,所述凸缘包括从周边壁的凹入端延伸的一个或多个突片。在一些实施方案中,脊具有近端,并且脊的近端在其中具有一个或多个凹口。
在一些实施方案中,本发明提供了组织容器组件,所述组织容器组件包括:基本上相同的顶部组织容器和底部组织容器,所述顶部组织容器和底部组织容器中的每一者包括限定盘状物的周边壁和基本上平坦的底表面,所述底表面具有周边并且包括围绕所述周边延伸的周边凸部以提供由周边凸部和底表面限定的贮存部,并且周边壁具有凸出端和凹入端,周边壁的所述凸出端具有由其突出的脊,所述脊具有长度和宽度,其中周边壁的所述凹入端限定对应于脊的长度和宽度的空间,使得当顶部组织容器放置在底部组织容器上时,底部组织容器的凹入端可释放地接纳从顶部组织容器的凸出端延伸的脊。在一些实施方案中,顶部组织容器的周边壁具有由其延伸的顶部凸缘,并且底部组织容器的周边壁具有由其延伸的底部凸缘,使得当顶部组织容器与底部组织容器组装时,顶部凸缘和底部凸缘彼此接触。在一些实施方案中,顶部凸缘包括从周边壁的凸出端延伸的一个或多个突片以及从周边壁的凹入端延伸的一个或多个突片。在一些实施方案中,底部凸缘包括从周边壁的凸出端延伸的一个或多个突片以及从周边壁的凹入端延伸的一个或多个突片。在一些实施方案中,底部凸缘包括从周边壁的凸出端延伸的一个或多个突片以及从周边壁的凹入端延伸的一个或多个突片,并且其中顶部凸缘包括从周边壁的凸出端延伸的一个或多个突片以及从周边壁的凹入端延伸的一个或多个突片,使得当顶部组织容器与底部组织容器组装时,突片是偏离的。
在一些实施方案中,本发明提供了组织容器系统,所述组织容器系统包括:基本上相同的顶部组织容器和底部组织容器以及包括多孔底表面的托盘,所述顶部组织容器和底部组织容器中的每一者包括限定盘状物的周边壁和基本上平坦的贮存部底表面,所述贮存部底表面具有周边并且包括围绕所述周边延伸的周边凸部以提供由周边凸部和贮存部底表面限定的贮存部,其中所述托盘的大小被设定成在插入到组织容器中时由凸部支撑并支撑在贮存部底表面上方,并且周边壁具有凸出端和凹入端,周边壁的所述凸出端具有由其突出的脊,所述脊具有长度和宽度,其中周边壁的凹入端限定对应于脊的长度和宽度的空间,使得当顶部组织容器放置在底部组织容器上时,底部组织容器的凹入端可释放地接纳从顶部组织容器的凸出端延伸的脊。在一些实施方案中,顶部组织容器的周边壁具有由其延伸的顶部凸缘,并且底部组织容器的周边壁具有由其延伸的底部凸缘,使得当顶部组织容器与底部组织容器组装时,顶部凸缘和底部凸缘彼此接触。在一些实施方案中,顶部凸缘包括从周边壁的凸出端延伸的一个或多个突片以及从周边壁的凹入端延伸的一个或多个突片。在一些实施方案中,底部凸缘包括从周边壁的凸出端延伸的一个或多个突片以及从周边壁的凹入端延伸的一个或多个突片。在一些实施方案中,底部凸缘包括从周边壁的凸出端延伸的一个或多个突片以及从周边壁的凹入端延伸的一个或多个突片,并且其中顶部凸缘包括从周边壁的凸出端延伸的一个或多个突片以及从周边壁的凹入端延伸的一个或多个突片,使得当顶部组织容器与底部组织容器组装时,突片是偏离的。在一些实施方案中,托盘的多孔底表面是多孔膜。在一些实施方案中,脊具有近端并且脊的近端在其中具有一个或多个凹口,并且托盘具有一个或多个托盘突片,使得当托盘插入到底部组织容器中时,一个或多个突片插入到一个或多个凹口中。在一些实施方案中,所述系统还包括支撑在托盘的多孔底表面上的组织。在一些实施方案中,组织是冷冻保存的。在一些实施方案中,组织是器官型皮肤替代物。在一些实施方案中,所述系统还包括含有组织容器系统的无菌包装。组织容器系统可以提供为套件,所述套件具有一种或多种吸收性介质和/或一种或多种液体介质,诸如组织相容溶液。
在一些实施方案中,本发明提供了提供供医疗保健提供者使用的组织的方法,所述方法包括:将组织包装在前述段落的组织容器系统中;以及将包装的组织提供给对其有需要的医疗保健提供者。在一些实施方案中,本发明提供了将冷冻保存的组织解冻的方法,所述方法包括:提供在如上所述的组织容器系统中的冷冻保存的组织;移除顶部组织容器以暴露冷冻保存的组织;任选地将冷冻保存的组织转移到新的容器系统;以及在冷冻保存的组织解冻来提供解冻的组织的条件下用液体介质填充底部组织容器中的贮存部。在一些实施方案中,冷冻保存的组织是器官型人皮肤替代物。在一些实施方案中,所述方法还包括将器官型人皮肤替代物施加或移植到有需要的患者身上的烧伤或伤口上。
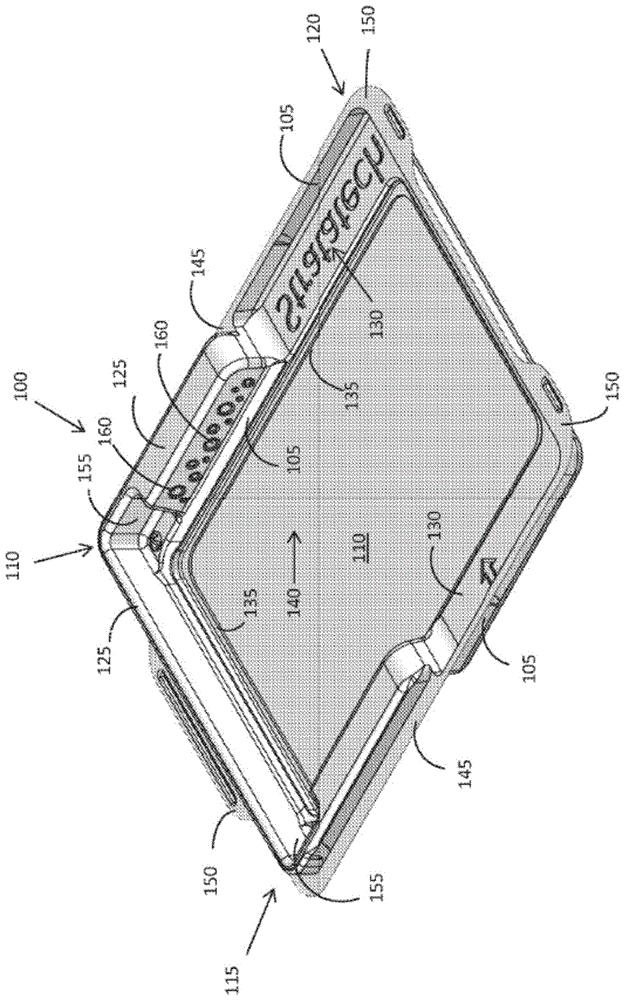
在一些实施方案中,本发明提供了图1所示的组织容器100,所述组织容器100包括限定盘状物的周边壁105和基本上平坦的底表面110。周边壁105具有凸出端115和凹入端120。周边壁105的凸出端115具有由其延伸的脊125,所述脊125具有长度和宽度。周边壁105的凹入端120限定对应于脊125的长度和宽度的空间130,使得当相同的组织容器放置在组织容器100的顶部上时,提供在组织容器的所述凹入端120中的空间130可以可释放地接纳如下文更详细示出的从相同的组织容器的凸出端延伸的脊125。底表面110包括围绕底表面110的周边延伸的周边凸部135。周边凸部135在容器的底部上形成贮存部140,所述贮存部140优选地为约0.50至1.5mm深,并最优选地为约0.75mm深并且可以用液体介质进行填充。周边壁105优选地具有由其延伸的凸缘145。在一些实施方案中,组织容器100还包括(a)凸缘145,所述凸缘145包括使周边壁的凸出端115和凹入端120伸长的一个或多个突片150;(b)脊125,所述脊125在其中具有一个或多个凹口155,所述一个或多个凹口155被配置成接纳托盘上的突片;(c)周边壁105,所述周边壁105包括多个抓握突出部160,其优选地定位在周边壁105的凸出端115上;或(d)其任何组合。本发明还提供了一种组织容器组件,所述组织容器组件包括基本上相同的底部容器和顶部容器,其中底部容器和顶部容器是本段中描述的组织容器。本发明还提供了图4所示的组织容器系统,所述组织容器系统包括本段的组织容器组件和托盘410。托盘的大小被设定成使得所述托盘搁置在如上所述的底部容器的底表面上的周边凸部的顶部上。托盘410包括侧壁415。突片420从侧壁415延伸,使得所述突片接合并插入到底部容器405的凸出端435上的脊430中的凹口425中。托盘具有多孔底表面440,所述多孔底表面440任选地是多孔膜。可以将相同的顶部容器放置在底部容器上并且将其闭合,而不会受到所容纳的托盘的干扰。组织容器系统可以任选地密封,优选地热密封在无菌袋中以提供初级包装。初级包装可以任选地密封在次级袋内部。组织容器系统或含有组织容器系统的包装可以提供为套件,所述套件具有一种或多种吸收性介质和/或一种或多种液体介质,诸如组织相容溶液。
在一些实施方案中,本发明提供了提供供医疗保健提供者使用的组织的方法,所述方法包括:将组织包装在如前述段落中所描述的组织容器系统中;以及将包装的组织提供给对其有需要的医疗保健提供者。在一些实施方案中,本发明提供了提供组织来用于治疗伤口或烧伤的方法,所述方法包括:将组织包装在如前述段落中所描述的组织容器系统中;以及将包装的组织提供给医疗保健提供者以用于治疗伤口或烧伤。在一些实施方案中,本发明提供了一种在施加到受试者之前将冷冻保存的皮肤等同物解冻的方法。所述方法包括:提供在如前述段落中所描述的组织容器系统中的冷冻保存的组织,优选地为器官型培养的皮肤等同物;移除顶部组织容器以暴露冷冻保存的组织;以及在冷冻保存的组织解冻来提供解冻的组织的条件下用液体介质填充底部组织容器中的贮存部,其中组织内所含的冷冻保护剂被稀释到液体介质中,从而留下基本上不含冷冻保护剂的组织。在其他实施方案中,所述方法包括:将含有包含冷冻保存的组织的组织容器系统的初级或次级包装从冷冻箱或装运集装箱移除;将组织容器系统从包装移除;移除顶部组织容器以暴露冷冻保存的组织;以及将具有冷冻保存的皮肤等同物的托盘从第一组织容器转移到第二组织容器中,所述第二组织容器是无菌的并位于无菌区中,并且在容器贮存部中含有液体介质,使得被转移的冷冻保存的组织解冻来提供解冻的组织并且组织内所含的冷冻保护剂被稀释到液体介质中。在以上实施方案的一些中,液体介质是组织相容溶液,优选地为缓冲溶液。在其他实施方案中,将具有冷冻保存的皮肤等同物的托盘从组织容器移除并且放置在吸收性介质上以将解冻的冷冻保护剂溶液从皮肤等同物去除。吸收性介质可以处于任何合适的,优选地无菌的器皿(例如,培养皿或新的组织容器组件)中。本发明不限于特定吸收性介质的使用。吸收性介质优选地包含组织相容溶液。
下文更全面地描述本发明的其他方面和复述。
附图说明
图1是根据一个实施方案的组织容器的透视图。
图2是根据一个实施方案的组织容器组件的分解透视图。
图3是根据一个实施方案的组装好的组织容器组件的透视图。
图4是根据一个实施方案的具有插入托盘的组织容器的透视图。
图5是在再培养1天之后的组织活力的图。数据是每组15个样品的平均值±标准偏差(每批中为5个样品/组织×3个组织/条件)。
图6是在再培养1天期间的解冻后的vegf分泌的图。数据是每批中每种条件下3个组织的平均值±标准偏差。
图7a和图7b是在初始dpm(图7a)和dpm改变(图7b)的情况下再培养1天之后的解冻后的组织屏障功能的图。数据是每组12个读数的平均值±标准偏差(每批中为4个样品/组织×3个组织/条件)。
具体实施方式
本发明总体涉及可用于组织的运输中的组织容器系统,以及其随后供医疗保健提供者的使用,并且特别涉及支持冷冻保存的人皮肤等同物的运输、解冻和使用的系统。
如本文所使用,术语“皮肤等同物”、“人皮肤等同物”、“人皮肤替代物”和“器官型人皮肤等同物”可互换使用来指代体外获得的已分层为鳞状上皮的角质细胞的培养物。通常,皮肤等同物通过器官型培养来产生,并且除了角质细胞层之外还包括真皮层。
如本文所使用,术语“无菌”指代皮肤等同物基本上或完全不含可检测的微生物或真菌污染。
如本文所使用,术语“niks细胞”指代具有作为细胞系atcccrl-12191保藏的细胞的特性的细胞。“niks”代表近二倍体的永生化角质细胞并且是注册商标。
如本文所使用,术语“有活力的”当提及皮肤等同物使用时指代皮肤等同物中的细胞在冷冻保存之后的活力。在优选的实施方案中,“有活力的”皮肤具有如通过mtt测定所测量为对照非冷冻保存组织的至少50%、60%、70%、80%或90%的a550,或类似的活力测定的读出值的至少50%、60%、70%、80%或90%。
如本文所使用,术语“培养皿”指代通常用于培养细胞或组织的类型的任何器皿,并且包括由合适的材料,诸如组织培养塑料、聚苯乙烯、聚合物、塑料、玻璃等形成的圆形、矩形和方形器皿。术语“培养皿”和“生长室”可互换使用。如本文所使用,本公开的组织容器不是培养皿,这至少是因为本公开的组织容器不具有适合于长期培养的尺寸。
本发明的组织容器有效利用冷冻箱和外科手术套房空间,因为所述组织容器比先前利用的容器小约60%。组织容器可与托盘相容,所述托盘包括作为底表面的多孔膜,组织(例如,器官型皮肤替代物)可以支撑在所述多孔膜上。托盘的其他表面优选地是透明或半透明塑料,所述透明或半透明塑料通过塑料片的热成形工艺、注塑模制或本领域已知用于操纵塑料的其他方法来产生。合适的塑料包括医用级塑料,例如乙二醇改性的聚对苯二甲酸乙二酯(petg)、聚苯乙烯等。在一些优选的实施方案中,托盘优选地是如此处第[0030]段所述的托盘。组织容器包括贮存部,所述贮存部可以用介质进行填充以对容器中的组织进行解冻,并且在组织已冷冻时去除冷冻保护剂。这提供了优于先前用于解冻组织的系统的优点,在所述系统中必须在无菌的外科手术区域中从容器移除组织,然后将所述组织放置在
图1示出了组织容器100。在一些实施方案中,组织容器100优选地包括限定盘状物的周边壁105和基本上平坦的底表面110。周边壁105具有凸出端115和凹入端120。周边壁105的凸出端115具有由其延伸的脊125,所述脊125具有长度和宽度。周边壁105的凹入端120限定对应于脊125的长度和宽度的空间130,使得当相同的组织容器放置在组织容器100的顶部上时,提供在组织容器的所述凹入端120中的空间130可以可释放地接纳如下文更详细示出的从相同的组织容器的凸出端延伸的脊125。底表面110包括围绕底表面110的周边延伸的周边凸部135。周边凸部135在容器的底部上形成贮存部140,所述贮存部140优选地为约0.50至1.5mm深,并最优选地为约0.75mm深并且可以用液体介质进行填充。周边壁105优选地具有由其延伸的凸缘145。在一些实施方案中,凸缘145包括一个或多个突片150,所述一个或多个突片150使周边壁的凸出端115和凹入端120伸长。在一些实施方案中,脊125在其中具有一个或多个凹口155,所述一个或多个凹口155被配置成接纳托盘上的突片,这在下文中更详细地示出。在一些另外的实施方案中,周边壁105优选地包括多个抓握突出部160,其优选地定位在周边壁105的凸出端115上。
图2示出了本发明的组织容器组件200的展开图。组织容器组件200优选地包括基本上相同的底部容器205和顶部容器210。底部容器205和顶部容器210中的每一者包括周边壁215和220,并且在底部容器205的情况下具有底表面225,并在顶部容器210的情况下具有顶表面230。底表面225包括围绕底表面225的周边延伸的周边凸部235。周边凸部235在底部容器205的底部上形成贮存部240,所述贮存部240优选地为约0.50至1.5mm深,并最优选地为约0.75mm深并且可以用液体介质进行填充。底部容器205和顶部容器210中的每一者包括凸出端245和凹入端250。凸出端245具有由其延伸的脊255,所述脊255具有长度和宽度。凹入端250限定对应于脊255的长度和宽度的空间260,使得当顶部容器210沿着由虚线265示出的对准放置在底部容器205上时,提供在底部组织容器205和顶部组织容器210的所述凹入端250中的空间260可以可释放地接纳脊255,使得底部容器205和顶部容器210可以可释放地卡合在一起。周边壁215和220优选地具有由其延伸的凸缘270和275。在一些实施方案中,凸缘包括使凸出端245和凹入端250伸长的一个或多个突片280。在一些实施方案中,脊255在其中具有一个或多个凹口285,所述一个或多个凹口285被配置成接纳托盘上的突片,这在下文中更详细地示出。在一些另外的实施方案中,周边壁优选地包括多个抓握突出部290,其优选地定位在凸出端245上。图3示出了本发明的容器组件300,其中底部容器305和顶部容器310完全接合来形成封闭的容器。
本发明进一步提供了一种组织容器系统,所述组织容器系统包括上文描述的底部容器和顶部容器以及托盘。图4示出了本发明的托盘410已插入其中的底部容器。托盘410的大小被设定使得所述托盘搁置在如上所述的底部容器的底表面上的周边凸部的顶部上。托盘410包括侧壁415。突片420从侧壁415延伸,使得所述突片接合并插入到底部容器405的凸出端435上的脊430中的凹口425中。侧壁415和突片420优选地是透明或半透明塑料,所述透明或半透明塑料通过塑料片的热成形工艺、注塑模制或本领域已知用于操纵塑料的其他方法来产生。优选的塑料是医用级可热成形的塑料,包括但不限于乙二醇改性的聚对苯二甲酸乙二酯(petg)和聚苯乙烯。在一些优选的实施方案中,用于侧壁415和突片420的塑料是聚苯乙烯。托盘优选地具有多孔底表面440。在一些优选的实施方案中,多孔底表面是多孔膜,优选地是半渗透的聚合物膜,更优选地是半渗透的径迹蚀刻的聚合物膜。可以对膜进行组织培养处理(例如,等离子体处理)以提高细胞附着。在另外的实施方案中,膜具有至少5微米,在一些实例中为约5微米至约20微米,优选地约10微米至约20微米,更优选地约10微米至约15微米的标称厚度。在其他实例中,膜具有约10微米的标称厚度。合适的膜材料是本领域已知的,并且包括但不限于:聚对苯二甲酸乙二酯、聚酯、聚碳酸酯、或用于可商购获得的经过组织培养处理的插入物(例如,
本发明可以用于冷冻保存、储存和/或运输各种组织。组织优选地支撑在托盘的多孔底表面上,并且用本发明的包括底部容器和顶部容器的容器组件封闭。在一些优选的实施方案中,组织是冷冻保存的。在一些实施方案中,组织是皮肤组织,例如尸体皮肤或器官型皮肤等同物。在一些示例性实施方案中,组织是器官型皮肤等同物或冷冻保存的器官型皮肤等同物。
本发明不限于任何特定的器官型皮肤等同物。实际上,本发明预期使用可以分化为鳞状上皮的包括原代角质细胞和永生化角质细胞两者的各种细胞系和细胞来源。细胞来源包括:从人和尸体供体活检取得的角质细胞和真皮成纤维细胞(auger等人,invitrocell.dev.biol.—animal36:96-103;美国专利号5,968,546和5,693,332,所述专利中的每一者都以引用的方式并入本文);新生儿包皮(asbill等人,pharm.research17(9):1092-97(2000);meana等人,burns24:621-30(1998);美国专利号4,485,096;6,039,760;以及5,536,656,所述专利中的每一者都以引用的方式并入本文);以及永生化角质细胞细胞系,诸如nm1细胞(baden,invitrocell.dev.biol.23(3):205-213(1987))、hacat细胞(boucamp等人,j.cell.boil.106:761-771(1988))和
对亲代bc-1-ep细胞的第3代以及
在培养的细胞中,p53功能的丧失与增强的增殖潜能和增加的永生频率相关联。
无贴壁依赖的生长与体内致瘤性高度关联。为此,研究了
为了确定亲代bc-1-ep角质细胞和永生化
分析了
对于浸没培养中的细胞,监测角质化包膜的形成作为鳞状分化的标志。在培养的人角质细胞中,角质化包膜装配的早期阶段会导致形成由内披蛋白、半胱氨酸蛋白酶抑制剂-a和其他蛋白质组成的未成熟结构,所述未成熟结构代表成熟角质化包膜最内部的三分之一。少于2%的来自粘附性bc-1-ep细胞或
为了证实
为了观察亲代(第5代)和
半桥粒是特化的结构,其增加角质细胞与基板的粘附并且有助于维持组织的完整性和强度。这些结构尤其明显存在于亲代细胞或
在一些实施方案中,支撑在多孔膜上并用容器组件封闭的组织是冷冻保存的。当这个组织是皮肤等同物时,冷冻保存的皮肤等同物优选地可在约-50c、-60c、-70c、-80c或更冷温度下储存一段较长的时间,诸如大于1、2、3、4、5或6个月,长达12或24个月,而不存在实质性的活力损失。
在优选的实施方案中,在产品包装之前的冷冻保存过程的所有步骤在10,000级洁净室中的100级生物安全柜内部无菌地执行。在一些实施方案中,冷冻保存过程包括在冷冻保护剂溶液中处理器官型培养的皮肤等同物。将器官型培养的皮肤等同物支撑在本公开的托盘的多孔膜上,并且将托盘放置在合适的器皿,诸如培养皿或本公开的组织容器组件中。将适量的冷冻保护剂溶液添加到器皿以与多孔膜接触,但是不浸没组织,从而允许冷冻保护剂通过所述多孔膜的底部转移到组织中。本发明的某些实施方案不限于任何特定冷冻保护剂的使用。在一些优选的实施方案中,冷冻保护剂是甘油。冷冻保护剂可以不同浓度提供在冷冻保护剂溶液中。在一些实施方案中,取决于温度,冷冻保护剂提供在按体积计构成约20%或21%至约70%的溶液,且更优选地按体积计构成约20%或21%至约45%的溶液,或按体积计构成37.5%至62.5%的溶液,或最优选地按体积计构成约25%至40%的溶液或按体积计构成42.5%至57.5%的溶液的溶液中。在一些实施方案中,冷冻保护剂溶液优选地包含约32.5%v/v或约50%v/v的冷冻保护剂(例如,甘油)。在一些实施方案中,冷冻保护剂提供在基础培养基溶液中。合适的基础培养基溶液包括但不限于:dmem、ham'sf-10、ham'sf-12、dmem/f-12、培养基199、mem和rpmi。在一些实施方案中,基础培养基构成溶液体积的剩余部分。在一些实施方案中,冷冻保护剂溶液是被缓冲的。合适的缓冲液包括但不限于:hepes、tris、mops和trizma缓冲液。可以提供在ph7.0至7.4的范围内的缓冲系统的量包括缓冲剂。在一些优选的实施方案中,冷冻保护剂溶液用约5mm至15mmhepes,最优选地约10mmhepes缓冲至约7.0至7.4的ph。
在一些特别优选的实施方案中,在单个步骤中进行用冷冻保护剂溶液进行的处理。所谓“单个步骤”意指在如本领域常见的平衡程序期间不会更换冷冻保护剂溶液。例如,使用具有限定浓度的冷冻保护剂的冷冻保护剂溶液来执行处理步骤,这与逐步平衡程序相反,其中若干培养基在每个步骤中随着冷冻保护剂的增加的浓度而变化。在一些实施方案中,处理步骤在降低的温度下进行。在优选的实施方案中,处理步骤是在约2c至8c下进行,而在其他实施方案中,处理步骤是在室温,例如约15c至30c下进行。在一些实施方案中,将皮肤等同物在冷冻保护剂溶液中孵育约10至60分钟,优选地为约20至30分钟。
在一些实施方案中,在用冷冻保护剂溶液处理之后,优选地在例如通过抽吸溶液或将处理过的皮肤等同物移动到新的器皿(例如,无菌培养皿或本公开的无菌组织容器组件)将过量的冷冻保护剂溶液从皮肤等同物去除之后冷冻支撑在托盘的多孔膜上的皮肤等同物。因此,在一些实施方案中,支撑在托盘的多孔膜上的处理过的皮肤等同物通过暴露于范围为约-50c至-100c的温度,且最优选地在约-80c下暴露来冷冻。在一些优选的实施方案中,将具有处理过的皮肤等同物的托盘简单地放入袋子或其他器皿中(例如,无菌培养皿或本公开的无菌组织容器组件)并且放入冷冻装置,诸如低温(例如,-80℃冷冻箱)冷冻装置中。相比之下,在本领域中常见的是,通过控制冷冻装置中的温度或通过将有待冷冻的组织放置在允许控制温度下降率的容器中来控制冷冻速率。
在一些实施方案中,将冷冻保存的皮肤等同物包装用于长期储存。在一些优选的实施方案中,皮肤等同物在其托盘中用如上文详述的底部容器和顶部容器封闭。在一些实施方案中,将含有人皮肤等同物的组件密封,优选地热密封在无菌袋(例如,塑料或聚合物袋)中以提供初级包装。然后将初级包装密封在次级袋,例如次级塑料、箔或mylar袋内部。本发明的冷冻保存的组织可以优选地在约-50c至约-100c或更低,优选地约-80c的低温下储存。皮肤等同物可以优选地储存约1、2、3、4、5或6个月,长达12或24个月,而不存在实质性的活力损失。
在一个优选的实施方案中,用如上所述的冷冻保护剂溶液处理在其托盘中的器官型培养的皮肤等同物,所述托盘被插入到本公开的无菌底部容器中。在冷冻之前通过从底部容器抽吸冷冻保护剂溶液来将过量的冷冻保护剂溶液从皮肤等同物去除。然后用本公开的无菌顶部容器封闭在其托盘中的处理过的皮肤等同物,从而形成组织容器系统。可选地,在冷冻之前通过将具有处理过的皮肤等同物的托盘移动到本公开的第二无菌底部容器来将过量的冷冻保护剂溶液从皮肤等同物去除,然后用本公开的无菌顶部容器封闭托盘,从而形成组织容器系统。然后将含有处理过的人皮肤等同物的组织容器系统密封,优选地热密封在无菌袋(例如,塑料或聚合物袋)中以提供初级包装。可以将初级包装密封在次级袋,例如次级塑料、箔或mylar袋内部。初级或次级袋之后在约-50c至约-100c,优选地约-80c的低温下储存。皮肤等同物可以储存约1、2、3、4、5或6个月,长达12或24个月,而不存在实质性的活力损失。
在另一个优选的实施方案中,用如上所述的冷冻保护剂溶液处理在其托盘中的器官型培养的皮肤等同物,所述托盘被放入培养皿中。在冷冻之前通过将具有处理过的皮肤等同物的托盘移动到本公开的无菌底部容器来将过量的冷冻保护剂溶液从皮肤等同物去除,然后用本公开的无菌顶部容器封闭托盘,从而形成组织容器系统。然后将含有处理过的人皮肤等同物的组织容器系统密封,优选地热密封在无菌袋(例如,塑料或聚合物袋)中以提供初级包装。可以将初级包装密封在次级袋,例如次级塑料、箔或mylar袋内部以产生次级包装。初级或次级包装之后在约-50c至约-100c,优选地约-80c的低温下储存。皮肤等同物可以储存约1、2、3、4、5或6个月,长达12或24个月,而不存在实质性的活力损失。
在一些实施方案中,本发明提供了一种在施加到受试者之前将冷冻保存的皮肤等同物解冻的方法,所述方法包括:提供在如上所述的组织容器系统中的冷冻保存的组织;移除顶部组织容器以暴露冷冻保存的组织;以及在冷冻保存的组织解冻来提供解冻的组织的条件下用液体介质填充底部组织容器中的贮存部,其中组织内所含的冷冻保护剂被稀释到液体介质中,从而留下基本上不含冷冻保护剂的组织。在其他实施方案中,所述方法包括:将含有包含冷冻保存的组织的组织容器系统的初级或次级包装从冷冻箱或装运集装箱移除;将组织容器系统从包装移除;移除顶部组织容器以暴露冷冻保存的组织;以及将具有冷冻保存的皮肤等同物的托盘从第一组织容器转移到第二组织容器中,所述第二组织容器是无菌的并位于无菌区中,并且在容器贮存部中含有液体介质,使得被转移的冷冻保存的组织解冻来提供解冻的组织并且组织内所含的冷冻保护剂被稀释到液体介质中。在以上实施方案的一些中,液体介质是组织相容溶液,优选地为缓冲溶液。合适的组织相容溶液包括但不限于:dmem、ham'sf-10、ham'sf-12、dmem/f-12、培养基199、mem和rpmi。合适的缓冲液包括但不限于:hepes、tris、mops和trizma缓冲液。可以提供在ph7.0至7.4的范围内的缓冲系统的量包括缓冲剂。在其他实施方案中,将具有冷冻保存的皮肤等同物的托盘从组织容器移除并且放置在吸收性介质上以将解冻的冷冻保护剂溶液从皮肤等同物去除。吸收性介质可以处于任何合适的,优选地无菌的器皿(例如,培养皿或新的组织容器组件)中。本发明不限于特定吸收性介质的使用。合适的吸收性介质包括但不限于:
可以预期的是,本发明的冷冻保存的皮肤等同物可以在解冻之后在治疗上使用。在一些实施方案中,冷冻保存的皮肤替代物在解冻之后用于伤口闭合和烧伤治疗应用中。使用自体移植物和同种异体移植物来进行烧伤治疗和伤口闭合被描述于myers等人,a.j.surg.170(1):75-83(1995)和美国专利号5,693,332;5,658,331;以及6,039,760,所述专利中的每一者以引用的方式并入本文。在一些实施方案中,皮肤等同物可以与真皮替代物,诸如dermagraft或integra结合使用。因此,本发明提供了包括溃疡或由烧伤造成的伤口的伤口闭合的方法,所述方法包括:提供在本公开的组织容器系统中的冷冻保存的皮肤等同物;将皮肤等同物解冻;以及在使得伤口得以闭合的条件下用解冻的皮肤等同物治疗具有伤口的患者。
在一些实施方案中,利用皮肤等同物来治疗慢性皮肤伤口。慢性皮肤伤口(例如,静脉性溃疡、糖尿病性溃疡、压力性溃疡)是严重的问题。治愈这种伤口常常要耗费远超过一年的治疗。治疗方案目前包括敷料和清创术(使用化学药品或外科手术清除坏死组织),和/或在感染的情况下为抗生素。这些治疗方案需要长久的时间和高度患者依从性。因此,可以增加执业医师在治愈慢性伤口方面的成功且加快伤口愈合速率的疗法将满足本领域未满足的需求。因此,本发明预期用冷冻保存的皮肤等同物治疗皮肤伤口。在一些实施方案中,将皮肤等同物在解冻之后局部施加到伤口。在其他实施方案中,将冷冻保存的皮肤等同物在解冻之后用于施加到部分皮层受损伤口(partialthicknesswounds)。在其他实施方案中,将冷冻保存的皮肤等同物在解冻之后用于治疗全层皮肤受损伤口(fullthicknesswounds)。在其他实施方案中,将冷冻保存的皮肤等同物在解冻之后用于治疗多种类型的内部伤口,包括但不限于:在胃肠道中形成一层的黏膜的内部伤口、溃疡性结肠炎和可能由癌症治疗引起的黏膜的炎症。在其他实施方案中,将表达宿主防御肽或促血管生成因子的皮肤等同物在解冻之后用作暂时或永久性的伤口敷料。
在另外的实施方案中,将细胞工程化以向受试者提供附加的治疗剂。本发明不限于任何特定治疗剂的递送。实际上,可以预期的是,可以向受试者递送各种治疗剂,包括但不限于:酶、肽、肽类激素、其他蛋白质、核糖体rna、核酶、小干扰rna(sirna)、微小rna(mirna)和反义rna。在优选的实施方案中,所述试剂是宿主防御肽,诸如人β-防御素1、2或3或抗菌肽或其他蛋白质,诸如vegf和hif-1a,参见例如美国专利号7,674,291;7,807,148;7,915,042;7,988,959;以及8,092,531;所述专利中的每一者以引用的方式整体并入本文。可以出于包括但不限于纠正遗传缺陷的目的的各种目的递送这些治疗剂。在一些特别优选的实施方案中,出于对有遗传的先天性代谢缺陷(例如,氨基酸代谢病(aminoacidopathesis))的患者进行解毒的目的而递送治疗剂,其中皮肤等同物充当野生型组织。可以预期的是,治疗剂的递送能纠正所述缺陷。在一些实施方案中,用编码治疗剂(例如,胰岛素、凝血因子ix、红细胞生成素等)的dna构建体转染所述细胞,并且向受试者施用由转染的细胞制备的皮肤等同物。然后将治疗剂从移植物递送到患者的血流或其他组织。在优选的实施方案中,编码治疗剂的核酸可操作地连接到合适的启动子。本发明不限于任何特定启动子的使用。实际上,各种启动子的使用是预期的,包括但不限于:诱导型启动子、组成型启动子、组织特异性启动子和角质细胞特异性启动子。在一些实施方案中,将编码治疗剂的核酸直接引入到角质细胞中(即,通过电穿孔、磷酸钙共沉淀或脂质体转染)。在其他优选的实施方案中,将编码治疗剂的核酸提供为载体,并且通过本领域已知的方法将所述载体引入到角质细胞中。在一些实施方案中,载体是附加型载体,诸如复制型质粒。在其他实施方案中,载体整合到角质细胞的基因组中。整合型载体的实例包括但不限于:反转录病毒载体、腺伴随病毒载体、非复制型质粒载体和转座子载体。
实施例
提供以下实施例是为了证明和进一步说明本发明的某些优选的实施方案和方面,而不应被解释为对其范围进行限制。
在以下实验性公开内容中,适用以下缩写:eq(当量);m(摩尔的);mm(毫摩尔的);μm(微摩尔的);n(正常);mol(摩尔);mmol(毫摩尔);μmol(微摩尔);nmol(纳摩尔);g(克);mg(毫克);lig(微克);ng(纳克);l或l(升);ml或ml(毫升);μl或μl(微升);cm(厘米);mm(毫米);pm(微米);nm(纳米);c(摄氏度);u(单位);mu(毫单位);min.(分钟);sec.(秒);%(百分率);kb(千碱基);bp(碱基对);pcr(聚合酶链反应);bsa(牛血清白蛋白);cfu(菌落形成单位数);kgy(千戈瑞);pvdf(聚偏二氟乙烯);bca(二辛可宁酸);sds-page(十二烷基硫酸钠聚丙烯酰胺凝胶电泳)。
实施例1
实施例2
这个实施例描述了利用预冷冻处理步骤的人皮肤等同物的改进的冷冻保存方法,所述预冷冻处理步骤是在室温下用含有32.5%或50%甘油的冷冻保存溶液进行;并且被描述于共同未决的美国专利公布20140271583,所述专利公布以引用的方式整体并入本文。大体的产生过程与先前描述的当前方法相同。在产生过程结束时,如下处理组织并且将其冷冻保存。
在最终产品包装步骤之前的冷冻保存过程的所有步骤在10,000级洁净室中的100级生物安全柜内部无菌地执行。在本实施例中描述的特定体积和器皿适用于在先前的圆形的44厘米2格式而不是本公开的较大矩形格式中产生的组织。
步骤1-将20ml冷冻保护剂溶液分配到100mm培养皿。
步骤2-将含有
步骤3-将含有处理过的
步骤4-将100mm培养皿热密封在透明的无菌袋中。将初级包装放置到次级mylar袋中并且进行热密封。
步骤5-将包装的
将冷冻保存的组织在室温下解冻10分钟,转移到包含
实施例3
本研究被执行来评估用作冷冻保存的
本实验评估了来自三个批次,并在
使用stratatech的标准过程来产生多批20个矩形的100厘米2
在产生过程结束时,抽吸培养基并且在
然后使用先前确立的利用吸收性介质(例如,
评估组织的外观、屏障功能、活力、组织形态结构和在条件培养基中的vegf分泌。此外,执行全组织mtt染色以评估组织活力的均一性。将在本发明的组织容器中冷冻的组织的结果(第2组和第3组)与对照组的结果进行比较。
本研究的结果表明,使用本发明的组织容器不会影响冷冻保存的
以上说明书中提及的所有公布和专利以引用的方式并入本文。在不脱离本发明的范围和精神的情况下,本发明的所描述的方法和系统的各种修改和变化对于本领域技术人员而言将是显而易见的。虽然已结合特定的优选实施方案描述了本发明,但是应理解,要求保护的本发明不应不适当地受限于所述特定实施方案。事实上,所描述的用于执行本发明的模式的对于组织培养、分子生物学、生物化学或相关领域的技术人员而言明显的各种修改意图处在以下权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!