一种大体积生物样本低温保存的方法与流程
本发明属于生物医学领域,具体涉及一种大体积生物样本低温保存的方法。
背景技术:
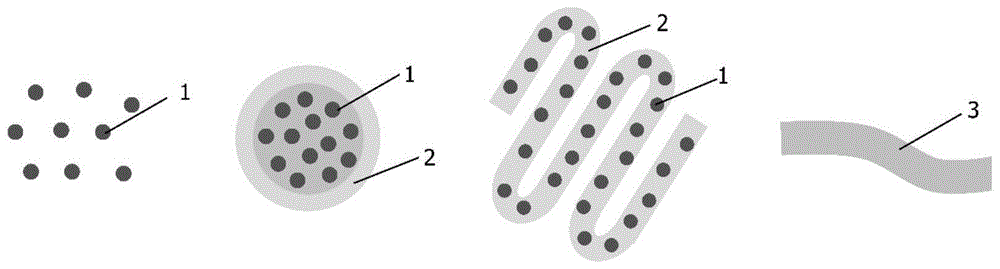
:生物材料的低温保存,是指采用特定的方法将生物材料冷却至低温,并长期保存;待需要时,可将生物材料按特定的方法复温至生理温度,且使其仍然保持足够的活性。随着现代生物医学发展,低温保存的作用日益凸显,尤其是对组织、器官等大体积生物样本的冻存具有重大意义。典型的低温保存主要包括五个步骤:添加保护剂、降温、长期保存、复温、去除保护剂。在低温保存过程中,生物材料不可避免会遭受各种损伤,其主要引发因素包括:渗透压的改变、冰晶的生长、降温和复温过程中样品内部的温度梯度、复温过程的反玻璃化和再结晶等。因此,低渗透性保护剂浓度以及快速、均匀的降复温过程是实现生物样品成功保存的重要条件。现有的低温保存诸如血管这样大尺寸生物样品的方案是将样品经处理后放入低温冻存管中,生物样品在冷冻后会蜷缩弯曲,这将对生物样品的结构、力学和生物学特性造成损伤。且现有的保存技术多采用逐步添加保护剂的方法,使用程序化的降温过程,采用恒温水浴中边摇动边被动复温的方式,历时漫长、操作繁琐,这些都严重影响了大体积生物样本的保存效果。由于低温冻存管的宏观尺寸,以及热量从外向内的传导方式,热量传输的速度有限,生物材料样品内部各个位置在降复温过程中的温度差异较大,样品内外温度梯度较大,这将导致较大的热应力产生,易引发断裂和微裂纹。复温速率不够快,会导致严重的反玻璃化和再结晶,从而严重影响保存的效果和存活率;同时,高浓度的冷冻保护剂可能导致不可控的渗透损伤和生化毒性,这对于生物材料来说是致命的。技术实现要素:有鉴于此,本发明的目的在于针对现有技术中存在的问题,提供一种大体积生物样本低温保存的方法,适合于细胞、细胞水凝胶构建物和微组织等大体积生物样本的长期高效保存。为实现本发明的目的,本发明采用如下技术方案:一种大体积生物样本低温保存的方法,生物样本经预处理后添加保护剂然后注入聚四氟乙烯管中冷冻保存,待需要时水浴复温。作为优选,在注入聚四氟乙烯管前还添加磁性纳米颗粒,且水浴复温时置于电磁线圈内进行电磁复温。作为优选,所述预处理为样本获取、核-壳结构的干细胞水凝胶构建物和干细胞水凝胶纤维的生成。作为优选,所述生物样本为核-壳结构的干细胞水凝胶构建物和干细胞水凝胶纤维时,所述保护剂包括第一保护剂和第二保护剂,第一保护剂为含1mol/l乙二醇和1mol/l1,2-丙二醇的培养基溶液,第二保护剂为含1mol/l~1.5mol/l乙二醇、1.5mol/l1,2-丙二醇、0.002mol/l葡聚糖和0.75mol/l~1mol/l海藻糖的培养基溶液;所述生物样本为脂肪干细胞时,所述保护剂包括第一保护剂、第二保护剂和第三保护剂,第一保护剂为含1mol/l乙二醇和1mol/l1,2-丙二醇的培养基溶液,第二保护剂为含1.5mol/l乙二醇+1.5mol/l1,2-丙二醇的培养基溶液,第三保护剂为含2mol/l乙二醇、2mol/l1,2-丙二醇、0.5mol/l海藻糖的培养基溶液;所述生物样本为血管组织时,所述保护剂为含2.9mol/l二甲亚砜+2.9mol/l甲酰胺+2.7mol/l乙二醇的器官保存液。作为优选,所述聚四氟乙烯管规格为1.2mm内径×1.6mm外径、2mm内径×2.4mm外径或3mm内径×3.4mm外径。作为优选,所述聚四氟乙烯管均匀缠绕在支架上形成一个单元,若干个单元形成一个容器整体。作为优选,所述冷冻为液氮冷冻;所述水浴温度为37℃。作为优选,所述磁性纳米颗粒为fe3o4纳米颗粒。作为优选,按g/ml计,所述磁性纳米颗粒与所述保护剂的质量体积比为(0.05-1):100。作为优选,所述电磁线圈内的电流为15a。由上述技术方案可知,本发明提供了一种大体积生物样本低温保存的方法,所述方法具体为生物样本经预处理后添加保护剂然后注入聚四氟乙烯管中冷冻保存,待需要时水浴复温。本发明所述低温保存的方法成功的实现了低浓度保护剂作用下的大体积生物样本冻存,是一种长期安全、稳定可靠、简单有效的保存生物样本的方法,通过该方法可以获得微结构完整、细胞活力强、生物功能优异的生物样本。与现有低温冻存的方法相比,本发明所述方法至少具有如下优点之一:1.本发明采用聚四氟乙烯管作为生物样本冻存容器,扩大了样品体积却不损害传热,从而实现了大体积生物样本的冻存。2.本发明采用电磁复温,对生物样本具有空间加热效果,再结合恒温水浴,可实现快速均匀复温,从而避免复温过程产生反玻璃化和再结晶,并可有效降低降复温过程引发的热应力等因素造成的机械损伤,提高了生物样本冻存的存活率。3.在上述优点的共同作用下,可以有效的抑制降、复温过程中的反玻璃化和再结晶,从而降低了低温保护剂的使用浓度,避免了渗透损伤和生化毒性,提高了生物样本冻存的存活率。4.不同的聚四氟乙烯管单元内可以注入不同种类和浓度的生物样本,结合不同种类和浓度的磁性纳米颗粒,可以实现在同一电磁场下同时进行不同种类的生物样本的冻存与复温,易于实现自动控制和集成。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。图1:细胞、核-壳结构的干细胞水凝胶构建物、干细胞水凝胶纤维和小型组织;图2:纳米颗粒介导的生物样品电磁加热原理;图3:聚四氟乙烯管与支架单元组成的冷冻容器;图4:冷冻容器整体在电磁线圈中的复温;各图中1为干细胞;2为水凝胶;3为血管组织;4为纳米颗粒;5为磁感线;6为聚四氟乙烯管;7为支架(有机玻璃);8为聚四氟乙烯管与支架构成一个单元;9为冷冻容器整体;10为250ml烧杯;11为电磁加热线圈。具体实施方式本发明公开了一种大体积生物样本冻存及复温的方法。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及产品已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文所述的方法进行改动或适当变更与组合,来实现和应用本发明技术。为实现本发明的目的,本发明采用如下技术方案:一种大体积生物样本低温保存的方法,生物样本经预处理后添加保护剂然后注入聚四氟乙烯管中冷冻保存,待需要时水浴复温。本发明所述低温保存的方法有别于常规的低温冻存管、冻存袋等冷冻容器,选用聚四氟乙烯管作为冻存容器,充分利用其优良的柔韧性、延展性和生物相容性等特性,在不改变生物样本特征尺寸的前提下对其进行了“微元化”,在保证传热效果的同时,扩大了样品的冻存体积,以达到冻存大体积生物样本的目标。根据生物样本的具体种类选择适当尺寸的聚四氟乙烯管对生物样本进行冻存。在一些实施方案中,所述生物样本为脂肪干细胞、核-壳结构的干细胞水凝胶构建物,所述聚四氟乙烯管规格为1.2mm内径×1.6mm外径。在一些实施方案中,所述生物样本为干细胞水凝胶纤维,所述聚四氟乙烯管规格为2mm内径×2.4mm外径。在一些实施方案中,所述生物样本为血管组织,所述聚四氟乙烯管规格为3mm内径×3.4mm外径。本发明所述低温保存的方法中,所述聚四氟乙烯管可以均匀缠绕在支架上形成一个单元,若干个单元可以组装形成一个容器整体,可以保证大体积生物样本的冻存。而且不同单元的聚四氟乙烯管内可以注入不同种类的生物样本,有利于不同种类的生物样本同时冻存与复温,便于集成化。所述缠绕聚四氟乙烯管的支架可以为有机玻璃支架。低温冻存所取的生物样本有时需进行预处理来获得所需的样品,才能进行后续的冻存。不同的生物样品需要经过不同的预处理,如细胞、微组织的获取,核-壳结构的干细胞水凝胶构建物、干细胞水凝胶纤维的生成。本发明所述低温保存的方法中所述的生物样品的预处理为样本获取、核-壳结构的干细胞水凝胶构建物或干细胞水凝胶纤维的生成。其中,所述核-壳结构的干细胞水凝胶构建物制备方法为使用一个三个同心圆构成的管中管装置,最内层通细胞和2%海藻酸钠水凝胶混合物,中间层通水凝胶,最外层通油,分别用注射泵以10μl/min、25μl/min和600μl/min的流速推动,用一根软管将装置头部生成的液滴导入0.12mol/l的氯化钙溶液中形成直径约为500μm的干细胞水凝胶构建物。所述干细胞水凝胶纤维制备方法为使用一个两个同心圆构成的管中管装置,内层通细胞和2%海藻酸钠水凝胶混合物,外层通0.12mol/l的氯化钙溶液,分别用注射泵以35μl/min和400μl/min的流速推动,用一根软管将装置头部生成的纤维导入0.12mol/l的氯化钙溶液中形成直径约为400μm的干细胞水凝胶纤维。本发明所述低温保存的方法中所述的生物样品经预处理后需要将适量保护剂溶液加入到生物样本(悬浮液)中加以平衡。由于聚四氟乙烯管的运用成功的实现在不改变生物样本特征尺寸的前提下对生物样本进行了“微元化”,因此低温保护剂浓度比常规冷冻保存时所需的低温保护剂浓度显著降低,可以有效避免高浓度保护剂对生物样本的毒性损害。所述的保护剂溶液其种类和浓度是根据生物样本的具体种类来确定。在一些实施方案中,所述生物样本为核-壳结构的干细胞水凝胶构建物和干细胞水凝胶纤维,所述保护剂包括第一保护剂和第二保护剂,第一保护剂为含1mol/l乙二醇和1mol/l1,2-丙二醇的培养基溶液,第二保护剂为含1mol/l~1.5mol/l乙二醇、1.5mol/l1,2-丙二醇、0.002mol/l葡聚糖和0.75mol/l~1mol/l海藻糖的培养基溶液。在一些实施方案中,所述生物样本为脂肪干细胞,所述保护剂包括第一保护剂、第二保护剂和第三保护剂,第一保护剂为含1mol/l乙二醇和1mol/l1,2-丙二醇的培养基溶液,第二保护剂为含1.5mol/l乙二醇+1.5mol/l1,2-丙二醇的培养基溶液,第三保护剂为含2mol/l乙二醇、2mol/l1,2-丙二醇、0.5mol/l海藻糖的培养基溶液。其中所述培养基溶液为常用细胞培养基。在一些实施方案中,所述生物样本为血管组织,所述保护剂为含2.9mol/l二甲亚砜+2.9mol/l甲酰胺+2.7mol/l乙二醇的器官保存液。其中所述器官保存液为常用的器官保存液。作为优选,本发明所述低温保存的方法中所述冷冻为液氮冷冻。作为优选,本发明所述低温保存的方法中所述水浴温度为37℃。进一步的,在一些实施方案中,本发明所述低温保存的方法在注入聚四氟乙烯管前还添加磁性纳米颗粒,且水浴复温时置于电磁线圈内进行电磁复温。即所述低温保存的方法依次包括以下步骤:生物样本预处理、保护剂添加、磁性纳米颗粒添加、悬浮液注射至聚四氟乙烯管中、纳米颗粒辅助的磁热效应复温。本发明所述低温保存的方法在冻存时将适量磁性纳米颗粒添加到生物样本(悬浮液)中加以平衡。在需要复温时采用电磁感应技术,对生物样本进行全体积多维加热,再结合恒温水浴,最终实现大体积生物样本的快速均匀复温(图2)。区别于从外到内的热传导,磁性纳米颗粒均匀分布于生物样本内,在电磁场的作用下,可实现对生物样本内外的同步复温,减小生物样本内外温差,避免由热应力等因素造成的机械损伤。同时,提高复温速率,避免反玻璃化和再结晶,降低对低温保护剂的依赖,进而降低低温保护剂的浓度。而且根据不同的生物样本,可以通过改变磁性纳米颗粒的浓度和种类,实现在同一磁场中不同的空间加热模式,有利于不同种类的生物样本同时复温。作为优选,所述磁性纳米颗粒为fe3o4纳米颗粒。fe3o4纳米颗粒具有生物相容性好、磁热效果显著、获得fda认证等优点。fe3o4纳米颗粒的加入可以更好的实现电磁复温。进一步的,作为优选,按g/ml计,所述磁性纳米颗粒与所述保护剂的质量体积比为(0.05-1):100。在一些实施例中,所述生物样品为干细胞,按g/ml计,所述磁性纳米颗粒与保护剂的质量体积比为0.05:100。在一些实施例中,所述生物样品为核-壳结构的干细胞水凝胶构建物或干细胞水凝胶纤维,按g/ml计,所述磁性纳米颗粒与保护剂的质量体积比为0.5:100。在一些实施例中,所述生物样品为血管组织,按g/ml计,所述磁性纳米颗粒与保护剂的质量体积比为1:100。在一些实施方案中,所述电磁复温具体操作为当需要使用生物样本时,将保存容器-聚四氟乙烯管从液氮中取出,放入盛有温水的烧杯中,同时将该烧杯置于电磁线圈内,通入电流,通过恒温水浴结合空间电磁场进行复温,实现快速均匀复温。当要实现不同种类的生物样本同时复温时,结合前文所述的不同种类和浓度的磁性纳米颗粒,可实现在同一电磁场下的不同的空间加热模型,从而实现不同种类的生物样本同时复温。作为优选,本发明所述低温保存的方法中,所述电磁线圈内的电流为15a。由上述技术方案可知,本发明提供了一种大体积生物样本低温保存的方法,所述方法具体为生物样本经预处理后添加保护剂然后注入聚四氟乙烯管中冷冻保存,待需要时水浴复温。本发明所述低温保存的方法成功的实现了低浓度保护剂作用下的大体积生物样本冻存,是一种长期安全、稳定可靠、简单有效的保存生物样本的方法,通过该方法可以获得微结构完整、细胞活力强、生物功能优异的生物样本。与现有低温冻存的方法相比,本发明所述方法至少具有如下优点之一:1.本发明采用聚四氟乙烯管作为生物样本冻存容器,扩大了样品体积却不损害传热,从而实现了大体积生物样本的冻存。聚四氟乙烯材料作为一种生物相容性材料,已广泛应用于人工血管等领域,具有良好的柔韧性和延展性,可与支架材料相结合,实现了在不影响传热的情况下扩大生物样品的体积。同时,这也为探索大体积生物样本的冷冻保存提供了一种新的思路。2.本发明采用电磁复温,对生物样本具有空间加热效果,再结合恒温水浴,可实现快速均匀复温,从而避免复温过程产生反玻璃化和再结晶,并可有效降低降、复温过程引发的热应力等因素造成的机械损伤,提高了生物样本冻存的存活率。3.在上述优点的共同作用下,可以有效的抑制降、复温过程中的反玻璃化和再结晶,从而降低了低温保护剂的使用浓度,避免了渗透损伤和生化毒性,提高了生物样本冻存的存活率。4.不同的聚四氟乙烯管单元内可以注入不同种类和浓度的生物样本,结合不同种类和浓度的磁性纳米颗粒,可以实现在同一电磁场下同时进行不同种类的生物样本的冻存与复温,易于实现自动控制和集成。为了进一步理解本发明,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。如无特殊说明,本发明实施例中所涉及的试剂均为市售产品,均可以通过商业渠道购买获得。实施例1、一种大体积生物样本低温保存的方法将核-壳结构的干细胞水凝胶构建物分两步添加保护剂,第一步添加含1mol/l乙二醇和1mol/l1,2-丙二醇的培养基溶液的保护剂平衡25分钟;第二步添加含1mol/l乙二醇、1.5mol/l1,2-丙二醇、0.002mol/l葡聚糖和1mol/l海藻糖的培养基溶液的保护剂平衡15分钟。然后分成两份分别加入聚四氟乙烯管(内径1.2mm)和麦管(内径1.84mm)中,各自投入液氮冻存24h。冻存后的样品采用37℃水浴复温。用荧光染色分别测试水浴复温后麦管和四氟乙烯管容器保存的干细胞水凝胶构建物的存活率,结果见表1。表1低温保存核-壳结构的干细胞水凝胶构建物复温后的存活率比较组别存活率%聚四氟乙烯管冻存组69%麦管冻存组71%结果显示,聚四氟乙烯管与麦管组的存活率没有明显差异(约为70%)。麦管的降复温速率快,但是保存的样品量很小(约为0.25ml),而聚四氟乙烯管能既有麦管的降复温速率,又可以保存大量体积的样品。实施例2、一种大体积生物样本低温保存的方法具体操作如下:1)将核-壳结构的干细胞水凝胶构建物分两步添加保护剂,第一步添加含1mol/l乙二醇和1mol/l1,2-丙二醇的培养基溶液的保护剂平衡25分钟;第二步添加含1mol/l乙二醇、1.5mol/l1,2-丙二醇、0.002mol/l葡聚糖和1mol/l海藻糖的培养基溶液的保护剂平衡15分钟。2)将干细胞水凝胶构建物分成两份,一份吸入聚四氟乙烯管中,投入液氮中冻存24h,冻存后的样品用水浴复温;另一份加入fe3o4纳米粒子(按g/ml计,所述磁性纳米颗粒与保护剂的质量体积比为0.5:100)后,吸入聚四氟乙烯管(1.2mm内径×1.6mm外径)中,投入液氮中冻存24h,冻存后的聚四氟乙烯管放入盛有37℃水的250ml烧杯中,并将烧杯放入通了15a电流的电磁线圈中进行复温。3)复温期间用光纤测温记录复温速率,结果见表2。表2聚四氟乙烯管电磁与水浴复温速率比较将两组复温速率进行比较结果显示,在复温速率上电磁复温组明显高于水浴复温组。实施例3、一种大体积生物样本低温保存的方法具体操作如下:1)从动物体内获取脂肪干细胞为生物样本;2)分三步添加保护剂,第一步添加1mol/l乙二醇+1mol/l1,2-丙二醇的培养基溶液的保护剂平衡20分钟;第二步添加1.5mol/l乙二醇+1.5mol/l1,2-丙二醇的培养基溶液的保护剂平衡15分钟,第三步添加2mol/l乙二醇+2mol/l1,2-丙二醇+0.5mol/l海藻糖的培养基溶液的保护剂平衡15分钟;3)将0.05%fe3o4纳米粒子加入到平衡后的生物样本悬浮液中;4)选取规格为1.2mm×1.6mm(内径×外径)的聚四氟乙烯管缠绕在支架上形成一个单元,将四个单元组装成一个容器整体。将含有干细胞、保护剂和fe3o4纳米粒子(按g/ml计,所述磁性纳米颗粒与保护剂的质量体积比为0.05:100)的悬浮液吸入聚四氟乙烯管支架容器中,并快速投入液氮中低温保存24h;5)将聚四氟乙烯管支架容器从液氮中取出,放入盛有37℃水的250ml烧杯中,并将烧杯放入通了15a电流的电磁线圈中进行电磁复温;6)将复温后的干细胞用荧光染色法测存活率,结果见表3。表3低温保存脂肪干细胞复温后的存活率比较组别存活率%水浴复温组21%电磁复温组77%将两组存活率进行比较结果显示,在存活率上电磁复温组明显高于水浴复温组。实施例4、一种大体积生物样本低温保存的方法具体操作如下:1)制备平均直径为500μm的具有核-壳结构的干细胞水凝胶构建物为生物样本;2)分两步添加保护剂,第一步添加1mol/l乙二醇+1mol/l1,2-丙二醇的培养基溶液的保护剂平衡25分钟;第二步添加1mol/l乙二醇+1.5mol/l1,2-丙二醇+0.002mol/l葡聚糖+1mol/l海藻糖的培养基溶液的保护剂平衡15分钟;3)将fe3o4纳米粒子(按g/ml计,所述磁性纳米颗粒与保护剂的质量体积比为0.5:100)加入到生物样本悬浮液中;4)选取规格为1.2mm×1.6mm(内径×外径)的聚四氟乙烯管将含有干细胞水凝胶构建物、保护剂和磁性纳米颗粒的悬浮液吸入聚四氟乙烯管中,并快速投入液氮中低温保存24h;5)将聚四氟乙烯管从液氮中取出,放入盛有37℃水的250ml烧杯中,并将烧杯放入通了15a电流的电磁线圈中进行电磁复温;6)将复温后的干细胞用荧光染色法测存活率,结果见表4。表4低温保存核-壳结构的干细胞水凝胶构建物复温后的存活率比较组别存活率%水浴复温组69%电磁复温组85%将两组存活率进行比较结果显示,在存活率上电磁复温组明显高于水浴复温组。实施例5、一种大体积生物样本低温保存的方法具体操作如下:1)制备平均直径为400μm的干细胞水凝胶纤维为生物样本;2)分两步添加保护剂,第一步添加1mol/l乙二醇+1mol/l1,2-丙二醇的培养基溶液的保护剂平衡25分钟;第二步添加1.5mol/l乙二醇+1.5mol/l1,2-丙二醇+0.002mol/l葡聚糖+0.75mol/l海藻糖的培养基溶液的保护剂平衡20分钟;3)将fe3o4纳米粒子(按g/ml计,所述磁性纳米颗粒与保护剂的质量体积比为0.5:100)加入到生物样本悬浮液中;4)选取规格为2mm×2.4mm(内径×外径)的聚四氟乙烯管将含有干细胞水凝胶纤维、保护剂和fe3o4纳米粒子的悬浮液吸入聚四氟乙烯管中,并快速投入液氮中低温保存24h;5)将聚四氟乙烯管从液氮中取出,放入盛有37℃水的250ml烧杯中,并将烧杯放入通了15a电流的电磁线圈中进行电磁复温;6)将复温后的核-壳结构的干细胞水凝胶纤维用荧光染色法测存活率,结果见表5。表5低温保存干细胞水凝胶纤维复温后的存活率比较组别存活率%水浴复温组58%电磁复温组79%结果显示,在存活率上电磁复温组明显高于水浴复温组。实施例6、一种大体积生物样本低温保存的方法具体操作如下:1)从动物体内获取血管组织为生物样本;2)在4℃条件下进行灌注含2.9mol/l二甲亚砜+2.9mol/l甲酰胺+2.7mol/l乙二醇的器官保存液的保护剂溶液。3)将fe3o4纳米粒子(按g/ml计,所述磁性纳米颗粒与保护剂的质量体积比为1:100)加入到生物样本悬浮液中;4)选取规格为3mm×3.4mm(内径×外径)的聚四氟乙烯管将含有血管、保护剂和fe3o4纳米粒子的悬浮液吸入聚四氟乙烯管中,并快速投入液氮中低温保存24h;5)将聚四氟乙烯管从液氮中取出,放入盛有37℃水的250ml烧杯中,并将烧杯放入通了15a电流的电磁线圈中进行电磁复温;6)将复温后的血管样品收集,复温后的血管组织进行形态学、力学性能检测,结果与冻存前的形态学、力学性能相似,可用于后续使用。实施例7、一种大体积生物样本低温保存的方法具体操作如下:1)选取干细胞、核-壳结构的干细胞水凝胶构建物、干细胞水凝胶纤维和血管组织作为生物样本;2)按照实施例3-6针对性分别添加上述各生物材料冻存时的最佳低温保护剂类型和浓度。(细胞、核-壳结构的干细胞水凝胶构建物、干细胞水凝胶纤维和血管组织等生物样本一般选用的保护剂浓度范围为:对应上述样品保护剂浓度分别为4、2.5、3和8.4mol/l);3)按照实施例3-6依据上述各生物样品的最佳复温速率添加对应的产热能力的fe3o4纳米颗粒并配置其合适的浓度(对应上述样品纳米颗粒浓度分别为0.05、0.5、0.5和1%);4)将配置好的各生物样品的悬浮液装载到聚四氟乙烯管(对应上述样品分别为1.2mm内径×1.6mm外径、1.2mm内径×1.6mm外径、2mm内径×2.4mm外径和3mm内径×3.4mm外径)中,并快速投入液氮中低温保存24h;5)将聚四氟乙烯管从液氮中取出,放入盛有37℃水的烧杯中,并将烧杯置于交变磁场中,设置电流为15a,最终利用纳米颗粒磁热效应获得多种空间加热模式,并同时对上述三种类型的生物样本实现高效同步复温。本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1