一种产毒黄曲霉的拮抗菌剂、其制备方法及应用与流程
本发明属于有害微生物拮抗菌剂
技术领域:
,具体涉及一种产毒黄曲霉的拮抗菌剂、其制备方法及应用。
背景技术:
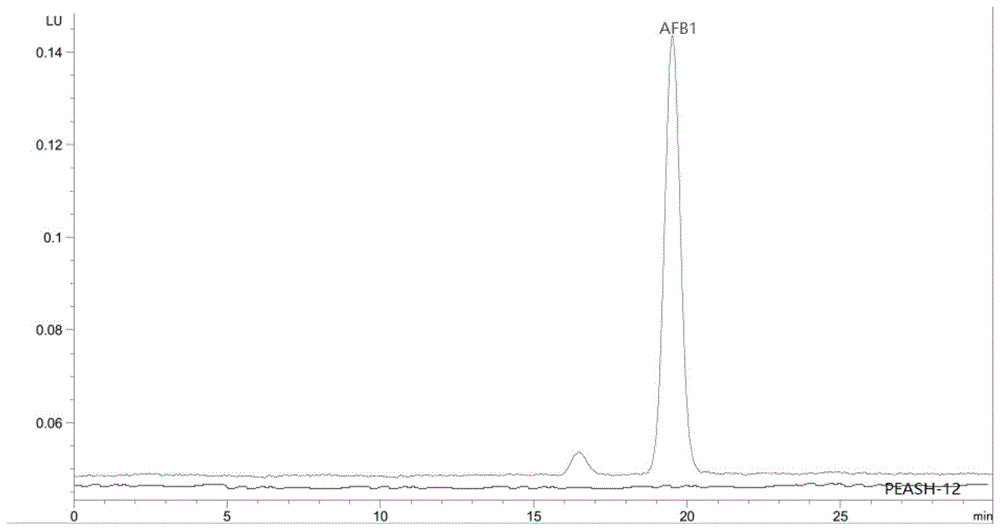
:黄曲霉毒素是黄曲霉和寄生曲霉的代谢产物。大量的实验数据表明,黄曲霉毒素可使人类和多种动物诱发实验性肝癌,是目前已发现的最强的化学致癌物,比二甲基亚硝胺诱发肝癌能力大75倍。黄曲霉毒素还是一种剧毒物,其急性毒性为砒霜的68倍,氰化钾的10倍,可在短期内使肝脏严重受损而造成死亡。花生是最容易感染黄曲霉菌的农作物。花生在生长的全过程中,都有可能感染黄曲霉菌,特别是在生长后期,优于温度、湿度的变化,病虫鼠的危害等使花生的种皮被破坏后都会加剧黄曲霉菌的污染。花生收获后受气温、气湿及储存条件的影响,更容易招致黄曲霉菌感染。黄曲霉菌在繁殖和新陈代谢过程中,就会产生大量的毒素(主要是黄曲菌毒b1),污染花生及其制品。现已查明,在保管不当的花生与花生油、花生饮料、花生酱中,都有可能存在此毒素。由于黄曲霉菌的污染,花生的生长还会受到抑制,造成花生的减产,减产达到10%左右。花生黄曲霉毒素污染主要有花生收获前污染和收获后污染。花生在收获前容易受到黄曲霉的侵染,研究表明土壤是花生黄曲霉菌的主要来源,花生荚果中的黄曲霉与土壤中的黄曲霉有直接的联系,因此为了有效地预防、减少花生黄曲霉毒素的污染,研究花生黄曲霉污染的大田生物防控具有非常重要的意义。生物防控(biocontrol)黄曲霉毒素是指利用有益(或者至少无害)的生物及其代谢产物来改变微生物的布局,抑制产毒菌株的生长或者抑制其毒素的合成,从而达到降低农产品黄曲霉毒素的水平;或者是通过生物粘附、降解等作用,吸附、降解黄曲霉毒素来达到去除黄曲霉毒素的目的。相比其他处理方法,生物防控操作简单、不破坏农产品原有品质,具有安全高效、环境友好等优点,代表了黄曲霉毒素绿色控制的新方向。花生黄曲霉菌污染的大田防治主要在花生生育后期,在花生荚果发育期间保证水分供给,避免收获前干旱造成种皮的破裂使黄曲霉菌的感染机会增多,避免其它病、虫和鼠害的发生,在结荚期和荚果发育期避免耕造成荚果损伤。在收获后及时晒干荚果,使含水量低于5%,筛选有抗性的花生新品种等。但是由于黄曲霉菌的生存力强,产生的孢子可以抵抗多种恶劣自然条件,并不能彻底避免黄曲霉菌的感染。目前从土壤中分离不产毒黄曲霉菌,只进行了实验室内抑制产毒黄曲霉菌生长的研究,也没有开展田间实验研究。目前存在有些拮抗菌不适宜田间生长,在田间没有生长优势,起不到抑制产毒黄曲霉菌的效果。而且,单一菌剂存在适应性差、防治效果差的问题。技术实现要素:针对现有技术中存在的问题,本发明的目的在于提供一种复合拮抗菌剂,该菌剂在田间能够快速生长、繁殖,并且能够高效抑制产毒黄曲霉的生长和繁殖和产毒,相对于单一菌剂处理,效果优异。为了达到上述目的,本发明的技术方案为:一种产毒黄曲霉的拮抗菌剂,其有效成分为不产黄曲霉毒素的黄曲霉菌peas-10和不产黄曲霉毒素的黄曲霉菌peash-12;所述不产毒素的黄曲霉菌peas-10,于2018年08月01日保藏于:中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno:15997,地址为:北京市朝阳区北辰西路1号院3号,请求保藏单位为山东省花生研究所;所述不产毒素的黄曲霉菌peash-12,于2018年08月01日保藏于:中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno:15998,地址为:北京市朝阳区北辰西路1号院3号,请求保藏单位为山东省花生研究所。在上述方案的基础上,所述拮抗菌剂中不产黄曲霉毒素的黄曲霉菌peas-10的孢子数量≥108个/g;不产黄曲霉毒素的黄曲霉菌peash-12的孢子数量≥108个/g。在上述方案的基础上,所述产毒黄曲霉拮抗菌剂的制备方法,步骤为:(1)将菌株分别接种在mea培养基上,30℃培养3-5天,直到产生黄绿色孢子;(2)将活化后的不产毒的黄曲霉菌株分别接种到灭菌后的菌剂培养基上,30℃培养5-8天,每天摇晃一次,使黄曲霉菌在培养基上生长均匀;培养后,黄曲霉菌孢子数量≥108/g培养基;(3)将(2)中培养好的含黄曲霉菌peas-10和黄曲霉菌peash-12的培养基按一定比例混合,最后两个菌株的孢子数比例为peas-10∶peash-12=1∶1-1∶3,即得产毒黄曲霉的拮抗菌剂,常温保藏即可在上述方案的基础上,所述产毒黄曲霉拮抗菌剂中黄曲霉菌peas-10和黄曲霉菌peash-12的孢子的混合比2∶3。在上述方案的基础上,所述菌剂培养基由以下方法制成:将花生壳粉碎至0.5×0.5cm大小,按花生壳和蒸馏水的质量比1∶1-2∶3的比例混合,同时加入质量百分比为1%-1.5%cacl2和0.5%的kcl,121℃灭菌20min。上述方法制备的产毒黄曲霉拮抗菌剂的用途,用于抑制黄曲霉菌生长和产毒、降低农作物病害、提高有机肥的利用率、提高农作物产量、降低收获时农产品中黄曲霉毒素含量、延长农产品贮藏期。在上述方案的基础上,所述的农作物为花生或玉米。一种抑制黄曲霉菌生长和产毒的方法,待作物收获前1个月,将上述方法制备的产毒黄曲霉拮抗菌剂,以30kg/亩撒于作物根际处。一种降低农作物病害、提高有机肥的利用率或提高农作物产量的方法,待作物收获前1个月,将上述方法制备的产毒黄曲霉拮抗菌剂,以30kg/亩撒于作物根际处,适时收获,晾晒后置于干燥阴凉处存放。一种降低收获时农产品中黄曲霉毒素含量或延长农产品贮藏期的方法,待作物收获前1个月,将上述方法制备的产毒黄曲霉拮抗菌剂,以30kg/亩撒于作物根际处,适时收获,晾晒后置于干燥阴凉处存放。本发明技术方案的优点:本发明的复合拮抗菌剂中不产黄曲霉毒素的黄曲霉菌株在田间能够快速生长、繁殖,并且能够高效抑制产毒黄曲霉的生长和繁殖和产毒,田间防控黄曲霉毒素污染效果显著,使用本发明拮抗菌剂处理花生,对花生根腐病、茎腐病具有显著防效;花生产量显著增加;处理后的花生收获后,黄曲霉毒素含量少,能够延长花生贮藏期。相对于单一菌剂处理,效果优异。附图说明图1菌株peash-12发酵液中黄曲霉毒素含量的测定;图2菌株peas-10发酵液中黄曲霉毒素含量的测定。具体实施方式在本发明中所使用的术语,除非有另外说明,一般具有本领域普通技术人员通常理解的含义。下面结合具体实施例,并参照数据进一步详细的描述本发明。以下实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。本发明的不产毒素的黄曲霉菌为黄曲霉菌(aspergillusflavus)peas-10,于2018年08月01日保藏于:中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno:15997,地址为:北京市朝阳区北辰西路1号院3号,请求保藏单位为山东省花生研究所。本发明的不产毒素的黄曲霉菌为黄曲霉菌(aspergillusflavus)peash-12,于2018年08月01日保藏于:中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno:15998,地址为:北京市朝阳区北辰西路1号院3号,请求保藏单位为山东省花生研究所。实施例1菌株peas-10和peash-12的获得一、菌株的分离纯化及鉴定1、样品采集:在花生种植地(2018.05,采样地点分别为四川省南充市嘉陵区土门乡塘村坝村和江西省良种繁殖场红旗分场)采集样品,每个样品(100g)在10×10m的范围内按对角线法取5个子样品(2cm宽,5cm深的土壤),混合作为一个样品。将采集的样品装进塑料袋中,扎些针孔以有利于气体交换,运至实验室,放于4℃保存,用于黄曲霉菌筛选。2、菌株的分离纯化。(1)土壤样品菌悬液的制备取10g土样,加入90ml0.1%蛋白胨无菌水(w/v),在室温震荡30min,制成10-1菌悬液;再取0.5ml10-1菌悬液加4.5ml0.1%蛋白胨无菌水,制备出10-2稀释度的菌悬液;按上述方法制备10-3稀释度的菌悬液。(2)菌株的分离与纯化每个稀释度取0.1ml菌液,涂布在改良的孟加拉红培养基上,30℃黑暗培养5d,每个稀释度重复3次。挑取长有黄绿色孢子的黄曲霉菌在改良的孟加拉红培养基上进行二次划线分离,直至得到单个菌落。挑取单个菌落的黄曲霉菌于mea斜面试管培养基上,于30℃培养3d后保存于4℃中。通过上述方法,本发明从四川省南充市嘉陵区土门乡塘村坝村土壤样品中分离获得菌株peas-10,从江西省良种繁殖场红旗分场土壤样品中分离获得菌株peash-12。(3)鉴定①菌株peas-10的鉴定形态鉴定本发明分离的菌株在改良的孟加拉红培养基上:黄曲霉菌产生白色菌丝和黄绿色孢子;在dg18培养基上产生黄色孢子,在afpa培养基上产生亮橘色的颜色反应;而且该菌株在产毒培养液中培养,不产生黄曲霉毒素。分子鉴定通过its基因序列对菌株peas-10进行分子鉴定。黄曲霉基因组its扩增所用的引物为:its1:5’-tccgtaggtgaacctgcgg-3’(seqidno.1);its4:5’-tcctccgcttattgatatgc-3’(seqidno.2)。pcr扩增条件为:pcr扩增反应程序为:94℃预变性5min,1个循环;94℃变性30s,54℃退火30s,72℃延伸90s,共30个循环;72℃最后延伸7min。扩增后,产物保存于4℃。产物送至上海生工生物工程有限公司测序,测序结果blastresearches上比对(http://www.ncbi.nlm.nih.gov/)。经测序可知,本发明菌株peas-10的its序列如下seqidno.3:acctgcggaaggatcattaccgagtgtagggttcctagcgagcccaacctcccacccgtgtttactgtaccttagttgcttcggcgggcccgccattcatggccgccgggggctctcagccccgggcccgcgcccgccggagacaccacgaactctgtctgatctagtgaagtctgagttgattgtatcgcaatcagttaaaactttcaacaatggatctcttggttccggcatcgatgaagaacgcagcgaaatgcgataactagtgtgaattgcagaattccgtgaatcatcgagtctttgaacgcacattgcgccccctggtattccggggggcatgcctgtccgagcgtcattgctgcccatcaagcacggcttgtgtgttgggtcgtcgtcccctctccgggggggacgggccccaaaggcagcggcggcaccgcgtccgatcctcgagcgtatggggctttgtcacccgctctgtaggcccggccggcgcttgccgaacgcaaatcaatctttttccaggttgacctcggatcaggtagggatacccgctgaacttaagcatatcaat经its序列比对可知,本发明菌株peas-10的its基因序列与黄曲霉菌株lwu-31小亚基核糖体rna基因序列的相似性100%。采用通用引物,检测菌株peas-10产毒基因表达情况,结果发现,该菌株peas-10产毒基因簇上的基因中的nor-1、afir、omta、orda、ver-1、vera、verb七个产毒关键基因没有表达,因此该菌株不产毒。形态学鉴定结合分子生物学鉴定结果可知,菌株peas-10为不产黄曲霉毒素的黄曲霉菌;将其于2018年08月01日保藏于:中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno:15997,地址为:北京市朝阳区北辰西路1号院3号,请求保藏单位为山东省花生研究所。②菌株peash-12的鉴定形态鉴定本发明分离的菌株在改良的孟加拉红培养基上:黄曲霉菌产生白色菌丝和黄绿色孢子;在dg18培养基上产生黄色孢子,在afpa培养基上产生亮橘色的颜色反应;而且该菌株在产毒培养液中培养,不产生黄曲霉毒素。分子鉴定通过its基因序列对菌株peash-12进行分子鉴定。黄曲霉基因组its扩增所用的引物为:its1:5’-tccgtaggtgaacctgcgg-3’(seqidno.1);its4:5’-tcctccgcttattgatatgc-3’(seqidno.2)。pcr扩增条件为:pcr扩增反应程序为:94℃预变性5min,1个循环;94℃变性30s,54℃退火30s,72℃延伸90s,共30个循环;72℃最后延伸7min。扩增后,产物保存于4℃。产物送至上海生工生物工程有限公司测序,测序结果blastresearches上比对(http://www.ncbi.nlm.nih.gov/)。经测序可知,本发明菌株peash-12的its序列如下seqidno.4:gacctgcggaaggatcattaccgagtgtagggttcctagcgagcccaacctcccacccgtgtttactgtaccttagttgcttcggcgggcccgccattcatggccgccgggggctctcagccccgggcccgcgcccgccggagacaccacgaactctgtctgatctagtgaagtctgagttgattgtatcgcaatcagttaaaactttcaacaatggatctcttggttccggcatcgatgaagaacgcagcgaaatgcgataactagtgtgaattgcagaattccgtgaatcatcgagtctttgaacgcacattgcgccccctggtattccggggggcatgcctgtccgagcgtcattgctgcccatcaagcacggcttgtgtgttgggtcgtcgtcccctctccgggggggacgggccccaaaggcagcggcggcaccgcgtccgatcctcgagcgtatggggctttgtcacccgctctgtaggcccggccggcgcttgccgaacgcaaatcaatctttttccaggttgacctcggatcaggtagggatacccgctgaacttaagcatatcat经its序列比对可知,本发明菌株peash-12的its基因序列与黄曲霉菌株s2599小亚基核糖体rna基因序列的覆盖率99%,相似性100%。采用通用引物,检测菌株peash-12产毒基因表达情况,结果发现,该菌株peash-12产毒基因簇上的基因中的afit、nor-1、afir、omta、orda、ver-1、vera、verb八个产毒关键基因没有表达,因此该菌株不产毒。形态学鉴定结合分子生物学鉴定结果可知,菌株peash-12为不产黄曲霉毒素的黄曲霉菌;将其于2018年08月01日保藏于:中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno:15998,地址为:北京市朝阳区北辰西路1号院3号,请求保藏单位为山东省花生研究所。实施例2黄曲霉菌peas-10和peash-12产毒情况分析(1)产毒培养将黄曲霉菌peas-10和peash-12菌株分别接种于mea斜面试管培养基上,28℃培养3d对其进行活化;将4ml无菌水加入斜面试管培养基上,冲洗,分别制得黄曲霉菌peas-10悬液和黄曲霉菌peash-12悬液。在显微镜下用血球计数板记录孢子的数量。加10ml的产毒培养液于50ml离心管中,再加入一定量的黄曲霉菌peas-10或peash-12菌悬液,使孢子终浓度为105/ml,30℃,200rpm,培养7天。(2)产毒培养液中黄曲霉毒素b1的测定采用免疫亲和层析净化、液相色谱分离、荧光检测器检测的方法分别检测上述发酵液中afb1。具体操作为:将2ml发酵液通过免疫亲和层析柱,流速每分钟3ml,用水20ml分2次洗脱,洗脱液弃去,使空气进入柱子,将水挤出柱子,再用1.5ml甲醇分次洗脱,收集洗脱液,浓缩至0.7ml,并用水稀释至1ml,摇匀,上样,高效液相色谱分离,荧光检测器检测。色谱条件:色谱柱为venusilmpc18(5μm,4.6mm×150mm);柱温为40℃;流动相为甲醇:水(v:v=45:55);流速为1.3ml/min;采用柱后光化学衍生法:光化学衍生器254nm;以荧光检测器检测,激发波长360nm,发射波长450nm,进样量20μl。结果见图1。黄曲霉菌株peas-10和黄曲霉菌株peash-12产毒发酵液中均未检出黄曲霉毒素,进一步证实黄曲霉菌株peas-10和黄曲霉菌株peash-12为不产毒菌株。实施例3一种防控黄曲霉毒素污染的拮抗菌剂及其制备方法(1)所用微生物:黄曲霉菌peas-10和黄曲霉菌peash-12(2)菌种活化:将菌株分别接种在mea培养基上,30℃培养3-5天,直到产生黄绿色孢子为宜。(3)菌剂培养基的制备:将花生壳粉碎至0.5×0.5cm左右大小,按花生壳和蒸馏水的质量比1∶1-2∶3的比例混合,同时加入质量百分比为1%-1.5%cacl2和0.5%的kcl,121℃灭菌20min。(3)将活化后的不产毒的黄曲霉菌株分别接种到灭菌后的菌剂培养基上,30℃培养5-8天,每天摇晃一次,使黄曲霉菌在培养基上生长均匀;培养5-8天后,黄曲霉菌孢子数量达到108个/g培养基以上。(4)将上述培养好的含黄曲霉菌peas-10和黄曲霉菌peash-12的培养基按一定比例混合,最后两个菌株的孢子数比例(peas-10∶peash-12)为2∶3,制备得到防控黄曲霉毒素污染的菌剂。常温保藏即可。一、本发明拮抗菌剂抑制黄曲霉菌产毒的效果1、在实验室抑制试验1)试验方法(1)培养基的准备挑选完整的没有破损的玉米和花生颗粒,然后分别称取10g大小均匀的花生和玉米,121℃15分钟灭菌。(2)菌悬液的制备将产毒黄曲霉菌(黄曲霉nrrl3357标准菌株(aspergillusflavusnrrl3357),由中山大学贺竹梅教授友情提供)接种于mea斜面试管培养基上,20℃培养5天,然后用棉签蘸取培养基上的孢子于无菌水中,利用涡旋振荡器震荡均匀,然后用血球计数板将孢子浓度调整到2×104孢子/ml,备用。称取0.1g防控黄曲霉毒素污染的菌剂于无菌水中,利用涡旋振荡器震荡均匀,然后用血球计数板将孢子浓度调整到2×104孢子/ml,备用。(3)抑制效果试验向三角瓶中分别加入上述稀释的1ml拮抗菌剂和产毒黄曲霉菌(104:104)孢子菌悬液作为实验组。然后向三角瓶中加入1ml产毒菌(104)和无菌水等体积混合的孢子菌悬液作为阳性对照组,轻轻摇动瓶子使孢子覆盖到花生和玉米上。每个做三个平行,30℃,黑暗条件下培养14天。(4)黄曲霉毒素含量测定将培养好的玉米和花生样品放入高压灭菌锅里121℃,30min下进行灭菌(使黄曲霉失活);将灭完菌的样品放入高速万能粉碎机中捣碎,然后并向三角瓶中加入50ml80%的甲醇,用振荡器高速震荡30min,然后用灭过菌的滤纸进行过滤提取液用hplc进行测定。2)试验结果表1拮抗菌剂抑制产毒菌的效果从表1可以看出,拮抗菌剂在花生中对产毒菌的抑制产毒率为86.45%,在玉米中的对产毒菌的抑制产毒率为88.21%,该拮抗菌剂能够很好的抑制产毒菌的产毒。而单独的peas-10在花生中抑制产毒率为74.02%,在玉米中抑制产毒率为81.19%;单一的peash-12在花生中抑制产毒率为83.81%,在玉米中的抑制产毒率为80.33%,由此可见,相对于单一菌,本发明的复合拮抗菌剂抑制产毒率显著提高。2、在田间应用1)试验方法待花生收获前1个月,将黄曲霉产毒菌拮抗菌剂(实施例3制备的黄曲霉产毒菌拮抗菌剂)以30kg/亩撒于花生根际处,以不施用拮抗菌剂组为空白对照组,其他日常管理试验组和空白对照组相同。施用拮抗菌剂后10、20天至收获各取一次土壤样品,检测土样中菌体数量并对黄曲霉菌进行分离鉴定,比较施用拮抗菌后土样中的黄曲霉数量及产毒黄曲霉比例变化情况。2)不产毒黄曲霉在土壤中的繁殖能力分析表2施用拮抗菌剂后土壤中黄曲霉数量及比例变化情况从表2可以看出,对照组(未施用拮抗菌剂),土壤中黄曲霉菌落数是213.45cfu/g,产毒黄曲霉菌所占比例为70.23%,而施用拮抗菌剂10天后,土壤中黄曲霉菌的菌落数从迅速增加到6874.10cfu/g土壤,土壤黄曲霉菌迅速增加,同时产毒菌所占比例迅速下降到1.11%;施菌20天,土壤中黄曲霉菌落数达到8857.21cfu/g,产毒黄曲霉菌所占比例降低为0.92%;收获时土壤中黄曲霉菌落数达到9087.45cfu/g,产毒黄曲霉菌所占比例降低为0.78%;从以上结果可以看出,施用拮抗菌剂后不产毒菌在土壤中迅速生长繁殖,施菌20天后土壤中黄曲霉菌落数增长迅速,之后增长趋于缓慢,说明施用不产毒菌应该花生收获前20天施用效果最好;同时施用不产毒菌后,不产毒菌能在花生土壤中迅速生长、繁殖,并能竞争抑制产毒黄曲霉菌的生长繁殖,降低产毒菌的比例,从实验可以看出,施用不产毒菌后,产毒菌所占的比例从对照组的70.23%降低到收获前的0.78%,产毒菌所占的比例迅速降低,从而降低产毒菌侵染花生的比例,降低花生黄曲霉毒素污染风险。3)花生根腐病的防控花生收获时统计对照组和施用拮抗菌剂后花生根腐病的发病情况,以根腐病发病菌株/总花生菌株为根腐病发病率,结果见表3。表3施用拮抗菌剂后花生根腐病发病情况组别根腐病发病率(%)对照组18.21拮抗菌剂组2.03由表3可以看出,施用拮抗菌剂后花生根腐病的发病率由对照组的18.21%降到2.03%,分析原因是拮抗菌剂在抑制产毒黄曲霉菌同时也能抑制花生根腐病菌。4)花生茎腐病的防控花生收获时统计对照组和施用拮抗菌剂后花生茎腐病的发病情况,以茎腐病发病菌株/总花生菌株为茎腐病发病率,结果见表4。表4施用拮抗菌剂后花生根腐病发病情况组别茎腐病发病率(%)对照组9.78拮抗菌剂组1.03由表4可以看出,施用拮抗菌剂后花生根腐病的发病率由对照组的9.78%降到1.03%。5)花生储藏及毒素测定上述花生收获后每个子样单独晾晒并称重,分别装入种子袋内,置于干燥阴凉处存放。测定储存0、1、2、3、4、5、6、7、8个月花生中黄曲霉毒素含量,与对照组相比,计算不产毒黄曲霉抑制花生黄曲霉毒素产生的能力。表5储藏过程中花生中黄曲霉毒素含量的变化从表5可以看出,对照组为未使用本发明拮抗菌剂花生田的花生,在收获时就能检测出黄曲霉毒素,随着储藏时间的延长,在储藏五个月时黄曲霉毒素含量为20.45μg/kg,超过国家限量标准20μg/kg,黄曲霉毒素超标,不能食用。随着储藏期的延长,对照组花生黄曲霉毒素含量增长迅速,到第八个月时已经达到100.45μg/kg。试验组在储藏时间7个月以内都未检测出黄曲霉毒素,说明将拮抗菌剂施于花生种植地,能明显降低花生贮藏过程中感染黄曲霉毒素的风险。单一peas-10菌剂处理或单一peash-12菌剂处理的花生在储藏第6个月就能检测出黄曲霉毒素;这说明本发明复合拮抗菌剂能够有效降低花生中黄曲霉毒素含量,延长花生储藏期。6)花生产量的影响花生收获时统计对照组和施用拮抗菌剂后花生产量情况,结果见表6。表6施用拮抗菌剂后花生产量的影响组别花生产量(kg/666.67m2)对照组259.32拮抗菌剂组324.15由表6可以看出,施用拮抗菌剂后,花生产量由对照的259.32kg/666.67m2升高到324.15kg/666.67m2,产量增加25%,这是由于拮抗菌剂的施用降低了黄曲霉菌的污染,降低了坏果量;此外拮抗菌剂中含有花生壳,花生壳撒入田间可以增加土壤的有机质,提高花生产量。二、培养方法对不产毒黄曲霉菌的影响1、菌剂培养基对不产毒黄曲霉菌的生长繁殖的影响试验组:(1)所用微生物:黄曲霉菌peas-10和黄曲霉菌peash-12(2)菌种活化:将菌株分别接种在mea培养基上,30℃培养3-5天,直到产生黄绿色孢子为宜。(3)菌剂培养基的制备:将花生壳粉碎至0.5×0.5cm左右大小,按花生壳和蒸馏水的质量比2∶3的比例混合,同时加入质量百分比为1%cacl2和0.5%的kcl,121℃灭菌20min。(3)将活化后的不产毒的黄曲霉菌株分别接种到灭菌后的菌剂培养基上,30℃培养,每天摇晃一次,使黄曲霉菌在培养基上生长均匀;培养5天后,经检测黄曲霉菌孢子数量达到≥108个/g培养基。(4)将上述培养好的含黄曲霉菌peas-10和黄曲霉菌peash-12的培养基按一定比例混合,最后两个菌株的孢子数比例(peas-10∶peash-12)为2∶3,制备得到防控黄曲霉毒素污染的菌剂。常温保藏即可。对照组1:所用微生物:黄曲霉菌peas-10和黄曲霉菌peash-12;菌种活化:将菌株分别接种在mea培养基上,30℃培养3-5天,直到产生黄绿色孢子为宜。菌剂培养基的制备:将花生壳粉碎至0.5×0.5cm左右大小,按花生壳和蒸馏水的质量比2∶3的比例混合,121℃灭菌20min。将活化后的不产毒的黄曲霉菌株分别接种到灭菌后的菌剂培养基上,30℃培养,每天摇晃一次,使黄曲霉菌在培养基上生长均匀;培养7天后,经检测黄曲霉菌孢子数量为≥108个/g培养基。将上述培养好的含黄曲霉菌peas-10和黄曲霉菌peash-12的培养基按一定比例混合,最后两个菌株的孢子数比例(peas-10∶peash-12)为2∶3,制备得到防控黄曲霉毒素污染的菌剂。常温保藏即可。对照组2:所用微生物:黄曲霉菌peas-10和黄曲霉菌peash-12;菌种活化:将菌株分别接种在mea培养基上,30℃培养3-5天,直到产生黄绿色孢子为宜。菌剂培养基的制备:按小麦和蒸馏水的质量比2∶3的比例混合,同时加入质量百分比为1%cacl2和0.5%的kcl,121℃灭菌20min。将活化后的不产毒的黄曲霉菌株分别接种到灭菌后的菌剂培养基上,30℃培养,每天摇晃一次,使黄曲霉菌在培养基上生长均匀;培养8天后,经检测黄曲霉菌孢子数量为≥108个/g培养基。将上述培养好的含黄曲霉菌peas-10和黄曲霉菌peash-12的培养基按一定比例混合,最后两个菌株的孢子数比例(peas-10∶peash-12)为2∶3,制备得到防控黄曲霉毒素污染的菌剂。常温保藏即可。以上结果说明本发明所用的菌剂培养基有利于不产毒黄曲霉菌的生长繁殖,到达有效浓度的黄曲霉菌孢子所用的培养时间短。2、菌剂培养基对不产毒黄曲霉菌田间生存能力的影响(1)试验组待花生收获前1个月,将试验组制备的黄曲霉产毒菌拮抗菌剂以30kg/亩撒于花生根际处,以不施用拮抗菌剂组为空白对照组,其他日常管理试验组和空白对照组相同。施用拮抗菌剂后30天取一次土壤样品,检测土样中菌体数量并对黄曲霉菌进行分离鉴定,比较施用拮抗菌后土样中的黄曲霉数量及产毒黄曲霉比例变化情况。(2)对照组1待花生收获前1个月,将对照组1制备的黄曲霉产毒菌拮抗菌剂以30kg/亩撒于花生根际处,其他日常管理上述(1)相同。施用拮抗菌剂后30天取一次土壤样品,检测土样中菌体数量并对黄曲霉菌进行分离鉴定,比较施用拮抗菌后土样中的黄曲霉数量及产毒黄曲霉比例变化情况。(3)对照组2待花生收获前1个月,将对照组2制备的黄曲霉产毒菌拮抗菌剂以30kg/亩撒于花生根际处,其他日常管理上述(1)相同。施用拮抗菌剂30天后取一次土壤样品,检测土样中菌体数量并对黄曲霉菌进行分离鉴定,比较施用拮抗菌后土样中的黄曲霉数量及产毒黄曲霉比例变化情况。结果见表7。表7施用不同培养方法培养的拮抗菌剂后黄曲霉数量及比例变化情况表7结果说明本发明所培养不产毒黄曲霉菌,田间生存能力强,对产毒黄曲霉菌的抑制作用好。三、本发明制备的拮抗菌剂对有机肥的利用率的影响试验组:(1)所用微生物:黄曲霉菌peas-10和黄曲霉菌peash-12(2)菌种活化:将菌株分别接种在mea培养基上,30℃培养3-5天,直到产生黄绿色孢子为宜。(3)菌剂培养基的制备:将花生壳粉碎至0.5×0.5cm左右大小,按花生壳和蒸馏水的质量比2∶3的比例混合,同时加入质量百分比为1%cacl2和0.5%的kcl,121℃灭菌20min。(3)将活化后的不产毒的黄曲霉菌株分别接种到灭菌后的菌剂培养基上,30℃培养,每天摇晃一次,使黄曲霉菌在培养基上生长均匀;培养5天后,经检测黄曲霉菌孢子数量达到≥108个/g培养基。(4)将上述培养好的含黄曲霉菌peas-10和黄曲霉菌peash-12的培养基按一定比例混合,最后两个菌株的孢子数比例(peas-10∶peash-12)为2∶3,制备得到防控黄曲霉毒素污染的菌剂。常温保藏即可。空白对照组:将花生壳粉碎至0.5×0.5cm左右大小,按花生壳和蒸馏水的质量比2∶3的比例混合,同时加入质量百分比为1%cacl2和0.5%的kcl,121℃灭菌20min,30℃培养5天,每天摇晃一次。待花生收获前1个月,将实验组拮抗菌剂以30kg/亩撒于花生根际处,同时将对照组培养基也以30kg/亩撒于花生根际处,作为空白对照组,其他日常管理试验组和对照组相同。施菌剂后立即采集试验组和对照组土壤,测定有机质含量。花生收获时采集试验组和对照组土壤,测定土壤中有机质含量,计算试验组和对照组有机质的利用率(有机质利用率/%=(收获时土壤中的有机质含量/刚施菌时土壤有机质含量)*100),结果见表8。表8施用拮抗菌剂后土壤有机质的利用情况组别有机质利用率(%)对照组58拮抗菌剂组84由表8可以看出,施用拮抗菌后土壤中有机质利用率较对照组显著增加,这说明本发明制备的拮抗菌剂不仅能够减少花生的病害的发生,还能增加土壤有机质的利用率,提高花生产量。以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。序列表<110>山东省花生研究所<120>一种产毒黄曲霉的拮抗菌剂、其制备方法及应用<130>2019<141>2019-05-28<160>4<170>siposequencelisting1.0<210>1<211>19<212>dna<213>人工序列(aspergillusflavus)<400>1tccgtaggtgaacctgcgg19<210>2<211>20<212>dna<213>人工序列(aspergillusflavus)<400>2tcctccgcttattgatatgc20<210>3<211>574<212>dna<213>aspergillusflavuspeas-10<400>3acctgcggaaggatcattaccgagtgtagggttcctagcgagcccaacctcccacccgtg60tttactgtaccttagttgcttcggcgggcccgccattcatggccgccgggggctctcagc120cccgggcccgcgcccgccggagacaccacgaactctgtctgatctagtgaagtctgagtt180gattgtatcgcaatcagttaaaactttcaacaatggatctcttggttccggcatcgatga240agaacgcagcgaaatgcgataactagtgtgaattgcagaattccgtgaatcatcgagtct300ttgaacgcacattgcgccccctggtattccggggggcatgcctgtccgagcgtcattgct360gcccatcaagcacggcttgtgtgttgggtcgtcgtcccctctccgggggggacgggcccc420aaaggcagcggcggcaccgcgtccgatcctcgagcgtatggggctttgtcacccgctctg480taggcccggccggcgcttgccgaacgcaaatcaatctttttccaggttgacctcggatca540ggtagggatacccgctgaacttaagcatatcaat574<210>4<211>574<212>dna<213>aspergillusflavuspeash-12<400>4gacctgcggaaggatcattaccgagtgtagggttcctagcgagcccaacctcccacccgt60gtttactgtaccttagttgcttcggcgggcccgccattcatggccgccgggggctctcag120ccccgggcccgcgcccgccggagacaccacgaactctgtctgatctagtgaagtctgagt180tgattgtatcgcaatcagttaaaactttcaacaatggatctcttggttccggcatcgatg240aagaacgcagcgaaatgcgataactagtgtgaattgcagaattccgtgaatcatcgagtc300tttgaacgcacattgcgccccctggtattccggggggcatgcctgtccgagcgtcattgc360tgcccatcaagcacggcttgtgtgttgggtcgtcgtcccctctccgggggggacgggccc420caaaggcagcggcggcaccgcgtccgatcctcgagcgtatggggctttgtcacccgctct480gtaggcccggccggcgcttgccgaacgcaaatcaatctttttccaggttgacctcggatc540aggtagggatacccgctgaacttaagcatatcat574当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1