一种脂肪组织保护液及其应用的制作方法
本发明涉及一种细胞的分离方法,尤其涉及一种脂肪源干细胞的分离制备方法。
背景技术:
脂肪源干细胞(adiposederivedstemcells,adsc)具有自我更新与多种分化潜能,通过分离培养可以在体外稳定增殖,在特定的诱导条件下,可以被分化诱导为脂肪细胞、成骨细胞、软骨细胞、神经细胞等。新鲜分离的adsc在组织工程、再生医学及修复中有着广泛的应用,如应用于股骨头坏死组织工程技术修复、辅助脂肪移植、面部年轻化、促进毛发生长、皮肤烧伤、糖尿病足、骨缺损修复、神经损伤修复以及炎症性疾病等的治疗。
新鲜分离的adsc是来源于脂肪组织的脂肪血管基质细胞(脂肪血管基质组分,stromalvascularfraction,svf)的主要组成部分之一(adiposetissue-derivedstromalvascularfractioninregenerativemedicine:abriefreviewonbiologyandtranslation.stemcellresther.201715;8(1):145.)。2018年复旦大学汤其群教授将从脂肪组织中分离的svf作为adsc的一种。clinicaltrials.gov网站上登记的众多相关临床研究中,有很多研究者直接使用新鲜分离的adsc进行临床研究。
cd34作为间充质干细胞的主要阴性标记,研究发现在新鲜分离的adsc中可以检测到cd34,而且会随着不断的传代而逐渐消失,adiposetissue-derivedstromalvascularfractioninregenerativemedicine:abriefreviewonbiologyandtranslation.(stemcellresther.201715;8(1):145.)一文cd34可作为新鲜分离的adsc纯度的评价指标之一,且有众多其他研究学者将cd34视为前脂肪细胞和祖细胞的标志物,以cd34的检测结果来判断新鲜分离的adsc纯度。
从脂肪中分离adsc的方法尚未达成共识,而且纯度不高,目前adsc的制备方法主要有两种:一是使用蛋白酶水解消化脂肪组织的酶消化法;二是不使用蛋白水解酶的物理机械法,如常鹏于2014年8月12申请的授权号为cn203999585u的专利“一种富集脂肪源干细胞自动提取装置”公开了一种自动提取装置分离富集脂肪源干细胞的方法,使用物理机械法分离脂肪源干细胞耗时很长,有些方法需要三天左右,同时细胞得率、活性以及纯度较低,很难满足临床需求。。
酶消化法常采用ⅰ型胶原酶或混合胶原酶与脂肪组织按一定比例混合,消化1~3小时,随后离心过滤得到脂肪源干细胞,细胞得率、活性和物理机械法相比虽然有一定程度的提高,但是仍有较大的改进和提升空间。
申请公布号为cn104560868a的发明专利“一种脂肪干细胞的原代分离培养方法”,公开了一种使用ⅰ型胶原酶和胰蛋白酶的混合液体分离脂肪干细胞的方法,每毫升脂肪分离的细胞量为3.79×106,该方法使用了来源于动物的胰蛋白酶,用于临床时增加感染的风险。申请号为cn110241078a的发明专利“一种脂肪干细胞的提取和注射方法”,公布了一种将脂肪组织破碎后使用ⅰ和ⅱ胶原酶混合液消化分离脂肪干细胞的方法,该方法细胞得率低,50ml脂肪分离的细胞总量为2.13~2.21×106,且活率低于80%。申请公布号为cn109652367的发明专利“一种制备临床级脂肪干细胞的方法”,公布了将脂肪组织机械破碎后使用ⅰ型胶原酶、透明质酸酶、脱氧核糖核酸酶ⅰ和胰蛋白酶混合液消化分离脂肪干细胞的方法,该方法分离过程中引入大量外源物质,1ml脂肪分离的细胞量仅有0.6~0.8×106,且活率低于90%。申请公布号为n107475190a的发明专利“一种脂肪svf细胞临床级高效制备和冻存的方法及其用途”,公开了一种脂肪svf细胞临床级高效制备方法,所得细胞中单核细胞含量较低仅有17%~30%,采用cd34进行纯度分析的结果可知纯度达不到60%。申请公布号为cn110129260a的发明专利“一种脂肪组织中的血管基质成分的提取方法及应用”,公开了一种采用0.2%的胶原酶进行低温酶解的方法处理脂肪组织,从而提高细胞的得率,该方法虽然得率高,但消化时间长达3小时,而且cd34+细胞的比例低,仅为32.82%,限制了其在临床上的应用。
综上所述,新鲜分离的adsc应用范围广,且分离方法不完善,主要问题有:(1)安全性未得到保证,使用的消化酶为非临床级或有动物源性物质引入,增加感染风险;(2)adsc得率低;(3)制备的adsc中单核细胞含量少、纯度低。这些问题限制了adsc临床应用,影响临床使用效果。因此需要开发出一种安全的、高效的、可制备高得率、高活率和高纯度adsc的方法。
技术实现要素:
本发明所解决的技术问题是提供一种脂肪组织保护液,用于保存脂肪组织,然后可通过使用该保护液保存脂肪组织,分离获得大量高纯度的优质临床级adsc,提高分离效率和adsc的活率和数量。
本发明提供一种脂肪组织保护液,所述脂肪组织保护液由人血白蛋白注射液、丙酮酸钠、生理盐水、青霉素、链霉素组成。
上述人血白蛋白注射液和生理盐水的体积比为5~10:90~95。
上述丙酮酸钠浓度为1~3mg/ml,青霉素和链霉素的浓度为100units/ml。
上述丙酮酸钠浓度为2mg/ml.
本发明第二方面还提供上述脂肪组织保护液的应用,所述脂肪组织保护液用于保存脂肪组织。
本发明第三方面,还提供上述脂肪组织保护液用于分离制备脂肪源干细胞。
本发明的突出优点:
1.在保护液中加入人血白蛋白为组织代谢提供氮源、维持细胞渗透压;
2.保护液中加入丙酮酸钠,为组织代谢提供碳源、同时具有抗氧化作用,维持细胞活性,减少细胞的凋亡;
3.adsc活性高、数量大,1ml脂肪组织可分离1.27~5.16*106的adsc,是现有方法的20倍左右,adsc活率>90%;
4.本发明提供的保护液大幅度提高了adsc的活率和纯度,分离adsc中单核细胞量为32.8%~65.49%,是现有技术的2倍左右,以检测细胞表面的cd34含量判断adsc的纯度,adsc纯度为51.01%~90.73%,是现有技术的1~3倍。
本发明因分离的svf中大部分为adsc,因此将分离的细胞统称为adsc。
本发明共采集20批数据,在具体实施例中包括以下步骤:
步骤一:对供者身体健康状况进行检查,供者身体状态良好,无遗传病家族病史、无恶性肿瘤、自身免疫性疾病、急慢性传染病、先天性疾病、无血液系统疾病和无其他影响手术抽脂疾病史。人源性特定病毒(hiv、hbv、hcv、htlv、ebv、cmv等)为阴性、梅毒螺旋体阴性,如果供者的相关检查结果为阳性,需在独立的操作空间和空调系统下完成,避免交叉污染的发生;
步骤二:配制脂肪组织保护液,脂肪组织保护液含人血白蛋白注射液、丙酮酸钠(原料药)、生理盐水、青霉素(注射用)、链霉素(注射用),人血白蛋白和生理盐水的比例为5~10:95~90,丙酮酸钠浓度为1~3mg/ml,青霉素和链霉素的浓度为100units/ml;
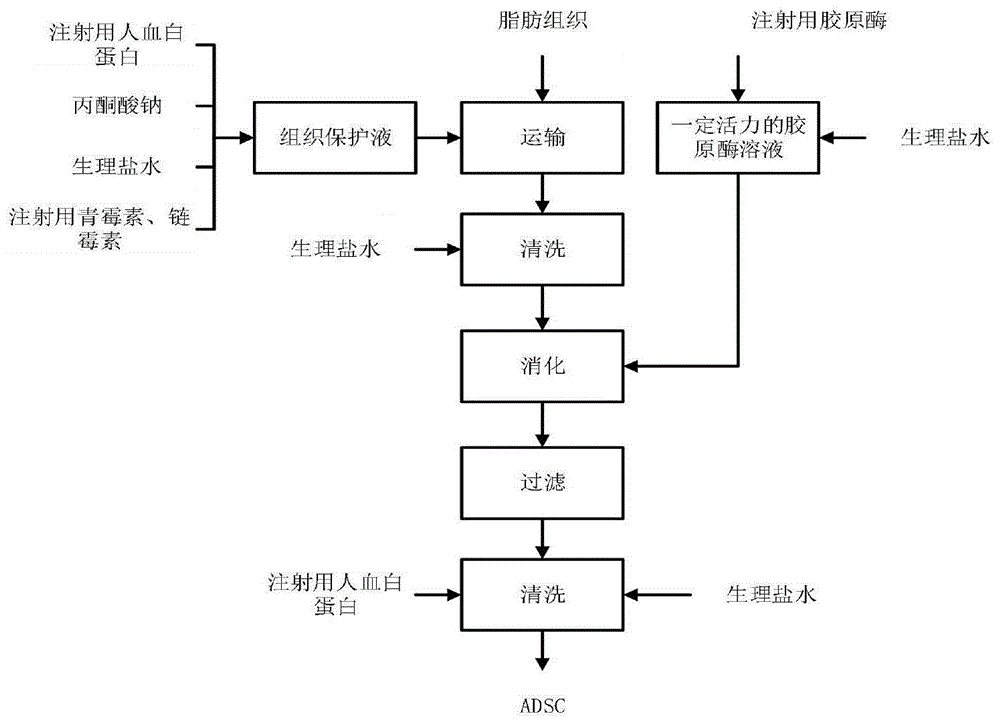
步骤三:通过吸脂术获取的脂肪组织,且脂肪采集在层流手术室进行,将脂肪组织保存在脂肪组织保护液中,运送至gmp车间;
步骤四:用生理盐水配制一定活力的注射用胶原酶溶液,并预热至37℃;
步骤五:将通过吸脂术获得的脂肪组织离心,分为四层,即油脂层、脂肪组织层、液体层和底部沉淀;
步骤六:弃去油脂层、液体层和底部沉淀,保留脂肪组织;
步骤七:加入脂肪组织3~4倍体积的生理盐水,用力震荡混匀后离心,离心后分四层,即少量油脂层、脂肪组织层、液体层和底部沉淀,弃去油脂层、液体层和底部沉淀,保留脂肪组织;
步骤八:重复第七步的操作,用生理盐水清洗脂肪组织2~3次,离心后无油脂层和底部沉淀,即可进行后续操作
步骤九:在清洗后的脂肪组织加入一定体积步骤四配制的注射用胶原酶溶液,在恒温气浴培养振荡器消化一定时间;
步骤十:将第九步消化后的脂肪组织离心,分别收集底部的细胞沉淀和上层脂肪组织;
步骤十一:将细胞沉淀重悬在含人血白蛋白的生理盐水中,备用;
步骤十二:在第十步所得的脂肪组织中继续加入一定体积的注射用胶原酶溶液,在恒温气浴培养振荡器消化一定时间;
步骤十三:将第十二步消化后的脂肪组织离心,弃去上层脂肪组织和中间液体层,收集底部的细胞沉淀;
步骤十四:将细胞沉淀重悬在含一定浓度人血白蛋白的生理盐水中,与第十步所得的细胞悬液混合,用70μm的滤网过滤上述细胞悬液,离心;
步骤十五:弃上清,并用含人血白蛋白的生理盐水重悬细胞,离心,重复操作两次,尽可能的去除红细胞;
步骤十六:用适量含人血白蛋白的生理盐水重悬细胞并取样,台盼蓝法计数并检测细胞活率,利用流式细胞仪检测cd34的含量;
步骤十七:根据临床要求制备相应浓度的adsc制剂直接使用,临床级adsc制剂仅含有adsc、人血白蛋白和生理盐水;或冻存于-196℃备用,冻存液为临床级冻存液和人血白蛋白注射液,体积比为5:95。
附图说明
图1:本发明工艺流程图;
图2:a为对比例1分离的adsc中有核细胞含量检测结果,b为实施例2和实施例4分离的adsc中有核细胞最高含量,c为实施例3、实施例5和实施6分离的adsc中有核细胞最低含量,d实施例3、实施例5和实施6分离的adsc中有核细胞最高含量;
图3:a为对比例1cd34检测结果,b为实施例2cd34检测结果,c为实施例3cd34检测结果,d为实施例4cd34检测结果,e为实施例5cd34检测结果,f为实施例6cd34检测结果。
具体实施方式
以下,参照实施例对本发明进行更详细和具体地描述,但下述实施例并不意在限制本发明。
通过以下实施例进一步说明本发明,而非限制本发明,本发明中百分比浓度为体积百分比浓度,本发明中adsc为新鲜分离制备的adsc。
实施例1对比例临床级adsc细胞的制备
采用目前公开的制备临床级adsc的方法制备adsc,对比例和实施例每毫升脂肪分离细胞量和活率对比见表1
1.对供者身体健康状况进行检查,供者身体状态良好,无遗传病家族病史、无恶性肿瘤、自身免疫性疾病、急慢性传染病、先天性疾病、无血液系统疾病和无其他影响手术抽脂疾病史。人源性特定病毒(hiv、hbv、hcv、htlv、ebv、cmv等)为阴性、梅毒螺旋体阴性;
2.配制常规脂肪组织保护液,0.9%生理盐水+100ug/ml青霉素+100ug/ml链霉素;
3.配制消化液:20%的人血白蛋白25ml、0.9%生理盐水75ml、5mg的混合胶原酶、145μl的200mg/ml的氯化镁溶液;
4.配制洗涤液:5ml20%的人血白蛋白注射用加入500ml生理盐水中;
5.通过吸脂术获取的脂肪组织,且脂肪采集在层流手术室进行,将脂肪组织保存在常规脂肪组织保护液中,运送至gmp车间;
6.脂肪组织清洗后,加入与脂肪组织等体积的消化酶,混匀后置于37℃水浴锅内,每间隔1min摇匀一次,消化20~30min,观察无大块脂肪组织时终止消化;
7.18℃、400g离心7min,弃去上层液体和脂肪组织,保留底部沉淀,用洗涤液重悬后,使用100μm细胞滤网过滤,补加洗涤液后,18℃、400g离心7min,弃上清,保留adsc沉淀;
8.用适量洗涤液重悬细胞,取样计数、检测细胞活率、单核细胞含量以及细胞纯度。
实施例2本发明分离方法制备优质临床级脂肪源干细胞制剂1
采用目前公开的制备临床级adsc的方法制备adsc,其主要步骤具体同实施例1,但是保护液采用本发明保护液,具体配方为,人血白蛋白和生理盐水的体积比为5:95,丙酮酸钠浓度为2mg/ml,青霉素和链霉素的浓度为100units/ml。脂肪组织保护液与脂肪组织比例为1:1。
实施例3本发明分离方法制备优质临床级脂肪源干细胞制剂2
一种从脂肪组织中高效分离制备优质临床级脂肪源干细胞的方法,其主要步骤包括:
1.对供者身体健康状况进行检查,供者身体状态良好,无遗传病家族病史、无恶性肿瘤、自身免疫性疾病、急慢性传染病、先天性疾病、无血液系统疾病和无其他影响手术抽脂疾病史。人源性特定病毒(hiv、hbv、hcv、htlv、ebv、cmv等)为阴性、梅毒螺旋体阴性,如果供者的相关检查结果为阳性,需在独立的操作空间和空调系统下完成,避免交叉污染的发生;
2.配制脂肪组织保护液,含人血白蛋白注射液、丙酮酸钠(原料药)、生理盐水、青霉素(注射用)、链霉素(注射用),具体配方为:人血白蛋白和生理盐水的体积比为10:90,丙酮酸钠浓度为2mg/ml,青霉素和链霉素的浓度为100units/ml;
3.在层流手术室中通过吸脂术采集脂肪组织,并将脂肪组织保存在脂肪组织保护液中,脂肪组织保护液与脂肪组织比例为1:1,运送至gmp车间;
4.用生理盐水配制注射用胶原溶液,酶活力为62.5~250.0u/ml,并预热至37℃;
5.脂肪组织在400g条件下离心10min,分为四层,即油脂层、脂肪组织层、液体层和底部沉淀;
6.弃去油脂层、液体层和底部沉淀,保留脂肪组织,在脂肪组织中,加入脂肪组织3~4倍体积的生理盐水,用力震荡充分摇匀,400g离心10min;
7.重复第6步的操作,用生理盐水清洗脂肪组织2~3次,离心后无油脂层和底部沉淀,即可进行后续操作;
8.在清洗后的脂肪组织中加入酶活力为62.5~250.0u/ml的注射用胶原酶溶液,脂肪组织与胶原酶溶液的体积比为1:0.25~1:1;
9.混匀后,置于恒温气浴培养振荡器中,恒温气浴培养振荡器转速80~100rpm,消化10~30min,观察无大块状脂肪组织,停止消化;
10.400g×10min离心,分别收集底部的细胞沉淀和上层脂肪组织;
11.用含终浓度为2%~4%人血白蛋白的生理盐水(生理盐水和20%人血白蛋白的体积比为9:1~4:1)重悬细胞沉淀,备用;
12.在第10步所得的脂肪组织中继续加入酶活力为62.5~250.0u/ml的胶原酶溶液,脂肪组织与胶原酶溶液的体积比为1:0.25~1:1;
13.混匀后,置于恒温气浴培养振荡器中,恒温气浴培养振荡器转速80~100rpm,消化10~20min,观察脂肪组织为乳状时,停止消化;
14.400g离心10min,弃去上层脂肪组织和中间液体层,收集底部细胞沉淀;
15.用含终浓度2%~4%人血白蛋白的生理盐水(生理盐水和20%人血白蛋白的体积比为9:1~4:1)重悬细胞沉淀,并与第10步所得的细胞悬液混合;
16.用70μm的滤网过滤上述细胞悬液,400g离心10min;
17.弃上清,用含终浓度2%~4%人血白蛋白的生理盐水清洗adsc,重悬细胞沉淀后,400g离心10min;
18.重复第17步的操作,清洗细胞2到3次。
19.弃上清,细胞沉淀用适量含2%~4%人血白蛋白的生理盐水重悬取样,利用台盼蓝法检测细胞数量、活率,用流式细胞仪检测单核细胞含量和cd34含量。
20.根据临床要求制备相应浓度的adsc制剂直接使用,临床级adsc制剂仅含有adsc、人血白蛋白和生理盐水;或冻存于-196℃液氮中备用,冻存液的配方是临床级dmso和人血白蛋白的体积比为5:95,使用程序降温仪进行降温。
21.adsc复苏率和复苏后细胞活率检测:从-196℃液氮中取出冻存的adsc,在37~40℃水浴锅中快速震荡进行复苏,时间少于1min,然后转移至含终浓度2%~4%人血白蛋白的生理盐水中,400g离心10min,弃上清,细胞沉淀用适量含终浓度2%~4%人血白蛋白的生理盐水重悬,取样用台盼蓝法计数并检测复苏后细胞活率,计算复苏率,由检测结果可知,复苏率都高于90%,且细胞活率大于90%,可满足临床应用需求
实施例4本发明分离方法制备优质临床级脂肪源干细胞制剂3
一种从脂肪组织中高效分离制备优质临床级脂肪源干细胞的方法,其主要步骤具体同实施例3,但是保护液采用常规脂肪组织保护液,具体配方为,0.9%生理盐水+100ug/ml青霉素+100ug/ml链霉素。
实施例5本发明分离方法制备优质临床级脂肪源干细胞制剂4
保存时,脂肪组织保护液与脂肪组织比例为1:1,脂肪组织保护液的具体配方为:人血白蛋白和生理盐水的体积比为5:95,丙酮酸钠浓度为3mg/ml,青霉素和链霉素的浓度为100units/ml;其余步骤同实施例3。
实施例6本发明分离方法制备优质临床级脂肪源干细胞制剂5
保存时,脂肪组织保护液与脂肪组织比例为1:1,脂肪组织保护液具体配方为:人血白蛋白和生理盐水的体积比为10:90,丙酮酸钠浓度为3mg/ml,青霉素和链霉素的浓度为100units/ml;其余步骤同实施例3。
各实施例每毫升脂肪分离细胞量和活率数据的实验结果如表1所示。
表1各实施例每毫升脂肪分离细胞量和活率对比
从以上结果可以看出,采用同样的分离方法,不同脂肪组织保护液,本发明脂肪组织保护液的效果均优于普通脂肪组织保护液,且如采用本发明分离方法和本发明脂肪组织保护液,则分离的细胞量和纯度均大大优于普通方法和普通脂肪组织保护液。
此外,应理解,以上实施例仅用以说明本发明的技术方案,而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细地说明,本领域的普通技术人员应当理解,在不脱离本发明的范围和实质的情况下,可以对本发明的技术方案进行各种修改或者等同替换。
- 还没有人留言评论。精彩留言会获得点赞!