一种抗根肿病耐抽薹大白菜的聚合育种方法与流程
本发明属于大白菜育种技术领域,尤其涉及一种抗根肿病耐抽薹大白菜的聚合育种方法。
背景技术:
大白菜(brassicarapasubsp.pekinensis)是十字花科芸薹属中的常见蔬菜,种植和分布面积广,是我国菜篮子中的重要蔬菜。大白菜为两性花,异花授粉作物,杂种优势十分明显。近年来,由于芸薹根肿菌的侵染,大白菜根肿病频发,且在世界范围内的危害面积日益扩大,导致大白菜的品质和产量受到了极大影响,根肿病严重时甚至导致绝收,该病现已成为大白菜育种过程中亟须解决的问题。由于根肿菌在土壤中的存活时间长,携带休眠孢子的土壤很容易导致病害的持续发生,而且利用农业、化学和生物等防治手段不能从根本上解决根肿病的防治问题,所以,培育抗根肿病的大白菜新品种是防治该病的最佳方法。
根肿病生理小种的性质会发生变化情况,这是每个根肿病研究者都不容小觑的一个问题,也是目前根肿病防治中最难克服的问题之一。多年种植单一的抗病品种,最后会使得抗病品种抗性丧失,这主要是由于根肿菌大多混生,繁殖力超强,在繁殖过程会迅速积累一些变异,随着某一抗病品种的长期种植,土壤中优势生理小种种群数量降低,而混生的其他生理小种或变异的生理小种则逐渐成为新的优势种群,由于抗病基因与不同生理小种存在对应关系,从而造成抗病品种抗病性丧失,给抗病育种带来了极大挑战。这也提醒我们需要掌握其变化规律,根据其规律合理的开发和利用抗病品种,减少根肿病的危害。
先期抽薹现象在我国春季大白菜及冷凉地区春夏白菜生产中普遍存在的现象,其后果主要是抑制白菜叶片中营养物质积累,导致产量和品质下降;大白菜抽薹开花是受复杂基因网络调控的数量性状,并且该网络中的很多基因都受表观遗传水平上的调控。
目前尚没有一种快速高效的抗根肿病和耐抽薹大白菜的选育方法。
技术实现要素:
有鉴于此,本发明的目的在于提供一种抗根肿病耐抽薹大白菜的聚合育种方法,所述方法将携带抗根肿病基因的两种亲本y1031-1(crr3)、y903-1(crb)杂交后、自交,将自交后材料与携带crr1a纯合根肿病抗性基因和纯合耐抽薹brflc1gg基因的14cr514-16(crr1a+brflc1gg)材料杂交,获得的纯合材料为抗根肿病耐抽薹大白菜;筛选的过程中利用分子标记技术选育纯合材料,所述方法能够显著提高目标性状选择的准确性和抗病育种工作的效率。
为了实现上述发明目的,本发明提供了以下技术方案:
本发明提供了一种一种抗根肿病耐抽薹大白菜的聚合育种方法,包括以下步骤:
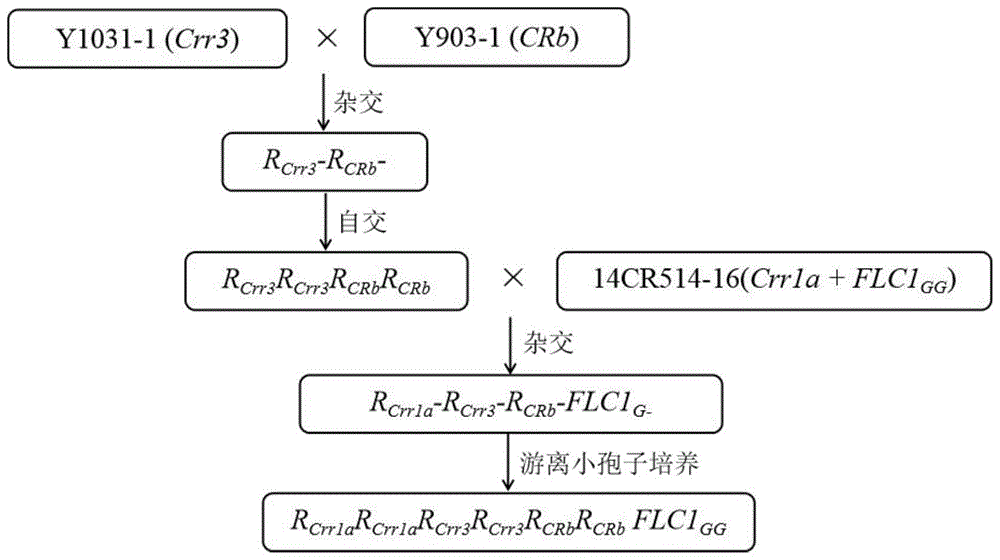
1)以y1031-1(crr3)为母本,以y903-1(crb)为父本进行杂交获得基因型为rcrr3-rcrb-的f1真杂种;将所述基因型为rcrr3-rcrb-的f1真杂种自交,利用分子标记筛选获得基因型为rcrr3rcrr3rcrbrcrb的f2种子;
2)以步骤1)中获得的基因型为rcrr3rcrr3rcrbrcrb的f2种子为母本,以携带纯合抗根肿病基因crr1a和耐抽薹纯合位点brflc1gg的14cr514-16为父本,杂交获得基因型为rcrr1a-rcrr3-rcrb-flc1g-的杂合f1代种子;
3)采用游离小孢子培养方法对所述基因型为rcrr1a-rcrr3-rcrb-flc1g-的杂合f1代种子进行培养,利用分子标记筛选纯合单株获得基因型为rcrr1arcrr1arcrr3rcrr3rcrbrcrbflc1gflc1g的纯合抗根肿病耐抽薹大白菜。
优选的,步骤1)中所述分子筛选标记包括rcrr3基因的分子标记;扩增所述rcrr3基因的分子标记的引物对的核苷酸序列如seqidno.1和seqidno.2所示。
优选的,步骤1)中所述分子筛选标记包括rcrb基因的分子标记;扩增所述rcrb基因的分子标记的引物对的核苷酸序列如seqidno.3和seqidno.4所示。
优选的,步骤2)中所述分子筛选标记包括rcrr1a基因的分子标记;扩增所述rcrrla基因的分子标记的引物对的核苷酸序列如seqidno.5和seqidno.6所示。
优选的,步骤2)中所述分子筛选标记包括brflc1gg基因的snp-kasp检测;进行所述brflc1gg基因的snp-kasp检测的引物包括核苷酸序列如seqidno.7、seqidno.8和seqidno.9所示。
优选的,步骤1)和步骤2)中的杂交为人工授粉杂交。
优选的,步骤4)中所述游离小孢子培养方法包括以下步骤:
s1)将所述基因型为rcrr1arcrr1arcrr3rcrr3rcrbrcrbflc1gflc1g的杂合f1代种子进行低温春化处理后进行播种,培养获得大白菜植株;
s2)从所述大白菜植株的花蕾中分离获得小孢子;
s3)将所述小孢子在32~35℃暗培养2~3d后,25℃继续暗培养8~12d获得胚状体;
s4)将所述胚状体光照培养、分化、生根获得大白菜植株。
优选的,所述低温春化处理为将催芽后的种子置于4~8℃,处理25~30d。
优选的,步骤s4)中所述光照培养的光照强度为8000~12000lx;所述光照培养的光照时间为10~14h/d。
优选的,所述光照培养的时间为2~3d。
本发明的有益效果:本发明提供的抗根肿病耐抽薹大白菜的聚合育种方法,通过将携带不同抗根肿病基因的亲本杂交后、进行自交,将自交后获得的纯合材料将自交后材料与携带crr1a纯合根肿病抗性基因和纯合耐抽薹brflc1gg基因的14cr514-16(crr1a+brflc1gg)材料杂交,获得的纯合材料为抗根肿病耐抽薹大白菜;,筛选的过程中利用分子标记技术选育纯合材料,所述方法能够显著提高目标性状选择的准确性和抗病育种工作的效率。利用本发明所述的方法能够获得聚合四种抗根肿病耐抽薹基因的纯合材料。
附图说明
图1为聚合含有crr3、crb、crr1a和brflc1gg四个基因纯合材料技术路线;
图2为聚合crr1a,crr3和crb三个抗性基因的纯合材料电泳图;
图3为聚合含有耐抽薹位点brflc1纯合材料的kasp-snp位点选择。
具体实施方式
本发明提供了一种抗根肿病耐抽薹大白菜的聚合育种方法,包括以下步骤:
1)以y1031-1(crr3)为母本,以y903-1(crb)为父本进行杂交获得基因型为rcrr3-rcrb-的f1真杂种;将所述基因型为rcrr3-rcrb-的f1真杂种自交,利用分子标记筛选获得基因型为rcrr3rcrr3rcrbrcrb的f2种子;
2)以步骤1)中获得的基因型为rcrr3rcrr3rcrbrcrb的f2种子为母本,以携带纯合抗根肿病基因crr1a和耐抽薹纯合位点brflc1gg的14cr514-16为父本,杂交获得基因型为rcrr1a-rcrr3-rcrb-flc1g-的杂合f1代种子;
3)采用游离小孢子培养方法对所述基因型为rcrr1a-rcrr3-rcrb-flc1g-的杂合f1代种子进行培养,利用分子标记筛选纯合单株获得基因型为rcrr1arcrr1arcrr3rcrr3rcrbrcrbflc1gflc1g的纯合抗根肿病耐抽薹大白菜。
在本发明中,以y1031-1(crr3)为母本,以y903-1(crb)为父本进行杂交获得基因型为rcrr3-rcrb-的f1真杂种。在本发明中,y1031-1(crr3)来自成都良庆园种业公司商品种怀春cr的小孢子培养dh系(双单倍体,doublehaploid),携带crr3纯合抗性基因,综合性状优良。在本发明中,y903-1(crb)来自韩国biotong公司商品种金太子的小孢子培养dh系(doublehaploid),携带crb纯合抗性基因,综合性状优良。在本发明中,所述杂交优选为人工授粉杂交;本发明对所述杂交的具体操作没有特殊限定,采用本领域常规的杂交操作即可。本发明在获得所述基因型为rcrr3-rcrb-的f1真杂种后,将所述基因型为rcrr3-rcrb-的f1真杂种进行自交。本发明对所述自交的具体操作没有特殊限定,采用本领域常规的自交操作即可。在本发明中,在所述自交获得的f2植株中利用分子标记筛选获得基因型为rcrr3rcrr3rcrbrcrb的f2种子。在本发明中,所述分子标记包括rcrr3基因的分子标记和rcrb基因的分子标记;扩增所述rcrr3基因的分子标记的引物对的核苷酸序列如seqidno.1和seqidno.2所示;具体如下:crr3(opc11-2f)-f:gtaacttggtacagaacagcatag(seqidno.1);crr3(opc11-2r)-r:acttgtctaatgaatgatgatgg(seqidno.2)。在本发明中,利用所述引物对扩增所述f2植株的基因组dna,获得扩增产物;当所述扩增产物的大小为1500bp时,所述f2植株为抗性植株,当所述扩增产物的大小为950bp时,所述f2植株为感病植株。在本发明中,扩增所述rcrb基因的分子标记的引物对的核苷酸序列如seqidno.3和seqidno.4所示;具体如下:crb(b0902)-f:agccttgcgtaaaagcaactac(seqidno.3);;crb(b0902)-r:gtttggaatccgacaaatacatccat(seqidno.4)。在本发明中,利用所述引物对扩增所述f2植株的基因组dna,获得扩增产物;当所述扩增产物的大小为170bp时,所述f2植株为抗性植株,当所述扩增产物的大小为240bp时,所述f2植株为感病植株。在本发明中,筛选同时携带rcrr3和rcrb抗性基因的f2植株,收集种子获得基因型为rcrr3rcrr3rcrbrcrb的f2种子。
在本发明中,以基因型为rcrr3rcrr3rcrbrcrb的f2种子为母本,以携带纯合抗根肿病基因crr1a和耐抽薹纯合位点brflc1gg的14cr514-16为父本,进行杂交获得基因型rcrr1a-rcrr3-rcrb-flc1g-的杂合f1代种子。在本发明中,所述杂交优选为人工授粉杂交;本发明对所述杂交的具体操作没有特殊限定,采用本领域常规的杂交操作即可。
在本发明中,扩增所述抗根肿病基因crr1a的分子标记的引物对的核苷酸序列如seqidno.5和seqidno.6所示;具体的如下:crr1a-f:gattaccactatgtactgaact(seqidno.5);crr1a-r:ctttcaaaaacgattgaaatttcat(seqidno.6)。
在本发明中,采用分子标记筛选所述杂交后代中携带brflc1gg基因的杂合f1代,在本发明中,所述brflc1gg基因优选的通过snp-kasp检测;进行所述brflc1gg基因的snp-kasp检测的引物包括核苷酸序列如seqidno.7、seqidno.8和seqidno.9所示;具体如下:正向引物:brflc1-fam:gaaggtgaccaagttcatgctgaaccatgttttggctagccaga(seqidno.7);正向引物:brflc1-hex:gaaggtcggagtcaacggattgaaccatgttttggctagccagg(seqidno.8);反向引物:brflc1-r:aatcggatcgaaacttaaaccgtaac(seqidno.9)。
在本发明中,所述kasp-snp检测的pcr反应总体积优选为10μl,优选的包括以下组分:mix(kaspv4.02xmastermix,lgc公司)5μl,kaspprimermixassay0.14μl正向引物在反应体系的终浓度为12μm,反向引物在反应体系的终浓度为30μm,模板dna5μl。在本发明中,kasp-pcr扩增程序优选的包括以下步骤:第1阶段94℃变性15min;第2阶段94℃变性20s,61℃退火60s,共10个循环(从第2个循环开始,每个循环降低0.6℃);第3个阶段94℃变性20s,55℃退火60s,共26个循环;第4阶段37℃1min。在本发明中,所述pcr扩增产物的片段大小为66bp。在本发明中,所述pcr扩增产物采用罗氏荧光定量pcr仪
在本发明中,采用游离小孢子培养方法对所述基因型为rcrr1a-rcrr3-rcrb-flc1g-的杂合f1代种子进行培养,利用分子标记筛选纯合单株获得基因型为rcrr1arcrr1arcrr3rcrr3rcrbrcrbflc1gflc1g的纯合抗根肿病耐抽薹大白菜。在本发明中,所述游离小孢子培养方法包括以下步骤:s1)将所述基因型为rcrr1a-rcrr3-rcrb-flc1g-的杂合f1代种子进行低温春化处理后进行播种,培养获得大白菜植株;s2)从所述大白菜植株的花蕾中分离获得小孢子;s3)将所述小孢子在32~35℃暗培养2~3d后,25℃继续暗培养8~12d获得胚状体;s4)将所述胚状体光照培养、分化、生根获得大白菜植株。
在本发明中,将所述基因型为rcrr1a-rcrr3-rcrb-flc1g-的杂合f1代种子进行低温春化处理后进行播种,培养获得大白菜植株。在本发明中,所述低温春化处理优选为将催芽后的种子置于4~8℃,处理25~30d。本发明对所述催芽的方法没有特殊限定,采用本领域常规的催芽方法即可,具体参见实施例记载。在本发明中,所述低温春化处理能够加快育种进程。在本发明中,所述培养优选在日光温室中进行,白天温度优选为25℃,时间优选为16h,夜晚温度优选为18℃,时间优选为8h,所述培养的光照强度优选为8000~12000lx,
在本发明中,从所述大白菜植株的花蕾中分离获得小孢子。在本发明中,所述花蕾优选为主苔及一级侧枝上健康、正常饱满花蕾;本发明对所述花蕾进行消毒后,收集所述花蕾中的小孢子,在本发明中,优选的将小孢子游离于洗涤培养基中进行洗涤后离心,调整小孢子的浓度为1~2×105个/ml置于培养基中进行培养。
在本发明中,将所述小孢子在32~35℃暗培养2~3d后,25℃继续暗培养8~12d获得胚状体;然后将所述胚状体光照培养、分化、生根获得大白菜植株。在本发明中,所述光照培养的光照强度优选为8000~12000lx;所述光照培养的光照时间优选为10~14h/d,更优选为12h/d。在本发明中,所述光照培养的时间优选为2~3d。在本发明中,所述分化的培养培养基优选为ms+3%蔗糖+8g/l的琼脂糖,所述分化的培养基的ph值优选为5.8。在本发明中,所述生根的培养基优选为ms+0.2mg/l的naa+3%蔗糖+8g/l的琼脂糖;所述生根的培养基的ph值优选为6.0。
在本发明中,所述分子标记筛选优选的筛选携带包括rcrr1a、rcrr3、rcrb和flc1g-四个基因的纯合材料,具体的筛选方法参见上述记载,在此不再赘述。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
确定抗根肿病耐抽薹大白菜聚合亲本
y1031-1(crr3):来自成都良庆园种业公司商品种怀春cr的小孢子培养dh系(双单倍体,doublehaploid),携带crr3纯合抗性基因,综合性状优良。
y903-1(crb):来自韩国biotong公司商品种金太子的小孢子培养dh系(doublehaploid),携带crb纯合抗性基因,综合性状优良。
14cr514-16(crr1a+brflc1gg):来自韩国太和种业公司的高冷地品种的小孢子培养dh系(doublehaploid),携带crr1a纯合根肿病抗性基因和纯合耐抽薹brflc1gg基因位点,综合性状优良。
杂交育种流程:
杂交获得f1代:以y1031-1(crr3)亲本为母本,y903-1(crb)为父本配置杂交组合,通过人工授粉获得f1杂交种子,获得f1真杂种(基因型rcrr3-rcrb-)。
自交获得f2种子:将f1种子(基因型rcrr3-rcrb-)种植,自交获得f2种子,利用分子标记结合根肿病抗性鉴定来检测抗性位点纯合单株,基因型为rcrr3rcrr3rcrbrcrb。
第2次杂交:以聚合2个根肿病抗性基因纯合系(基因型为rcrr3rcrr3rcrbrcrb)为母本,含有纯合抗根肿病基因crr1a和耐抽薹纯合位点brflc1gg的14cr514-16为父本,杂交获得杂合f1代,基因型为rcrr1a-rcrr3-rcrb-flc1g-。
上述杂交育种流程种利用pcr进行根肿病抗性位点检测的具体方法
根据已发表的与大白菜根肿病抗性基因紧密连锁的分子标记合成引物crr1(suwabek.,tsukazakih.,iketanih.,etal.(2006)simplesequencerepeat-basedcomparativegenomicsbetweenbrassicarapaandarabidopsisthaliana:thegeneticoriginofclubrootresistance.genetics,173:309-319)、crr3(saitom.,kubon.,matsumotos.,etal.(2006)finemappingoftheclubrootresistancegene,crr3,inbrassicarapa.theor.appl.genet.,114:81-91)、crb(hatakeyamak.,niwat.,katot.,etal.(2017)thetandemrepeatedorganizationofnb-lrrgenesintheclubroot-resistantcrblocusinbrassicarapal.moleculargeneticsandgenomics,mgg292,397-405)、crc(sakamotok.,saitoa.,hayashidan.,etal.(2008)mappingofisolate-specificqtlsforclubrootresistanceinchinesecabbage(brassicarapal.ssp.pekinensis).theor.appl.genet.,117:759-767)。
pcr反应总体积为20μl,含有12.6μlddh2o,2μl的10×pcrbuffer(mgcl2),1.6μldntps(10mm),上下游引物各0.8μl(10μm),0.2μlacetaq酶(5.0u/μl),2μldna模板(40ng/μl),试剂购自南京诺唯赞生物科技有限公司公司。
crr1a抗性位点检测
检测引物:crr1a-f:gattaccactatgtactgaact;crr1a-r:ctttcaaaaacgattgaaatttcat
pcr扩增程序:94℃变性5min;35个循环,每循环94℃变性1min,55℃退火2min,72℃延伸4min;72℃延伸5min;4℃保存。利用1.2%琼脂糖凝胶电泳分离pcr扩增产物。
片段大小:抗性位点pcr片段大小为950bp,感病位点pcr片段大小为580bp。
crr3抗性位点检测
检测引物:crr3(opc11-2f)-f:gtaacttggtacagaacagcatag;crr3(opc11-2r)-r:acttgtctaatgaatgatgatgg
pcr扩增程序:94℃变性5min;35个循环,每循环94℃变性1min,55℃退火2min,72℃延伸3min;72℃延伸5min;4℃保存。利用1.2%琼脂糖凝胶电泳分离pcr扩增产物。
片段大小:抗性位点pcr片段大小为1500bp,感病位点pcr片段大小为950bp。
crb抗性位点检测
检测引物:crb(b0902)-f:agccttgcgtaaaagcaactac;crb(b0902)-r:gtttggaatccgacaaatacatccat
pcr扩增程序:94℃变性2min;35个循环,每循环94℃变性30sec,55℃退火30sec,68℃延伸30sec;68℃延伸5min;4℃保存。利用3.0%琼脂糖凝胶电泳分离pcr扩增产物。
片段大小:抗性位点pcr片段大小为170bp,感病位点pcr片段大小为240bp。
brflc1耐抽薹位点snp-kasp检测
kasp-snppcr反应总体积为10μl,5μlmix(kaspv4.02xmastermix,lgc公司),0.14μlkaspprimermixassay(正向引物终浓度为12μm,反向引物终浓度为30μm),5μl模板dna。
kasp-snp检测引物:正向引物:brflc1-fam:gaaggtgaccaagttcatgctgaaccatgttttggctagccaga;正向引物:brflc1-hex:gaaggtcggagtcaacggattgaaccatgttttggctagccagg;
反向引物:brflc1-r:aatcggatcgaaacttaaaccgtaac
kasp-pcr扩增程序为:第1阶段94℃变性15min;第2阶段94℃变性20s,61℃退火60s,共10个循环(从第2个循环开始,每个循环降低0.6℃);第3个阶段94℃变性20s,55℃退火60s,共26个循环;第4阶段37℃1min。
kasp-pcr片段大小66bp。
kasp-pcr扩增产物用罗氏荧光定量pcr仪
获得基因型为rcrr1a-rcrr3-rcrb-flc1g-的杂合f1代种子后,按照游离小孢子培养程序进行培养,获得dh系单株,进行分子标记结合根肿病抗性鉴定来检测抗性位点纯合单株,选定目的株系。
为加快回交育种进程,利用种子春化对目的株系材料进行低温处理,具体如下:催芽阶段的处理:选用纯、净度好的种子,用45℃水浸种2h,倒水时搅动4~5min,把种子捞出摊在纸巾晾一晾,把多余的水沥出去,湿度达到90%以上为宜;然后放到发芽的器皿中,下面垫上湿润的滤纸,放到25℃恒温的条件下催芽。这样经20~40h,种子全部萌动,用肉眼看到有60%~70%的种子长出胚根,催芽即可结束。低温阶段的处理:将催完芽的种子装入底部铺上滤纸的培养皿上,然后放到预先调好,温度稳定在4~8℃冰箱内,把种子摊平。处理时间25~30d。在这个时期三天检查一次种子湿度,补充水分,处理25~30d后通过春化阶段即可播种,日光温室(温度白天25℃,16h),夜晚18℃,8h),光照强度8000~12000lx中种植,当白菜现蕾开花时,进行每年两代人工授粉回交。
小孢子培养
取材与挑蕾:取大白菜主苔及一级侧枝上健康、正常饱满花蕾(时间一般为早上8:00-9:00),其长为2~3mm。
消毒:先用洗涤灵(立白集团,广州)将花蕾冲洗干净,然后将洗净的花蕾置于消过毒的样品夹中,再用75%的酒精进行表面消毒30s,接着倒出酒精,用10%次氯酸钠(上海沪试试剂,上海)消毒15min,最后用灭菌水冲洗3次,每次3min,备用。
把消毒的花蕾置于无菌的研钵中,加入适量b5培养基(phytotechnologylaboratories,美国),用研钵棒轻捣花蕾挤出孢子将小孢子游离于洗涤培养基中,用400目孔径的钢丝网过滤到10ml离心管中,待离心。
将收集好的滤液3500rpm离心,每次3min,共离心3次,弃上清,加入nln-13培养基(phytotechnologylaboratories,美国);
用血球计数板检测小孢子密度,将浓度调至每ml1×105~2×105个游离小孢子,分装于已灭菌的培养皿中,每皿2ml,用parafilm封口膜(bemiscompany,美国)封口;同时,每皿加入2~3滴活性炭(1%)(用于吸附有毒物质);减少褐变,防止玻璃化;创造黑暗环境,增加培养基的通透性,利于根的生长;活性炭购自智科生物科技有限公司,济南。
将分装好的小孢子放入32~35℃的恒温培养箱中,暗培养2~3天,然后转入25℃条件下继续暗培养;
10天后,将有胚状体产生的培养皿移至组培室光照培养,光照时间12h/d,光照强度8000~10000lx;2-3d后,胚状体变绿,接种至ms分化培养基上(ms+3%蔗糖+8g/l琼脂糖,ph值5.8)。
将正常生长的小孢子植株接种至继代培养基上(ms+0.2mg/l的naa+3%蔗糖+8g/l的琼脂糖,ph值6.0)进行培养。
待根生长至2~3cm即可移栽。
实施例2
筛选获得的目的株系的抗性鉴定
供试菌源
大白菜根肿菌取自河南新野(4号生理小种),洗净于-20℃冰箱保存备用。
接种液的制备
将预存于-20℃冰箱内的大白菜根肿块搅碎,四层纱布过滤,收集滤液,常温下,离心5000rpm离心10min,弃上清,用蒸馏水悬浮沉淀,共重复3次,最后弃上清,取一滴休眠孢子提取液于血球计数板(上海精密仪器仪表有限公司,上海)上,盖上盖玻片,于600倍显微镜下镜检。用蒸馏水将悬浮液孢子浓度分别调至2×108个/ml。4℃保存备用。
接种
以蛭石和草炭1:1配制的营养土,用ph值为6.0的酸性水浇透。将目的株系的种子栽于营养土中。接种后,前两周要在苗盘下放酸性水浸泡,靠土壤吸水力保持水分供应,2周后,撤掉底盘,喷淋浇水。定苗后4周鉴定。
试验材料的抗病性鉴定采用田间人工接种鉴定,利用灌根接种法对实验材料进行抗性鉴定,接菌处理30天后,开始对每株材料根部发病程度进行分级调查,并认真记载发病情况。大白菜根肿病的发病级别主要是将发病植株的发病部位和肿根的大小结合一起来进行确定的。
表1大白菜根肿病发病级别鉴定标准
病株率和病情指数的计算公式如下:
植株的抗病性差异主要依据病情指数来进行划分,主要分类标准:高抗≤30.0;30.0<抗病≤40.0;40.0<低抗/低感≤50.0;50.0<感病≤80.0;高感>80.0。
经鉴定本发明筛选的目的株系的病情指数为0,抗病性为高抗。
耐抽薹性能测定结果:
大白菜耐抽薹性在河南新野基地(东经112.35,北纬32.52)根肿病鉴定病原圃进行,在2019年立春(2月4日),在塑料大棚内进行穴盘基质育苗,苗龄30-35天,定植时,覆盖白色塑料地膜,60-65天后采收,结合目的性状分子标记进行耐抽薹性等综合性状评估。对照品种为本发明的两个亲本材料怀春cr、金太子及当地春白菜主栽品种菊锦。
分别培养本发明中耐抽薹的亲本、本发明筛选获得耐抽薹株系和常规的不耐抽薹株系,测定心柱长、心柱宽和心柱形状,结果如表2所示。
表2耐抽薹性能测定结果
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>河南省农业科学院园艺研究所
<120>一种抗根肿病耐抽薹大白菜的聚合育种方法
<160>9
<170>siposequencelisting1.0
<210>1
<211>24
<212>dna
<213>artificialsequence
<400>1
gtaacttggtacagaacagcatag24
<210>2
<211>23
<212>dna
<213>artificialsequence
<400>2
acttgtctaatgaatgatgatgg23
<210>3
<211>22
<212>dna
<213>artificialsequence
<400>3
agccttgcgtaaaagcaactac22
<210>4
<211>26
<212>dna
<213>artificialsequence
<400>4
gtttggaatccgacaaatacatccat26
<210>5
<211>22
<212>dna
<213>artificialsequence
<400>5
gattaccactatgtactgaact22
<210>6
<211>25
<212>dna
<213>artificialsequence
<400>6
ctttcaaaaacgattgaaatttcat25
<210>7
<211>44
<212>dna
<213>artificialsequence
<400>7
gaaggtgaccaagttcatgctgaaccatgttttggctagccaga44
<210>8
<211>44
<212>dna
<213>artificialsequence
<400>8
gaaggtcggagtcaacggattgaaccatgttttggctagccagg44
<210>9
<211>26
<212>dna
<213>artificialsequence
<400>9
aatcggatcgaaacttaaaccgtaac26
- 还没有人留言评论。精彩留言会获得点赞!