一种厚朴胚性愈伤组织玻璃化超低温保存方法与流程
本发明属于厚朴种质保存
技术领域:
,具体涉及一种厚朴胚性愈伤组织玻璃化超低温保存方法。
背景技术:
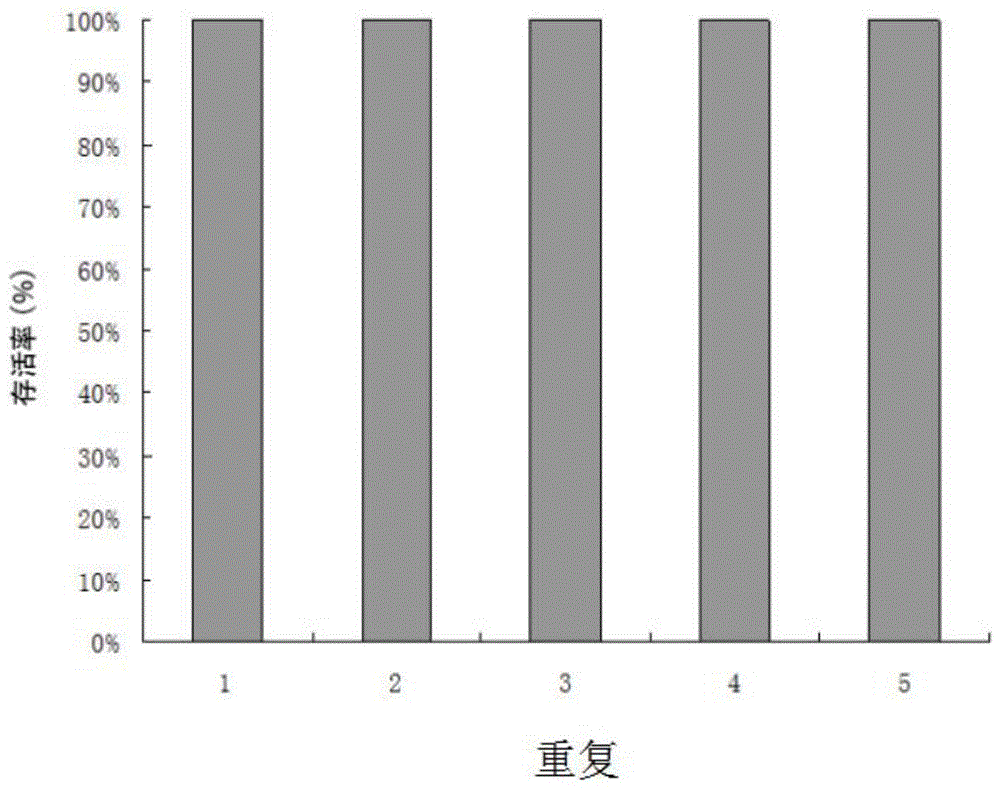
:厚朴(magnoliaofficinalisrehd.etwils)属于木兰科(magnoliaceaejuss.)木兰属(magnolia)植物。厚朴树皮、根皮、枝皮和花果均可入药,皮为著名中药,在我国已有两千多年药用历史。厚朴中主要成分有厚朴酚、和厚朴酚、厚朴碱、挥发油、β-桉叶醇等,其中主要成分厚朴酚(c18h18o2)与和厚朴酚(c18h18o2)具有抗肿瘤,抗菌、抗溃疡、抗抑郁及防龋作用。厚朴酚对多种细癌症胞具有抑制作用,对治疗抑郁有一定的效果。厚朴不仅有重要的药用价值,而且也有较高的观赏价值。因树皮可用药,造成了过度砍伐,资源和分布急剧下降,现已被列为国家二级保护野生植物。因此厚朴种质资源的保存成为了厚朴的可持续利用的关键。目前对于厚朴的种质资源保存多是通过建立保护区和人工种植为主。技术实现要素:有鉴于此,本发明的目的在于一种厚朴胚性愈伤组织玻璃化超低温保存方法,方法简便易行、稳定性高、高效可靠,利用胚性愈伤组织的分化能力,经保存后,还能快速大量的分化成厚朴体细胞胚,并进一步的发育成完整植株,且植株移栽后生长状态良好。为了实现上述发明目的,本发明提供以下技术方案:本发明提供了一种厚朴胚性愈伤组织玻璃化超低温保存方法,包括以下步骤:(1)将厚朴胚性愈伤组织与装载溶液混合进行加载处理,得加载愈伤组织;所述装载溶液由wpm基础培养基、184g/l甘油和136.8g/l蔗糖组成;(2)将所述加载愈伤组织与冰的玻璃化溶液2溶液混合进行玻璃化处理,得玻璃化愈伤组织;所述玻璃化溶液2溶液由wpm基础培养基、300g/l甘油、150g/l乙二醇、150g/l二甲基亚砜和0.4mol/l蔗糖组成;(3)将所述玻璃化愈伤组织置于液氮中保存。优选的,步骤(1)所述厚朴胚性愈伤组织的制备方法,包括将厚朴种子在诱导培养基中诱导培养2周;所述诱导培养基由wpm基础培养基、2mg/l2,4-d、0.25mg/l6-ba、1g/l聚乙烯吡咯烷酮、1g/l水解酪蛋白、40g/l蔗糖和3g/l植物凝胶组成,ph5.8;优选的,所述诱导培养为暗培养,所述诱导培养的温度为25℃。优选的,步骤(1)所述混合时,所述厚朴胚性愈伤组织与装载溶液的体积比为1:8。优选的,步骤(2)所述混合前,还包括吸弃装载溶液;步骤(2)所述混合时,所述加载愈伤组织与玻璃化溶液2溶液的体积比为1:8。优选的,步骤(2)所述玻璃化处理为在冰上进行,所述玻璃化处理的时间为30min。优选的,在步骤(3)所述保存后,还包括对经过保存的愈伤组织进行恢复。优选的,所述保存的时间至少为24h。优选的,所述恢复的方法,包括以下步骤:(a)将所述经过保存的愈伤组织置于40℃水浴中解冻;(b)吸弃经所述解冻的愈伤组织内的玻璃化溶液2溶液,将解冻后的愈伤组织与卸载溶液混合后,进行卸载处理,得卸载愈伤组织;所述卸载溶液由wpm基础培养基和410.4g/l蔗糖组成,ph5.8;(c)吸弃卸载溶液后,将所述卸载愈伤组织转移到所述诱导培养基中进行恢复培养。优选的,在步骤(c)所述转移前,还包括利用wpm液体培养基清洗所述卸载愈伤组织,再将清洗后的卸载愈伤组织与wpm液体培养基混合,利用滤纸吸干所述wpm液体培养基。相比于现有技术,本发明具有以下有益效果:本发明所述厚朴胚性愈伤组织玻璃化超低温保存方法基于再生的厚朴胚性愈伤组织增殖速率快,能够长期进行增殖和分化,且分化为体细胞胚的效率较高,转化为植株的效率高的特点,利用胚性愈伤组织进行加载处理,植物玻璃化处理从而完成超低温保存;加载处理和玻璃化处理的目的是减少细胞内含水量,增加细胞内的渗透式,这样在细胞投入液氮时可以减少细胞内的结冰,进而保护细胞膜完整。相比于现有的原地建立保护区保存、迁地保存,具有永久保存,不受自然环境变化的影响,保存效率高,方便管理。与现有的组织培养保存,遗传稳定性高,保存效率高,快速简便,再生后可以快速进行增殖和分化,分化的体细胞胚直接发育成植株,且转化率高,无需进行生根培养。本发明超低温保存的再生率为100%,能够长期对厚朴种质资源进行超低温保存。附图说明图1为厚朴胚性愈伤组织超低温保存成活率;图2为厚朴胚性愈伤组织超低温保存的恢复过程;图3为再生的胚性愈伤组织分化成苗过程。具体实施方式本发明提供了一种厚朴胚性愈伤组织玻璃化超低温保存方法,包括以下步骤:(1)将厚朴胚性愈伤组织与装载溶液混合进行加载处理,得加载愈伤组织;所述装载溶液由wpm基础培养基、184g/l甘油和136.8g/l蔗糖组成;(2)将所述加载愈伤组织与冰的玻璃化溶液2溶液混合进行玻璃化处理,得玻璃化愈伤组织;所述玻璃化溶液2溶液由wpm基础培养基、300g/l甘油、150g/l乙二醇、150g/l二甲基亚砜和0.4mol/l蔗糖组成;(3)将所述玻璃化愈伤组织置于液氮中保存。本发明所述方法中,将厚朴胚性愈伤组织与装载溶液(loadingsolution)混合进行加载处理,得加载愈伤组织;所述loadingsolution由wpm基础培养基、184g/l甘油和136.8g/l蔗糖组成。本发明所述厚朴胚性愈伤组织的制备方法,优选包括将厚朴种子在诱导培养基中诱导培养2周;所述诱导培养基由wpm基础培养基、2mg/l2,4-d、0.25mg/l6-ba、1g/l聚乙烯吡咯烷酮、1g/l水解酪蛋白、40g/l蔗糖和3g/l植物凝胶组成,ph5.8。本发明对所述厚朴种子的来源并没有特殊限定,优选以成熟种子为材料进行愈伤组织的诱导。本发明所述诱导培养优选为暗培养,所述暗培养的温度优选为25℃。本发明对所述诱导培养基的制备方法并没有特殊限定,将所述组分混合后,121℃下灭菌,调节ph为5.8即可。本发明所述wpm基础培养基的组成如表1所示:表1wpm基础培养基构成序号化合物浓度mg/l1nh4no34002cacl2·2h2o963ca(no3)2·4h2o5564mgso4·7h2o3705k2so49906kh2po41707h3bo36028cuso4·5h2o0.259mnso4·h2o22.310na2mo4·2h2o0.2511znso4·7h2o8.612na2edta37.313feso4·7h2o27.814myo-inositol100本发明进行所述混合时,优选的还包括量取定量的所述胚性愈伤组织,以0.25ml为例,优选的在灭菌1.5ml离心管中,加入1mlwpm液体培养基,量取体积为0.25ml的厚朴胚性愈伤组织。本发明所述wpm液体培养基优选为将上述wpm基础培养基按照表1所示的浓度进行配比后,灭菌杀毒后即得。本发明所述混合时,所述厚朴胚性愈伤组织与loadingsolution的体积比优选为1:8。本发明在所述混合后进行加载处理,所述加载处理的温度优选为25℃所述加载处理的时间优选为20min。本发明对所述loadingsolution的制备方法并没有特殊限定,优选将上述组成成分混合后调节ph值为5.8后,还包括在121℃高压湿热灭菌15min放置到常温。得加载愈伤组织后,本发明将所述加载愈伤组织与冰的玻璃化溶液2溶液(pvs2solution)混合进行玻璃化处理,得玻璃化愈伤组织;所述玻璃化溶液2溶液(pvs2solution)由wpm基础培养基、300g/l甘油、150g/l乙二醇、150g/l二甲基亚砜和0.4mol/l蔗糖组成。本发明在所述混合前,优选还包括吸弃装载溶液(loadingsolution)。本发明所述混合时,所述加载愈伤组织与pvs2solution的体积比优选为1:8。本发明所述玻璃化处理为在冰上进行,所述玻璃化处理的时间优选为30min。本发明对所述pvs2solution的制备方法并没有特殊限定,优选的将上述组成成分混合后调节ph值为5.8后,121℃高压湿热灭菌15min而后静置至室温。本发明进行所述玻璃化处理时,对所述pvs2solution进行预处理,优选将所述pvs2solution转到冰上预冷处理,得冰pvs2solution。得玻璃化愈伤组织后,本发明将所述玻璃化愈伤组织置于液氮中保存。本发明在所述保存时,优选的将所述玻璃化愈伤组织和pvs2solution的混合液置于冻存管中,并固定在冻存管支架上,放入液氮罐保存。本发明在所述保存后,优选还包括对经过保存的愈伤组织进行恢复;所述保存的时间优选至少为24h。本发明所述恢复的方法,优选包括以下步骤:(a)将所述经过保存的愈伤组织置于40℃水浴中解冻;(b)吸弃经所述解冻的愈伤组织内的pvs2solution,将解冻后的愈伤组织与卸载溶液(unloadingsolution)混合后,进行卸载处理,得卸载愈伤组织;所述卸载溶液(unloadingsolution)由wpm基础培养基和410.4g/l蔗糖组成,ph5.8;(c)吸弃卸载溶液(unloadingsolution)后,将所述卸载愈伤组织转移到所述诱导培养基中进行恢复培养。本发明在进行步骤(a)所述水浴时,优选的将附着所述冻存管的冻存支架,快速的插入40℃恒温水浴中,水浴解冻的时间优选为2min。本发明在进行步骤(b)所述卸载处理前,优选还包括对水浴后的冻存管表面进行消毒,所述消毒优选为利用体积分数为75%的酒精擦拭,然后置于超净工作台内进行所述卸载处理。本发明所述unloadingsolution的添加量优选与loadingsolution的添加量相同。本发明所述卸载处理优选为在25℃下处理20min。本发明对所述unloadingsolution的制备方法并没有特殊限定,优选将上述组成成分混合后调节ph至5.8后,121℃高压湿热灭菌15min放置到常温即可。本发明在所述卸载处理结果后,所述转移前,优选还包括利用wpm液体培养基清洗所述卸载愈伤组织,再将清洗后的卸载愈伤组织与wpm液体培养基混合,利用滤纸吸干所述wpm液体培养基。本发明所述滤纸优选为3张叠放的滤纸,放置在9cm玻璃培养皿中。本发明所述恢复培养,优选为在黑暗条件下25℃进行培养,得到再生胚性愈伤组织。本发明在得到所述再生胚性愈伤组织后,优选还包括再生胚性愈伤组织的继代、分化和成苗,更优选的在所述恢复培养1个月后,将滤纸上再生的胚性愈伤组织,转移到不加滤纸的所述诱导培养基上,于25℃黑暗条件下进行继代培养。本发明在所述继代培养过程中,每隔两周换一次培养基。本发明优选在继代两次后,挑选继代两周的胚性愈伤组织,转到wpm培养基上让其分化,1个月后有体细胞胚产生,不带愈伤组织,将体细胞胚挑出,放置于wpm培养基上,待根和子叶开始长出,转到组培瓶中继续培养,根系发到后移到育苗穴中,最后做成袋苗。本发明所述wpm培养基优选为在所述wpm基础培养基的基础上,添加1%(质量比)的琼脂,溶解后杀毒灭菌后即得。下面结合实施例对本发明提供的厚朴胚性愈伤组织玻璃化超低温保存方法进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。实施例11、材料的选取:通过厚朴成熟种子合子胚诱导出的厚朴胚性愈伤组织,在wpm+2mg/l2,4-d+0.25mg/l6-ba+1g/lpvp(聚乙烯吡咯烷酮)+1g/l水解酪蛋白(ch)+40g/l蔗糖+3g/l植物凝胶,ph5.8,25℃黑暗条件下培养2周的厚朴胚性愈伤组织。2、0.25ml厚朴胚性愈伤组织的量取:在超净工作台内,在灭过菌的1.5ml离心管中,加入1mlwpm体培养基,此时刻度与1ml凹液面最低处相平。用镊子挑生长状态良好的厚朴胚性愈伤组织,转到1.5ml离心管中,直到凹液面最低处与刻度1.25ml刻度相平,量取体积为0.25ml的厚朴胚性愈伤组织。3、加载处理:移液枪装上1ml剪口的蓝枪头,将称取的0.25ml胚性愈伤组织转移到2ml冻存管中,吸尽wpm液体,加入2mlloadingsolution加载处理20分钟。4、玻璃化处理:加载处理结束,用移液枪将加载液吸尽,加入2ml冰上预冷的pvs2solution,在冰上处理30分钟。5、超低温保存:玻璃化处理结束,将冻存管冻固定在冻存管支架上。把冻存管支架迅速放入液氮罐保存24小时以上。6、40℃水浴解冻:将在液氮保存24小时以上,附着冻存管的冻存支架,从液氮罐取出,快速的插入40℃恒温水浴中,水浴解冻2分钟。7、卸载处理:水浴后的冻存管,用75%的酒精擦拭外表面,超净工作台内,用移液枪吸尽pvs2solution,在加入2mlunloadingsolution,在25℃下处理20分钟;8、清洗及恢复培养:卸载处理结束,用移液枪吸尽unloadingsolution,加入2mlwpm液体培养基清洗,再用移液枪吸尽wpm液体。清洗完后,2ml冻存管中加入1mlwpm液体。用移液枪装上剪口的枪头,将胚性愈伤组织转移到放有3张滤纸的9cm玻璃培养皿中,滤液完全渗透,转移到:wpm+2mg/l2,4-d+0.25mg/l6-ba+1g/lpvp+1g/lch+30g/l蔗糖+3g/lphytagel(植物凝胶),ph5.8,25℃黑暗条件下进行恢复培养。对冻存两周后的190管胚性愈伤组织分5次进行恢复培养,结果如图1所示,其中第1、2、3和4次每次恢复40管,第5次恢复30管,恢复后成活率100%。9、成活率和恢复能力的鉴定和最佳玻璃化溶液处理时间的选定用荧光素双醋酸酯(fda)活细胞荧光染料和碘化丙啶(pi)死细胞荧光染料染色,激光共聚焦显微镜对厚朴胚性愈伤组织恢复时间0小时、1天、2天、3天、4天、5天和6天时的荧光变化进行观察,结果得出在恢复培养过程中活率值先下降,48小时的细胞活力值最低,随后开始增加,7天的时候活力值,已接近对照。从而得出48小时为厚朴胚性愈伤组织成活率测定最准确时间点。再对pvs2玻璃化溶液处理时间0分钟,5分钟、10分钟,30分钟、50分钟、70分钟、90分钟时间梯度下,超低温保存,恢复培养48小时的荧光和荧光强度,结果恢复48小时,pvs2玻璃化溶液处理30分钟获得最高的荧光强度,即活力最高。在结合两周的时候对超低温胚性愈伤组织的观察(如图2所示,其中a为用于超低温保存继代两周的原材料;b为解冻后,恢复培养48小时的厚朴胚性愈伤组织;c为解冻后恢复培养2周的厚朴胚性愈伤组织;d为超低温再生继代两周的厚朴胚性愈伤组织),得出30分钟为厚朴胚性愈伤组织最有玻璃化处理时间。10、再生胚性愈伤组织的继代、分化和成苗恢复培养1个月时,将滤纸上再生的胚性愈伤组织,转移到不加滤纸的:wpm+2mg/l2,4-d+0.25mg/l6-ba+1g/lpvp+1g/lch+30g/l蔗糖+3g/lphytagel(植物凝胶),ph5.8,25℃黑暗条件下进行继代培养。每隔两周换一次培养基。继代两次后,挑选继代两周的胚性愈伤组织,转到wpm培养基上让其分化,1个月后有体细胞胚产生,不带愈伤组织,将体细胞胚挑出,放置于wpm培养基上,待根和子叶开始长出,转到组培瓶中继续培养,根系发到后移到育苗穴中,最后做成袋苗。其恢复成苗过程如图3所示,其中a为液氮冻存再生的厚朴胚性愈伤组织;b为再生胚性愈伤组织分化体细胞胚;c为体细胞胚;d厚朴组培小苗;e为厚朴组培瓶苗;f为移栽到16×16cm的育苗袋的厚朴植株,其成苗率100%,成活率100%。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1