一种水稻花药愈伤组织的培养方法与流程
[0001]
本发明涉及植物花药离体培养技术,具体是一种水稻花药愈伤组织的培养方法。
背景技术:
[0002]
水稻是稻属谷类作物,水稻原产于中国和印度,七千年前中国长江流域的先民们就曾种植水稻。水稻按稻谷类型分为籼稻和粳稻、早稻和中晚稻、糯稻和非糯稻。按留种方式分为常规水稻和杂交水稻。
[0003]
花药培养是通过植物组织培养技术,将发育到一定阶段的花药,通过无菌操作技术,接种在人工培养基上,以改变花药内花药粒的发育程序,诱导其分化,并连续进行有丝分裂,形成细胞团,进而形成一团无分化的薄壁组织-愈伤组织,或分化成胚状体,随后诱使愈伤组织分化成完整的植株,目前,将花药得到的植株用于育种的理论基础已经建立,水稻已经成为可利用花药培养技术快速育种的作物,然而在水稻花药的离体培养中,还存在着愈伤组织诱导率低下的问题。
技术实现要素:
[0004]
本发明的目的在于提供一种水稻花药愈伤组织的培养方法,以解决上述背景技术中提出的问题,能够缩短水稻花药愈伤组织的培养时间,建立高效快速的水稻花药愈伤组织培养体系,水稻花药愈伤组织诱导率大大提高。
[0005]
一种水稻花药愈伤组织的培养方法,由如下步骤构成:
[0006]
1)取稻穗,将其置于三角瓶内,加入浓度为75%的酒精溶液,采用纱布封住瓶口,置于摇床上振荡漂洗10-15min,再用1.5%的次氯酸钠消毒20-25min,置于流水下冲洗0.5-1h,置于摇床上振荡漂洗10-15min,然后用无菌水清洗2-3次;
[0007]
2)消毒后去除颖壳的顶端;
[0008]
3)在灭菌过的工作台中,将上述消毒处理过的稻穗取出,用灭菌滤纸吸干水分后,将稻苞茎杆朝上,然后将穗部朝下分别接种在诱导培养基上,然后置于摇床上振荡0.5-1min,振荡频率为1-8hz,接好的种子放在诱导培养基中培养,得到水稻花药愈伤组织;
[0009]
4)将步骤3)中诱导形成的愈伤组织转入增殖培养基中进行增殖;
[0010]
诱导培养基的配方为:1.5-3mg/l s+2,4-d、0.2-1mg/l kt、0.4-1mg/l 6-ba、0.3%蔗糖、7.5%琼脂粉、50-90mg/l维生素、水解酪蛋白0.6.-1.2g/l;
[0011]
增殖培养基主要由:1.0-2.0mg/lkt、0.5-1.5mg/liba、0.2-0.8mg/l naa、0.3%蔗糖、7.5%琼脂粉、50-90mg/l维生素、水解酪蛋白0.6-1.2g/l;
[0012]
2,4-d和kt能够很好的协同诱导和促进水稻花药愈伤组织的形成(提高诱导率的同时还能使得到的愈伤组织质量好;蔗糖在植物组织培养基中起到能源物质和渗透调节剂的作用,除供能之外,还能诱导愈伤组织的再分化;琼脂粉在培养基中主要起固定支撑的作用。
[0013]
6-ba是6-苄氨基腺嘌呤,是一种细胞分裂素类的物质,具有高效、稳定、廉价和易
于使用等特点是组织培养者最喜爱的细胞分裂素,可以诱导愈伤组织发生。
[0014]
naa为萘乙酸,是组织培养中常用的植物生长调节剂,对于愈伤组织的诱导和生长非常有效。
[0015]
作为优选:所述愈伤组织诱导培养基的培养温度为25-28℃,ph值为5.8-6.0,培养15-22天。
[0016]
作为优选:所述愈伤组织增殖培养基的培养温度为26-30℃,ph值为5.6-6.5,培养10-15天。
[0017]
作为优选,每升诱导培养基以及增殖培养基内含有:no3k硝酸钾300-500mg/l、k2so4硫酸钾800-1000mg/l、mgso4.7h2o七水合硫酸镁350-400mg/l、kh2po4磷酸二氢钾150-200mg/l、mnso4.4h2o四水合硫酸锰15-25mg/l、znso4.7h2o七水合硫酸锌8.0-9.0mg/l、h3bo3硼酸6.0-6.5mg/l、cuso4.5h2o五水合硫酸铜0.03-0.08mg/l、namoo4.2h2o二水合钼酸钠0.1-0.4mg/l、fe-eddha乙二胺邻二羟基乙酸铁8-12mg/l、cacl2.2h2o二水合氯化钙80-120mg/l、ca(no3)2.4h2o四水硝酸钙550-650mg/l、肌醇80-120mg/l、烟酸0.8-1.2mg/l。
[0018]
作为优选:去除颖壳的顶端时,可以采用剪切或切除的方法。
[0019]
作为优选:稻苞抽出的剑叶叶枕到第2叶,颖壳出现浅绿色时从所述的稻苞中取出稻穗,此时水稻的花粉处于单核靠边期,该时期取水稻的花药进行离体培养,愈伤组织诱导率高。
[0020]
作为优选:颖壳去除的部分占颖壳的3/5,若去除的部分过少,则颖壳开口小,花药不易被振荡出,影响收集效果;去除的部分过大,则易使花药受到机械损伤。
[0021]
作为优选:消毒前,将所述的稻穗于3-6℃放置7-10天,适当的低温预处理可抑制花药壁的退化及褐变,促使花药脱分化形成愈伤组织。
[0022]
与现有技术相比,本发明的有益效果是:一种水稻花药愈伤组织的培养方法:
[0023]
1)消毒是植物组织培养中的一个重要环节,本发明采用1.5%的次氯酸钠消毒20-25min,置于流水下冲洗0.5-1h,置于摇床上振荡漂洗10-15min,然后用无菌水清洗2-3次,该方法污染率最低,存活率最高;
[0024]
2)本发明通过水稻花药愈伤组织诱导培养和增殖培养,可快速获得大量质地优良的水稻花药愈伤组织,成功率更高;
[0025]
3)本发明通过在诱导组织培养基中设置2,4-d和kt,能够很好的协同诱导和促进水稻花药愈伤组织的形成(提高诱导率的同时还能使得到的愈伤组织质量好;通过添加6-ba是6-苄氨基腺嘌呤,是一种细胞分裂素类的物质,具有高效、稳定、廉价和易于使用等特点是组织培养者最喜爱的细胞分裂素,可以诱导愈伤组织发生;
[0026]
4)本发明通过在增殖培养基中添加萘乙酸,萘乙酸是组织培养中常用的植物生长调节剂,对于愈伤组织的诱导和生长非常有效。
具体实施方式
[0027]
下面结合具体实施方式对本发明的技术方案作进一步详细地说明。
[0028]
本发明通过设置增殖培养基能够缩短水稻花药愈伤组织的培养时间,建立高效快速的水稻花药愈伤组织培养体系,水稻花药愈伤组织诱导率和增殖效果大大提高。
[0029]
实施例1
[0030]
取稻穗,将稻苞抽出的剑叶叶枕到第2叶,颖壳出现浅绿色时从所述的稻苞中取出稻穗;将所述的稻穗于3℃放置7天;取稻穗,将其置于三角瓶内,加入浓度为75%的酒精溶液,采用纱布封住瓶口,置于摇床上振荡漂洗10min,再用1.5%的次氯酸钠消毒20min,置于流水下冲洗0.5h,置于摇床上振荡漂洗10min,然后用无菌水清洗2次;在单人无菌超净台用剪刀将着生于穗部中间部分生理状态较好的颖壳顶端的3/5以上部分剪去;将上述消毒处理过的稻穗取出,用灭菌滤纸吸干水分后,将稻苞茎杆朝上,然后将穗部朝下分别接种在诱导培养基上,然后置于摇床上振荡0.5min,振荡频率为1hz,接好的种子放在诱导培养基中培养,愈伤组织诱导培养基的培养温度为25℃,ph为5.8,培养15天,得到水稻花药愈伤组织,诱导培养基的配方为:1.5mg/l s+2,4-d、0.2mg/l kt、0.4mg/l 6-ba、0.3%蔗糖、7.5%琼脂粉、50mg/l维生素、水解酪蛋白0.6.g/l;将诱导培养基中诱导形成的愈伤组织转入增殖培养基中进行增殖,所述愈伤组织增殖培养基的培养温度为26℃,ph值为5.6,培养10天,增殖培养基主要由:1.0mg/lkt、0.5mg/liba、0.2mg/l naa、0.3%蔗糖、7.5%琼脂粉、50mg/l维生素、水解酪蛋白0.6g/l;
[0031]
实施例2
[0032]
取稻穗,将稻苞抽出的剑叶叶枕到第2叶,颖壳出现浅绿色时从所述的稻苞中取出稻穗;将所述的稻穗于4℃放置8天;取稻穗,将其置于三角瓶内,加入浓度为75%的酒精溶液,采用纱布封住瓶口,置于摇床上振荡漂洗12min,再用1.5%的次氯酸钠消毒22min,置于流水下冲洗0.6h,置于摇床上振荡漂洗12min,然后用无菌水清洗3次;在单人无菌超净台用剪刀将着生于穗部中间部分生理状态较好的颖壳顶端的3/5以上部分剪去;将上述消毒处理过的稻穗取出,用灭菌滤纸吸干水分后,将稻苞茎杆朝上,然后将穗部朝下分别接种在诱导培养基上,然后置于摇床上振荡0.6min,振荡频率为3hz,接好的种子放在诱导培养基中培养,愈伤组织诱导培养基的培养温度为26℃,ph值为5.9,培养16天,得到水稻花药愈伤组织,诱导培养基的配方为:1.8mg/l s+2,4-d、0.4mg/l kt、0.6mg/l 6-ba、0.3%蔗糖、7.5%琼脂粉、60mg/l维生素、水解酪蛋白0.8.g/l;将诱导培养基中诱导形成的愈伤组织转入增殖培养基中进行增殖,所述愈伤组织增殖培养基的培养温度为27℃,ph值为5.7,培养11天,增殖培养基主要由:1.2mg/lkt、0.7mg/liba、0.4mg/l naa、0.3%蔗糖、7.5%琼脂粉、60mg/l维生素、水解酪蛋白0.8g/l;
[0033]
实施例3
[0034]
取稻穗,将稻苞抽出的剑叶叶枕到第2叶,颖壳出现浅绿色时从所述的稻苞中取出稻穗;将所述的稻穗于5℃放置9天;取稻穗,将其置于三角瓶内,加入浓度为75%的酒精溶液,采用纱布封住瓶口,置于摇床上振荡漂洗13min,再用1.5%的次氯酸钠消毒23min,置于流水下冲洗0.7h,置于摇床上振荡漂洗13min,然后用无菌水清洗3次;在单人无菌超净台用剪刀将着生于穗部中间部分生理状态较好的颖壳顶端的3/5以上部分剪去;将上述消毒处理过的稻穗取出,用灭菌滤纸吸干水分后,将稻苞茎杆朝上,然后将穗部朝下分别接种在诱导培养基上,然后置于摇床上振荡0.7min,振荡频率为4hz,接好的种子放在诱导培养基中培养,愈伤组织诱导培养基的培养温度为27℃,ph值为6.0,培养17天,得到水稻花药愈伤组织,诱导培养基的配方为:2.0mg/l s+2,4-d、0.5mg/l kt、0.7mg/l 6-ba、0.3%蔗糖、7.5%琼脂粉、65mg/l维生素、水解酪蛋白1.0g/l;将诱导培养基中诱导形成的愈伤组织转入增殖培养基中进行增殖,所述愈伤组织增殖培养基的培养温度为27℃,ph值为5.7,培养11天,增
殖培养基主要由:1.4mg/lkt、0.8mg/liba、0.6mg/l naa、0.3%蔗糖、7.5%琼脂粉、70mg/l维生素、水解酪蛋白0.9g/l;
[0035]
实施例4
[0036]
取稻穗,将稻苞抽出的剑叶叶枕到第2叶,颖壳出现浅绿色时从所述的稻苞中取出稻穗;将所述的稻穗于5℃放置9天;取稻穗,将其置于三角瓶内,加入浓度为75%的酒精溶液,采用纱布封住瓶口,置于摇床上振荡漂洗13min,再用1.5%的次氯酸钠消毒23min,置于流水下冲洗0.7h,置于摇床上振荡漂洗13min,然后用无菌水清洗3次;在单人无菌超净台用剪刀将着生于穗部中间部分生理状态较好的颖壳顶端的3/5以上部分剪去;将上述消毒处理过的稻穗取出,用灭菌滤纸吸干水分后,将稻苞茎杆朝上,然后将穗部朝下分别接种在诱导培养基上,然后置于摇床上振荡0.7min,振荡频率为4hz,接好的种子放在诱导培养基中培养,愈伤组织诱导培养基的培养温度为27℃,ph值为6.0,培养17天,得到水稻花药愈伤组织,诱导培养基的配方为:2.4mg/l s+2,4-d、0.8mg/l kt、0.8mg/l 6-ba、0.3%蔗糖、7.5%琼脂粉、70mg/l维生素、水解酪蛋白1.0g/l;将诱导培养基中诱导形成的愈伤组织转入增殖培养基中进行增殖,所述愈伤组织增殖培养基的培养温度为27℃,ph值为5.7,培养11天,增殖培养基主要由:1.6mg/lkt、1.2mg/liba、0.7mg/l naa、0.3%蔗糖、7.5%琼脂粉、75mg/l维生素、水解酪蛋白1.0g/l;
[0037]
实施例5
[0038]
取稻穗,将稻苞抽出的剑叶叶枕到第2叶,颖壳出现浅绿色时从所述的稻苞中取出稻穗;将所述的稻穗于6℃放置10天;取稻穗,将其置于三角瓶内,加入浓度为75%的酒精溶液,采用纱布封住瓶口,置于摇床上振荡漂洗14min,再用1.5%的次氯酸钠消毒24min,置于流水下冲洗0.7h,置于摇床上振荡漂洗13min,然后用无菌水清洗3次;在单人无菌超净台用剪刀将着生于穗部中间部分生理状态较好的颖壳顶端的3/5以上部分剪去;将上述消毒处理过的稻穗取出,用灭菌滤纸吸干水分后,将稻苞茎杆朝上,然后将穗部朝下分别接种在诱导培养基上,然后置于摇床上振荡0.8min,振荡频率为6hz,接好的种子放在诱导培养基中培养,愈伤组织诱导培养基的培养温度为27℃,ph值为6.0,培养20天,得到水稻花药愈伤组织,诱导培养基的配方为:2.8mg/l s+2,4-d、0.9mg/l kt、0.9mg/l 6-ba、0.3%蔗糖、7.5%琼脂粉、80mg/l维生素、水解酪蛋白1.1g/l;将诱导培养基中诱导形成的愈伤组织转入增殖培养基中进行增殖,所述愈伤组织增殖培养基的培养温度为28℃,ph值为6.0,培养13天,增殖培养基主要由:1.9mg/lkt、1.2mg/liba、0.7mg/l naa、0.3%蔗糖、7.5%琼脂粉、80mg/l维生素、水解酪蛋白1.1g/l;
[0039]
实施例6
[0040]
取稻穗,将稻苞抽出的剑叶叶枕到第2叶,颖壳出现浅绿色时从所述的稻苞中取出稻穗;将所述的稻穗于6℃放置10天;取稻穗,将其置于三角瓶内,加入浓度为75%的酒精溶液,采用纱布封住瓶口,置于摇床上振荡漂洗14min,再用1.5%的次氯酸钠消毒24min,置于流水下冲洗0.7h,置于摇床上振荡漂洗13min,然后用无菌水清洗3次;在单人无菌超净台用剪刀将着生于穗部中间部分生理状态较好的颖壳顶端的3/5以上部分剪去;将上述消毒处理过的稻穗取出,用灭菌滤纸吸干水分后,将稻苞茎杆朝上,然后将穗部朝下分别接种在诱导培养基上,然后置于摇床上振荡0.8min,振荡频率为6hz,接好的种子放在诱导培养基中培养,愈伤组织诱导培养基的培养温度为27℃,ph值为6.0,培养20天,得到水稻花药愈伤组
织,诱导培养基的配方为:2.9mg/l s+2,4-d、0.9mg/l kt、0.8mg/l 6-ba、0.3%蔗糖、7.5%琼脂粉、78mg/l维生素、水解酪蛋白1.1g/l;将诱导培养基中诱导形成的愈伤组织转入增殖培养基中进行增殖,所述愈伤组织增殖培养基的培养温度为28℃,ph值为6.0,培养13天,增殖培养基主要由:1.8mg/lkt、1.1mg/liba、0.7mg/l naa、0.3%蔗糖、7.5%琼脂粉、78mg/l维生素、水解酪蛋白1.1g/l;
[0041]
实施例7
[0042]
取稻穗,将稻苞抽出的剑叶叶枕到第2叶,颖壳出现浅绿色时从所述的稻苞中取出稻穗;将所述的稻穗于6℃放置10天;取稻穗,将其置于三角瓶内,加入浓度为75%的酒精溶液,采用纱布封住瓶口,置于摇床上振荡漂洗15min,再用1.5%的次氯酸钠消毒25min,置于流水下冲洗1h,置于摇床上振荡漂洗15min,然后用无菌水清洗3次;在单人无菌超净台用剪刀将着生于穗部中间部分生理状态较好的颖壳顶端的3/5以上部分剪去;将上述消毒处理过的稻穗取出,用灭菌滤纸吸干水分后,将稻苞茎杆朝上,然后将穗部朝下分别接种在诱导培养基上,然后置于摇床上振荡1min,振荡频率为8hz,接好的种子放在诱导培养基中培养,愈伤组织诱导培养基的培养温度为28℃,ph值为6.0,培养22天,得到水稻花药愈伤组织,诱导培养基的配方为:3mg/l s+2,4-d、1mg/l kt、1mg/l 6-ba、0.3%蔗糖、7.5%琼脂粉、90mg/l维生素、水解酪蛋白1.2g/l;将诱导培养基中诱导形成的愈伤组织转入增殖培养基中进行增殖,所述愈伤组织增殖培养基的培养温度为30℃,ph值为6.5,培养15天,增殖培养基主要由:1.9mg/lkt、1.2mg/liba、0.7mg/l naa、0.3%蔗糖、7.5%琼脂粉、80mg/l维生素、水解酪蛋白1.1g/l;
[0043]
实施例8
[0044]
取稻穗,将稻苞抽出的剑叶叶枕到第2叶,颖壳出现浅绿色时从所述的稻苞中取出稻穗;将所述的稻穗于6℃放置10天;取稻穗,将其置于三角瓶内,加入浓度为75%的酒精溶液,采用纱布封住瓶口,置于摇床上振荡漂洗13min,再用1.5%的次氯酸钠消毒23min,置于流水下冲洗0.8h,置于摇床上振荡漂洗14min,然后用无菌水清洗3次;在单人无菌超净台用剪刀将着生于穗部中间部分生理状态较好的颖壳顶端的3/5以上部分剪去;将上述消毒处理过的稻穗取出,用灭菌滤纸吸干水分后,将稻苞茎杆朝上,然后将穗部朝下分别接种在诱导培养基上,然后置于摇床上振荡1min,振荡频率为7hz,接好的种子放在诱导培养基中培养,愈伤组织诱导培养基的培养温度为27℃,ph值为6.0,培养20天,得到水稻花药愈伤组织,诱导培养基的配方为:1.8mg/l s+2,4-d、0.4mg/l kt、0.6mg/l 6-ba、0.3%蔗糖、7.5%琼脂粉、60mg/l维生素、水解酪蛋白0.8.g/l;将诱导培养基中诱导形成的愈伤组织转入增殖培养基中进行增殖,所述愈伤组织增殖培养基的培养温度为26℃,ph值为5.6,培养10天,增殖培养基主要由:1.0mg/lkt、0.5mg/liba、0.2mg/l naa、0.3%蔗糖、7.5%琼脂粉、50mg/l维生素、水解酪蛋白0.6g/l;
[0045]
实施例9
[0046]
取稻穗,将稻苞抽出的剑叶叶枕到第2叶,颖壳出现浅绿色时从所述的稻苞中取出稻穗;将所述的稻穗于3℃放置7天;取稻穗,将其置于三角瓶内,加入浓度为75%的酒精溶液,采用纱布封住瓶口,置于摇床上振荡漂洗10min,再用1.5%的次氯酸钠消毒20min,置于流水下冲洗0.5h,置于摇床上振荡漂洗10min,然后用无菌水清洗2次;在单人无菌超净台用剪刀将着生于穗部中间部分生理状态较好的颖壳顶端的3/5以上部分剪去;将上述消毒处
理过的稻穗取出,用灭菌滤纸吸干水分后,将稻苞茎杆朝上,然后将穗部朝下分别接种在诱导培养基上,然后置于摇床上振荡0.6min,振荡频率为3hz,接好的种子放在诱导培养基中培养,愈伤组织诱导培养基的培养温度为26℃,ph值为5.9,培养16天,得到水稻花药愈伤组织,诱导培养基的配方为:2.9mg/l s+2,4-d、0.9mg/l kt、0.8mg/l 6-ba、0.3%蔗糖、7.5%琼脂粉、78mg/l维生素、水解酪蛋白1.1g/l;将诱导培养基中诱导形成的愈伤组织转入增殖培养基中进行增殖,所述愈伤组织增殖培养基的培养温度为28℃,ph值为6.0,培养13天,增殖培养基主要由:1.9mg/lkt、1.2mg/liba、0.7mg/l naa、0.3%蔗糖、7.5%琼脂粉、80mg/l维生素、水解酪蛋白1.1g/l;
[0047]
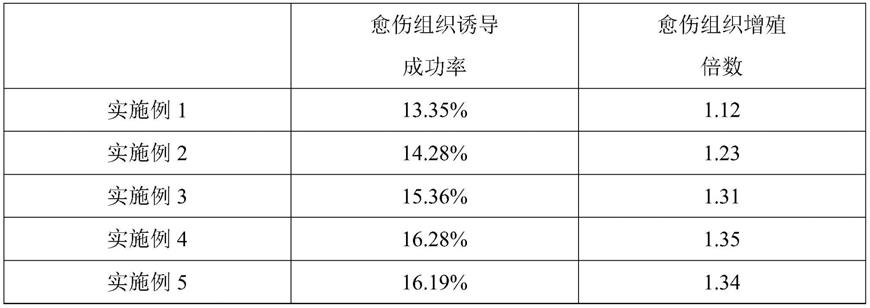
对实施例1-9的花药愈伤组织诱导成功率和增殖倍数进行统计,统计结构如下表1:
[0048]
表1
[0049][0050][0051]
由表面1的结果可知,本发明通过设置增殖培养基能够缩短水稻花药愈伤组织的培养时间,建立高效快速的水稻花药愈伤组织培养体系,水稻花药愈伤组织诱导率和增殖效果大大提高。
[0052]
对比例1
[0053]
对比例1与实施例6不同之处在于,诱导组织培养基中不含2,4-d和kt,其余与实施例6相同。
[0054]
对比例2
[0055]
对比例2与实施例6不同之处在于,诱导组织培养基中不含6-ba,其余与实施例6相同。
[0056]
对比例3
[0057]
对比例3与实施例6不同之处在于,诱导组织培养基中不含2,4-d、kt和6-ba,其余与实施例6相同。
[0058]
对比例4
[0059]
对比例4与实施例6不同之处在于,增殖培养基中不含萘乙酸,其余与实施例6相
同。
[0060]
对比例5
[0061]
对比例5与实施例6不同之处在于,诱导组织培养基中不含2,4-d、kt和6-ba、增殖培养基中不含萘乙酸,其余与实施例6相同。
[0062]
对比例6
[0063]
对比例6与实施例6不同之处在于,不设置增殖培养基,其余与实施例6相同。
[0064]
对比以上对比例1-6,水稻花药愈伤组织的诱导成功率和增殖倍数如下表2:
[0065]
表2
[0066][0067][0068]
综上,由表2可知,实施例1-8中诱导培养基的诱导成功率以及愈伤组织的增值倍数均比对比例1-6要好,通过设置增殖培养基能够缩短水稻花药愈伤组织的培养时间,建立高效快速的水稻花药愈伤组织培养体系,水稻花药愈伤组织诱导率和增殖效果大大提高,能够很好的协同诱导和促进水稻花药愈伤组织的形成(提高诱导率的同时还能使得到的愈伤组织质量好;通过添加6-ba是6-苄氨基腺嘌呤,是一种细胞分裂素类的物质,具有高效、稳定、廉价和易于使用等特点是组织培养者最喜爱的细胞分裂素,可以诱导愈伤组织发生,通过在增殖培养基中添加萘乙酸,萘乙酸是组织培养中常用的植物生长调节剂,对于愈伤组织的诱导和生长非常有效,具有良好的发展前景。
[0069]
上面对本发明的较佳实施方式作了详细说明,但是本发明并不限于上述实施方式,在本领域的普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1