一种人参不定根中人参皂苷的转化方法与流程
1.本发明属于植物组织培养技术领域,具体地说,涉及一种人参不定根中人参皂苷的转化方法。
背景技术:
2.人参(panax ginseng c.a.mey.)是五加科人参属植物,分布于中国、日本、韩国,其根茎是名贵的中药材,号称“百草之王”。人参味甘、微苦,微温,具有大补元气,复脉固脱,补脾益肺,生津养血,安神益智等功效,多用于体恤欲脱,脾虚食少,肺虚喘咳,津伤口渴,惊悸失眠等。人参皂苷是人参主要的活性成分,有抗疲劳、延缓衰老、调节中枢神经系统、提高机体免疫力、改善心脑血管供血不足、抑制肿瘤细胞生产等功效。近年来,人参被广泛地用在各类化妆品、保健品、饮品中。人参的市场前景非常广阔。
3.目前由于过度采挖、环境破坏等,野生人参资源几乎灭绝,大田栽培是人参的主要来源。然而人参生长缓慢,种植年限长,对环境条件要求严格,其品质易受气候、栽培条件及病虫害的影响,栽培技术复杂以及农残超标、老参地等问题也极大地限制了人工栽培人参的发展前景。大田栽培人参供应难以满足市场的需求。人参组织培养技术周期短,不受季节限制,容易进行大规模的工业化生产,具有很大的发展前景。
4.目前不定根一般是由人参愈伤组织诱导产生的,需要先诱导产生愈伤组织,再诱导产生不定根,所需的实验周期长,操作步骤复杂,污染风险较高的问题。另外,培养的人参中还存在人参皂苷含量低,难以满足临床应用需求的问题。
5.申请号为cn201711459037.0的中国专利申请公开了一种野人参不定根组织培养的方法,包括如下步骤:(1)野人参愈伤组织的诱导;(2)野人参愈伤组织的增殖;(3)野人参不定根的诱导;(4)液体培养基中野人参不定根增殖。上述技术方案中,需要先诱导愈伤组织,再诱导不定根,所需要的周期长,过程复杂,且人参皂苷的含量也不高。
6.申请号为201410698528.0的中国专利公开了一种人参不定根诱导增殖方法,包括以下步骤:将人参组培苗切割成组织小块后接种于固体诱导培养基中诱导形成不定根,将所述不定根切割成不定根小块后接种于液体增殖培养基中进行不定根的增殖培养;其中,所述固体诱导培养基和液体增殖培养基为以1/2ms(
‑
n)培养基为基本培养基含有浓度为1
‑
10mg/l的吲哚丁酸。上述方案中,将日龄为28
‑
32天的组培苗切成小块直接诱导不定根,组培苗幼嫩,分化能力强,且实际上需要先经过种子萌发或者外植体培养获得组培苗,仍然需要至少28
‑
32天的时间,外植体培养仍然需要诱导愈伤组织。因此,实际上并没有缩短周期。因此,倘若能够探索获得一种能够从成熟人参直接诱导产生不定根的方法,不但能够缩减诱导周期,简化诱导条件的方法则具有广泛的意义。
7.另外,目前不定根中皂苷的转化方法也较为繁琐,若能够获得稀有皂苷转化率高、方便快捷的转化方法则能够进一步提高效率。
8.有鉴于此特提出本发明。
技术实现要素:
9.本发明要解决的技术问题在于克服现有技术的不足,提供一种人参不定根中人参皂苷的转化方法。本发明中,由成熟人参的各个部分诱导产生不定根,不需要诱导愈伤组织的中间步骤,可以简化诱导步骤、缩短诱导时间;不定根中人参皂苷的转化方法步骤简单,易于操作,稀有皂苷转化率高。
10.为解决上述技术问题,本发明采用技术方案的基本构思是:
11.本发明的第一目的是提供一种人参不定根中人参皂苷的转化方法,包括以下步骤:
12.(1)制备人参不定根样品;
13.(2)向人参不定根样品中加入碱液,升温至85
‑
125℃,保温20
‑
60min,降至室温,然后重复升温、保温和降温的过程,检测处理后样品中人参皂苷的含量。
14.各种人参皂苷在人参属植物中含量不同,并且具有不同的药理功能。有些人参皂苷含量较高,如re、rb1和rg1等,而另外一些人参皂苷含量甚微,称为稀有人参皂苷,如rh1、rh2、rh3和rg3等。
15.许多药理研究表明,稀有人参皂苷通常具有更好的药理活性。人参皂苷苷元的抗肿瘤活性最强,随着糖基数目的增加,人参皂苷抗肿瘤活性依次减弱,即:苷元>单糖苷>二糖苷>三糖苷>四糖苷。通过研究人参皂苷在体内的代谢规律,也发现绝大多数人参皂苷在胃肠道中吸收较差,而脱去糖基的次级苷和苷元比皂苷具有更强的药理活性和更高的生物利用度。稀有人参皂苷和苷元在人参原植物、细胞培养物、不定根及毛状根中含量甚微,目前主要通过物理法和化学法水解皂苷糖苷键获得,或者通过酶法、微生物法进行生物法转化,较为繁琐。
16.本发明提供的不定根中人参皂苷的转化方法步骤简单,易于操作,稀有皂苷转化率高。
17.进一步的方案,步骤(1)中,所述人参不定根样品的制备方法包括:
18.取人参不定根,用清水冲洗,剪成小段,加适量水,将小段研碎,按重量分为若干等份,其中一份为对照样品,其他等份为供试样品。
19.进一步的方案,所述对照品样品不做处理,所述供试样品中碱液的浓度为2
‑
8mmol/l。
20.进一步的方案,步骤(2)中,重复升温、保温和降温的过程,处理2
‑
6次。
21.进一步的方案,步骤(2)中,所述碱液选自碳酸钠、氢氧化钠、碳酸氢钠中的至少一种;
22.优选碳酸钠。
23.作为一种优选的实施方案,步骤(2)中,向人参不定根样品中加入碳酸钠溶液,人参不定根样品中na2co3的浓度为2mmol/l,升温至115℃,保温30min,降温后再重复升温、保温和降温过程,处理4次。
24.采用上述优选的条件,添加的碱液为na2co3,可以避免碱污染,有利于保护环境,且步骤简单方便,易于操作,同时得到的稀有皂苷rh2的含量高。
25.进一步的方案,步骤(3)中,处理样品的方法包括:将处理后的样品转移到50ml离心管中,加入水混匀,超声破碎,然后冻干;再将冻干后的样品在研钵上研细,准确称取50mg
于离心管中,加入70%甲醇溶液,涡旋,超声振荡,过滤备用。
26.本发明上述方法中采用的不定根由成熟人参直接诱导产生,不需要诱导愈伤组织的中间步骤,可以简化诱导步骤、缩短诱导时间。
27.本发明的第二目的是提供一种人参不定根的培养方法,将成熟人参清洗消毒,切片,接种到诱导培养基中诱导出人参不定根;将获得的人参不定根再次接种到诱导培养基中继代培养扩繁;然后将获得的人参不定根剪切成段,接种到液体培养基中培养获得不定根。
28.目前不定根一般是由人参愈伤组织诱导产生的,需要先诱导产生愈伤组织,再诱导产生不定根,所需的实验周期长,操作步骤复杂,污染风险较高的问题。另外,培养的人参中还存在人参皂苷含量低,难以满足临床应用需求的问题。
29.鉴于成熟人参参龄较长,成熟度高,不易再进行分化,目前还没有可以直接从成熟人参诱导不定根的报道。而本发明经过大量的试验,意外的发现在特定诱导培养基上,成熟人参切片可以直接诱导产生不定根,如此,不需要诱导愈伤组织的中间步骤,可以直接从成熟参一步诱导得到不定根,从而可以简化诱导步骤、缩短诱导时间。
30.进一步的方案,所述诱导培养基包括1
‑
6mg/l萘乙酸,0.1
‑
0.6mg/l激动素,0.2
‑
1mg/l赤霉素,0.75
‑
1.5g/l柠檬酸,0.03
‑
1g/l抗坏血酸,1
‑
4g/l b5培养基和1
‑
2.4g/l wpm培养基。
31.上述方案的诱导培养基,实现了成熟参的各个部分直接诱导产生不定根,不需要诱导愈伤组织的中间步骤,从而可以简化诱导步骤、缩短诱导时间。
32.本方案中,萘乙酸和吲哚乙酸是植物生长素,可以促进不定根形成。激动素为一种细胞分裂素,可以促进细胞的分裂。柠檬酸和抗坏血酸能够产生协同抗氧化的作用,防止成熟人参离体组织褐变,有利于从成熟参离体组织直接诱导不定根。诱导培养基中各个成分协同作用,最终实现了从成熟参的各个部分直接诱导产生不定根,而不需要诱导愈伤组织的中间步骤。
33.进一步的方案,所述诱导培养基还包括20
‑
60g/l蔗糖和1
‑
6g/l植物凝胶。
34.进一步的方案,所述诱导培养基包括4mg/l萘乙酸,0.4mg/l激动素,0.6mg/l赤霉素,0.1g/l柠檬酸,0.05g/l抗坏血酸,1.55g/l b5培养基和1.21g/l wpm培养基。
35.进一步的方案,所述诱导培养基还包括30g/l蔗糖、3g/l植物凝胶。
36.上述成分配比下的诱导培养基,对成熟参的产生不定根的诱导效果最好,产生的不定根数量多,质量好,有利于下一步扩繁,提高不定根中的活性成分含量。
37.进一步的方案,所述液体培养基为以wpm培养基、b5培养基或者以1/2ms培养基为基础培养基,含有4mg/l吲哚丁酸,0.1g/l柠檬酸,0.05g/l抗坏血酸,30g/l蔗糖。
38.本发明中,对诱导产生的不定根进行进一步的液体培养时,可以采用常规培养的培养基,如1/2ms培养基,与常用的不定根的培养基保持一致,说明通过本发明一步法诱导产生的不定根,与其他两步法无异,均可以采用常规培养基培养,同时还缩短了诱导时间,降低了污染风险。
39.进一步的方案,所述切片为宽0.5
‑
0.7cm、长0.5
‑
0.7cm和厚0.2
‑
0.5mm的薄片。
40.进一步的方案,人参不定根的培养方法,包括以下步骤:
41.(1)将成熟人参清洗消毒后,切片,接种到诱导培养基中,22
±
1℃条件下暗培养4
~5周诱导出人参不定根;
42.(2)将步骤(1)获得的人参不定根接种到和步骤(1)中相同的诱导培养基中,相同条件下暗培养4~5周;
43.(3)将步骤(2)获得的人参不定根,剪切成小段,接种到液体培养基中,22
±
1℃条件下在摇床上培养3~4周获得不定根。
44.进一步的方案,所述成熟人参的参龄为3年以上;优选的,成熟人参的参龄为6年以上。
45.作为一种优选的实施方案,所述成熟人参为百年人参。百年人参在自然界非常罕见,具有很高的食用、药用价值,可补五脏,安精神,定魂魄,止惊悸,除邪气,明目,开心益智。其价值远大于种植的参龄短的人参。本发明不需要诱导愈伤组织的中间步骤,可以直接从百年人参切块直接一步诱导获得不定根,不但可以简化诱导步骤、缩短诱导时间,还可以获得母本百年老参中特有的功能成分,从而获得营养价值更好的不定根。
46.进一步的方案,将所述成熟人参的主根部、或芦头、或艼部、或支根、或须根清洗消毒,切片,接种到诱导培养基中诱导出人参不定根。
47.进一步的方案,所述人参选自野山参,移山参,林下参,园参;
48.优选的,所述人参为野山参。
49.作为一种具体的优选实施方式,本发明的培养不定根的步骤具体包括:
50.(1)不定根的诱导
51.清洗成熟人参的主根部,消毒除菌后,切成宽0.5
‑
0.7cm、长0.5
‑
0.7cm和厚0.2
‑
0.5mm的薄片,接种到含有4mg/l萘乙酸,0.6mg/l赤霉素,0.4mg/l激动素,0.1g/l柠檬酸,0.05g/l抗坏血酸,30g/l蔗糖,3g/l植物凝胶,1.55g/l b5培养基和1.21g/l wpm培养基的诱导培养基中,22
±
1℃条件下暗培养4~5周诱导出人参不定根
52.(2)不定根的继代培养
53.将步骤(1)获得的人参不定根接种到和步骤(1)中相同的诱导培养基中,相同条件下暗培养4~5周;
54.(3)不定根的培养
55.将步骤(2)获得的人参不定根,剪切成长度为1
‑
2cm左右的组织,接种到含有4mg/l吲哚丁酸,0.1g/l柠檬酸,0.05g/l抗坏血酸,1/2ms培养基、30g/l蔗糖的液体培养基中,22
±
1℃条件下在摇床上培养3~4周获得不定根。
56.进一步的,为了提高人参不定根中人参皂苷的含量,进一步对液体培养基进行筛选优化。
57.作为一种优选的实施方式,所述的液体培养基包括:35g/l蔗糖,1.2g/l wpm培养基,1g/l n6培养基,50mg/l抗坏血酸,225mg/l柠檬酸,3mg/l吲哚丁酸。
58.作为再一种优选的实施方式,所述的液体培养基包括:45g/l蔗糖,1.28g/l b5培养基,0.905g/l 1/2ms培养基,4.2mg/l 6
‑
苄氨基腺嘌呤,3mg/l萘乙酸,0.8mg/l赤霉素,0.6mg/l吲哚乙酸,0.6mg/l吲哚丁酸。
59.作为又一种优选的实施方式,所述的液体培养基包括:35g/l蔗糖,1.35g/l wpm培养基,1g/l n6培养基,5mg/l萘乙酸,1mg/l激动素,0.5mg/l吲哚丁酸。
60.进一步的方案,本发明中的诱导培养基和液体培养基的ph为5.6
‑
6.0。
61.采用上述优选实施方式的液体培养基培养的不定根,不定根增长倍数与总皂苷含量综合最佳。
62.需要说明的是本发明中,wpm培养基、b5培养基、n6培养基、1/2ms培养基等为现有技术中已知的培养基。
63.1/2ms培养基
64.成分(mg/l):硝酸钾950,硝酸铵825,二水氯化钙220,硫酸镁185,磷酸二氢钾85,硫酸锰11.15,硫酸锌4.3,硼酸3.1,碘化钾0.415,钼酸钠0.125,硫酸铜0.0125,氯化钴0.0125,乙二胺四乙酸二钠37.3,硫酸亚铁27.8,肌醇100,甘氨酸2,盐酸0.5,盐酸吡哆醇0.5,盐酸硫铵0.1。
65.b5培养基
66.成分(mg/l):硝酸钾kno
3 2500,mgso4·
7h2o 250,cacl2·
2h2o 150,(nh4)2so
4 134,nah2po4.h2o 150,ki 0.75,h3bo
3 3.0,mnso4·
4h2o 10,znso4·
7h2o 2.0,na2moo4·
2h2o 0.25,cocl2·
6h2o 0.025,cuso4·
5h2o 0.025,na2‑
edta 37.3,feso4·
7h2o 27.8,肌醇100,烟酸1.0,盐酸吡哆醇1.0,盐酸硫铵10。
67.木本植物用培养基(wpm,woody plant medium)
68.成分(mg/l):硝酸铵400,四水硝酸钙556,硫酸钾990,无水氯化钙72,磷酸二氢钾170,二水钼酸钠0.25,无水硫酸镁180,一水合硫酸锰22.4,七水合硫酸锌8.6,五水合硫酸铜0.25,七水合硫酸亚铁27.8,乙二胺四乙酸二钠37.3,肌醇100,维生素b1 1,烟酸0.5,维生素b6 0.5,甘氨酸2,ph 5.2。
69.n6培养基(n6 medium)
70.成分(mg/l):硝酸钾2800,硫酸铵463,磷酸二氢钾400,硫酸镁(mgso4·
7h2o)185,氯化钙(cacl2·
2h2o)165,乙二胺四乙酸二钠37.3,硫酸亚铁(feso4·
7h2o)27.8,硫酸锰(mnso4·
h2o)4.4,硫酸锌(znso4·
7h2o)1.5,硼酸1.6,碘化钾0.8,维生素b1(盐酸硫胺素)1.0,维生素b6(盐酸吡哆醇)0.5,烟酸0.5,甘氨酸2.0,蔗糖20000,ph值5.8,25℃。
71.采用上述技术方案后,本发明与现有技术相比具有以下有益效果:
72.1、本发明的不定根中人参皂苷的转化方法步骤简单,易于操作,稀有皂苷转化率高。
73.2、本发明的不定根的培养方法,实现了采用一步法,将成熟人参的各部分处理后接种到诱导培养基中直接诱导出人参不定根,不需要诱导愈伤组织的中间步骤,可以简化诱导步骤、缩短诱导时间,降低污染风险。
74.3、本发明的不定根的培养方法,采用的诱导培养基包括1
‑
6mg/l萘乙酸,0.1
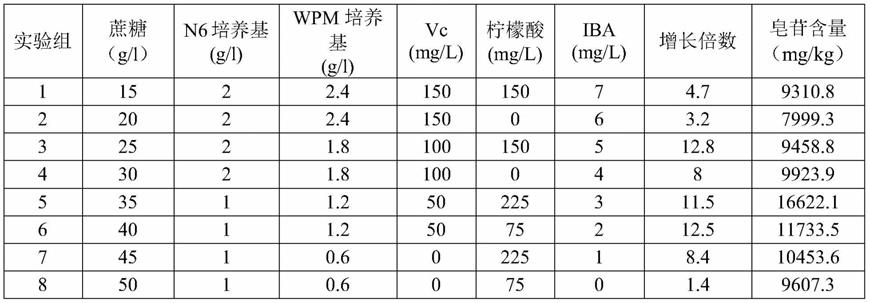
‑
0.6mg/l激动素,0.2
‑
1mg/l赤霉素,0.75
‑
1.5g/l柠檬酸,0.03
‑
1g/l抗坏血酸,20
‑
60g/l蔗糖,1
‑
6g/l植物凝胶,1
‑
4g/l b5培养基和1
‑
2.4g/l wpm培养基,各个成分协同作用,解决了一步法从成熟参直接诱导不定根的问题,产生的不定根数量多。
75.下面结合附图对本发明的具体实施方式作进一步详细的描述。
附图说明
76.附图作为本发明的一部分,用来提供对本发明的进一步的理解,本发明的示意性实施例及其说明用于解释本发明,但不构成对本发明的不当限定。显然,下面描述中的附图
仅仅是一些实施例,对于本领域普通技术人员来说,在不付出创造性劳动的前提下,还可以根据这些附图获得其他附图。在附图中:
77.图1是采用本发明实施例1诱导培养基诱导不定根的示意图;
78.图2是采用对比例1的诱导培养基诱导不定根的示意图。
具体实施方式
79.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对实施例中的技术方案进行清楚、完整地描述,以下实施例用于说明本发明,但不用来限制本发明的范围。
80.实施例1
81.(1)不定根的诱导
82.将20年龄的野山参,去掉芦头,艼部,主根部清洗、消毒除菌后,切成宽0.6cm、长0.7cm和厚0.3mm的薄片,接种到诱导培养基中,22
±
1℃条件下暗培养4~5周诱导出山参不定根;其中,诱导培养基包括4mg/l萘乙酸,0.6mg/l赤霉素,0.4mg/l激动素,0.1g/l柠檬酸,0.05g/l抗坏血酸,30g/l蔗糖、3g/l植物凝胶,1.55g/l b5培养基和1.21g/l wpm培养基,ph值为5.8。
83.(2)不定根的继代培养
84.将步骤(1)获得的山参不定根接种到与步骤(1)中相同的诱导培养基中,相同条件下暗培养4~5周;
85.(3)不定根的培养
86.将步骤(2)获得的山参不定根,剪切成长度为1cm左右的组织,接种到液体培养基中,22
±
1℃条件下在摇床上培养3~4周获得不定根;其中,液体培养基为含有4mg/l吲哚丁酸,0.1g/l柠檬酸,0.05g/l抗坏血酸,1/2ms培养基和30g/l蔗糖,ph值为5.8。本实施例中,步骤(1)中诱导培养基上产生的不定根如图1所示,其中,a为培养1周的照片,b为培养3周的照片,c为培养5周的照片。可见,5周后,成熟野山参切片上直接诱导产生了不定根。
87.实施例2
88.(1)不定根的诱导
89.将6年龄的园参的芦头清洗、消毒除菌后,切成宽0.5cm、长0.6cm和厚0.3mm的薄片,接种到诱导培养基中,22
±
1℃条件下暗培养4~5周诱导出不定根;其中,诱导培养基包括6mg/l萘乙酸,0.2mg/l赤霉素,0.4mg/l激动素,1.2g/l柠檬酸,0.1g/l抗坏血酸,20g/l蔗糖、5g/l植物凝胶,4g/l b5培养基和1.8g/l wpm培养基,ph值为5.6。
90.(2)不定根的继代培养
91.将步骤(1)获得的不定根接种到与步骤(1)中相同的诱导培养基中,相同条件下暗培养4~5周;
92.(3)不定根的培养
93.将步骤(2)获得的不定根,剪切成长度为1cm左右的组织,接种到液体培养基中,22
±
1℃条件下在摇床上培养3~4周获得不定根;其中,液体培养基为含有4mg/l吲哚丁酸,0.1g/l柠檬酸,0.05g/l抗坏血酸,1/2ms培养基和30g/l蔗糖,ph值为5.6。
94.与实施例1结果类似,本实施例步骤(1)中可以一步诱导产生不定根。
95.实施例3
96.(1)不定根的诱导
97.将10年龄的林下参的艼部清洗、消毒除菌后,切成宽0.7cm、长0.7cm和厚0.5mm的薄片,接种到诱导培养基中,22
±
1℃条件下暗培养4~5周诱导出不定根;其中,诱导培养基包括5mg/l萘乙酸,1mg/l赤霉素,0.1mg/l激动素,0.75g/l柠檬酸,0.03g/l抗坏血酸,40g/l蔗糖,4g/l植物凝胶,2g/l b5培养基和1g/l wpm培养基,ph值为6.0。
98.(2)不定根的继代培养
99.将步骤(1)获得的不定根接种到与步骤(1)中相同的诱导培养基中,相同条件下暗培养4~5周;
100.(3)不定根的培养
101.将步骤(2)获得的不定根,剪切成长度为2cm左右的组织,接种到液体培养基中,22
±
1℃条件下在摇床上培养3~4周获得不定根;其中,液体培养基为含有4mg/l吲哚丁酸,0.1g/l柠檬酸,0.05g/l抗坏血酸,wpm培养基和30g/l蔗糖,ph值为6.0。
102.与实施例1结果类似,本实施例步骤(1)中可以一步诱导产生不定根。
103.实施例4
104.(1)不定根的诱导
105.将15年龄的移山参的主根部清洗、消毒除菌后,切成宽0.5cm、长0.6cm和厚0.4mm的薄片,接种到诱导培养基中,22
±
1℃条件下暗培养4~5周诱导出山参不定根;其中,诱导培养基包括1mg/l萘乙酸,0.5mg/l赤霉素,0.6mg/l激动素,1.5g/l柠檬酸,1g/l抗坏血酸,50g/l蔗糖、6g/l植物凝胶,1g/l b5培养基和2.4g/l wpm培养基,ph值为5.7。
106.(2)不定根的继代培养
107.将步骤(1)获得的山参不定根接种到与步骤(1)中相同的诱导培养基中,相同条件下暗培养4~5周;
108.(3)不定根的培养
109.将步骤(2)获得的山参不定根,剪切成长度为1cm左右的组织,接种到液体培养基中,22
±
1℃条件下在摇床上培养3~4周获得不定根;其中,液体培养基为含有4mg/l吲哚丁酸,0.1g/l柠檬酸,0.05g/l抗坏血酸,b5培养基和30g/l蔗糖,ph值为5.7。
110.与实施例1结果类似,本实施例步骤(1)中可以一步直接诱导产生不定根。
111.实施例5
112.(1)不定根的诱导
113.将百年野山参,去掉芦头,艼部,主根部清洗、消毒除菌后,切成宽0.6cm、长0.7cm和厚0.3mm的薄片,接种到诱导培养基中,22
±
1℃条件下暗培养4~5周诱导出山参不定根;其中,诱导培养基包括4mg/l萘乙酸,0.6mg/l赤霉素,0.4mg/l激动素,0.1g/l柠檬酸,0.05g/l抗坏血酸,30g/l蔗糖、3g/l植物凝胶,1.55g/l b5培养基和1.21g/l wpm培养基,ph值为5.8。
114.(2)不定根的继代培养
115.将步骤(1)获得的山参不定根接种到与步骤(1)中相同的诱导培养基中,相同条件下暗培养4~5周;
116.(3)不定根的培养
117.将步骤(2)获得的山参不定根,剪切成长度为1cm左右的组织,接种到液体培养基
中,22
±
1℃条件下在摇床上培养3~4周获得不定根;其中,液体培养基为含有4mg/l吲哚丁酸,0.1g/l柠檬酸,0.05g/l抗坏血酸,1/2ms培养基和30g/l蔗糖,ph值为5.8。
118.与实施例1结果类似,本实施例步骤(1)中可以一步直接诱导产生不定根。
119.对比例1
120.本对比例与实施例1的区别在于采用的诱导培养基不同,其他的步骤均参照实施例1实施。本对比例的诱导培养包括:30g/l蔗糖,0.5mg/l激动素,3mg/l吲哚丁酸,1.5mg/l 2,4
‑
二氯苯氧乙酸,1/2ms培养基,3g/l植物凝胶,ph值为5.8。
121.本对比例步骤(1)中诱导培养基上产生的不定根如图2所示,其中,a为培养1周的照片,b为培养3周的照片,c为培养5周的照片。可见,5周后,采用对比例1的培养基无法从成熟野山参切片上直接诱导产生不定根。
122.对比例2
123.本对比例与实施例1的区别在于采用的诱导培养基不同,其他的步骤均参照实施例1实施。本对比例的诱导培养包括:30g/l蔗糖,0.5mg/l激动素,3mg/l吲哚丁酸,1/2ms培养基,3g/l植物凝胶,ph值为5.8。
124.结果,与对比例1图片展示类似,无法从成熟野山参切片上直接诱导产生不定根。
125.对比例3
126.本对比例与实施例1的区别在于采用的诱导培养基不同,其他的步骤均参照实施例1实施。本对比例的诱导培养包括:30g/l蔗糖,0.5mg/l激动素,3mg/l吲哚乙酸,wpm,3g/l植物凝胶,ph值为5.8。结果:第一周,通体颜色变黄,第三周,颜色加深,中部开始变成褐色,第五周,全部变成褐色,并呈干枯状。
127.试验例1液体培养基的筛选
128.为了提高人参不定根中人参皂苷的含量,进一步对液体培养基进行筛选优化。
129.本试验例的培养方法参照实施例1的方法,区别在于将实施例1中液体培养基替换为下述的本试验例的多种液体培养基,并检测人参不定根中的人参皂苷含量。
130.其中,人参不定根中人参皂苷的检测方法包括:
131.(1)原理
132.试样经提取等前处理后,经c18色谱柱分离,高效液相色谱
‑
紫外检测器检测,外标法定量测定人参皂苷各组分的含量。
133.(2)试剂
134.甲醇(ch4o):色谱纯
ꢀꢀ
乙腈(c6h
11
n):色谱纯
135.(3)分析步骤
136.取混合均匀的试样约6g(精确至0.01g),于150ml研钵中研细,转移到50ml离心管中,加入10ml水混匀,于超声波细胞粉碎机上400w破壁3分钟,在
‑
18℃的冰箱中冷冻3小时。于冻干机冻干48小时,直至杯体外面没有水珠为止。
137.样品在研钵上研细,准确称取50mg于10ml离心管中,加入70%甲醇溶液,涡旋。于超声振荡器上超声10分钟,重复两次,过滤备用。
138.(4)仪器参考条件
139.a)色谱柱:c18柱,柱长150mm,柱内径4.6mm,柱填料粒径5μm,或相当者;
140.b)流动相:a:乙腈,b:水过0.45μm微孔滤膜过滤;
141.c)流速:0.7ml/min;梯度洗脱程序:0~13min,23%~46%乙腈,体积流量0.7ml/min;13~33min,46~68%乙腈,体积流量0.7ml/min;33~46.5min,68~85%乙腈,体积流量0.7ml/min;
142.d)柱温:30℃;
143.e)检测波长:203nm;
144.f)进样体积:10μl。
145.(5)分析结果的表述
146.试样中人参皂苷各组分的含量按式(1)计算:
[0147][0148]
式中:
[0149]
x——试样中人参皂苷各组分的含量,单位为毫克每千克(mg/kg)或毫克每升(mg/l);
[0150]
a1——试样中人参皂苷各组分的峰面积
[0151]
a2——标准品中人参皂苷各组分的峰面积
[0152]
ρ——标准品中人参皂苷各组分的浓度(ug/ml)
[0153]
v——试样溶液的最终定容体积,单位为毫升(ml);
[0154]
m——试样质量,单位为克(g);
[0155]
试样中人参皂苷的含量是将检测的各组分相加得到的总和。
[0156]
增长倍数的计算方式如下:
[0157]
增长倍数=生长结束后的不定根的重量/接种的不定根种子的重量。
[0158]
1、液体培养基一
[0159]
液体培养基一包括:15
‑
50g/l蔗糖,0.6
‑
2.4g/l wpm培养基,1
‑
2g/l n6培养基,0
‑
150mg/l抗坏血酸(vc),0
‑
225mg/l柠檬酸,0
‑
7mg/l吲哚丁酸(iba),ph值为5.8。
[0160]
表1
[0161][0162]
由上表1中可以看出,采用实验组5
‑
7的配比的液体培养基一,不定根的增长倍数较高,检测的皂苷的总量较高,其中,实验组5获得的不定根的增长倍数和皂苷含量综合最佳。
[0163]
2、液体培养基二
[0164]
液体培养基二包括:10
‑
55g/l蔗糖,0.3
‑
1.2g/l 1/2ms培养基,0.6
‑
1.6g/l b5培
养基,0
‑
5.4mg/l吲哚乙酸(iaa),0
‑
5.4mg/l吲哚丁酸(iba),0
‑
5.4mg/l萘乙酸(naa),0
‑
5.4mg/l 6
‑
苄氨基腺嘌呤(6ba),0
‑
8mg/l赤霉素(ga),ph值为5.8。。
[0165]
表2
[0166][0167]
由上表2中可以看出,采用实验组4和6的配比的液体培养基二,不定根的增长倍数较高,检测的皂苷的总量较高,其中,实验组4获得的不定根的增长倍数和皂苷含量综合最佳。
[0168]
3、液体培养基三
[0169]
液体培养基三包括:35g/l蔗糖,1.35g/l wpm培养基,1g/l n6培养基,0
‑
1.8mg/l吲哚丁酸(iba),1
‑
6mg/l萘乙酸(naa),0.2
‑
1.2mg/l激动素(kt),ph值为5.8。
[0170]
表3
[0171][0172][0173]
由上表3中可知,在蔗糖,wpm,n6的使用量在确定数值的基础上,考察植物激素iba、naa、kt在不同添加量时对不定根产量和皂苷含量的影响,从而选择合适的植物激素及配比。从表中可以看出,实验组4、7
‑
8、10
‑
12以及15
‑
18的组方下,不定根增长倍数与总皂苷含量较好,其中,按照实验组12的条件下获得了不定根增长倍数与总皂苷含量综合最佳值。
[0174]
实施例6
[0175]
本实施例提供一种人参不定根中皂苷的转化方法,具体包括以下步骤:
[0176]
(1)取通过本发明实施例1的培养方法制备得到的山参不定根,用清水冲洗3遍,剪切至1
‑
2cm的小段,将小段置于研钵中,加适量水,研磨1
‑
2分钟,研磨至80%以上研碎,按重量均分成等量的六组,一组为对照组,不做任何处理,另外五组为实验组1
‑
5。
[0177]
(2)将实验组1
‑
5分别按照表4中的条件进行处理,具体为:将na2co3溶液加入到准备好的不定根中,使各实验组中na2co3浓度不同,升温至设定温度(℃),保温设定时间(min),然后降温到室温,再重复升温、保温和降温的过程,重复设定次数。
[0178]
例如,实验组1中,na2co3溶液加入到研磨后的不定根中,样品中na2co3的浓度为1m na2co3,8ml/l(相当于8mmol/l);升温至设定温度85℃,保温60min,然后降温到室温,再重复升温、保温和降温的过程,重复2次。其他实验组类似。
[0179]
(3)处理样品,采用试验例1中的方法检测人参皂苷的含量。
[0180]
处理样品的方法包括:将处理后的样品转移到50ml离心管中,加入10ml水混匀,于超声波细胞粉碎机上400w破壁3分钟,在
‑
18℃的冰箱中冷冻3小时。于冻干机冻干48小时,直至杯体外面没有水珠为止。
[0181]
样品在研钵上研细,准确称取50mg于10ml离心管中,加入70%甲醇溶液,涡旋。于超声振荡器上超声10分钟,重复两次,过滤备用。
[0182]
表4
[0183][0184]
由上表中可知,实验组4的样品中,na2co3浓度为:1m的na2co3,2ml/l,升温至115℃,保温30min,降温后再重复处理4次,此种方式综合得到的转化皂苷最多,效果最好。该种方式中添加的为na2co3,可以避免碱污染,有利于保护环境,简便快捷,同时得到的稀有皂苷rh2的含量高。
[0185]
以上所述仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本专利的技术人员在不脱离本发明技术方案范围内,当可利用上述提示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1