利用搭桥技术防止植物愈伤褐化和胶状物形成的有效方法
1.本发明涉及生物技术领域,尤其涉及防止植物愈伤褐化和胶状物形成的有效方法。
背景技术:
2.植物组织培养是指利用植物细胞的全能性原理,在无菌条件下,将离体的植物器官(根、茎、叶、花、果实、种子),组织、细胞、原生质体等,在配制好的培养基上培养,使其长出完整植株。由于培养是脱离植物母体的培养物,也称为离体培养。目前植物组织培养技术应用广泛,最有效的一个方面是进行植物脱毒及离体快繁。通过该技术可以保持优良品种,提高产量,而且具有比常规繁殖方法快数十万倍的速度繁殖优势,对增收、规模化生产以及推动我国农业生产发展具有重要意义。
3.本方法通过对以下三种植物进行实验:
4.野生稻是栽培稻的原始祖先,长期生长在野外经受了各种逆境胁迫的选择,遗传多样性丰富,保存有大量栽培稻不具有或已经消失了优异基因,具有重要的学术价值和经济价值。其中药用野生稻(oryza officinalis wall.ex wstt)是最具有研究价值的资源。
5.药用野生稻为多年生禾本科植物,具有超大穗、超宽叶片、超粗茎秆、抗虫抗病及抗逆能力非常强,其基因组、基因型和栽培稻、普通野生稻的差异很大。由于其特殊性,如果发掘利用,对水稻育种和生产将会取得突破性进展。然而在组培中愈伤褐化严重、胶状物分泌过多,阻碍了分化的形成,这是亟待解决的首要问题。
6.山药(dioscoreae rhizoma)为薯蓣科薯蓣属中能形成地下肉质块茎的栽培种,一年生或多年生缠绕性藤本植物,别名淮山、怀山药等。山药是一种药食兼用的高产、高效经济作物,目前薯蓣在国内外需求量不断增加,使山药生产开发供不应求。长期以来繁殖采用块茎切段方式,块茎切开伤口出现严重褐化和分泌出较多的粘性胶状物,并且出现品质退化、品种变异,产量降低。利用组培快繁技术培养中同样出现的褐化和粘性胶状物的问题一直以来没有得到有效解决。
7.近年来花卉组织培养及快繁脱毒技术越来越多地应用于花卉种苗繁殖生产中,国外花卉组培苗,产业化生产得到了较快发展,世界各国竞相投资,世界最大的花卉王国荷兰,其花卉种苗的组织培养已相当普及,在无性繁殖的花卉种苗中,80%以上是通过组培繁殖。国内花卉组培苗产业化,现已处于国际领先水平,开发利用实现了规模化、产业化。
8.蓝星花(evolvulus nuttallianus)为旋花科、蓝星花属多年生半蔓性常绿灌木,原产美洲,我国各地均有栽培。蓝星花植株清新,花色雅致,花期全年,适合庭院美化,盆栽,也可用于花坛布置或做地被植物。在组培诱导愈伤中,最棘手的问题也是愈伤褐化和胶状物的形成,得不到控制,抑制了愈伤的出愈率,使苗的分化过低。
9.组织培养的目的在于利用生物技术手段快速获得大量规模化的组培苗,然而要获得大量分化苗与愈伤诱导率、愈伤增殖率以及愈伤质量好坏和数量的多少密切相关。要获得优质愈伤必须首先解决在愈伤诱导中出现的褐化和胶状物。过去曾有学者对组培中植物
出现褐化进行过研究,采取方法:例如:水洗、多次转移培养基或在培养基中添加吸附剂和抗氧化剂(活性炭、维生素c、亚硫酸钠、聚乙烯比咯烷酮)等化学试剂。鲁旭东于1999年就植物培养中褐化的发生与防治进行了简单阐述(鲁旭东,植物组织培养中褐变的发生及防止,农业与科技,1999年8月第4期)。于清章等1998年利用几种防褐变剂对去皮切片马铃薯进行处理,取得一定防褐效果(于清章等.几种防褐变剂对去皮切片马铃薯贮藏的影响.长江蔬菜,1998,11:25)。王东霞等于2002年就如何对花卉组织培养中的褐变进行阐述(王东霞.如何对抗植物组培中的组织褐变.中国花卉盆景,2002.12)。同时也有学者在山药组织培养中的褐化现象做过去褐化处理,均有一定效果。以上列举主要添加化学试剂来抑制褐化,在诱导愈伤采用添加化学试剂方法抑制褐化的同时,也同样抑制了出愈率及愈伤增殖率,更严重抑制了后期的分化成苗率,当弊大于利时,只能寻找更好的方法。曾经采用水洗愈伤或更换培养基方法,暂时抑制外植体褐化,培养几天后甚至褐化更严重,胶状物疯狂长满整个培养瓶。通过查阅相关资料,在野生稻和其它植物组培方面,愈伤诱导应用物理手段有效控制和防止愈伤褐化形成方面,未见报道。在胶状物的有效控制方面未曾提及和报道过。
技术实现要素:
10.本发明的目的在于克服了植物愈伤诱导、愈伤增殖出现的严重褐化和胶状物形成的棘手难题,提出一种不添加任何化学试剂,而是利用搭桥技术物理手段有效防止愈伤褐化和胶状物形成的方法。
11.术语:胶状物是一种不溶于水带粘性的透明的像凝胶的一种物质。
12.本发明提供的利用搭桥技术防止植物愈伤褐化和胶状物形成的有效方法,包括以下步骤:
13.(1)外植体无菌处理;外植体经无菌处理后放入超净工作台备用;
14.(2)植物凝胶液的配制:按3g植物凝胶溶于1000ml蒸馏水的比例将植物凝胶溶于蒸馏水中得到植物凝胶液,按每瓶装40ml植物凝胶液分装于玻璃瓶中,高温灭菌,备用;
15.(3)无菌滤纸的装配:将无菌滤纸铺在步骤(2)中经高温灭菌装有植物凝胶液的玻璃瓶中的植物凝胶液表面得到装有植物凝胶液并铺有无菌滤纸的玻璃瓶,备用;
16.(4)植物叶片无菌处理:剪取步骤(1)所述外植体的叶片进行灭菌处理,植物叶片的无菌处理现用现灭菌处理;
17.(5)配制1号、2号、3号固定液:
18.1号固定液:ms+2,4
‑
d 5mg/l+蔗糖30%,ph 5.8
‑
6.0;
19.2号固定液:ms+2,4
‑
d4mg/l+蔗糖30%,ph 5.8
‑
6.0;
20.3号固定液:ms+2,4
‑
d6mg/l+蔗糖30%,ph 5.8
‑
6.0;
21.(6)防止愈伤褐化和胶状物形成的第一阶段愈伤诱导培养:先将1号固定液加入步骤(3)装有植物凝胶液并铺有无菌滤纸的液玻璃瓶中,再接入步骤(1)中所述的经无菌处理的外植体,置于27~28℃,暗培养30~40天;
22.(7)防止愈伤褐化和胶状物形成的第二阶段愈伤诱导培养:将2号固定液加入步骤(3)新的装有植物凝胶液并铺有无菌滤纸的玻璃瓶中,再接入步骤(6)第一阶段愈伤诱导培养的材料,置于27~28℃,暗培养35~40天;
23.(8)防止愈伤褐化和胶状物形成的第三阶段愈伤诱导培养:将3号固定液加入步骤
(3)新的装有植物凝胶液并铺有无菌滤纸的玻璃瓶中,再接入步骤(7)第二阶段愈伤诱导培养的材料,置于27~28℃,暗培养35天;
24.(9)防止愈伤褐化和胶状物形成的第四阶段愈伤增殖培养:将3号固定液加入步骤(2)中经高温灭菌装有植物凝胶液的玻璃瓶中,摇匀,再在其玻璃瓶内液体表面铺满步骤(4)中所述的经无菌处理的植物叶片,并将步骤(8)第三阶段愈伤诱导培养的材料接入该玻璃瓶内植物叶片上,置于27~28℃,1000lx弱光培养,光照周期12~16小时/每天,每14~15天按前述方法同时更换3号固定液、经无菌处理的植物叶片和植物凝胶液一次,共培养56~60天;
25.(10)增殖愈伤筛选:经过步骤(9)的56~60天培养后,挑选出颗粒状的愈伤和或分化出的小芽作为分化材料;
26.上述所有步骤全部都是在无菌条件下完成。
27.进一步,步骤(6)的第一阶段愈伤诱导培养中1号固定液加入量为每40ml植物凝胶液加入30ml 1号固定液。
28.进一步,步骤(7)的第二阶段愈伤诱导培养中2号固定液加入量为每40ml植物凝胶液加入30ml 2号固定液。
29.进一步,步骤(8)的第三阶段愈伤诱导培养中3号固定液加入量为每40ml植物凝胶液加入30ml 3号固定液。
30.进一步,步骤(9)的第四阶段愈伤增殖培养中3号固定液加入量为每40ml植物凝胶液加入30ml 3号固定液。
31.进一步,步骤(9)中所铺的植物叶片的厚度为2~3cm。
32.进一步,步骤(1)中所述的外植体为药用野生稻茎段、幼嫩紫山药带芽点茎段或蓝星花茎段。
33.进一步,步骤(6)的第一阶段愈伤诱导培养中接入的外植体为药用野生稻茎段时,将药用野生稻茎段切成长0.5~1cm再接入;接入的外植体为幼嫩紫山药带芽点茎段时,将幼嫩紫山药带芽点茎段被氧化的茎段表面切掉,再切成长1~1.5cm后再接入;接入的外植体为蓝星花茎段时,将蓝星花茎段剪成长2~3cm茎段再接入。
34.与现有技术相比,本发明有以下有益效果:
35.本发明方法不添加任何化学试剂,而是采用物理手段、通过三个阶段的滤纸法,避免了愈伤组织直接接触培养基,愈伤组织分泌出胶状物被铺垫的滤纸吸附,减少了愈伤分泌出的物质对培养基的污染,就减少了褐化,解决了长期以来植物诱导愈伤易出现褐化和胶状物形成的困扰,严重抑制愈伤出愈率和愈伤增殖率的难题,愈伤诱导率大幅度提高。同时通过第四阶段利用外植体自身的叶片(叶片法),提供了自身相同的营养,模拟了植物培养的一个小立体微循环生长环境,减少了实验材料脱离母体的不适应性,提高了愈伤增殖效率、增殖质量收到异常好的效果。本发明方法适合极易出现褐化、分泌胶状物质的培养材料。培养过程中无需添加任何化学试剂和诱变剂,无毒、无害,不会造成环境污染。本发明方法在短期内实现并满足了规模化生产所需的分化前所需要的优质的和大量的基础愈伤材料,为分化前提供了强有力的技术支持。
具体实施方式
36.实施例1防止药用野生稻愈伤褐化和胶状物形成实验
37.以下所有步骤全部都是在无菌条件下完成。
38.(1)外植体无菌处理;选择药用野生稻茎段为外植体,将药用野生稻茎段用自来水冲洗10min,用无菌蒸馏水洗一遍,再用体积百分比75%乙醇对其表面灭菌30s,然后倒掉所述乙醇,加入5%体积百分比的次氯酸钠溶液灭菌5min,然后倒掉所述次氯酸钠溶液,无菌水洗一遍,然后倒掉无菌水,再用质量百分比0.1%hgcl2溶液灭菌8min,然后倒掉所述hgcl2溶液,无菌蒸馏水洗5遍,用吸水纸吸干其表面水分,放入超净工作台备用。
39.(2)植物凝胶液的配制:称取3g植物凝胶溶于1000ml蒸馏水中得到植物凝胶液,按每瓶装40ml植物凝胶液分装在瓶口直径为6cm,瓶高10.5cm玻璃瓶中,121℃高温灭菌20min,备用。
40.(3)无菌滤纸的装配:将无菌7cm中速滤纸铺在步骤(2)中经高温灭菌装有植物凝胶液的玻璃瓶中的植物凝胶液表面得到装有植物凝胶液并铺有无菌滤纸的玻璃瓶,待用。
41.(4)植物叶片无菌处理:剪取步骤(1)所述药用野生稻的叶片进行灭菌处理,自来水冲洗药用野生稻叶片15min,用体积百分比75%乙醇对其表面灭菌30s,然后倒掉所述乙醇,再用质量百分比0.1%hgcl2溶液灭菌10min,然后倒掉所述次氯酸钠溶液,无菌蒸馏水洗7遍,用吸水纸吸干其表面水分,剪成长2~3cm叶片片段,放置于无菌瓶中,备用,所述药用野生稻叶片的无菌处理现用现灭菌处理。
42.(5)配制1号、2号、3号固定液:
43.1号固定液:ms+2,4
‑
d 5mg/l+蔗糖30%,ph 5.8
‑
6.0;
44.2号固定液:ms+2,4
‑
d 4mg/l+蔗糖30%,ph 5.8
‑
6.0;
45.3号固定液:ms+2,4
‑
d 6mg/l+蔗糖30%,ph 5.8
‑
6.0;
46.1号固定液配制:分别称取ms 4.43g和蔗糖30g溶于一定量的蒸馏水中,加入2,4
‑
d5mg/l,摇匀,用蒸馏水定容在1000ml三角瓶中,调ph值在5.8
‑
6.0之间,放在高压灭菌锅中,121℃灭菌20min,取出,自然冷却,备用。
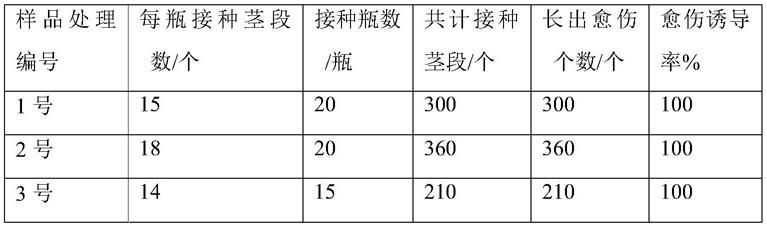
47.2号固定液配制:分别称取ms 4.43g和蔗糖30g溶于一定量的蒸馏水中,加入2,4
‑
d4mg/l,摇匀,用蒸馏水定容在1000ml三角瓶中,调ph值在5.8
‑
6.0之间,放在高压灭菌锅中,121℃灭菌20min,取出,自然冷却,备用。
48.3号固定液配制:分别称取ms 4.43g和蔗糖30g溶于一定量的蒸馏水中,加入2,4
‑
d6mg/l,摇匀,用蒸馏水定容在1000ml三角瓶中,调ph值在5.8
‑
6.0之间,放在高压灭菌锅中,121℃灭菌20min,取出,自然冷却,备用。
49.(6)防止愈伤褐化和胶状物形成的第一阶段愈伤诱导培养:先将1号固定液加入步骤(3)中所述的装有植物凝胶液并铺有无菌滤纸的玻璃瓶中无菌滤纸的表面,1号固定液加入量为每40ml植物凝胶液加入30ml 1号固定液,再接入步骤(1)中所述的经无菌处理的药用野生稻茎段切成长0.5
‑
1cm的茎段,每瓶接入20个茎段,接30瓶,共接种600个茎段,置于28℃,暗培养30天后,茎段长出透明白点。同时茎段褐化严重,在植物凝胶液上第一次铺的无菌滤纸中间变成深褐色,滤纸边缘变成浅褐色,胶状物粘在滤纸表面。〔步骤(6)中植物凝胶液上铺的无菌滤纸称为第一次铺的无菌滤纸,以下其它实施例中相同〕。
50.(7)防止愈伤褐化和胶状物形成的第二阶段愈伤诱导培养:将2号固定液加入步骤
(3)新的装有植物凝胶液并铺有无菌滤纸的玻璃瓶中无菌滤纸的表面(即另一瓶没有使用过的只装有植物凝胶液并铺有无菌滤纸的玻璃瓶),2号固定液加入量为每40ml植物凝胶液加30ml2号固定液,再接入步骤(6)防止愈伤褐化和胶状物形成的第一阶段愈伤诱导培养中培养已长出透明白点茎段材料,置于28℃,暗培养40天后,茎段长出愈伤,白色透明凸起点增多,开始统计愈伤出愈率。长出的愈伤经过滤纸第二次吸附变成透明浅褐色,在植物凝胶液上第二次铺的无菌滤纸中间变成浅褐色,滤纸边缘变成姜黄色,胶状物粘在滤纸表面。〔步骤(7)中植物凝胶液上铺的无菌滤纸称为第二次铺的无菌滤纸,以下其它实施例中相同〕。
51.(8)防止愈伤褐化和胶状物形成的第三阶段愈伤诱导培养:将3号固定液加入步骤(3)新的装有植物凝胶液并铺有无菌滤纸的玻璃瓶中无菌滤纸的表面(即另一瓶没有使用过的只装有植物凝胶液并铺有无菌滤纸的玻璃瓶),3号固定液加入量为每40ml植物凝胶液加30ml3号固定液,再接入步骤(7))防止愈伤褐化和胶状物形成的第二阶段愈伤诱导培养中培养的已经长出的愈伤和透明白点材料,置于28℃,暗培养35天后,在植物凝胶液上第三次铺的无菌滤纸中间变成浅黄色,滤纸边缘淡黄色,愈伤经过三次的纸桥滤纸吸附,愈伤透明、浅黄色,愈伤出愈率大部分长出,愈伤白色凸起点增多增大,少量胶状物粘在滤纸表面,此时的愈伤用来增殖培养效果最好。〔步骤(8)中植物凝胶液上铺的无菌滤纸称为第三次铺的无菌滤纸,以下其它实施例中相同〕。
52.(9)防止愈伤褐化和胶状物形成的第四阶段愈伤增殖培养:将3号固定液加入步骤(2)中经高温灭菌装有植物凝胶液的玻璃瓶中摇匀,3号固定液加入量为每40ml植物凝胶液加入30ml 3号固定液,再在所述玻璃瓶内液体表面铺满步骤(4)中所述的经无菌处理的药用野生稻叶片,所铺的药用野生稻叶片的厚度为2~3cm,并将步骤(8)防止愈伤褐化和胶状物形成的第三阶段愈伤诱导培养中培养的愈伤材料接入瓶内最上层所述药用野生稻叶片上,置于28℃,1000lx弱光培养,光照周期12小时/每天,每15天按前述方法同时更换3号固定液、经无菌处理的药用野生稻叶片和植物凝胶液一次,共培养60天后,愈伤大幅增多,愈伤颗粒紧实,愈伤颜色淡绿。
53.每15天按前述方法同时更换3号固定液、经无菌处理的植物叶片和植物凝胶液一次的具体操作:每15天将瓶内培养的愈伤材料接种到新的装有3号固定液和植物凝胶液并铺有经无菌处理的植物叶片的玻璃瓶中最上层植物叶片上,所述新的装有3号固定液和植物凝胶液并铺有经无菌处理的植物叶片的玻璃瓶是将3号固定液加入步骤(2)中新的经高温灭菌装有植物凝胶液的玻璃瓶中摇匀,3号固定液加入量为每40ml植物凝胶液加入30ml 3号固定液,再在玻璃瓶内液体表面铺满步骤(4)中所述的新的经无菌处理的植物叶片,新铺的植物叶片的厚度为2~3cm。
54.(10)增殖愈伤筛选:经过步骤(9)60天愈伤增殖后,愈伤组织干净,此时挑选出紧实颗粒状,颜色呈淡绿的愈伤作为分化材料。
55.经统计:实施例1接种600个茎段,共长出598个愈伤。
56.对照1
57.对照1是不铺滤纸和不铺垫植物叶片的愈伤培养。对照1除以下具体操作不同外,其余步骤与实施例1相同。
58.省略步骤(3)无菌滤纸的装配:即在步骤(2)中装有植物凝胶液的玻璃瓶不铺无菌
7cm中速滤纸。
59.省略(4)植物叶片无菌处理。
60.在步骤(6)防止愈伤褐化和胶状物形成的第一阶段愈伤诱导培养中、步骤(7)防止愈伤褐化和胶状物形成的第二阶段愈伤诱导培养中、步骤(8)防止愈伤褐化和胶状物形成的第三阶段愈伤诱导培养中,对应的装有植物凝胶液的玻璃瓶内均没有铺无菌7cm中速滤纸。
61.在步骤(6)防止愈伤褐化和胶状物形成的第一阶段愈伤诱导培养中、每瓶接入药用野生稻茎段切成长0.5
‑
1cm的茎段20个,接种15瓶,共计接种300个茎段,置于28℃,暗培养35天后,茎段长出透明白点。
62.在步骤(7)防止愈伤褐化和胶状物形成的第二阶段愈伤诱导培养中43天开始统计愈伤出愈率,直到所有愈伤全部长出。
63.在步骤(9)防止愈伤褐化和胶状物形成的第四阶段愈伤增殖培养中,在装有3号固定液和植物凝胶液摇匀的玻璃瓶内液体表面不铺垫经无菌处理的药用野生稻叶片。
64.经统计:对照1,接种300个茎段,共长出愈伤8个。
65.对照1中由于步骤(6)防止愈伤褐化和胶状物形成的第一阶段愈伤诱导培养、步骤(7)防止愈伤褐化和胶状物形成的第二阶段愈伤诱导培养、步骤(8)防止愈伤褐化和胶状物形成的第三阶段愈伤诱导培养均没有铺垫无菌7cm中速滤纸,让愈伤正常生长,结果胶状物长满整个培养瓶,并且愈伤严重褐化,愈伤颗粒小,愈伤无法继续增殖培养,此方法不可取。
66.愈伤诱导率:实际诱导出的愈伤数
÷
实际接种的外植体数
×
100%。
67.实施例1的愈伤诱导率为:598个愈伤
÷
600个外植体茎段
×
100%=99.7%。
68.对照1的愈伤诱导率为:8个愈伤
÷
300个外植体茎段
×
100%=2.7%。
69.结果:铺垫三次滤纸防止愈伤褐化和胶状物的形成的愈伤诱导率为:99.7%;不铺垫滤纸进行愈伤诱导培养的愈伤诱导率为:2.7%。
70.实施例2 防止紫山药愈伤褐化和胶状物形成实验
71.实施例2除以下具体操作不同外,其余步骤与实施例1相同。
72.步骤(1)外植体无菌处理:选择栽种的1号、2号、3号三个样品的紫山药长至长度10~15cm,直径为1~2cm的幼嫩紫山药带芽点茎段为外植体,分别将1号、2号、3号三个紫山药样品的外植体弃掉须根,用清水洗掉泥土,切成2cm长的茎段,再用洗洁精洗5min,自来水冲洗30min,再用蒸馏水漂洗一次,用75%(体积百分比)乙醇对其进行表面灭菌1
‑
2min,加入0.3%(质量百分比)kmno4溶液灭菌30min然后倒掉所述kmno4溶液,再用相同浓度kmno4溶液灭菌15min,然后再倒掉所述kmno4溶液,用无菌蒸馏水洗8遍,用吸水纸吸干其表面水分,放入超净工作台备用。
73.经无菌处理的1号、2号、3号三个紫山药样品的外植体均按以下各步骤进行:
74.步骤(4)植物叶片无菌处理:剪取步骤(1)所述幼嫩紫山药的叶片进行灭菌处理:自来水冲洗嫩紫山药叶片30min,75%(体积百分比)乙醇对其表面灭菌1min,再用0.3%(质量百分比)kmno4溶液灭菌12min,然后倒掉所述kmno4溶液,无菌蒸馏水洗7遍,用吸水纸吸干其表面水分,剪成长3
‑
5cm叶片片段,放置于无菌瓶中,备用,所述幼嫩紫山药叶片的无菌处理现用现灭菌处理。
75.步骤(6)防止愈伤褐化和胶状物形成的第一阶段愈伤诱导培养:先将1号固定液加
入步骤(3)中所述的装有植物凝胶液并铺有无菌滤纸的玻璃瓶中无菌滤纸的表面,1号固定液加入量为每40ml植物凝胶液加入30ml 1号固定液,用手术刀片将步骤(1)经灭菌处理的外植体被氧化的表面薄薄切掉,再切成长1~1.5cm,按一定接种数量接入前述在装有植物凝胶液并铺有无菌滤纸的玻璃瓶中加入了1号固定液的玻璃瓶中,置于28℃培养30天,三个样品均出现:茎段褐化严重,在植物凝胶液上第一次铺的无菌滤纸中间变成深褐色,滤纸边缘变成褐色,大量胶状物粘在滤纸表面。
76.步骤(7)防止愈伤褐化和胶状物形成的第二阶段愈伤诱导培养:将2号固定液加入步骤(3)新的装有植物凝胶液并铺有无菌滤纸的玻璃瓶中无菌滤纸的表面(即另一瓶没有使用过的只装有植物凝胶液并铺有无菌滤纸的玻璃瓶),2号固定液加入量为每40ml植物凝胶液加入30ml 2号固定液,再接入步骤(6)防止愈伤褐化和胶状物形成的第一阶段愈伤诱导培养中培养的茎段材料,置于28℃,暗培养40天后,三个样品均出现:茎段长出透明白点,长出的愈伤经过滤纸第二次吸附变成透明褐色,在植物凝胶液上第二次铺的无菌滤纸中间变成褐色,滤纸边缘变成浅褐色,减少的胶状物粘在滤纸表面。
77.步骤(8)防止愈伤褐化和胶状物形成的第三阶段愈伤诱导培养:将3号固定液加入步骤(3)新的装有植物凝胶液并铺有无菌滤纸的玻璃瓶中无菌滤纸的表面(即另一瓶没有使用过的只装有植物凝胶液并铺有无菌滤纸的玻璃瓶),3号固定液加入量为每40ml植物凝胶液加入30ml 3号固定液,再接入步骤(7)防止愈伤褐化和胶状物形成的第二阶段愈伤诱导培养中培养的长出透明白点的茎断材料,置于28℃,暗培养35天后,三个样品均出现:透明白点増多,长出愈伤,开始统计愈伤,在植物凝胶液上第三次铺的无菌滤纸中间变成姜黄色,滤纸边缘浅黄色,愈伤经过三次的纸桥滤纸吸附,愈伤透明、淡黄色,少量胶状物粘在滤纸表面,此时的愈伤用来增殖培养效果最好。
78.步骤(9)防止愈伤褐化和胶状物形成的第四阶段愈伤增殖培养:将3号固定液加入步骤(2)中经高温灭菌装有植物凝胶液的玻璃瓶中摇匀,3号固定液加入量为每40ml植物凝胶液加入30ml 3号固定液,再在所述玻璃瓶内液体表面铺满步骤(4)中对应所述的经无菌处理的幼嫩紫山药叶片,所铺的幼嫩紫山药叶片的厚度为2~3cm,并将步骤(8)防止愈伤褐化和胶状物形成的第三阶段愈伤诱导培养的愈伤材料接入瓶内最上层幼嫩紫山药叶片上,置于28℃,1000lx弱光培养,光照周期16小时/每天,每15天按前述方法同时更换3号固定液、经无菌处理的幼嫩紫山药叶片和植物凝胶液一次,共培养60天。
79.步骤(10)增殖愈伤筛选:经过步骤(9)60天愈伤增殖培养,三个样品均出现:愈伤增殖后,愈伤组织干净、透明,带浅绿色,挑选出紧实颗粒状的愈伤和分化出的小芽作为基础分化苗的培养材料。
80.实施例2中紫山药愈伤诱导1号、2号、3号三个样品的愈伤诱导率都在100%,见表1。
81.表1 实施例2防止紫山药愈伤褐化和胶状物形成效果
[0082][0083]
对照2
[0084]
对照2是不铺滤纸和不铺垫植物叶片的愈伤培养。对照2除以下具体操作不同外,其余步骤与实施例2相同。
[0085]
省略步骤(3)无菌滤纸的装配,即在步骤(2)中装有植物凝胶液的玻璃瓶不铺无菌7cm中速滤纸。
[0086]
省略(4)植物叶片无菌处理。
[0087]
在步骤(6)防止愈伤褐化和胶状物形成的第一阶段愈伤诱导培养中、步骤(7)防止愈伤褐化和胶状物形成的第二阶段愈伤诱导培养中、步骤(8)防止愈伤褐化和胶状物形成的第三阶段愈伤诱导培养中,对应的装有植物凝胶液的玻璃瓶内均没有铺无菌7cm中速滤纸。
[0088]
在步骤(9)防止愈伤褐化和胶状物形成的第四阶段愈伤增殖培养中,在装有3号固定液和植物凝胶液摇匀的玻璃瓶内液体表面不铺紫山药无菌叶片。
[0089]
对照2紫山药愈伤诱导率最好的是1号样品只有5%,其次是3号样品愈伤诱导率是4.5%,最差的是2号样品,见表2
[0090]
表2 对照2紫山药防止愈伤褐化和胶状物形成效果
[0091][0092]
实施例3 防止蓝星花愈伤褐化和胶状物形成实验
[0093]
实施例3除以下具体操作不同外,其余步骤与实施例1相同。
[0094]
步骤(1)外植体无菌处理;选择蓝星花茎段为外植体,将蓝星花茎段用无菌蒸馏水洗一遍,再用75%(体积百分比)乙醇对其表面灭菌30s,然后倒掉所述乙醇,在加入0.3%(质量百分比)高锰酸钾溶液灭菌10min,然后倒掉高锰酸钾溶液,再用相同浓度高锰酸钾溶液灭菌5min,再倒掉高锰酸钾溶液,无菌蒸馏水洗7遍,用吸水纸吸干其表面水分,放入超净工作台备用。
[0095]
步骤(4)植物叶片无菌处理:剪取步骤(1)所述蓝星花的叶片进行灭菌处理,自来水冲洗蓝星花叶片20min,用无菌蒸馏水洗一遍,加入0.3%(质量百分比)高锰酸钾溶液灭菌8min,然后倒掉高锰酸钾溶液灭菌,再用相同浓度高锰酸钾溶液灭菌3min,再倒掉高锰酸钾溶液灭菌,无菌蒸馏水洗7遍,用吸水纸吸干其表面水分,剪成长2~3cm叶片片段,放置于
无菌瓶中,备用;所述蓝星花叶片的无菌处理现用现灭菌处理。
[0096]
步骤(6)防止愈伤褐化和胶状物形成的第一阶段愈伤诱导培养中,先将1号固定液加入步骤(3)中所述的装有植物凝胶液并铺有无菌滤纸的玻璃瓶中无菌滤纸的表面,1号固定液加入量为每40ml植物凝胶液加入30ml 1号固定液,再接入步骤(1)中所述的经无菌处理的蓝星花茎段切成长0.5
‑
1cm的茎段,每瓶接入20个茎段,接30瓶,共接种600个茎段,置于28℃暗培养40天后,茎段长出透明白点,茎段褐化严重,在植物凝胶液上第一次铺的无菌滤纸中间变成深褐色,滤纸边缘变成褐色,大量胶状物粘在滤纸表面。
[0097]
步骤(7)防止愈伤褐化和胶状物形成的第二阶段愈伤诱导培养:将2号固定液加入步骤(3)新的装有植物凝胶液并铺有无菌滤纸的玻璃瓶中无菌滤纸的表面(即另一瓶没有使用过的只装有植物凝胶液并铺有无菌滤纸的玻璃瓶),2号固定液加入量为每40ml植物凝胶液加入30ml 2号固定液,再接入步骤(6)防止愈伤褐化和胶状物形成的第一阶段愈伤诱导培养中已长出透明白点茎段材料,置于28℃,暗培养35天后,茎段透明白点増多,长出的愈伤经过滤纸第二次吸附变成透明褐色,在植物凝胶液上第二次铺的无菌滤纸中间变成褐色,滤纸边缘变成浅褐色,减少的胶状物粘在滤纸表面。
[0098]
步骤(8)防止愈伤褐化和胶状物形成的第三阶段愈伤诱导培养中,将3号固定液加入步骤(3)新的装有植物凝胶液并铺有无菌滤纸的玻璃瓶中无菌滤纸的表面(即另一瓶没有使用过的只装有植物凝胶液并铺有无菌滤纸的玻璃瓶),3号固定液加入量为每40ml植物凝胶液加入30ml 3号固定液,再接入步骤(7)防止愈伤褐化和胶状物形成的第二阶段愈伤诱导培养中已经长出透明白点材料,置于28℃,暗培养35天后长出愈伤,在植物凝胶液上第三次铺的无菌滤纸中间变成姜黄色,滤纸边缘浅黄色,愈伤经过三次的纸桥滤纸吸附,愈伤透明、淡黄色,少量胶状物粘在滤纸表面,此时的愈伤用来增殖培养效果最好。
[0099]
步骤(9)防止愈伤褐化和胶状物形成的第四阶段愈伤增殖培养中,将3号固定液加入步骤(2)中经高温灭菌装有植物凝胶液的玻璃瓶中摇匀,3号固定液加入量为每40ml植物凝胶液加入30ml 3号固定液,再在所述玻璃瓶内液体表面铺满步骤(4)中所述的经无菌处理蓝星花叶片,所铺的蓝星花叶片的厚度为2~3cm,并将步骤(8)防止愈伤褐化和胶状物形成的第三阶段愈伤诱导培养的愈伤材料接入瓶内最上层蓝星花叶片上,置于28℃,1000lx弱光培养,光照周期14小时/每天,每15天按前述方法同时更换3号固定液、经无菌处理的蓝星花叶片和植物凝胶液一次,共培养56天。
[0100]
步骤(10)增殖愈伤筛选:经过步骤(9)中56天愈伤增殖后,愈伤组织干净,此时挑选出紧实颗粒状,颜色深绿的优质愈伤和分化出的小芽作为基础分化材料。
[0101]
经统计,实施例3蓝星花愈伤诱导率在100%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1