鹿角蕨的组培快繁方法
1.本发明涉及植物组培技术领域,具体地说,涉及鹿角蕨(platycerium)的组培快繁方法。
背景技术:
2.绿孢鹿角蕨(platycerium wallichii hooker)是水龙骨科(polypodiaceae)鹿角蕨属(platycerium)植物,为典型的热带雨林附生蕨类,该属约有15种,分布于非洲、热带亚洲和热带美的热带雨林中。中国仅有一种,即绿孢鹿角蕨,野外分布于云南省德宏州盈江县、陇川县和瑞丽市。绿孢鹿角蕨姿态优美,作为观叶植物中的珍稀物种,具有较高的观赏价值;作为热带雨林的标志物种,可为热带雨林的生态恢复提供依据,具有较高的生态价值;作为蕨类植物中的进化类群,对研究植物种间协同进化关系具有重要意义,具有较高的科学价值;此外具有药用价值,被当地人用作跌打药。目前绿孢鹿角蕨赖以生存的森林环境由于热区开发而遭到严重破坏,使其野生资源日益减少。加之绿孢鹿角蕨叶形奇特,观赏期长、易于管护,作为室内观叶植物中珍贵稀有的精品,一株株型优美的绿孢鹿角蕨在市场上可售卖数百元至上千元,野外残存的绿孢鹿角蕨资源因人为采挖获取暴利而进一步流失。绿孢鹿角蕨现已被列为国家二级保护植物,并有学者建议应将其列入一级保护并尽早进行人工有性繁殖研究。鹿角蕨属植物的栽培品种中,开发利用较好的有荷兰、美国加州圣迭戈、罗伯特和齐森亨尼等。然而市场上的绿孢鹿角蕨绝大部分来源于直接进口,国内缺乏规模化的繁殖与栽培,有关其市场开发在国内还属于空白阶段。因此,有必要开展绿孢鹿角蕨的繁殖技术研究,有效保护我国野生绿孢鹿角蕨资源的同时,促进其野生居群的扩大和可持续开发利用。
技术实现要素:
3.本发明的目的是提供一种鹿角蕨的组培快繁方法。
4.为了实现本发明目的,本发明提供一种鹿角蕨(platycerium)的组培快繁方法,包括以下步骤:
5.1)采集的鹿角蕨孢子经消毒后,接种在1/2ms或改良knops培养基上进行孢子萌发及孢子体诱导;
6.2)待孢子体生长至叶宽0.5
‑
1.0cm(优选0.5cm),转接至ms培养基上进行孢子体增殖,或者,转接至培养基i上进行ggb诱导。
7.所述培养基i为ms+6
‑
ba 0.5
‑
1.0mg
·
l
‑1+naa 1.0
‑
1.5mg
·
l
‑1+ac 0.1
‑
0.3g
·
l
‑1;优选ms+6
‑
ba0.5 mg
·
l
‑1+naa 1.0mg
·
l
‑1+ac 0.1g
·
l
‑1。
8.上述各步骤使用的培养基中琼脂含量为4
‑
6g
·
l
‑1,ph 5.8
‑
6.0(优选ph 5.8)。
9.前述方法还包括步骤3):待孢子体生长至叶宽1
‑
2cm,转接于含有200
‑
300mg
·
l
‑1(优选200mg
·
l
‑1)磷酸二氢钾的1/2ms培养基中进行组培苗的培养。磷酸二氢钾能增强植株持水力。
10.进一步地,待孢子体生长至叶宽3
‑
4cm(移栽炼苗的最佳时机,成活率较高),移栽于培养基质(如泥炭藓)中进行培养。
11.所述培养基质还可以是泥炭藓与蛭石的混合物,其中泥炭藓与蛭石的体积比为3:1。
12.培养过程中,可辅以0.1
‑
0.3mg
·
l
‑1乙烯利(优选0.1mg
·
l
‑1)和/或400
‑
600mg
·
l
‑1(优选500mg
·
l
‑1)多效唑对组培苗进行叶面喷施。喷施乙烯利能有效提高组培苗木质化;喷施多效唑能有效抑制植株失水,提高木质化程度。
13.前述的方法,培养条件均为温度23
±
2℃,光照强度150
‑
200μmol
·
m
‑2·
s
‑1,光周期12h
·
d
‑1。
14.步骤1)中消毒的方法为:将鹿角蕨孢子用0.1或0.2%氯化汞溶液消毒4
‑
6min(优选5min)后,用无菌水冲洗3
‑
5次。
15.优选地,所述鹿角蕨为绿孢鹿角蕨(platycerium wallichii)、二歧鹿角蕨(platycerium bifurcatum)。
16.本发明以绿孢鹿角蕨的孢子为材料,从孢子萌发、孢子体诱导、孢子体带根增殖,以及外源物质处理生根苗以提高其适应性等方面进行了试验比较,并建立了绿孢鹿角蕨的组培快繁体系,优化其组培工艺、提高移栽炼苗成活率,实现了绿孢鹿角蕨的组培苗批量化繁育。本发明为绿孢鹿角蕨的产业化开发及利用提供了技术支撑,同时也为绿孢鹿角蕨的种群恢复、野生资源保护提供了保障。该方法同样适用于二歧鹿角蕨的组培快繁。
附图说明
17.图1为本发明较佳实施例中绿孢鹿角蕨配子体状态及诱导孢子体情况(60d)。a:从左到右依次为ms、1/2ms、1/4ms、knops;b:1/2ms上诱导出孢子体。
18.图2为本发明较佳实施例中不同培养基中绿孢鹿角蕨孢子体长势。a:处理1(60d);b:处理2(60d);c:处理3(60d);d:处理4(40d);e:处理4(60d)。
19.图3为本发明较佳实施例中组培苗持水力。a:组培苗含水量变化;b:组培苗失水速率变化。
20.图4为本发明较佳实施例中组培苗持水力。a:组培苗含水量变化;b:组培苗失水速率变化。
21.图5为本发明较佳实施例中组培苗生长情况(30d)。a:处理ck(对照);b:处理1(喷施脱落酸);c:处理2(喷施磷酸二氢钾);d:处理3(喷施乙烯利);e:处理4(喷施多效唑)。
22.图6为本发明较佳实施例中组培苗长势图。a:规格为<1cm(左)、1
‑
2cm(右);b:规格为3
‑
4cm;c:规格为>4cm的生长状态。
具体实施方式
23.本发明涉及的术语:
[0024]6‑
ba:6
‑
苄基腺嘌呤;
[0025]
naa:萘乙酸;
[0026]
ac:活性炭;
[0027]
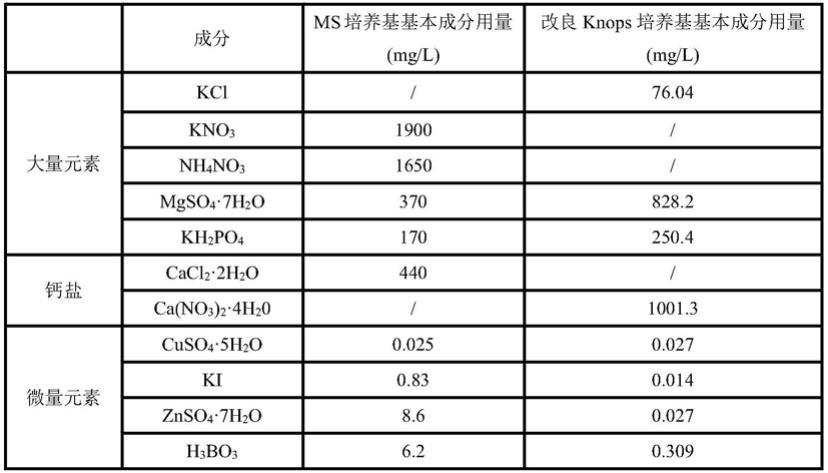
ms培养基和改良knops培养基配方如下:
[0028][0029][0030]
1/2ms培养基:在ms培养基的基础上,将其中大量元素和钙盐减少为全量的1/2;
[0031]
1/4ms培养基:在ms培养基的基础上,将其中大量元素和钙盐减少为全量的1/4。
[0032]
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
[0033]
以下实施例中涉及的指标测定及数据分析
[0034]
1、相对含水量和水分饱和亏
[0035]
相对含水量(rwc)(%)=(组织鲜重-组织干重)/(组织被水充分饱和后的重量-组织干重)
×
100
[0036]
水分饱和亏(wsd)(%)=(饱和后鲜重-原鲜重)/(饱和后鲜重-干重)
×
100
[0037]
2、持水力测定
[0038]
试验以含水率和失水速率为依据,对持水力的大小做出判断。用自然干燥法测定:称取植株鲜重后浸于自来水中,吸水12h后称取植株饱和重。然后在室内正常条件下进行自然脱水。脱水0.5h时称重一次,之后每隔1h称重一次,直至恒重。最后将叶片烘干,称取干重。根据所得数据,计算出每次称重时的植株含水率(占干重)和失水速率,计算公式如下:
[0039]
含水率(%)=(失水前植株重
‑
植株干重)/植株干重
×
100
[0040]
失水速率(%)=(失水前植株重
‑
失水后植株重)/植株干重
×
100
[0041]
3、木质化程度的测定
[0042]
将鹿角蕨植株进行称重,记录其鲜重、干重,利用公式:植株干重/植株鲜重,计算鹿角蕨植株的木质化程度。
[0043]
4、数据分析
[0044]
试验相关数据采用originpro 8.5、excel2010等软件进行统计分析。
[0045]
实施例1绿孢鹿角蕨组培快繁方法的建立
[0046]
1材料与方法
[0047]
1.1试验材料
[0048]
绿孢鹿角蕨孢子采自西南林业大学温室。将孢子叶置于硫酸纸袋中,待孢子自然散落后收集在离心管内,置于4℃种子柜里备用。
[0049]
1.2试验方法
[0050]
1.2.1孢子萌发及孢子体诱导
[0051]
将孢子用0.1%的氯化汞溶液消毒5min,再用无菌水冲洗3次后,接种在1/2ms培养基上。待孢子萌发至出现深绿色的心形配子体后,将其转接至ms、1/2ms、1/4ms、改良knops 4种培养基上,琼脂4g
·
l
‑1,ph 5.8。每瓶接种5个配子体团,每个处理5瓶,重复3次。接种后每周观察配子体长势及孢子体诱导情况,2个月后通过比较筛选出最适于诱导孢子体的培养基。
[0052]
不同培养基对诱导孢子体的影响:
[0053]
试验结果显示,4种培养基中配子体生长状况呈现出明显差别,配子体生长状态由优到差的培养基配方依次为ms、1/4ms、1/2ms、改良knops(图1a)。其中ms和1/4ms培养基上配子体长势虽好但并未诱导出孢子体,而1/2ms培养基上诱导出少量孢子体(图1b),改良knops培养基上配子体长势最差,但也有少量孢子体产生。综上,ms、1/4ms培养基利于配子体的营养生长,1/2ms、改良knops培养基可用于诱导绿孢鹿角蕨孢子体产生。
[0054]
1.2.2孢子体带根增殖培养基筛选
[0055]
选取同一规格(叶宽约0.5cm)孢子体,分别接种在以下培养基中:ms、1/2ms、1/4ms、ms+6
‑
ba0.5 mg
·
l
‑1+naa 1.0mg
·
l
‑1+ac 0.1g
·
l
‑1、1/2ms+6
‑
ba0.5 mg
·
l
‑1+naa 1.0mg
·
l
‑1+ac 0.1g
·
l
‑1、1/4ms+6
‑
ba0.5 mg
·
l
‑1+naa 1.0mg
·
l
‑1+ac 0.1g
·
l
‑1。每瓶接种5株,每个处理5瓶,重复3次。接种后每周观察一次,2个月后统计孢子体增殖和生长状况,筛选出最适于孢子体带根增殖的培养基。
[0056]
不同培养基对孢子体带根增殖的影响:
[0057]
如表1所示,处理1中孢子体生长健壮,小苗增殖较多,长势较好(图2a);处理2和3中存在玻璃化现象,且处理3小苗多数褐化,生长状况较差(图2b、c);处理4、5、6的孢子体经培养后,叶片逐渐萎蔫,孢子体中央生长点开始膨大,培养25天后形成较多ggb。其中,处理4的ggb诱导率达100%,并在培养40天后开始分化小苗(图2d),60天时生成较多丛生苗(图2e)。综上,ms培养基为绿孢鹿角蕨孢子体带根增殖的最适培养基,ms+6
‑
ba0.5 mg
·
l
‑1+naa 1.0mg
·
l
‑1+ac 0.1g
·
l
‑1的培养基配方能有效诱导ggb,且适合ggb分化小苗。
[0058]
表1不同培养基对孢子体生长的影响
[0059][0060]
1.2.3不同浓度的磷酸二氢钾对绿孢鹿角蕨组培苗持水力的影响
[0061]
以1/2ms为基本培养基,加入不同浓度磷酸二氢钾(0、100、200、300、400、500mg
·
l
‑1)。琼脂6g
·
l
‑1,ph 5.8。试验选取叶宽约2cm的健壮组培苗,转接于培养基中。每瓶3株苗,每个处理5瓶,重复3次。培养1个月后,进行各项指标测定。
[0062]
不同浓度磷酸二氢钾处理对组培苗持水力的影响:
[0063]
本试验以脱水6h过程中的含水量和失水速率为依据,对持水力的强弱做出判断。由图3可知,组培苗含水量随失水时间逐级递减,失水速率均呈现“由快到慢”的趋势。失水30min内含水量下降最快,5h后含水量曲线趋于平缓。失水前后含水量变化幅度从大到小依次是:ck(89.72%)>处理1(79.60%)>处理2(78.72%)>处理3(77.43%)>处理4(76.80%)>处理5(73.36%)(图3a),可见磷酸二氢钾处理能有效抑制植株失水。整体失水速率从高到低呈现为处理3>处理1>ck>处理4>处理5>处理2(图3b),可见处理2(添加磷酸二氢钾200mg)能在维持植株含水量的同时,有效抑制植株失水,增强持水力及植株对环境的适应性。
[0064]
1.2.4喷施不同外源物质对绿孢鹿角蕨叶片木质化的影响
[0065]
以泥炭藓为培养基质,选取叶宽约2cm的组培苗移栽于基质中。选取脱落酸(4mg
·
l
‑1),磷酸二氢钾(1000mg
·
l
‑1),乙烯利(0.1mg
·
l
‑1)、多效唑(500mg
·
l
‑1)及喷施水(对照),对组培苗进行叶面喷施(1次/天,喷适量20ml/次)。每盆16株组培苗,每个处理1盆,重复3次。处理1个月后,进行各项指标测定。
[0066]
(1)喷施不同外源物质对绿孢鹿角蕨叶片木质化的影响:
[0067]
表2结果显示,木质化程度由高到低依次是:处理3>处理4>ck>处理2>处理1;植株相对含水量由高到低依次是:处理1>处理3>处理4>处理2>ck,水分饱和亏则与此相反。各处理相对含水量均显著高于对照,由此说明各处理均能有效增强植株保水性。移栽后除ck处理的植株有多数发黄萎蔫现象外,其他处理只有少数萎蔫。综上,该试验中外源物质的喷施能显著提高组培苗的保水性,其中乙烯利、多效唑能有效增强组培苗木质化,有利于提高幼苗对环境的适应能力。
[0068]
表2不同外源物质处理的组培苗生长状况
[0069][0070]
注:同列不同小写字母表示在p≤0.05水平差异显著;“+”、“++”和“+++”分别代表
整体状况“一般”、“良好”和“较好”。
[0071]
(2)喷施不同外源物质对组培苗持水力的影响
[0072]
本试验以脱水6h过程中的含水量和失水速率为依据,对持水力的强弱做出判断。由图4可知,组培苗含水量随失水时间逐级递减,失水速率均呈现“由快到慢”的趋势。失水1h内含水量下降最快,5h后含水量曲线趋于平缓。其中失水前后含水量下降幅度从大到小依次是:ck(88.39%)>处理3(84.59%)>处理1(82.72%)>处理4(72.20%)>处理2(70.67%),处理2和处理4含水量的下降幅度接近,且失水2h后明显高于其他处理(图4a)。失水过程中,处理ck的失水速率在半小时内达最高值,此后逐级递减;其余处理失水速率变化趋势相似,均在1h内失水最快,之后逐渐降低,总体呈现出“慢—快—慢”的趋势。失水速率由高到低依次是:ck>处理1>处理3>处理2>处理4。综上,该试验中喷施四种外源物质都有助于降低植株失水速率,其中处理4(多效唑)、处理2(磷酸二氢钾)对增强植株保水性的作用更明显(图4b)。组培苗生长情况(30d)见图5。
[0073]
1.2.5组培苗规格大小对移栽成活的影响
[0074]
以泥炭藓为培养基质,选取4个规格的组培苗:叶宽0.5
‑
1cm、1
‑
2cm、3
‑
4cm、4
‑
5cm。将不同大小的组培苗分别移栽到基质上,浇水后覆盖保湿。每盆30株,每个处理1盆,重复3次。处理3个月后统计组培苗成活率和生长情况。
[0075]
由于组培苗生长环境相对于外界是无菌、恒温的,转移到室外时需先开盖适应,待小苗稳定生长后进行移栽。经3个月炼苗后,四种规格的小苗呈现出的生长状况有了明显差异。其中处理3的幼苗成活率最高,且状态较好,陆续长出新叶;处理2的幼苗成活率次之,但长势一般,生长状况稍差;处理4的幼苗新生的叶片数最多,但移植成活率、长势一般;处理1的幼苗在炼苗过程中成活率较低,仅占一半的存活量。综上,幼苗生长至叶宽3
‑
4cm时最适合用于出瓶移栽(表3)。
[0076]
表3不同规格组培苗的炼苗效果
[0077][0078]
注:成活率=成活株数/总株数
×
100%
[0079]
组培苗长势图见图6。
[0080]
1.2.6培养条件
[0081]
以上试验培养条件均为温度23℃,光照强度150μmol
·
m
‑2·
s
‑1,光周期12h
·
d
‑1,ph 5.8。
[0082]
诱导孢子体是蕨类植物组织培养中的重要过程,除了受到糖类、无机盐含量、外源激素等因素影响外,还与环境中光照、水分、群体密度、性器官发育有关。有研究指出,群体密度会影响配子体的性别分化,miller也认为高培养密度下的配子体通常发育成无性或雄性的狭长丝状体,而低培养密度下的配子体则通常发育为雌性或两性配子体。本发明研究结果也显示,在诱导孢子体阶段,配子体长势较好较密集的培养基中,配子体仅进行营养生长而不产生孢子体;而配子体生长状态相对差、分布较稀疏的培养基中,能产生孢子体,推
测该现象可能与配子体群体密度有关。通过诱导获得的孢子体数量有限,所以孢子体的增殖过程尤为关键。常规的增殖须经历诱导愈伤组织、丛生芽,分化成苗以及生根培养等阶段,具有增殖缓慢、生根率较低等缺点。本发明采取“带根增殖”的方式,利用绿孢鹿角蕨根源型克隆生长(root derived clonal growth)的特性,达到孢子体增殖的目的,同时提高孢子体成活率。这与白芳芳等的无性繁殖试验中,发现带根繁殖的成活率要高于不带根的结果相同。目前尚未有关绿孢鹿角蕨带根增殖的研究,该试验结果可为后期繁育研究提供实验基础。此外,该试验通过添加激素成功诱导出大量ggb,且该ggb仅在原培养基上便可正常分化成苗,该ggb途径能显著提高增殖率,也是孢子体增殖的有效途径。
[0083]
植物组织培养是一个系统工程,各个环节相互衔接,只有各阶段达到相互统一的状态,其培育出的组培苗才会更加优质。移栽炼苗作为组培过程中的最后一个环节,它的成功与否,将会直接决定着整个组培快繁体系的成败。在组培苗移栽炼苗过程中,由于试管苗长期处于无菌、稳定的环境中,在生根初期还无法具备完全自养的能力。特别是生理特性和组织结构与自然环境下的植株差别较大,如叶片组织发育不完善,输导系统作用弱,易失水。因而在移栽时极易出现水分失去平衡,使细胞失去膨压,造成组培苗萎蔫或死亡。提高组培苗移栽成活率的一个有效办法是提高植株木质化程度,木质化不仅有利于维持植物正常生命活动,而且能够增强植物适应外界生物和非生物胁迫的能力。有研究表明,磷酸二氢钾和多效唑能有效提高植株的木质化程度。本发明中,磷酸二氢钾和多效唑处理均未能有效增强木质化,但在维持绿孢鹿角蕨组培苗水分平衡和持水力方面有明显作用,或许是由于材料不同以及浓度过低所致。此外,植物生长调节剂是调控木质化发育的重要信号分子。其中,脱落酸在植物逆境胁迫,如干旱、高盐、低温和病虫害中有着功不可没的作用。有研究表明,外源脱落酸能显著提高抗氧化酶活性,使气孔快速关闭,提高叶片保水能力,是一种理想的抗蒸腾剂。本发明中,喷施外源脱落酸的植株相对含水量最高,可见该处理能显著促进保水,增强植株的抗旱性;在木质化方面未有明显作用,说明脱落酸处理不能有效增强植株木质化。本发明中,乙烯利处理的组培苗木质化程度和相对含水量最高,移栽成活率也最高,可将其作为首选外源物质而广泛应用于炼苗阶段。
[0084]
此外,试验过程中发现移栽成活率高低与组培苗大小有较大关系,组培苗叶片较小则营养积累少且适应能力差,易受环境变化而影响成活率;组培苗叶片较大,营养物质的储存较多,虽有利于产生新叶,但炼苗过程中容易造成在新根产生之前失水过多的问题,从而导致叶片褐化萎蔫,成活率较低。通过筛选得出,叶宽3
‑
4cm的绿孢鹿角蕨组培苗最适宜于出瓶移栽。
[0085]
本发明采用孢子繁殖的方法,通过组织培养,筛选出适合绿孢鹿角蕨孢子萌发到成苗的培养基,通过“带根增殖”和ggb途径,缩减并优化了组培工序;找到促进组培苗木质化和增强其持水力的外源物质,以及适合出瓶移栽的组培苗规格,从而提高组培苗质量和炼苗成活率。为绿孢鹿角蕨组培过程复杂和炼苗困难提供了解决方案,也为种苗的规模化生产提供技术支持。
[0086]
实施例2二歧鹿角蕨组培快繁技术的优化
[0087]
1材料与方法
[0088]
1.1试验材料
[0089]
二歧鹿角蕨孢子采自西南林业大学温室。将孢子叶置于硫酸纸袋中,待孢子自然
散落后收集在离心管内,置于4℃种子柜里备用。
[0090]
1.2试验方法
[0091]
1.2.1孢子萌发及诱导ggb
[0092]
将孢子用5%的次氯酸钠溶液消毒5min,再用无菌水冲洗5次后,接种在1/2ms培养基上。待孢子萌发至出现深绿色的心形配子体后,将其进行继代培养,直至诱导长出少量孢子体。将孢子体转接在1/2ms+蔗糖15g/l+琼脂4g/l,ph5.8的培养基中。分别添加不同种类和浓度的激素,以及不同浓度的活性炭。采用l9(33)正交设计进行试验(表4),共9个处理组合,每个处理5瓶,每瓶接种5株孢子体,重复3次。培养条件均为温度23
±
2℃,光照强度150
‑
200μmol
·
m
‑2·
s
‑1,光周期12h
·
d
‑1。接种后每周观察一次,2个月后统计ggb诱导率和生长状况。
[0093]
表4试验的因素水平表
[0094][0095]
不同激素组合对诱导ggb的影响如表5所示,处理5和9中的ggb诱导率较高,且ggb生长健壮,长势较好,无褐化现象;处理6和8中ggb诱导率高,但少数ggb有褐化的现象出现;处理2和3中ggb诱导率一般,ggb生长健康;处理4和7中ggb诱导率较低,ggb长势略差,体积较小;其中处理1(对照)中,孢子体正常生长,但未成功诱导出ggb。综上,处理5和9最适宜用于诱导ggb。
[0096]
表5不同激素组合对诱导ggb的影响
[0097][0098]
注:同列不同小写字母表示在p≤0.05水平差异显著;“+”、“++”和“+++”分别代表整体状况“一般”、“良好”和“较好”。
[0099]
1.2.2ggb分化成苗及移栽炼苗
[0100]
将诱导得到的ggb在原配方培养基中进行继代培养,ggb能正常分化成苗。将小苗转接于1/2ms培养基上,小苗能正常生长。选取其中叶宽3
‑
4cm的小苗,在室温下开盖适应7天后,进行移栽炼苗试验。选取泥炭藓、泥炭藓:蛭石=3:1(体积比)和泥炭藓:蛭石:沙=2:1:1(体积比)三种基质,去除小苗根部的培养基残留物后,将其移栽至基质上,每盆30株,每个处理1盆,重复3次。浇水后覆盖保湿,在室温下进行炼苗。处理1个月后统计组培苗成活率
和生长情况。
[0101]
不同栽培基质的炼苗效果:
[0102]
经培养后,三种处理的小苗生长状况有了明显差异。如表6所示,处理1的小苗成活率最高,达86.67%,且小苗状态较好,陆续长出新叶;处理2的幼苗成活率次之,少数小苗萎蔫外其他生长状况均较好;处理3的小苗移栽成活率最差,较多小苗萎蔫。综上,小苗适合移栽于泥炭藓、泥炭藓:蛭石=3:1两种基质中。
[0103]
表6不同栽培基质的炼苗效果
[0104][0105]
注:成活率=成活株数/总株数
×
100%
[0106]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
[0107]
参考文献:
[0108]
[1]吴征镒,洪德元.floraofchina(v.2
‑
3)[m].北京:科学出版社,2013.
[0109]
[2]张哲,区智,李双智,等.鹿角蕨的资源调查与保护[j].黑龙江农业科学,2018(07):89
–
93.
[0110]
[3]于永福.中国野生植物保护工作的里程碑—《国家重点保护野生植物名录(第一批)》出台[j].植物杂志,1999(05):3.
[0111]
[4]向建英,陈远书,王立彦.西南边陲的山国王子——鹿角蕨[j].中华环境,2019(06):42
–
44.
[0112]
[5]庞静,彭明俊,温绍龙,等.核桃嫁接苗木质化和抗寒性因素分析[j].林业实用技术,2011(11):7
–
9.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1