一种白菜小孢子超低温冻存及复苏和诱导获得胚状体的方法
1.本发明涉及植物细胞培养技术领域,具体涉及一种白菜小孢子超低温冻存及复苏和诱导获得胚状体的方法。
背景技术:
2.超低温保存是指以液氮为冷源,储存温度保持在-196℃的长期储存生物材料的方法。在如此低的温度下,保存的生物材料活体细胞的物质代谢几乎完全停止,处于“活力停滞”(stagnant vitality)状态。在“活力停滞”状态下,细胞、组织及器官在低温保存过程中不会引起遗传特性的改变,从而可减缓甚至停止生物材料的新陈代谢和老化过程,达到不发生遗传变异、维持生物材料高活力的情况下延长储存材料的寿命,从而安全、有效地长期保存珍稀种质资源的效果。
3.超低温保存技术最初使用及推广主要针对动物细胞的保存,如动物的精子、卵子、胚胎的保存等。1973年nag和street首次成功地利用液氮保存胡萝卜悬浮体细胞,使超低温保存技术在植物保存上有了突破性的进展。因该方法所需空间小、投入少,能高度维持细胞的遗传稳定、且保存后生物材料活性好等优点,该技术逐渐在植物学领域受到广泛关注。目前,利用超低温保存的植物材料涉及原生质体、愈伤组织、花粉、种子、胚状体、植物枝条等,并在植株再生繁殖获得了有效的应用,但植物的小孢子超低温保存还未见报道。
4.植物的雄配子体培养是利用处于单核靠边期的小孢子受逆境胁迫诱导,发生发育途径的逆转进而生成胚状体。该技术是植物获得单倍体或dh材料的有效方法。自sato(1989年)首次成功利用大白菜游离小孢子培养获得胚状体及再生植株,有力推动了十字花科芸薹属作物单倍体培养技术的快速发展,目前该技术是十字花科芸薹属植物诱导双单倍体(dh系)构建dh永久群体,并应用dh材料开展植物遗传研究的图谱构建、重要基因定位和加速育种亲本纯化的有效途径之一。
5.目前,对小孢子培养体系的不断优化,推动了该技术在科研相关领域的更多应用,但在植物细胞培养范畴,优质高活力的小孢子收集获取及应用时期受到供体植株的生长季节和栽培条件的极大影响。如两年生的大白菜,利用温室大棚等栽培条件,可在每年3~5月白菜开花期获得最佳诱导的小孢子,一旦进入高温季节,缺少人工气候室,大白菜植株无法继续正常生长,则严重影响小孢子的获取,使相关研究工作无法按计划推进。如何确保有活力的白菜小孢子持续的获取是推进白菜细胞工程研究面临的重要问题之一。利用超低温保存技术为妥善保存白菜小孢子提供了可能。收集提取白菜小孢子并维持长期保存和获得具高活力、具胚胎发生能力的小孢子,对推动并确保芸薹属单倍体诱导相关的细胞工程试验的顺利开展具实际意义。并对其他植物的小孢子保存提供了参考。
技术实现要素:
6.为解决白菜这种两年生作物开展单倍体培养研究中小孢子因季节、栽培条件等限制因素而无法周年收集获得小孢子的困难,本发明的目的是提供一种白菜小孢子超低温冻
存及复苏和诱导获得胚状体的方法,本发明提供的技术方案如下。
7.第一方面,本发明提供一种白菜小孢子超低温冻存及复苏和诱导获得胚状体的方法,包括:白菜小孢子的收集和分离、采用改良b5 培养基作为冷冻保护剂进行冷冻保存;所述改良b5培养基中包含常规 b5培养基组分、120-140g/l蔗糖和30-50g/l甘露醇,改良b5培养基ph 为5-5.5。
8.在本发明提供的方法中,冷冻保存的白菜小孢子在35-38℃处理38-42s进行复苏。
9.本发明提供的白菜小孢子超低温冻存及复苏和诱导获得胚状体的方法,包括:利用改良b5培养基为冷冻保护剂,将所述白菜小孢子分装于0.5ml冻存管中进行超低温保存,保存温度为-80℃。复苏条件为以0.5ml冻存管保存小孢子在37℃恒温水浴加热40s溶解复苏。对复苏后的白菜小孢子参照游离小孢子培养体系进行诱导启动获得胚状体。诱导获得胚状体转入改良b5固体培养基进行组织继代,直至获得具根、茎、叶的组培再生植株。
10.采用本发明提供的方法,可以实现冷冻保存6个月的白菜小孢子仍具高活力,平均活力可达80%~85%,并保持胚胎发生能力。复苏小孢子经游离小孢子培养仍可诱导获得胚状体。具体步骤如下。
11.在本发明提供的方法中,白菜小孢子的收集和分离包括:选取白菜花蕾长度2-3mm,收集主要处于单核靠边期的小孢子。
12.在本发明提供的方法中,将花蕾收集后,用酒精浸泡消毒花蕾,再用次氯酸钠溶液洗涤花蕾,无菌蒸馏水冲洗;向花蕾中加入改良 b5培养基,进行破碎处理。
13.更具体地,白菜供体植株种子于每年12月催芽,播种于直径10cm 苗碗,温室育苗培养,常规管理。培养植株幼苗于次年3月定植于大棚,供体植株通过冬季短期的营养生长并感应低温春化开始花芽分化抽薹开花。春季3月至6月供体植株盛花期收集适合小孢子诱导期的花蕾,一般选取花蕾长度2-3mm,白菜小孢子处于单核靠边期为宜。
14.白菜小孢子的机械化提取是指,收集供体植株长度2-3mm的花蕾,此时小孢子主要处于单核靠边期。用75%酒精浸泡消毒花蕾30s,再用7%次氯酸钠溶液洗涤15min,无菌蒸馏水冲洗3遍;然后加入b5改良培养基,采用细胞破碎仪(tomy ms-100r)收集提取小孢子。一般每40个花蕾收集于5ml离心管,细胞破碎仪3000r
·
min-1
条件下破碎10s,进行小孢子的机械化提取。
15.在本发明提供的方法中,破碎处理后,离心取上清,将小孢子沉淀分装于冻存管中,小孢子体积不超过冻存管的2/3,改良b5培养基作为冷冻保护剂,覆盖住小孢子沉淀,放于超低温冰箱中保存。
16.更具体地,本发明提取小孢子后离心去上清,加入改良b5培养基作为冷冻保护剂代替传统冷冻保护剂(二甲基亚砜等),分装于 0.5ml灭菌冻存管,保存的小孢子体积不超过冻存管体积的2/3,冷冻保护剂刚覆盖住小孢子提取沉淀,确保冻存管密闭性并放于-80℃超低温冰箱中保存。利用改良b5培养基作为小孢子超低温冷冻保护剂,可避免二甲基亚砜等传统冷冻保护剂对保存的组织材料带来的潜在毒害,冻存小孢子复苏后检测活力,高于以传统冷冻保护剂进行冻存的对照组。
17.在本发明提供的方法中,白菜小孢子的冻存温度为-80℃或
ꢀ‑
196℃;优选地,所述冻存温度为-80℃。
18.在本发明提供的方法中,白菜小孢子复苏后诱导胚状体的生成,包括:冻存复苏后
的白菜小孢子悬浮于nln-13液体培养基,血球计数板调整小孢子细胞悬浮液浓度为0.8
×
105/ml-1.2
×
105/ml左右,在 30-33℃培养箱热激暗培养诱导20-24小时,胁迫促进单核小孢子向胚胎发生方向发育。诱导启动的小孢子悬浮液转入23-26℃继续暗培养,获得胚状体。
19.在本发明提供的方法中,将诱导获得的胚状体转入改良b5固体培养基于温度24-26℃,光照强度1000-1500lx,每天光照时间为12-16 h组培室进行继代培养,获得具根、茎、叶的组培再生植株。
20.第二方面,本发明请求保护一种冷冻保护剂,包括:b5培养基、 120-140g/l蔗糖和30-50g/l甘露醇,ph为5-5.5。
21.根据本领域技术人员的理解,本发明还请求保护上述的冷冻保护剂在延长十字花科植物小孢子冷冻储存寿命中的应用。
22.本发明的有益效果在于:
23.(1)本发明利用改良b5液体培养基作为白菜小孢子超低温冷冻保护剂,可避免传统冷冻保护剂(二甲基亚砜等)对保存的植物组织材料带来的潜在毒害,且小孢子复苏后活力检测高于传统冷冻保护剂。
24.(2)本发明提供的冷冻和复苏方法,在-196℃、-80℃保存小孢子活力差异不显著。即采用本发明提供的方法可以选择-80℃超低温冰箱保存替代液氮(-196℃)保存小孢子,达到相同的超低温保存效果,简化了传统液氮的长期保存需不断补充液氮的环节,并提高了操作的安全性。
25.(3)本发明提供的方法解决了十字花科中,类似白菜这种两年生作物开展游离小孢子培养因季节逆境、栽培条件等限制因素而无法全年收集获得小孢子的困难。
26.(4)本发明提供的方法可以保存白菜小孢子3个月以上,目前保存6个月小孢子平均活力可达80%~85%;保存3个月以上的出胚供体植株小孢子仍可诱导获得胚状体。
附图说明
27.图1为本发明实施例1中10倍镜下观察冻存6个月的小孢子在热激胁迫下发生膨大,具有胚胎发生能力。
28.图2为本发明实施例1中白菜2100330的小孢子分别在-196℃、
ꢀ‑
80℃、-40℃、-20℃、4℃、室温25℃下保存3个月和新鲜小孢子10 倍镜下的活力检测结果图。
29.图3为本发明实施例2中白菜2100436的小孢子在-80℃下保存1个月、2个月、3个月后复苏产生的胚状体结果图。
30.图4为本发明实施例3中白菜2100440的小孢子在-80℃下保存1个月、2个月、3个月后复苏产生的胚状体结果图。
31.图5为本发明实施例3中白菜2100440的小孢子在-80℃超低温冻存3个月复苏后,诱导胚状体在改良b5固体培养基继代培养的实验图。
32.图6为本发明实施例3中白菜2100440的小孢子在-80℃超低温冻存3个月复苏后,诱导胚状体在改良b5固体培养基继代培养得到的再生植株图。
33.图7为本发明对比例1中37℃不同复苏时间检测得到的小孢子活力结果的柱状图。
34.图8为本发明对比例1中40℃不同复苏时间检测得到的小孢子活力结果的柱状图。
35.图9为本发明对比例1中50℃不同复苏时间检测得到的小孢子活力结果的柱状图。
具体实施方式
36.以下实施例用于说明本发明,但不用来限制本发明的范围。
37.本发明所用白菜品种为市售购买得到。本发明实施例中,根据实验时间和批次对实验材料进行了编号。
38.本发明所用改良b5培养基的配方为:
39.(1)大量元素:0.3g/l kno3,0.15g/l nah2po
4-h2o,0.134g/l (nh4)2so4;
40.(2)镁元素:0.5g/l mgso4·
7h2o;
41.(3)钙元素:0.75g/l cacl2·
2h2o;
42.(4)铁钠元素:0.04g/l feedta;
43.(5)微量元素:10mg/l mnso4·
h2o,3mg/l h3bo3,2mg/l znso4·
7h2o,0.75mg/l ki,0.25mg/l namoo4·
2h2o,0.25mg/l cuso4·
5h2o,0.25mg/l cocl2·
6h2o;
44.(6)有机元素:0.01g/l肌醇,1mg/l烟酸,1mg/l盐酸吡哆( vb6),10mg/l盐酸硫铵(vb1);
45.(7)130g/l蔗糖,40g/l甘露醇。
46.调整改良b5培养基ph为5.5。
47.实施例1白菜小孢子超低温冻存及复苏
48.本实施例提供一种白菜小孢子超低温冻存及复苏后仍具有高活力的方法,具体如下:
49.本实施例选择的实验材料,为结球白菜品种,编号为2100330。1.白菜供体植株培养及花蕾的收集
50.白菜供体植株2100330种子于每年12月催芽,播种于直径10cm苗碗,温室育苗或12月育苗培养,常规育苗管理。培养植株幼苗于次年 3月定植于大棚,供体植株通过经历冬季短期的营养生长和感应低温春化开始花芽分化抽薹开花。春季3月至6月供体植株盛花期收集适合小孢子诱导期的花蕾,一般选取花蕾长度2-3mm,白菜小孢子处于单核靠边期,花蕾长度2-3mm为宜。
51.2.白菜小孢子的收集
52.白菜小孢子的机械化提取:收集供体植株2100330花蕾长度2~3 mm,小孢子主要处于单核靠边期的花蕾。
53.先用75%酒精浸泡消毒花蕾30s,再用7%次氯酸钠溶液洗涤15 min,无菌蒸馏水冲洗3遍;然后加入改良b5培养基,采用细胞破碎仪(tomy ms-100r)收集提取小孢子。一般每40个花蕾收集于5ml离心管,细胞破碎仪3000r
·
min-1
条件下破碎10s,进行小孢子的机械化提取。
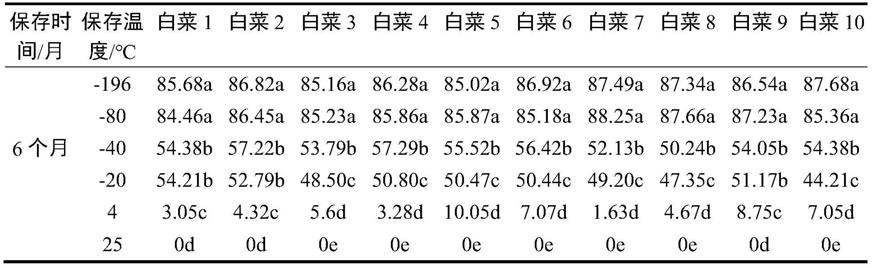
54.3.白菜小孢子的冻存
55.提取后小孢子离心去上清,加入改良b5培养基作为冷冻保护剂代替传统冷冻保护剂(二甲基亚砜等),分装于0.5ml灭菌冻存管,保存的小孢子体积不超过冻存管体积的2/3,冷冻保护剂刚覆盖住小孢子提取沉淀,确保冻存管密闭性并放于-80℃超低温冰箱中保存。利用改良b5培养基作为小孢子超低温冷冻保护剂,可避免二甲基亚砜等传统冷冻保护剂对
保存的组织材料带来的潜在毒害,冻存小孢子复苏后检测活力高于传统冷冻保护剂的对照。
56.4.白菜小孢子的复苏
57.从-80℃超低温冰箱取出保存小孢子冻存管快速放入37℃恒温水域加热40s,之后进行小孢子活力检测。小孢子活力80%以上可用于进一步单倍体的悬浮培养。
58.5.白菜小孢子活力检测:
59.将化冻后的小孢子取1-2μl,放置载玻片上,滴一滴醋酸洋红染液后盖上载玻片。将样品载玻片置于室温下放置10min,在蔡司(axiolab a1)倒置显微镜10倍镜下观察,有活力的小孢子被染成深红色,无活力的小孢子呈现浅红色或无色。染色样品滴于载玻片上,随机观察3个视野,计算并获得小孢子活力。
60.活力检测结果证实了,白菜小孢子利用此方法经过-80℃保存6个月时活力仍可以在80%~85%,(如表2所示),热激后小孢子能感应胁迫并膨大(图1),仍然具备继续诱导胚胎发生的能力。(小孢子活力(%)=有活力小孢子数/全部小孢子数
×
100%)。
61.本发明提供的方法解决了十字花科中类似白菜这种两年生作物开展游离小孢子培养因季节逆境、栽培条件等限制因素而无法全年收集获得小孢子的困难,本方法可以保存白菜小孢子3个月以上,本实施例中,提供2100330的白菜小孢子分别在-196℃、-80℃、-40℃、
ꢀ‑
20℃、4℃、室温25℃下保存3个月和新鲜小孢子的活力检测情况,见图2。其中-80℃和-196℃保存的小孢子生活力最高,且与新鲜小孢子生活力无明显差异。
62.目前保存6个月小孢子平均活力可达80%~85%;保存3个月以上的易出胚供体植株小孢子仍可诱导获得胚状体。本发明的应用可有效延长白菜小孢子的利用周期,以确保白菜小孢子相关实验的顺利进行,并推动白菜小孢子在细胞工程的应用研究领域的进一步扩大。
63.实施例2白菜小孢子复苏后悬浮培养诱导胚状体生成
64.本实施例中,采用与实施例1相同的方法,对实验材料编号为 2100436的结球白菜品种进行冻存及复苏。
65.本实施例提供白菜小孢子复苏后悬浮培养诱导胚状体生成的方法,具体步骤如下。
66.冻存复苏后具高活力小孢子悬浮于nln-13液体培养基,血球计数板调整小孢子细胞悬浮液浓度为1
×
105/ml左右,分装于直径为 60mm无菌培养皿中(玻璃培养皿需进行120℃高温灭菌20min后使用),每皿加入小孢子悬浮液10-12ml,parafilm封口膜封口。在33℃培养箱热激暗培养诱导24小时,胁迫促进单核小孢子向胚胎发生方向发育。诱导启动的小孢子悬浮液转入25℃继续暗培养,直至观察到肉眼可见的胚状体。该材料诱导孵育2周后可获得胚状体。2100436冻存 1-3个月小孢子复苏后培养获得的胚状体如图3所示。
67.所述nln-13培养基根据文献:j.b.m.custers.2003.microsporeculture in rapeseed(brassica napus l.)//m.maluszynski etal.(eds.),doubled haploid production in crop plants.published bykluwer academic publishers,printed in the netherlands:185-193.中所述成份,然后调整溶液ph值为6.0,用0.22μm针式过滤器过滤灭菌制得,4℃冰箱保存备用。
68.实施例3胚状体继代培养及获得再生植株组培苗
69.本实施例中,采用与实施例1相同的方法,对实验材料编号为 2100440的结球白菜品种进行冻存及复苏。采用与实施例2相同的方法,诱导实验材料编号为2100440的结球白菜品种小孢子的胚状体生成,实验材料编号为2100440的胚状体如图4所示。
70.本实施例提供胚状体继代培养及获得再生植株组培苗,具体步骤如下。
71.诱导获得胚状体转入改良b5固体培养基于温度24-26℃,光照强度1000-1500lx,每天光照时间为12-16h组培室进行继代培养,直至获得具根、茎、叶的组培再生植株(如图5、图6所示)。
72.所述改良b5固体培养基为在b5固体培养基的基础上还包含:6
‑ꢀ
苄氨基嘌呤(6-ba)1.5mg/l、α-萘乙酸(naa)0.05mg/l和蔗糖 30g/l,ph值为5.8-6.0。
73.b5固体培养基是本领域常规使用的培养基,具体成分可以参考 gamborg,o.l.,et al.,1968,nutrient requirements of suspension culturesof soybean root cells.exp.cell res.50,151-158.文献中公开的b5固体培养基的组成。
74.对比例1不同复苏处理条件
75.本对比例中,对实施例1收集并冷冻保存3个月的白菜小孢子进行复苏,本对比例中复苏处理采用温度37℃,40s;或37℃,50s;或37℃, 60s,本对比例得到的白菜小孢子复苏结果如表1所示,柱状统计图见图7。
76.本对比例还采用温度40℃,40s;或40℃,50s或40℃,60s进行白菜小孢子的复苏处理,结果如表1所示,柱状统计图见图8。
77.本对比例还采用温度50℃,40s;或50℃,50s或50℃,60s进行白菜小孢子的复苏处理,结果如表1所示,柱状统计图见图9。
78.表1不同复苏温度和时间,白菜小孢子复苏的结果(%)
79.37℃白菜1白菜2白菜3白菜4白菜5白菜6白菜7白菜8白菜9白菜10平均40s87.685.684.387.288.387.185.189.286.887.486.8650s79.479.277.370.975.374.766.976.572.372.174.4660s64.863.263.667.455.658.658.864.863.969.663.0340℃白菜1白菜2白菜3白菜4白菜5白菜6白菜7白菜8白菜9白菜10平均40s82.680.781.279.978.382.180.180.280.878.480.4350s70.469.272.373.970.371.773.972.568.367.170.9660s54.852.155.254.650.751.352.154.956.253.753.5650℃白菜1白菜2白菜3白菜4白菜5白菜6白菜7白菜8白菜9白菜10平均40s72.270.771.269.968.372.170.170.270.868.470.3950s60.459.262.363.960.361.763.962.558.357.160.9660s44.843.243.647.440.641.642.844.843.943.643.63
80.表1的结果显示,在进行复苏处理时,温度37℃,处理40s得到的小孢子活力效果最好。
81.对比例2不同冷冻温度保存
82.本对比例采用不同冷冻保存温度,对收集的白菜小孢子进行冻存。在存储6个月后,对小孢子活力进行检测,结果见表2。
83.表2不同冷冻温度保存6个月的小孢子活力检测结果(%)
[0084][0085]
表2结果表明,-80℃和-196℃保存的小孢子生活力最高,且无显著差异,在保存六个月时生活力可以达到80%以上,远高于其他温度保存时的生活力,且复苏后可诱导出胚状体,在节省人力、物力资源的条件下,可选择利用-80℃来保存小孢子。
[0086]
对比例3不同冷冻保护剂的效果
[0087]
本对比例中,采用与实施例1中的步骤3相同的方法,在-80℃下,对十种白菜小孢子进行冻存,区别在于:本对比例使用的是传统的冷冻保护剂二甲基亚砜。对采用不同冷冻保护剂,冷冻保存1个月、2 个月和3个月的白菜小孢子进行37℃,40s的复苏处理,并进行活力检测,白菜小孢子平均活力结果见表3。
[0088]
表3不同冻存保护剂的小孢子活力检测结果(%)
[0089][0090]
表3结果显示,改良b5洗液为冷冻保护剂更适于白菜小孢子的冻存保护,小孢子冻存3个月的平均活力为85.7%;显著高于以二甲基亚砜为冷冻保护剂小孢子的平均活力47.7%。
[0091]
本发明利用改良b5液体培养基作为白菜小孢子超低温冷冻保护剂,可避免传统冷冻保护剂对保存的植物组织材料带来的潜在毒害,且小孢子复苏后活力检测高于传统冷冻保护剂对照;选择-80℃超低温冰箱保存替代液氮(-196℃)保存小孢子,可达到相同的超低温保存效果,简化了传统液氮的长期保存需不断补充液氮的环节,并提高了操作的安全性。
[0092]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1