一种固液双层培养基及其制备方法和应用
1.本发明涉及组织培养方法领域,具体涉及一种固液双层培养基及其制备方法和应用。
背景技术:
2.植物组织培养是把植物的器官、组织以致单个细胞,应用无菌操作使其在人工条件下能够继续生长,甚至分化发育成一完整植株的过程。植物组织培养过程中,培养基极为重要,决定了组培的结果。
3.长寿花(kalanchoe blossfeldiana)是景天科伽蓝菜属的观叶和观花植物,为优质地室内观赏花卉。其叶片深厚多汁、色泽鲜艳,在低温和光线较强时,常出现泛红色,因此长寿花既可观花又可观叶,是一种具有较高观赏价值的两用花卉,又因其名字寓意健康长寿,因此具有广阔的市场发展前景。长寿花常采用带腋芽茎段和带叶柄的叶片进行扦插繁殖,但是繁殖方法易受季节影响,繁殖系数低,速度慢,远不能满足生产上的需求。而植物组织培养选取便捷,一年四季都可以进行,没有时间的限定,并且繁殖系数高、繁殖时间短、成本比较低、可常年进行大规模生产等优点,补充了其常规繁殖的不足,为大规模快速生产提供了技术保障。
4.琼脂作为固体培养基中最主要固化剂之一,其浓度直接影响着培养基的凝固效果和软硬程度,在长寿花愈伤组织的萌发阶段,培养基状态对愈伤组织形成、芽的分化及生长情况等都有着重要的影响。固体培养基可以固定材料同时满足对氧气的需求;液体培养基:材料更容易吸收营养和水分,但材料在液体培养基中不容易获得充足的氧气;固液双层培养基具有固体培养基和液体培养基两者的优点,更有利于愈伤组织的诱导和芽的分化。长寿花的很多器官、组织都可以作为外植体进行愈伤组织的诱导、不定芽分化和植株再生。然而其具体受到培养基的直接影响。
技术实现要素:
5.为解决上述技术问题,本发明提供了一种固液双层培养基及其制备方法和应用,通过制备固液双层培养基提高了愈伤组织诱导率,提高了芽分化率,进而提高了繁殖效率。
6.本发明提供了一种固液双层培养基,所述固液双层培养基由上层培养基和下层培养基组成;
7.所述上层培养基配方为:ms+6-ba 0.2mg/l+naa 0.1mg/l+蔗糖30g/l,不添加琼脂(向ms中添加6-ba、naa和蔗糖);所述下层培养基配方为:ms+6-ba 0.2mg/l+naa 0.1mg/l+蔗糖30g/l,琼脂6g/l,(向ms中添加6-ba、naa、蔗糖和琼脂)。
8.本发明还提供了上述固液双层培养基的制备方法,包括如下步骤:
9.s1,上层培养基的配制:在ms培养基中依次加入6-ba、naa和蔗糖,使6-ba终浓度为0.2mg/l,naa终浓度为0.1mg/l,蔗糖终浓度为30g/l,拌至蔗糖溶解,将ph值调整为6.0;
10.s2,下层培养基的配制:在ms培养基中加入6-ba和naa,使6-ba终浓度为0.2mg/l,
naa终浓度为0.1mg/l,然后加入琼脂,用量为6g/l,加热至微沸,琼脂溶解后,停止加热,加入蔗糖,搅拌至蔗糖溶解,将ph值调整为6.0,分装至培养瓶;
11.s3,将上述两种培养基进行高温高压灭菌;
12.s4,待分装灭菌后的下层培养基凝固后,注入等量灭菌后的上层培养基,温度降至室温后即可接种。
13.进一步地,s1-s2中,用1mol/l hcl或1mol/l naoh调节ph值。
14.进一步地,s2中,分装后的培养基厚度为0.5-0.7cm。
15.进一步地,s3中,高温高压灭菌条件为121℃,20min。
16.本发明还提供了上述固液双层培养基在植物组织培养中的应用。
17.进一步地,所述固液双层培养基用于培养长寿花。
18.进一步地,所述固液双层培养基用于培养长寿花成熟叶片和带茎节的茎段。
19.与现有技术相比,本发明的有益效果在于:
20.1、本发明制备的固液双层培养基用于长寿花外植体培养,发现其能够提高愈伤组织的诱导率,提高芽分化率,提高繁殖效率,是长寿花外植体的优质组培培养基。
附图说明
21.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
22.图1表示本发明中不同培养基状态下长寿花叶片愈伤组织诱导表观;
23.其中,图a为本发明对比例1的培养基中的愈伤组织;
24.图b为本发明实施例1的培养基中的愈伤组织;
25.图c为本发明对比例2的培养基中的愈伤组织;
26.图2表示本发明中不同培养基状态下长寿花茎段芽生长情况;
27.其中,图a为本发明对比例1的培养基中的愈伤组织;
28.图b为本发明实施例1的培养基中的愈伤组织;
29.图c为本发明对比例2的培养基中的愈伤组织。
具体实施方式
30.下面对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明各实施例中所述实验方法,如无特殊说明,均为常规方法,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
31.实施例1
32.本实施例提供了一种固液双层培养基,所述固液双层培养基的下层为固体培养基,上层为液体培养基;
33.其中,下层培养基配方为:ms+6-ba 0.2mg/l+naa 0.1mg/l+蔗糖30g/l,琼脂6g/l;
上层培养基配方为:ms+6-ba0.2mg/l+naa0.1mg/l+蔗糖30g/l,不添加琼脂。
34.所述固液双层培养基的制备步骤如下:
35.s1,上层培养基的配制:在ms培养基中依次加入6-ba、naa和蔗糖,使6-ba终浓度为0.2mg/l,naa终浓度为0.1mg/l,蔗糖终浓度为30g/l,拌至蔗糖溶解,用1mol/l hcl或1mol/l naoh将ph值调整为6.0;
36.s2,下层培养基的配制:在ms培养基中加入6-ba和naa,使6-ba终浓度为0.2mg/l,naa终浓度为0.1mg/l,然后加入琼脂,用量为6g/l,加热至微沸,琼脂溶解后,停止加热,加入蔗糖,搅拌至蔗糖溶解,用1mol/l hcl或1mol/l naoh将ph值调整为6.0,分装至培养瓶,分装量使分装后的培养基厚度0.5-0.7cm;
37.s3,将上述两种培养基进行高温高压灭菌;
38.s4,待分装灭菌后的下层培养基凝固后,注入等量灭菌后上层培养基,温度降至常温即可接种。
39.对比例1
40.对比例1提供了一种固体培养基,所述固体培养基配方为:ms+30g/l+naa 0.1mg/l+6-ba 0.2mg/l+蔗糖30g/l,琼脂6g/l。
41.对比例2
42.对比例2提供了一种液体培养基,所述液体培养基配方为:ms+30g/l+naa 0.1mg/l+6-ba 0.2mg/l+蔗糖30g/l。
43.一、不同培养基对长寿花组培的影响
44.1、供试材料
45.叶片选取健壮的长寿花中部成熟叶片,茎段选取长寿花瓶苗带茎节的茎段作为外植体。
46.2、外植体处理
47.剪下采集完整健康无病且带叶柄长寿花的成熟叶片,用洗衣粉水浸泡10min,然后用流水冲洗30min后,晾干水分,在超净工作台上面进行常规消毒。先使用75%的酒精溶液进行消毒7s;接着取出后放入0.1%升汞(hgcl2)溶液当中消毒6min;用无菌水清洗3次,然后用无菌滤水纸吸收材料的表面水分,将叶片切成1~1.5cm2大小,接种在培养基上,每瓶接种1-2个。
48.茎段选用生长健壮的无菌苗,将其切分为约1.0cm带腋芽的茎段,每一瓶接种1-2个。
49.3、接种操作
50.将处理后外植体放入灭菌的培养瓶中,置于超净工作台上。用75%酒精棉球擦拭双手。
51.叶片接种:用解剖刀切割叶片至1-1.5cm2大小,用灭菌的镊子将切好的叶片放入培养瓶中部,固体培养基和固液双层培养基,叶片斜插进固体培养基,部分露出培养基表面,液体培养基叶片放入培养基中部即可,每瓶接种1~2个外植体,然后拧紧瓶盖并。每接种一瓶,需要将解剖刀和镊子浸入75%的酒精中,在酒灯的火焰上进行燃烧和消毒,冷却后进行下一瓶的接种。
52.茎段接种:将生长健壮的无菌苗,切分为约1.0cm带腋芽的茎段,每一瓶接种1-2个
茎段,用灭菌的镊子将切好的茎段接种在培养基上,固体培养基和固液双层培养基,茎段直插进固体培养基,部分露出培养基表面,液体培养基则将茎段放入培养基中部即可,然后拧紧瓶盖并。每接种一瓶,需要将解剖刀和镊子浸入75%的酒精中,在酒灯的火焰上进行燃烧和消毒,冷却后进行下一瓶的接种。
53.4、外植体培养:将接种好的培养瓶放在培养室中进行外植体培养,培养条件为:温度25
±
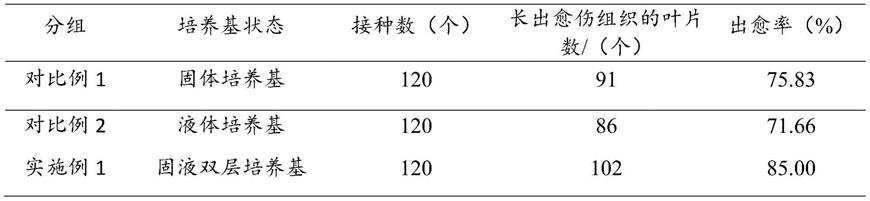
2℃,70-80%的相对湿度,光照时间10h/d。
54.5、实验观察:25天后观察叶片愈伤组织的分化情况并统计愈伤组织的出愈率,及带茎节茎段芽分化及生长情况。
55.6、测定指标与方法
56.统计接种后25天愈伤组织诱导率、茎段出芽率。
57.出愈率=有愈伤叶片数量/(接种总数-污染数-死亡数)
×
100%
58.芽诱导率=出芽茎段数/接种总数
×
100%
59.增值系数=单芽总数/接种总数
60.二、实验结果
61.1、不同培养基状态对叶片愈伤组织的出愈率的影响
62.利用上述方法分别在实施例1和对比例1-2制备的培养基中进行组织培养,计算不同培养基对外植体的出愈率的影响。结果如表1所示。
63.表1 不同状态的培养基对叶片愈伤组织的诱导率
[0064][0065]
如表1所示,不同培养基状态对于长寿花叶片的愈伤组织的诱导情况是不同的(如图1)。经过25天左右的培养观察,长寿花的叶片切块在不同状态下培养基当中都有愈伤组织的产生,产生的愈伤组织也会呈现黄绿色,并且随着培育的时间不断增加,渐渐增长。其中,固液双层状态下(实施例1)的愈伤组织诱导率是最高,为85.00%,相比液体培养基(对比例2)高出18.61%,比固体培养基(对比例1)高出15.69%。固体状态下的愈伤组织诱导率次之,叶片虽然保持了原有的生理活性,但是愈伤程度较低,且诱导产生的愈伤组织生长状况不佳,为75.83%,而液体培养基状态下的愈伤程度介于固体培养基和固液双层培养基之间,但愈伤组织诱导率只有71.66%,诱导率最低。
[0066]
2、不同培养基状态对茎段出芽率的影响
[0067]
利用上述方法分别在实施例1和对比例1-2制备的培养基,观察不同培养基状态长寿花带茎节的茎段定芽的生长情况。结果如表2所示。
[0068]
表2 不同状态的培养基对茎段芽生长的影响
[0069][0070]
如表2所示,每种状态的培养基均能诱导芽的分化,芽诱导率均为100%。但在不同培养基状态长寿花茎段芽的生长情况有所不同。其中实施例1的固液双层培养基高于对比例1的固态培养基和对比例2的液态培养基,实施例1中定芽生长质量较好,芽增殖系数也最高,达到5.25,而液体培养基(对比例2)中外植体愈伤化程度严重,分化的芽的质量不佳,固体培养基(对比例1)芽生长速度居中,但增殖系数最低,说明长寿花的生长适宜于该培养基的诱导,对于定芽的诱导有增进的作用。由图2可以看出在培养试验当中,长寿花在所接种的液体培养基(对比例2)、固体培养基(对比例1)和固液双层培养基(实施例1)的试验中,每种状态的培养基当中都有所生长,但是伴随培养的时间的不断增加而表现有所不同,在固液双层培养基(实施例1)当中的生长状况最好,其次是固体培养基(对比例1),而液体培养基(对比例2)愈伤化程度严重,芽生长缓慢。根据表1和表2可以得出长寿花叶片愈伤组织及茎段芽诱导培养的合适培养基是固液双层状态,增殖系数达到5.25,相比固体培养基高出18.51%,比液体培养基高出59.09%,芽生长快且叶片颜色绿,长势好。
[0071]
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
[0072]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1