一种适用于大鼠供体心脏的常温血液机械灌注系统
1.本实用新型涉及医疗技术领域,特别是涉及一种适用于大鼠供体心脏的常温血液机械灌注系统。
背景技术:
2.心脏移植是目前治疗终末期心脏衰竭最有效的方法,但供体心脏短缺很大程度上限制了国内外心脏移植手术的开展。目前在临床上,供体心脏主要来源于脑死亡供体(donation after brain death,dbd),而最近5年,利用循环死亡供体(donation after circulatory death,dcd)来源的心脏被认为是扩大供体心脏来源的重要策略。
3.心脏移植过程中,心脏从供体取出到移植到受体之间,往往需要经历长时间、长距离的运输,这个过程中供体心脏将持续缺血缺氧,因而对供体心脏进行充分有效的保存,减少缺血再灌注损伤,是确保移植手术成功开展的关键。低温静态保存(static cold storage,scs)是传统的供体心脏保存方法
‑‑‑‑
通过低温降低供体心脏的代谢水平,使其可以耐受一定时间的缺血缺氧。但是,与dbd心脏相比,dcd心脏在取出前需要经历长时间的热缺血,这期间心脏将耗竭能量储备,产生大量毒性代谢产物,导致细胞内酸中毒,也意味着dcd心脏缺乏足够的生理储备而对体外保存期间的缺血缺氧敏感,因而明显降低供体心脏的质量,在心脏移植过程中将遭受更大的缺血再灌注损伤。因此,传统的供体心脏保存方法不能满足dcd心脏对保存条件的要求,我们迫切需要一种更完善的dcd心脏的保存方法,减轻其缺血再灌注损伤,提高供体心脏质量。
4.机械灌注是近十年来获得广泛关注的供体心脏保存方法,可以简单分为低温机械灌注(hypothermic machine perfusion,hmp)和常温机械灌注(normothermic machine perfusion,nmp)。与scs相比,机械灌注可以持续灌注离体心脏,不断提供氧气和代谢底物,减少供体心脏的缺血缺氧时间,并清除微循环中的毒性代谢产物,从而减轻缺血再灌注损伤。另外,nmp更接近生理条件,将供体心脏保存在35-37℃下,供体心脏在此过程中可以恢复代谢活动,启动修复过程,甚至可以恢复搏动,因此可以实现在移植前客观全面地评估供体心脏的功能。更重要的是,在机械灌注保存的过程中,供体心脏可以维持低水平或完全恢复代谢活动,这意味着机械灌注提供了一个绝妙的时间窗,在此期间可以通过各种心肌保护药物、生物分子或干细胞修复dcd心脏,减轻其缺血再灌注损伤,提高供体心脏质量,改善移植后患者生存率。另外,由于机械灌注是针对离体器官的保存方法,在此过程中使用药物或干细胞治疗供体心脏更具有“靶向治疗”的效果,而不需要考虑其他组织器官的影响或药物对其他器官的影响。
5.目前越来越多的研究开始投入到将机械灌注与药物、干细胞治疗等相结合,应用于dcd心脏的保存与修复中。因此,在这些新的治疗方法正式应用于临床之前,基于动物dcd心脏的机械灌注模型将是这些研究的核心基础。
6.但是,如前面所说,dcd心脏缺乏足够的生理储备而对缺血缺氧敏感,不耐受缺血再灌注损伤,而由于常温机械灌注系统中,供体心脏将保持在生理温度而需要更高要求的
灌注条件和器官保护,因而动物dcd心脏常温机械灌注模型的建立无疑是困难重重。另外,相对于猪、猴等动物,大鼠的心脏体积小,容易受灌注压力、气体栓子等影响,操作难度大,无疑进一步提高了模型建立的难度。但是,相对于猪、猴等大型动物对资金、实验室条件等极高的要求,使用大鼠为研究对象,可以大幅度降低研究成本,可以在一般实验室实现,而且能够根据需要建立不同的基因修饰或疾病实验模型,更适合用于前期的探索研究。因此,建立大鼠供体心脏的常温机械灌注模型是非常有必要的。
7.目前世界上仅有几个实验室在研究当中使用了大鼠离体心脏常温机械灌注模型,但都是基于langendorff系统(一种以复方电解质溶液作为灌注液的开放式离体心脏灌注系统)进行研究。由于这种常温机械灌注模型是开放灌注系统(灌注液流经供体心脏后不再返回系统中),所以药物、生物分子等若加入系统中,通过灌注液作用到供体心脏,将面临作用时间短或需要量大的问题。ocs(organ care system)是目前已投入临床使用的心脏常温机械灌注系统,大体上为氧合器、加热器、离心泵和灌注管道组成的闭环系统,采用的灌注液以血液为主要成分。因此,使用langendorff系统建立的大鼠dcd心脏常温机械灌注模型,与临床实际相差较远,很可能不能真实地反映出常温机械灌注对供体心脏的保护作用,而损害研究结果的真实性、严谨性。而到目前为止,只有瑞士的一个实验室的研究是基于大鼠离体心脏常温血液机械灌注系统,但这种系统不能实时评估供体心脏功能。
8.现有技术的灌注系统都是通过蠕动泵将灌注液作用到供体心脏中。通常,蠕动泵以挤压装置持续挤压、松开(比如利用滚轮挤压、松开)硅胶管的方式使液体在硅胶管内流动以实现对流量的控制,因而硅胶管的回弹性能对蠕动泵流量控制的精度的影响很大。但是,硅胶管在受到长时间单向挤压后会存在应力释放不及时的现象,弹性材料形变不能及时恢复会导致硅胶管发生难以恢复的形变,如硅胶管沿挤压方向出现扁平形变,而这种形变会导致蠕动泵流量控制的精度下降。
技术实现要素:
9.针对现有技术中存在的技术问题,本实用新型的目的是:提供一种适用于大鼠供体心脏的常温血液机械灌注系统,硅胶管不会发生难以恢复的形变,能够有效保持蠕动泵流量控制的精度,可实现对供体心脏功能的实时评估。
10.为了达到上述目的,本实用新型采用如下技术方案:
11.一种适用于大鼠供体心脏的常温血液机械灌注系统,包括控制器、贮血器、氧气瓶、氧合器、蠕动泵、水浴箱和微量输液泵;蠕动泵包括硅胶管、第一挤压装置和第二挤压装置,第一挤压装置和第二挤压装置分别设于硅胶管旁侧,氧气瓶连接氧合器,用于为氧合器供氧;氧合器两端分别连接供体心脏和硅胶管一端,硅胶管另一端分别连接贮血器和微量输液泵一端,贮血器内存储有灌注液,贮血器设于水浴箱内,水浴箱用于储存热水,微量输液泵另一端连接有葡萄糖溶液、碳酸氢钠溶液和肾上腺素溶液;控制器分别与蠕动泵和微量输液泵连接,控制器用于控制第一挤压装置和第二挤压装置轮流挤压、松开硅胶管,第一挤压装置挤压硅胶管的方向垂直于第二挤压装置挤压硅胶管的方向。
12.进一步,水浴箱内设有温控开关、测温探头、加热器和螺旋搅拌器,温控开关分别与测温探头、加热器和控制器连接。
13.进一步,葡萄糖溶液和碳酸氢钠溶液的质量浓度分别为50%和5%;所述肾上腺素
溶液注入量为4.8
×
10-5
mg/h/kg。
14.进一步,还包括球囊导管和压力传感器;球囊导管连接压力传感器,用于实时评估供体心脏功能。
15.进一步,还包括显示器,显示器与压力传感器连接。
16.总的说来,本实用新型具有如下优点:
17.蠕动泵工作时,通过控制器控制第一挤压装置和第二挤压装置轮流挤压、松开硅胶管的上下侧和左右侧,使得硅胶管不会长时间受到单向挤压,不存在应力释放不及时的现象,不会导致硅胶管发生难以恢复的形变,能够有效保持蠕动泵流量控制的精度。将球囊导管从左心房通过二尖瓣放入左心室,连接压力传感器,可实现对供体心脏功能的实时评估。
附图说明
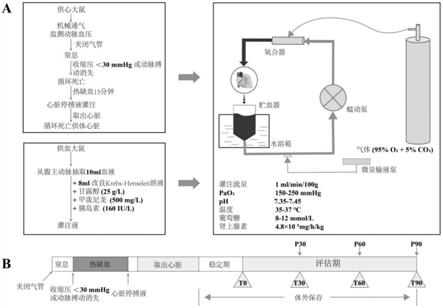
18.图1为本实用新型的操作流程与实验设计流程图。
19.图2适用于供体心脏的常温血液机械灌注系统的硬件结构示意图。
20.图3为循环死亡供体心脏体外保存期间的心功能。(a)供心大鼠夹闭气管后颈动脉血压的典型发展过程,线a:夹闭气管;线b:循环死亡;(b)心率(heart rate,hr);(c)发展压力(developed pressure,dp);(d)左心室内压最大上升速率(dp/dt
max
);(e)左心室内压最大下降速率(dp/d
tmin
),数据以中位数和四分位数间距的形式呈现。每组8个样本。*p《0.05vs.t0。
21.图4.循环死亡供体心脏体外保存期间心肌组织atp、gsh、sod和mda水平。(a)三磷酸腺苷(atp);p30组5个样本,p60组6个样本,p90组4个样本;(b)还原型谷胱甘肽(gsh)。每组6个样本;(c)超氧化物歧化酶活性(sod activity);每组6个样本;(d)丙二醛(mda)。p30和p60组每组6个样本;p90组5个样本.数据以中位数和四分位数间距的形式呈现。
22.图5.循环死亡供体心脏体外保存期间心肌组织hne、il-6和tnf-α表达。(a)p30、p60和p90组心肌组织的代表性免疫组化图片。比例尺为100μm;(b)4-羟基壬烯醛(hne)平均iod,每组6个样本;(b)白细胞介素-6(il-6)平均iod,每组6个样本;(c)肿瘤坏死因子-α(tnf-α)平均iod,p30和p90组每组6个样本;p60组5个样本。数据以中位数和四分位数间距的形式呈现。
23.图6.循环死亡供体心脏体外保存期间组织病理学改变。(a)p30、p60和p90组心肌组织的代表性苏木精-伊红染色图片(
×
200倍,比例尺为200μm);(b)病理学评分,每组6个样本;(c)p30、p60和p90组心肌组织的代表性苏木精-伊红染色图片(
×
400倍,比例尺为100μm);(d)细胞平均面积,每组6个样本;(e)苏木精-伊红染色下心肌损伤示例数据以中位数和四分位数间距的形式呈现。
24.图7.循环死亡供体心脏体外保存期间的心肌凋亡。(a)循环死亡供体心脏体外保存期间心肌tunel染色代表性图片;(b)tunel染色细胞百分比,每组6个样本。数据以中位数和四分位数间距的形式呈现。
25.图8.循环死亡供体心脏体外保存期间心肌梗死评估。上部为循环死亡供体心脏体外保存期间心肌ttc染色代表性图片;深红色:存活心肌组织;白色:坏死心肌组织。下部为dcd心脏梗死面积的量化结果。数据以中位数和四分位数间距的形式呈现。每组6个样本。
26.图9为蠕动泵的第一挤压装置和第二挤压装置的示意图。
27.图10为蠕动泵的工作原理图。
28.附图标记说明:
29.1-供体心脏,2-氧合器,3-氧气瓶,4-蠕动泵,41-第一挤压装置,42-第二挤压装置,43-硅胶管,5-微量输液泵,6-水浴箱,7-贮血器。
具体实施方式
30.下面来对本实用新型做进一步详细的说明。
31.如图1、图2、图9、图10所示,一种适用于大鼠供体心脏的常温血液机械灌注系统,包括控制器、贮血器7、氧气瓶3、氧合器2、蠕动泵4、水浴箱6和微量输液泵5;蠕动泵4包括硅胶管43、第一挤压装置41和第二挤压装置42,第一挤压装置41和第二挤压装置42分别设于硅胶管43旁侧,氧气瓶3连接氧合器2,用于为氧合器2供氧;氧合器2两端分别连接供体心脏1和硅胶管43一端,硅胶管43另一端分别连接贮血器7和微量输液泵5一端,贮血器7内存储有灌注液,贮血器7设于水浴箱6内,水浴箱6用于储存热水,微量输液泵5另一端连接有葡萄糖溶液、碳酸氢钠溶液和肾上腺素溶液;控制器分别与蠕动泵4和微量输液泵5连接,控制器用于控制第一挤压装置41和第二挤压装置42轮流挤压硅胶管43,第一挤压装置41挤压硅胶管43的方向垂直于第二挤压装置42挤压硅胶管43的方向。
32.具体地,贮血器7设于水浴箱6内,通过热水加热,贮血器7里的灌注液的温度更加平均,不会出现温度高低不等的现象。水浴箱6内贮存的热水使贮血器7内存储的灌注液流经管道到达供体心脏时可保持在35-37℃,能够使灌注液和供体心脏保持最佳状态,有利于获得更好的灌注效果。控制器与蠕动泵4连接,通过控制蠕动泵4的输出功率来调整灌注液的灌注压力和流速。微量输液泵5分别连接葡萄糖溶液、碳酸氢钠溶液和肾上腺素溶液,用于向灌注液中补充葡萄糖溶液、碳酸氢钠溶液和肾上腺素溶液,以维持灌注液葡萄糖浓度为8-12mmol/l,ph为7.35-7.45。
33.通常,蠕动泵4以挤压装置挤压、松开硅胶管43的方式使液体在硅胶管43内流动以控制流量,因而硅胶管43的回弹性能对蠕动泵流量控制精度的影响很大。但是,硅胶管43在受到长时间单向挤压后会存在应力释放不及时的现象,弹性材料形变不能及时恢复会导致硅胶管43发生难以恢复的形变,如硅胶管43沿挤压方向出现扁平形变,而这种形变会导致蠕动泵流量控制精度下降。
34.本实用新型在蠕动泵4内设置第一挤压装置41和第二挤压装置42两个挤压装置,第一挤压装置41和第二挤压装置42分别设于硅胶管43旁侧,优选地,第一挤压装置41和第二挤压装置42分别挤压硅胶管43的上下侧和左右侧。蠕动泵4工作时,通过控制器控制第一挤压装置41和第二挤压装置42轮流挤压、松开硅胶管43的上下侧和左右侧,使得硅胶管43不会长时间受到单向挤压,不存在应力释放不及时的现象,不会导致硅胶管43发生难以恢复的形变,能够有效保持蠕动泵流量控制精度。
35.在现有技术的蠕动泵公开了挤压装置挤压硅胶管43的基础上,在申请人提出通过挤压硅胶管43的不同部位以解决硅胶管43长时间受到单向挤压而难以恢复形变的技术问题的发明构思下,将一个挤压装置扩展为第一挤压装置41和第二挤压装置42,使它们分别位于硅胶管43的不同侧部,并利用控制器控制它们轮流挤压、松开于硅胶管43的不同侧部,
是本领域普通技术人员容易想到并实现的结构,在此不再赘述。
36.水浴箱6内设有温控开关、测温探头、加热器和螺旋搅拌器,温控开关分别与测温探头、加热器和控制器连接。
37.螺旋搅拌器在水浴箱6内搅拌,能够保持水浴箱6内的水温平均。加热器用于加热水浴箱6内的水。测温探头设于水浴箱6内的热水中,用于实时检测热水温度。温控开关用于控制加热器的加热动作,从而自动调节热水温度。
38.葡萄糖溶液和碳酸氢钠溶液的质量浓度分别为50%和5%。
39.还包括球囊导管和压力传感器,球囊导管连接压力传感器,用于实时评估供体心脏功能。
40.将球囊导管从供体心脏1的左心房通过二尖瓣放入左心室内,通过压力传感器可以实时评估供体心脏1的心功能。
41.还包括显示器,显示器与压力传感器连接。
42.通过显示器可以实时显示压力传感器检测到的供体心脏1的心功能图像,有助于操作者随时掌握供体心脏1的心功能情况。
43.本实施例中,灌注液中的血液采用大鼠血液,也可以采用其它动物血液或人工血液。
44.本实施例通过建立的改良“dcd大鼠离体心脏常温血液机械灌注模型”(如图1所示),适用于较长时间的dcd大鼠供体心脏保存,并可实现实时评估供体心脏1功能。该灌注系统为使用以血液为基础的灌注液的闭环灌注系统,由灌注管道、贮血器7、氧合器2、蠕动泵4、微量输液泵5和水浴箱6(水箱、温控开关、测温探头、加热器和小型螺旋搅拌器)组合而成(如图2所示)。通过从另一只大鼠抽取10ml血液,与8ml改良krebs-henseleit溶液(10mmol/l葡萄糖,117mmol/l nacl,4.5mmol/l kcl,25mmol/l nahco3,1.2mmol/l nah2po4,2mmol/l cacl2,0.512mmol/l mgcl2)混合后,加入甲泼尼龙(500mg/l)、胰岛素(160iu/l)和甘露醇(25g/l)形成灌注液,并持续泵注肾上腺素溶液(4.8
×
10-5
mg/h/kg,泵速为0.1ml/h)。预先设定氧流量和灌注流量为1:1(灌注流量为1ml/min/100g),维持氧分压为150-250mmhg,维持离体心脏温度为35-37℃,并根据血气分析结果补充50%葡萄糖溶液、5%碳酸氢钠溶液,维持葡萄糖浓度为8-12mmol/l,ph为7.35-7.45,维持供体心脏正常代谢和内环境稳态。将球囊导管从左心房通过二尖瓣放入左心室,连接压力传感器,实现对供体心脏功能的实时评估。
45.实验动物:雄性sprague-dawley大鼠
46.实验设计:
47.(1)26只雄性sprague-dawley大鼠(200-300g,8-12周龄)作为dcd供心大鼠,另有26只雄性sprague-dawley大鼠(300-400g,12-15周龄)作为供血大鼠。所有dcd心脏都使用我们设计的常温血液机械灌注系统进行体外保存。在体外保存期间进行心脏功能评估和血气分析。在灌注结束时,收集心脏组织以评估组织能量储备、氧化应激、细胞凋亡、炎症、心肌梗死和组织病理学改变。
48.(2)实验方案:
49.①
8个dcd心脏在常温血液机械灌注系统中保存90分钟,期间将进行心功能评估;
50.②
18个dcd心脏在常温血液机械灌注系统中分别保存30、60或90分钟(p30、p60和
p90组,每组6只),用于分子生物学分析。
51.组建常温血液机械灌注系统:
52.(1)灌注系统由蠕动泵、氧合器、16#硅胶管、贮血器、输液泵和水浴箱组成。水浴箱中包括水、加热器、搅拌器和温控开关及测温探头。使用含95%o2/5%co2的湿润气体通过氧合器持续给氧。氧合器用保温袋进行包裹。贮血器和管道部分浸泡在水浴箱的水中,用以加热灌注液。取下的dcd心脏将通过灌注针悬挂在贮血器中,低于水浴箱的液面,以提供温暖的环境。水浴箱的水温设为41~42℃,使离体心脏的温度维持在35~37℃。
53.(2)灌注系统使用灌注液进行预充。灌注液由供血大鼠的血液(10ml)和改良krebs-henseleit溶液(8ml;包含10mmol/l葡萄糖、117mmol/l nacl、4.5mmol/l kcl、25mmol/l nahco3、1.2mmol/l nah2po4、2mmol/l cacl2、0.512mmol/l mgcl2)组成,并加入甘露醇(终浓度为25g/l)、甲基强的松龙琥珀酸钠(终浓度为500mg/l)和胰岛素(终浓度为160iu/l)。
54.表1.灌注液成分
[0055][0056][0057]
具体步骤:
[0058]
(1)获取dcd大鼠心脏
[0059]
①
诱导大鼠循环死亡
[0060]
选择250-350g雄性sprague-dawley大鼠,用3%异氟醚吸入诱导麻醉,腹腔注射氯胺酮(75mg/kg)和甲苯噻嗪(5mg/kg)维持麻醉。气管插管,呼吸机辅助呼吸(潮气量8-10ml/kg,呼吸频率60次/分),右侧颈总动脉插管,连接压力传感器,监测大鼠动脉血压。通过右颈总动脉进行肝素化(2000iu/kg)。肝素化15分钟后,夹闭大鼠气管,待大鼠动脉收缩压小于30mmhg或动脉波动消失后,计时15分钟。
[0061]
②
取出供体心脏
[0062]
15分钟后,打开大鼠胸腔,游离升主动脉、主动脉弓、头臂干、左颈总动脉和左锁骨下动脉。在头臂干和左颈总动脉和左锁骨下动脉间夹闭主动脉弓,在距离右心房1mm处剪断下腔静脉。经大鼠右侧颈总动脉注入20ml的4℃的htk心脏停搏液,维持压力为60-80mmhg,
并在胸腔内和心脏表面放置碎冰。灌注结束后,将主动脉弓沿第三分支后方离断,在上腔静脉距离右心房1mm处离断。将供体心脏抬起,将肺动脉、肺静脉离断,取下供心。将14g灌注针插入供体心脏主动脉,丝线固定,用4℃改良krebs-henseleit溶液进行排气。
[0063]
(2)准备灌注液
[0064]
选择另外一只300-400g雄性sprague-dawley大鼠,用3%异氟醚吸入诱导麻醉,腹腔注射氯胺酮(75mg/kg)和甲苯噻嗪(5mg/kg)维持麻醉。打开腹腔,游离腹主动脉,分别钳夹腹主动脉远心端和近心端,在靠近远心端主动脉夹处剪开腹主动脉,插入20g静脉留置针,松开近心端主动脉夹,用含有0.2ml(1250u)肝素钠注射液的20ml注射器抽取10ml血液,并与8ml改良krebs-henseleit溶液(10mmol/l葡萄糖,117mmol/l nacl,4.5mmol/l kcl,25mmol/l nahco3,1.2mmol/l nah2po4,2mmol/l cacl2,0.512mmol/l mgcl2)混合后,加入甲泼尼龙(500mg/l)、胰岛素(160iu/l)和甘露醇(25g/l)形成灌注液。使用灌注液预充灌注系统,调节氧流量和灌注流量约为1:1(灌注流量为1ml/min/100g),氧合15分钟(pao2150-250 mmhg)。
[0065]
(3)大鼠dcd心脏体外保存
[0066]
灌注液氧合15分钟后,将灌注针与灌注管道连接,灌注开始。灌注流量从2ml/min开始,10分钟内逐渐升高至目标流量(1ml/min/100g)。达到目标流量后,开始通过输液泵持续泵注肾上腺素(4.8
×
10-5
mg/h/kg)。灌注期间,维持离体心脏温度为35-37℃,灌注液氧分压pao2150-250mmhg,根据血气分析结果补充50%葡萄糖溶液和5%碳酸氢钠溶液,维持葡萄糖浓度为8-12mmol/l,维持ph为7.35-7.45。灌注期间分为两个阶段,灌注开始后的15分钟为稳定期,15分钟后为评估期(90分钟)。
[0067]
(4)心功能评估
[0068]
稳定期结束后,将球囊导管从左心房通过二尖瓣放入左心室内,另一端连接压力传感器和生物信息分析仪。评估期开始(t0)及此后每30分钟(t30,t60,t90),通过往球囊内注入0.15ml生理盐水,评估dcd心脏功能。心功能指标包括发展压力(dp,收缩压与舒张压的差值),心率(hr),左心室内压最大上升速率(dp/dt
max
)和左心室内压最大下降速率(dp/dt
min
)。
[0069]
(5)血气分析
[0070]
在t0,t30,t60和t90,取部分灌注液进行血气分析。
[0071]
(6)标本收集
[0072]
实验结束后,将dcd心脏取下,沿着左心室长轴进行连续切片(四个左心室切片,1-2mm厚)。心尖部第一块切片用于三磷酸腺苷(atp)水平测定,第二块用于超氧化物歧化酶(sod)活性,还原型谷胱甘肽(gsh)和丙二醛(mda)水平测定,第三块用于组织学和免疫组化分析,第四块用于评估心肌梗死面积。
[0073]
(7)分子生物学实验
[0074]
①
组织能量储备
[0075]
称量心肌组织,用煮沸的双蒸馏水1:9稀释,制备组织匀浆,随后进行离心,收集上清液。用磷钼酸比色法测定组织atp水平(a095-1-1,南京建成)。使用全自动酶标仪(clariostar,德国bmg)进行分析。
[0076]
②
氧化应激
[0077]
称量心肌组织,用生理盐水1:9稀释,制备组织匀浆,随后进行离心,收集上清液。采用5,5
’‑
二硫代双-(2-硝基苯甲酸)比色法、硫代巴比妥酸反应物法和水溶性四氮唑-1法(a001-3-2、a003-1-2、a006-2-1,南京建成)分别测定培养上清液中sod活性和mda、gsh含量。使用全自动酶标仪进行分析。4-羟基壬烯醛(hne)的表达通过免疫组化分析测定。
[0078]
③
炎症反应
[0079]
白细胞介素-6(il-6)和肿瘤坏死因子-α(tnf-α)的表达通过免疫组化分析测定。
[0080]
④
免疫组化分析
[0081]
心肌组织切片用4%多聚甲醛溶液固定,石蜡包埋,并制备4μm厚切片。对il-6(1:500,abcam,ab9324,美国)、tnf-α(1:200,abcam,ab109322,美国)、hne(1:1000,abcam,ab46545,美国)进行免疫反应性评价。通过二氨基联苯胺反应观察抗原抗体反应,并在光学显微镜下观察,每个切片均随机选取4个不重叠的区域进行分析。图像采用imagej软件进行分析。使用积分光密度(iod)衡量il-6、tnf-α和hne的表达。
[0082]
⑤
组织学分析
[0083]
将石蜡块另外制备4μm厚切片,并进行苏木精-伊红染色。在光学显微镜下观察,每个切片均随机选取4个不重叠的区域,使用病理学评分对样本进行评估。病理学评分包括0-4级:0级:无,1级:最小(局灶性心肌细胞损伤),2级:轻度(偶有心肌纤维紊乱伴多灶性心肌纤维变性和炎症反应),3级:中度(弥漫性炎症和/或广泛心肌纤维变性伴波浪形病变和脱落细胞核),4:严重(弥漫性炎症过程伴心肌坏死:细胞核皱缩,细胞严重受损)。另外,通过imagej计算每个细胞的平均面积来评估细胞水肿。
[0084]
⑥
细胞凋亡
[0085]
上述石蜡块另外制备4μm厚切片,进行用于脱氧核糖核酸末端转移酶介导的缺口末端标记技术(tunel)检测心肌细胞凋亡情况。
[0086]
⑦
心肌梗死面积评估
[0087]
将心室切片用2%2,3,5-三苯基-氯化四氮唑(ttc)在37℃下染色30分钟,以区分存活心肌和非存活心肌。用imagej评估梗死面积百分比。
[0088]
⑧
统计分析
[0089]
结果以中位数和四分位数间距表示。组间比较采用kruskal-wallis检验和dunn多重比较检验。心功能结果采用friedman检验进行分析,dunn多重比较检验用于比较不同时间点的值。p《0.05认为差异具有统计学意义。使用graphpad prism 8.3软件(graphpad sofware,inc.,san diego,ca,usa)进行统计分析。
[0090]
实验结果
[0091]
夹闭气管诱导窒息后,供心大鼠的血压迅速下降(图3)。dcd心脏均在灌注开始后5min内恢复窦性心律。
[0092]
(1)心功能
[0093]
在评估期,dcd心脏的hr在前30分钟逐渐升高,而在随后的60分钟逐渐下降,但各时间点的差异均无统计学意义(图3b)。此外,dcd心脏的dp和dp/dt
max
从t0开始迅速升高,t30到t90期间维持相对稳定。而dcd心脏在t60和t90时刻的dp与t0的相比差异有统计学意义(图3c)。dcd心脏在t60时刻的dp/dt
max
显著高于t0(图3d)。dcd心脏的dp/dt
min
在t30和t60时刻显著低于t0时刻(图3e)。
[0094]
(2)能量储备
[0095]
三个低于0的atp值被剔除(p90组2个,p30组1个)。p30、p60和p90组之间心脏组织的atp含量没有发现显著差异(图4)。
[0096]
(3)氧化应激
[0097]
p30组的gsh水平较p60和p90组低,但差异无统计学意义。而p30、p60和p90组dcd心脏的sod活性、mda和hne水平差异无统计学意义(图4)。
[0098]
(4)炎症反应
[0099]
p30、p60和p90组dcd心脏的il-6和tnf-α水平没有显著差异(图5)。
[0100]
(5)组织病理学
[0101]
p30、p60和p90组dcd心脏均可见少量局灶性心肌细胞损伤、心肌纤维紊乱和出血,但无明显急性炎症和心肌坏死。p30组病理评分为1分(四分位数间距为1-1.25),p60组为2分(四分位数间距为1-2),p90组为1分(四分位数间距为1-2)。此外,三组的病理学评分和心肌细胞平均面积(细胞水肿的指标)没有显著差异(图6)。
[0102]
(6)细胞凋亡
[0103]
p30、p60和p90组dcd心脏的心肌细胞凋亡均不明显,三组之间没有显著差异(图7)。
[0104]
(7)心肌梗死
[0105]
p30、p60和p90组dcd心脏均无明显心肌梗死,三组间无显著性差异(图8)。
[0106]
综上所述,通过我们建立的改良式“dcd大鼠离体心脏常温血液机械灌注模型”,可以实现将dcd大鼠心脏在体外保存至少90分钟,且dcd心脏在此期间可处于稳定状态。dcd心脏均在灌注开始后5min内恢复窦性心律。dcd心脏的功能在灌注开始后30分钟内逐渐恢复,并在随后的60分钟维持在稳定水平。体外保存期间,dcd心脏的氧化应激、细胞凋亡、组织能量状态、组织病理学改变、细胞水肿和炎症反应无明显改变。此外,dcd心脏的组织病理学改变轻微,没有急性炎症和坏死的迹象,且dcd心脏在体外保存期间无明显心肌梗死。
[0107]
上述实施例为本实用新型较佳的实施方式,但本实用新型的实施方式并不受上述实施例的限制,其他的任何未背离本实用新型的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本实用新型的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1