一种龙胆苦苷的新用途
1.本发明涉及一种除草剂,具体涉及一种龙胆苦苷的新用途。
背景技术:
2.杂草与作物争夺光、水、肥等资源而成为影响作物产量和品质的重要因子,长期以来主要采用化学除草的手段来控制杂草的危害,但长期持续使用化学除草剂引发的食品安全、公共卫生、自然环境及杂草抗(耐)药性等方面的不利影响已日益引起人们的关注。
3.化学农药的广泛使用,在保障农作物高产和稳产方面发挥了巨大的作用然而传统化学农药的长期使用导致害虫产生的抗药性迫使人们加大用药剂量,引起了越来越严重的环境问题。如土壤、农产品中农药残留逐年增加,危害人、畜安全等。因此,寻求和开发对人类健康和生态环境安全的新型农药越来越迫切。
4.为了保护人类生存的环境和农业的可持续发展,化学除草剂的研制与使用将严格受到环境和生态的制约。利用天然产物开发新的除草剂,已表现出强大的生命力,天然产物除草剂逐渐受到人们的重视,植物来源的除草活性物质是杂草的生物防除及新型生物源除草剂的研究方向。为了维持和增加作物的产量、减少劳动力的需求,化学除草剂已被广泛用于农田杂草的防除。但是,长期大量使用同种化学除草剂会造成严重的杂草抗药性的问题。因此,通过生物防治手段,安全、有效地控制马铃薯田间杂草,尤其是利用植物化感作用开发新型化合物及其先导化合物防治田间杂草,被认为是当今农田除草的重要生物防除手段之一。
技术实现要素:
5.本发明的目的是提供一种龙胆苦苷的新用途,龙胆苦苷经除草生物活性测试对受体双子叶杂草自生油菜和禾本科杂草野燕麦、旱雀麦的种子萌发及幼苗生长均具有明显抑制作用。
6.为了达到上述目的,本发明提供了一种龙胆苦苷的新用途,该龙胆苦苷用于作为除草剂。
7.该龙胆苦苷是马铃薯的化感物质,前期从马铃薯根际分泌物中提取分离获取的,经除草生物活性测试对受体双子叶杂草自生油菜和禾本科杂草野燕麦、旱雀麦的种子萌发及幼苗生长均具有明显抑制作用,该化合物属马铃薯植株参与生命活动过程的次生代谢产物,其在自然界中有其固然的降解途径,安全低风险,且具有较高的生物活性,后期在除草方面具有广泛应用前景。
[0008][0009]
龙胆苦苷的结构表征数据,具体如下:
[0010]
13
c nmr(151mhz,cd3od)δ166.3,150.6,135.0,127.0,118.5,117.2,104.9,100.2,98.5,78.4,78.0,74.5,71.5,70.9,62.8,46.6。
[0011]1h nmr(600mhz,cd3od)δ7.47(s,1h),5.78(ddd,j=17.2,10.4,6.9hz,1h),5.69(d,j=3.0hz,1h),5.64(m,1h),5.28
–
5.21(overlap,2h),5.09(m,1h,h
b-7),5.01(dd,j=17.8,3.6hz,1h),4.67(d,j=7.9hz,1h),3.92(dd,j=12.0,2.3hz,1h),3.67(dd,j=11.9,6.3hz,1h),3.39
–
3.32(overlap,3h),3.27(m,1h),3.17(dd,j=9.2,7.9hz,1h,h-9)。
[0012]
优选地,该龙胆苦苷用于作为除去禾本科杂草和双子叶杂草的除草剂。
[0013]
优选地,所述禾本科杂草包含:野燕麦和/或旱雀麦。
[0014]
优选地,所述双子叶杂草包含:自生油菜。
[0015]
优选地,所述龙胆苦苷作为除去自生油菜的除草剂时,浓度为25~200μg/ml。
[0016]
优选地,所述龙胆苦苷作为除去野燕麦的除草剂时,浓度为25~200μg/ml。
[0017]
优选地,所述龙胆苦苷作为除去旱雀麦的除草剂时,浓度为1~5μg/ml。
[0018]
本发明的龙胆苦苷的新用途,具有以下优点:
[0019]
本发明的龙胆苦苷的新用途,前期从马铃薯根际分泌物中提取分离获取的,经除草生物活性测试对受体双子叶杂草自生油菜和禾本科杂草野燕麦、旱雀麦的种子萌发及幼苗生长均具有明显抑制作用,该化合物属马铃薯植株参与生命活动过程的次生代谢产物,其在自然界中有其固然的降解途径,安全低风险,且具有较高的生物活性,后期在除草方面具有广泛应用前景。
附图说明
[0020]
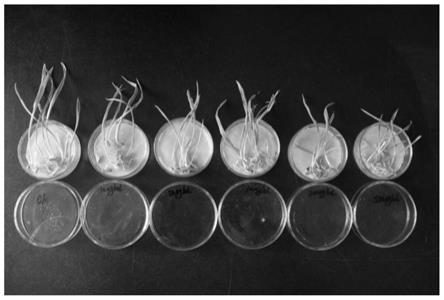
图1为本发明龙胆苦苷100μg/ml供试浓度下油菜种子萌发的影响。
[0021]
图2为本发明龙胆苦苷不同供试浓度下对野燕麦幼苗生长的影响。
[0022]
图3为本发明龙胆苦苷不同供试浓度下对野燕麦种子萌发的影响。
[0023]
图4为本发明龙胆苦苷低浓度下琼脂中对旱雀麦种子萌发的影响。
具体实施方式
[0024]
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0025]
实施例1化合物对自生油菜种子萌发及幼苗生长的影响
[0026]
1、药液准备
[0027]
分别称取一定量的化合物gentiopicroside,预溶在1%(v/v)二甲基亚砜(dmso),用蒸馏水将其定容为浓度10、25、50、100、200μg/ml的溶液。以含有1%(v/v)dmso的蒸馏水溶液作为对照。
[0028]
2、试验及分析方法
[0029]
通过培养皿生测法,进行不同浓度的化合物gentiopicroside溶液对自生油菜浩油11号的种子萌发和幼苗生长的活性测定。培养皿(d=9cm)在高压灭菌器中在121℃下灭菌20min。将供试种子在5%naclo溶液中浸泡10min进行灭菌,然后将种子用无菌水洗涤三次。分别将20粒自生油菜种子放置于在带有滤纸的培养皿中。以只加蒸馏水作为对照。向每个培养皿中加入6ml甲醇提取物溶液或蒸馏水,放置于24℃培养箱中培养。7d后测定不同浓度的化合物gentiopicroside溶液对杂草的种子萌发率和幼苗生长(发芽率、根长、芽长和干重)的活性。计算公式如下:
[0030]
ir=1-c/t
×
100%(t》c)或ir=t/c-1
×
100%(t《c)
[0031]
式中,c为对照值,t为处理值。将ir为抑制率衡量指标,ri》0为促进,ri《0为抑制,绝对值的大小与作用强度一致。计算发芽率、根长、芽长和干重的ir值。
[0032]
采用ibm spss statistics 24.0进行数据统计分析,结果均以平均值
±
标准差表示。采用duncan氏新复极差法进行差异显著性(a=0.05)检验。
[0033]
如图1所示,结果显示,化合物gentiopicroside在100和200μg/ml的浓度下对自生油菜的根长具有显著的抑制作用,抑制率分别为-64.2%和-69.7%;在25和50μg/ml的浓度下对根长具有中等的抑制作用,抑制率分别为-51.8%和-55.5%。该化合物在浓度为50、100和200μg/ml时对自生油菜的芽长具有中等的抑制作用,抑制率分别为-50.0%、-53.0%和-54.5%。
[0034]
表1不同浓度的化合物水溶液对自生油菜(brassica napus l.)种子萌发及幼苗生长的影响
[0035][0036]
实施例2化合物对禾本科杂草野燕麦种子萌发及幼苗生长的影响
[0037]
该化合物对单子叶杂草野燕麦(avenafatua l.)种子萌发及生长的显著影响是从其纯品的不同浓度水溶液中筛选出来的。
[0038]
1、供试种子前处理
[0039]
选取大小一致、颗粒饱满的野燕麦种子,剥去种皮后,用2.5%的次氯酸钠溶液浸
泡,同时用磁力搅拌器搅拌10min,再用无菌水搅拌冲洗3次(每次3min),吸水纸吸干,25℃条件下催芽24h。挑选露白一致的供试种子进行测定。
[0040]
2、药液准备
[0041]
在高压灭菌后的玻璃培养皿(ф=9cm)中铺双层滤纸,分别加入制备好的不同浓度10、25、50、100、200μg/ml的水溶液5.00ml,以清水为ck对照。
[0042]
3、试验及分析方法
[0043]
每皿放置露白一致的供试种子10粒,每个处理3次重复。将培养皿放在25℃恒温培养箱中黑暗条件下培养3天,第4天开始培养箱内的光照周期为18h光照/6h黑暗。培养期间加适量无菌水保持种子及幼苗生长所需要的水分。3d测定种子发芽率,种子发芽的标准为胚根突破种皮2mm,7d同时测定根长、芽长、鲜重、干重及计算抑制率(%)。
[0044]
所得数据用spss20.0进行方差分析和显著性分析。
[0045]
测量指标,具体如下:
[0046]
(1)萌发率:萌发的标准是胚根突破种皮1~2mm;萌发率=(种子的萌发数/培养皿中种子总数)
×
100%;
[0047]
(2)根长:根颈部位到根尖部位作为根长;每个培养皿测全部发芽的种子,每个处理共取3个培养皿,用量度为20cm的直尺测定根长;
[0048]
(3)株高:以根颈以上部位的长度作为株高;每个培养皿测全部发芽的种植,每个处理共取3个培养皿,用量度为20cm的直尺测定株高;
[0049]
根长(株高)抑制率:引用williamson等和曾任森的方法计算株高抑制率;公式为:ir=(t
0-t1)
×
100/t0,其中t1为测试项目的处理值,t 0
为对照值;当ir》0时表示存在抑制效应,ir《0时表示存在促进效应;ir的绝对值表示抑制作用的强弱;
[0050]
(4)综合抑制效应指数(se):是萌发、根长和芽长3个测定指标的对照抑制百分率的算术平均值,是评价化合物对植株萌发及生长整体影响的参数。
[0051]
用培养基法测试化合物的生物活性,可以更好的模仿土壤环境,有利于化合物在脂溶性和水溶性环境中传导。龙胆苦苷不同供试浓度下对野燕麦幼苗生长的影响参见图2,对野燕麦种子萌发的影响参见图3。结果如表2所示,该化合物在浓度为100μg/ml时,对禾本科杂草野燕麦的综合抑制率达到90%以上,当化合物在浓度为200μg/ml时,可完全抑制禾本科杂草野燕麦的萌发和幼苗生长。
[0052]
表2为化合物不同浓度水溶液对野燕麦杂草种子萌发及幼苗生长的综合抑制影响
[0053][0054]
实施例3化合物对禾本科杂草旱雀麦种子萌发及幼苗生长的影响
[0055]
该化合物对单子叶杂草旱雀麦种子萌发及生长的显著影响是从其纯品的不同浓度水溶液中筛选出来的。
[0056]
1、供试种子前处理
[0057]
选取大小一致、颗粒饱满的野燕麦种子,剥去种皮后,用2.5%的次氯酸钠溶液浸泡,同时用磁力搅拌器搅拌10min,再用无菌水搅拌冲洗3次(每次3min),吸水纸吸干,25℃条件下催芽24h。挑选露白一致的供试种子进行测定。
[0058]
2、药液准备
[0059]
在高压灭菌后的玻璃培养皿(ф=9cm)中铺双层滤纸,分别加入制备好的不同浓度10、25、50、100、200μg/ml的水溶液2.00ml,以清水为ck对照。
[0060]
3、试验及分析方法
[0061]
制备培养基,经灭菌后,凉至50~60℃,无菌操作加入化合物制备好的不同浓度1、2、5μg/ml的溶液,加入每个培养皿中,待培养基凝固后,每皿种植露白一致的供试种子10粒,每个处理3次重复。将培养皿放在25℃恒温培养箱中黑暗条件下培养3天,第4天开始培养箱内的光照周期为18h光照/6h黑暗。培养期间加适量无菌水保持种子及幼苗生长所需要的水分。3d测定种子发芽率,种子发芽的标准为胚根突破种皮2mm,7d同时测定根长、芽长、鲜重、干重及计算抑制率(%)。
[0062]
所得数据用spss20.0进行方差分析和显著性分析。
[0063]
测量指标,具体如下:
[0064]
(1)萌发率:萌发的标准是胚根突破种皮1~2mm;萌发率=(种子的萌发数/培养皿中种子总数)
×
100%;
[0065]
(2)根长:根颈部位到根尖部位作为根长;每个培养皿测全部发芽的种子,每个处理共取3个培养皿,用量度为20cm的直尺测定根长;
[0066]
(3)株高:以根颈以上部位的长度作为株高;每个培养皿测全部发芽的种植,每个处理共取3个培养皿,用量度为20cm的直尺测定株高;
[0067]
根长(株高)抑制率:引用williamson等和曾任森的方法计算株高抑制率;公式为:ir=(t
0-t1)
×
100/t0,其中t1为测试项目的处理值,t 0
为对照值;当ir》0时表示存在抑制效应,ir《0时表示存在促进效应;ir的绝对值表示抑制作用的强弱;
[0068]
(4)综合抑制效应指数(se):是萌发、根长和芽长3个测定指标的对照抑制百分率的算术平均值,是评价化合物对植株萌发及生长整体影响的参数。
[0069]
龙胆苦苷低浓度下琼脂中对旱雀麦种子萌发的影响参见图4,结果如表3所示,当培养基浓度为5μg/ml时,该化合物对旱雀麦的综合抑制影响接近90%。
[0070]
表3为化合物不同浓度对旱雀麦杂草种子萌发及幼苗生长的综合抑制影响
[0071][0072]
尽管本发明的内容已经通过上述优选实施例作了详细介绍,但应当认识到上述的描述不应被认为是对本发明的限制。在本领域技术人员阅读了上述内容后,对于本发明的多种修改和替代都将是显而易见的。因此,本发明的保护范围应由所附的权利要求来限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1