一种子痫前期疾病动物模型及其构建方法和应用
1.本发明涉及动物模型构建技术领域,具体涉及一种子痫前期疾病动物模型及其构建方法和应用。
背景技术:
2.子痫前期(preeclampsia,pe)是妊娠期特有的多系统进展性疾病,主要表现为妊娠后半期或产后新发高血压和蛋白尿;或新发高血压和显著终末器官功能障碍,伴或不伴尿蛋白。常导致母儿不良妊娠结局及增加远期心血管疾病的发生风险,目前病因不明,尚无有效治疗手段。但因分娩后临床症状会消退,最新指南归因于胎盘及母体血管功能障碍。
3.理想的动物模型,应呈现疾病的临床特征。pe因特发于妊娠中晚期,表现为滋养层细胞浸润不足、螺旋动脉重铸障碍,伴发高血压、弥漫性血管内皮功能损伤,并进一步导致肾脏损伤、尿蛋白,及其他终末器官功能障碍。因致病因素未明,而全身累及病征较广,目前已知的模型均不能完全呈现pe的所有症状。目前常用的大鼠、小鼠模型有脂多糖诱导的炎症模型、rupp术式减少子宫-胎盘灌注压的血管收缩模型,以及可溶性fms样酪氨酸激酶1等诱导的抗血管生成模型等,往往只聚焦于血压和尿蛋白体征,并不能较好还原病程,也无法兼顾滋养细胞侵袭障碍和子痫前期特有的肾脏等终末脏器功能障碍,无法还原疾病的临床特征。且造模成本较高,操作较为繁琐,无论是药物剂量还是手术方式,都存在实验操作者的个体差异,进而影响造模成功率。
4.sirt1是一种尼克酰胺腺嘌呤二核苷酸(nad
+
)依赖的蛋白去乙酰化酶,是sir2蛋白在哺乳动物中的同源体,属于哺乳动物sirtuins蛋白家族。目前的研究认为sirt1在细胞核和细胞质中均有分布。sirt1通过使多种蛋白质的赖氨酸残基发生去乙酰化而发挥抗炎、抗氧化应激、抗衰老、激活t细胞免疫甚至线粒体产生等作用。
5.针对上述模式动物高昂的造模成本,繁琐的造模过程,以及不能完全复原的病理生理过程这一系列技术问题,本发明提供了一种新的动物模型,sirt1
+/-全身敲除杂合子状态下即可还原疾病病理生理过程,解除妊娠状态或使用激动剂治疗可以恢复。此外,无需外界药物和术式干预,繁殖无需特殊饲料和特殊饲养环境,为子痫前期发病过程及机制的研究提供了全新的动物模型。
技术实现要素:
6.本发明的目的是提供一种子痫前期疾病动物模型及其构建方法和应用,以解决现有技术的不足。
7.本发明采用以下技术方案:
8.本发明第一方面提供了sirt1基因在构建子痫前期疾病动物模型中的应用。
9.本发明第二方面提供了一种子痫前期疾病动物模型,以sirt1
+/-全身敲除杂合子孕鼠为子痫前期疾病动物模型。
10.进一步地,所述sirt1
+/-全身敲除杂合子孕鼠由如下步骤获得:将sirt1
flox/flox
基
因编辑小鼠扩繁后与dppa3-ires-cre小鼠杂交,并经由去cre繁育。
11.本发明第三方面提供了一种子痫前期疾病动物模型的构建方法,包括如下步骤:将sirt1
flox/flox
基因编辑小鼠扩繁后与dppa3-ires-cre小鼠杂交,并经由去cre繁育后,获得sirt1
+/-全身敲除杂合子孕鼠即为构建的子痫前期疾病动物模型。
12.本发明第四方面提供了所述子痫前期疾病动物模型在研究子痫前期疾病的发病过程及机制中的应用。
13.本发明第五方面提供了所述子痫前期疾病动物模型在防治子痫前期疾病药物筛选和药效评价中的应用。
14.本发明第六方面提供了sirt1基因在制备防治子痫前期疾病药物中的应用。
15.本发明的有益效果:
16.本发明提供了一种无需外界药物和术式干预,繁殖无需特殊饲料和特殊饲养环境,但又能比较完整还原子痫前期疾病发生的全新子痫前期疾病动物模型。
17.本发明方法通过部分敲除目标动物sirt1基因表达,使目标动物表现出较为典型的子痫前期特征,自发形成妊娠晚期血压上升,分娩后恢复,且发现胎鼠基因与sirt1
+/-孕鼠妊娠早晚期血压差值存在相关性;此外,在妊娠晚期发现sirt1
+/-孕鼠胎盘功能层占比下降,提示胎盘滋养细胞侵袭、螺旋动脉重铸等功能障碍,并出现蛋白尿及肾脏病变;在该基因激动剂给药作用下,相关病理表现能得以恢复,提示疾病模型构建成功,并论证该基因确为子痫前期的致病基因之一。
18.本发明子痫前期疾病动物模型可用于帮助阐明子痫前期疾病的发病过程及机制,还可用于帮助防治子痫前期疾病药物筛选和药效评价。
附图说明
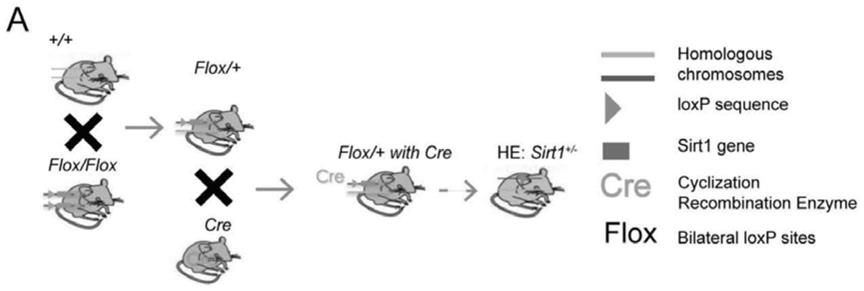
19.图1a为sirt1
+/-全身敲除杂合子孕鼠构建示意图。
20.图1b为pcr琼脂糖凝胶电泳分析sirt1
+/-全身敲除杂合子孕鼠子代(胎鼠,e18.5:妊娠18.5天)的基因型。图中m为dna指示条带,wt为sirt1
flox/flox
孕鼠鼠尾对照,ko敲除基因条带指示大小:500bp,ho:纯合子,he:杂合子,wt野生基因条带指示大小:900bp。b33-1、b33-2、b33-4为杂合子sirt1
+/-,b33-3、b33-5为纯合子sirt1-/-。
21.图1c为sirt1
+/-组和sirt1
flox/flox
组胎盘(e18.5)组织中sirt1的免疫荧光。ck7标记滋养细胞,dapi标识细胞核。可见sirt1
+/-组胎盘中滋养细胞sirt1表达显著下调,验证敲除效率。
22.图1d为sirt1
+/-组和sirt1
flox/flox
组胎鼠(e18.5)和胎盘(e18.5)的外观。可见sirt1
+/-组的胎鼠和胎盘均小于sirt1
flox/flox
组。
23.图1e为sirt1
+/-组和sirt1
flox/flox
组胚胎吸收率。sirt1
+/-组虽有上升趋势,但无统计学差异。
24.图1f为sirt1
+/-组和sirt1
flox/flox
组胎盘(e18.5)重量。sirt1
+/-组虽有下降趋势,但无统计学差异。
25.图1g为sirt1
+/-组和sirt1
flox/flox
组胎鼠(e18.5)重量。sirt1
+/-组较sirt1
flox/flox
组显著下降。
26.图1h为sirt1
+/-组和sirt1
flox/flox
组胎鼠在e18.5和p28的基因比例。e18.5:妊娠
18.5天,p28:出生后28天,ho:纯合子,he:杂合子,wt:野生型。出生28天后纯合子存活率极低,验证纯合子围产期致死现象。
27.图1i为sirt1
+/-组和sirt1
flox/flox
组孕鼠妊娠期的各期血压情况。basic condition:基础状态(未孕期),earlypg:妊娠早期,midpg:妊娠中期,latepg:妊娠晚期。可见sirt1
+/-孕鼠妊娠晚期血压显著上升。
28.图1j为sirt1
+/-组和sirt1
flox/flox
组孕鼠妊娠早晚期的血压差值。可见sirt1
+/-组妊娠晚期血压较妊娠早期呈现明显升高趋势。
29.图1k为sirt1
+/-孕鼠妊娠早晚期的血压差值与胎鼠(e18.5)敲除基因即sirt1基因占比的相关性分析。可见敲除基因在胎鼠中占比和孕鼠妊娠早晚期的血压差值存在一定的线性关系,有统计学意义。
30.图1l为sirt1
+/-组和sirt1
flox/flox
组孕鼠(e18.5)肾组织的masson染色和pas染色。可见sirt1
+/-孕鼠妊娠晚期肾小球毛细血管内皮细胞弥漫性增生和肿胀,毛细血管腔狭窄,呈现较为典型的子痫前期肾脏病变。
31.图1m为sirt1
+/-组和sirt1
flox/flox
组孕鼠(e17.5-e18.5)尿蛋白浓度测定。可见sirt1
+/-孕鼠妊娠晚期尿蛋白显著上升。
32.图1n为sirt1
+/-组和sirt1
flox/flox
组孕鼠(e18.5)胎盘纵切面。迷路层:由母体血窦及绒毛组成,介导母体和胎儿之间营养、气体和代谢废物的交换,为孕鼠胎盘功能层,连接区:即海绵层,主要具有内分泌功能,往往以迷路层/连接区指示胎盘活性功能面积。
33.图1o为上述胎盘迷路层/连接区统计图。可见sirt1
+/-孕鼠胎盘活性功能面积较sirt1
flox/flox
孕鼠明显更窄。
34.图1p为sirt1
+/-组和sirt1
flox/flox
组孕鼠妊娠晚期血压和产后血压。e17/18:妊娠17.5天血压,p2/3:产后2.5天血压。可见sirt1
+/-孕鼠在分娩后升高的血压恢复。
35.图1q为sirt1
+/-组和sirt1
flox/flox
组孕鼠产后尿蛋白(p2.5-p3.5)。可见sirt1
+/-孕鼠在分娩后升高的尿蛋白恢复。
36.图2a为给药方案。妊娠0.5天见栓后,将sirt1
+/-孕鼠随机分为两组,srt2104组和vehicle(溶剂)组,从e1.5到e17.5(妊娠第1.5天到第17.5天),每隔一天予srt2104组腹腔注射srt2104 200mg/kg,vehicle组注射等量溶剂。
37.图2b为vehicle组和srt2104组胎鼠(e18.5)和胎盘(e18.5)的外观。srt2104组胎鼠较vehicle组显著增大。
38.图2c为vehicle组和srt2104组胚胎吸收率。srt2104组胚胎吸收率有下降趋势,但无统计学差异。
39.图2d为vehicle组和srt2104组胎盘(e18.5)重量。srt2104组胎盘重于vehicle组。
40.图2e为vehicle组和srt2104组胎鼠(e18.5)重量。srt2104组胎鼠重于vehicle组。
41.图2f为vehicle组和srt2104组孕鼠妊娠期的各期血压情况。basic condition:基础状态(未孕期),earlypg:妊娠早期,midpg:妊娠中期,latepg:妊娠晚期。显示srt2104给药后sirt1
+/-孕鼠妊娠晚期因基因升高的血压得到纠正。
42.图2g为vehicle组和srt2104组孕鼠妊娠早晚期的血压差值。可见srt2104给药后sirt1
+/-孕鼠妊娠晚期因基因升高的血压得到纠正。
43.图2h为vehicle组和srt2104组孕鼠(e17.5-e18.5)的尿蛋白水平。显示srt2104给
药后sirt1
+/-孕鼠妊娠晚期因基因升高的尿蛋白得到纠正。
44.图2i为vehicle组和srt2104组孕鼠(e18.5)肾组织的masson染色和pas染色。可见srt2104给药后sirt1
+/-孕鼠妊娠晚期因基因导致的肾脏病变得到纠正。
45.图2j为vehicle组和srt2104组孕鼠(e18.5)胎盘纵切面。
46.图2k为上述胎盘迷路层/连接区统计图。提示srt2104给药后sirt1
+/-孕鼠妊娠晚期因基因缩窄的迷路层得到纠正。
具体实施方式
47.下面结合实施例和附图对本发明做更进一步地解释。下列实施例仅用于说明本发明,但并不用来限定本发明的实施范围。
48.1子痫前期疾病动物模型:sirt1
+/-全身敲除杂合子孕鼠的构建
49.因后续实验需要,本发明采用启动子驱动的cre-loxp系统。自jax(the jackson laboratory)引入sirt1
flox/flox
基因编辑小鼠(b6.129-sirt1
tm3fwa
/dsinj)。并订购南模生物公司(上海南方模式生物科技股份有限公司)dppa3-ires-cre小鼠,因dppa3-cre可有效地在胚胎早期及生殖细胞系中发挥cre重组酶活性,为构建全身敲除模型有效的商品化工具鼠。委托南模生物公司进行杂交,并经由去cre繁育后,获得sirt1
+/-全身敲除杂合子孕鼠,交配策略如图1a所示:
50.1).自jax引入sirt1
flox/flox
基因编辑小鼠(b6.129-sirt1
tm3fwa
/dsinj,编号:029603,又名sirt1
flox/flox
小鼠)。
51.2).订购南模生物公司商业化dppa3-ires-cre小鼠。
52.3).将sirt1
flox/flox
小鼠与野生型sirt1
+/+
小鼠杂交扩繁,获得sirt1
flox/+
小鼠。
53.4).将sirt1
flox/+
小鼠与dppa3-ires-cre小鼠杂交,获得sirt1
flox/+
dppa3-cre
+
小鼠。
54.5).将sirt1
flox/+
dppa3-cre
+
小鼠与野生型sirt1
+/+
小鼠杂交,去除dppa3-cre基因,并进一步扩繁,获得sirt1
+/-全身敲除杂合子小鼠。
55.6).将sirt1
+/-全身敲除杂合子小鼠合笼,获得sirt1
+/-全身敲除杂合子孕鼠(以下简称sirt1
+/-孕鼠)即所述子痫前期疾病动物模型。
56.7).sirt1
+/-孕鼠繁殖可得子代,基因型表现为:1/2杂合子:sirt1
+/-,1/4野生型:sirt1
flox/flox
,和1/4纯合子:sirt1-/-(围产期较少存活)。将sirt1
flox/flox
小鼠合笼,获得sirt1
flox/flox
孕鼠。
57.8).通过pcr琼脂糖凝胶电泳验证胎鼠基因型、免疫荧光技术验证胎盘组织中sirt1蛋白表达下调,如图1b、图1c所示;并证实文献报道纯合子胎鼠围产期致死现象,如图1h所示。
58.2构建的子痫前期疾病动物模型出现子痫前期样症状
59.本发明进一步对所构建的子痫前期疾病动物模型的子痫前期相关表现进行了系统评估,包括收集孕鼠24h尿,并对孕鼠孕期血压、胎鼠大小、胎鼠体重、孕鼠胚胎吸收率等基本情况进行观察,至妊娠18.5天予以颈椎脱臼处死,并取肾脏、胎盘组织进行进一步形态学观察。同批次分组中随机选择sirt1
+/-孕鼠留存至分娩后,观察血压恢复情况,尿蛋白改善情况等。杂合子组即sirt1
+/-组的孕鼠为sirt1
+/-孕鼠,对照组即sirt1
flox/flox
组的孕鼠为
sirt1
flox/flox
孕鼠。
60.我们发现sirt1
+/-孕鼠的胚胎吸收率几乎是正常的(图1e)。两组胎盘重量差异无统计学意义(图1f,sirt1
+/-组vs.sirt1
flox/flox
组)。由于子痫前期可引起胎儿生长受限(fgr),我们分析了sirt1
flox/flox
组和sirt1
+/-组的活胎体重,发现sirt1
+/-组的活胎体重显著降低(图1g,sirt1
+/-组vs.sirt1
flox/flox
组:0.7803
±
0.1651vs.0.8559
±
0.1585g)。各组胎鼠和胎盘的代表性图像如图1d所示,与sirt1
flox/flox
组相比,sirt1
+/-组胎鼠较小。随后,我们分析收缩压(sbp)的变化。有趣的是,sirt1
+/-组孕鼠妊娠晚期sbp水平显著升高(图1i,sirt1
+/-组vs.sirt1
flox/flox
组:119.6
±
9.952vs.108
±
6.340mmhg)。为了了解血压升高的水平,我们计算了妊娠晚期收缩压与妊娠早期收缩压的差值δbp。我们发现,δbp在sirt1
+/-组中呈现出更高的水平(图1j,sirt1
+/-组vs.sirt1
flox/flox
组:12.45
±
9.186vs.-1.562
±
10.47mmhg)。有趣的是,δbp水平与胎鼠的sirt1基因值呈正相关(图1k)。sirt1
+/-孕鼠分娩后血压恢复,尿蛋白水平恢复,如图1p、图1q所示。
61.肾损伤是子痫前期的另一个特征。典型的表现为尿蛋白和肾脏病理,包括肾小球增大和血供减少,这是由于内皮细胞肿胀,伴系膜细胞和毛细血管管腔闭塞。在本研究中,我们检测了sirt1
+/-孕鼠妊娠早期和妊娠晚期尿蛋白的浓度,sirt1
+/-孕鼠妊娠晚期尿蛋白的浓度明显升高(图1m,sirt1
+/-组vs.sirt1
flox/flox
组:2.316
±
0.05245vs.2.189
±
0.05252ug/ml)。我们还用masson染色和pas染色观察各组肾脏的病理变化。与sirt1
flox/flox
组相比,sirt1
+/-组孕鼠表现出典型的子痫前期相关肾小球损伤(图1l)。另外,胎盘异常是子痫前期患者的本质变化。在我们的小鼠模型中,我们观察到masson染色结果中sirt1
+/-迷路层较sirt1
flox/flox
窄(图1n)。我们测量了各组胎盘的迷路层/连接区比值,发现sirt1
+/-组与sirt1
flox/flox
组相比,迷路层/连接区比值明显下降(图1o)。迷路层是由滋养细胞和相关的胎儿血管经历广泛的绒毛分支形成的致密结构。迷路层是胎盘的功能层,迷路层变窄意味着胎盘功能障碍。但是,正如我们前面所提到的,两组胎盘的重量没有显著差异(图1f),这可能是由于在初次剥离时部分胎盘残留蜕膜造成的操作差异。
62.sirt1
+/-孕鼠孕期出现典型的子痫前期样症状,表现为高血压、尿蛋白、胎儿体重低、肾损伤、胎盘迷路层比例降低,提示子痫前期样小鼠模型构建成功。
63.3 sirt1激动剂srt2104明显改善sirt1
+/-孕鼠子痫前期样症状
64.此外,我们实验发现,补充sirt1激动剂后可以逆转上述病理表现发生。为了验证sirt1在子痫前期的作用,我们从e1.5到e17.5(妊娠第1.5天到第17.5天),每隔一天腹腔注射srt2104 200mg/kg(工作液浓度3mg/ml)给sirt1
+/-孕鼠,作为srt2104组。vehicle(溶剂)组注射等量溶剂(溶剂为srt2104的溶剂:5%dmso+40%peg300+5%tween80+50%ddh2o),作为对照组。治疗小鼠的过程如图2a所示。
65.予srt2104治疗sirt1
+/-孕鼠后,胚胎吸收率没有明显的变化(图2c),胎盘重量略有增加(图2d,vehicle组vs.srt2104组:0.08519
±
0.01009vs.0.09237
±
0.01213g),胎鼠体重显著增加(图2e,vehicle组vs.srt2104组:0.6808
±
0.08630vs.0.7719
±
0.1483g)。这些结果与胎鼠和胎盘的代表性图像一致(图2b)。显然,srt2104组妊娠晚期收缩压水平(图2f,vehicle组vs.srt2104组:117.8
±
8.311vs.107.4
±
10.21mmhg)和δbp(图2g,vehicle组vs.srt2104组:8.158
±
9.212vs.-5.234
±
12.86mmhg)与vehicle组相比均明显降低。srt2104改善了肾损伤,妊娠晚期尿蛋白浓度降低(图2h,vehicle组vs.srt2104组:7.397
±
3.293vs.3.392
±
0.7711ug/ml),肾小球形态基本正常(图2i)。使用srt2104腹腔注射后,胎盘也显示迷路层增宽(图2j-图2k)。
66.这些结果说明sirt1表达增加可以逆转子痫前期样表现,进一步证明sirt1是子痫前期的重要致病因素。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1