一种构建比格犬重症哮喘模型的方法
1.本发明涉及医学技术领域,具体涉及一种构建比格犬重症哮喘模型的方法。
背景技术:
2.重症哮喘即重度哮喘,who在2010年确定重症哮喘的定义:是指哮喘症状严重,伴有一些慢性疾病症状,病情波动,常发生急性加重,且用药物未能控制的状态。在哮喘病患者中,重症哮喘患者的占比高达10%以上。重症哮喘患者不能像大部分哮喘患者那样可以通过接受吸入激素及支气管扩张剂治疗即得到有效控制,重症患者即使全身应用激素仍无法控制其症状,其生活质量差且疾病负担重,是哮喘研究中的重要课题方向。构建稳定可靠的重症哮喘动物模型,是探索重症哮喘治疗方法的关键。
3.目前未有专门的重症哮喘动物模型,已有的哮喘模型多是以使用小鼠、豚鼠建立的小动物模型,成本低、造模周期短,广泛应用于哮喘发病机制和治疗药物研究。但是,小动物哮喘模型症状维持时间短,症状不显著,有自愈趋势,无法形成有效的重症哮喘模型,并且由于动物体型较小,难以用于呼吸介入等非药物性治疗哮喘技术(如支气管热成形术)的临床前研究。
4.目前也有用比格犬建立的大动物模型(doi:10.1080/08958370304474),比格犬具有与人类结构高度相似气管结构,但是该比格犬哮喘模型存在造模成功率低(50~60%)、造模周期长(需8个月时间)、哮喘病理改变不典型(如3mg/ml支气管激发剂刺激下气道阻力仅增加约1倍)等问题,也无法用于重症哮喘的研究。
技术实现要素:
5.本发明为了填补重症哮喘动物模型的技术空白,以及克服现有技术中比格犬哮喘模型造模成功率低、周期长、哮喘病理改变不典型的问题,提供了一种操作简便、耗时短的构建具有具备典型哮喘症状以及病理改变的比格犬重症哮喘模型的方法。
6.为了实现上述目的,本发明是通过以下方案予以实现的:
7.一种构建比格犬重症哮喘模型的方法,包括如下步骤:
8.s1.致敏:将致敏液加至成年比格犬的耳部,间隔一周后,在比格犬的相同部位进行相同处理;所述致敏液为含v/v%=0.1%~0.4%的甲苯二异氰酸酯溶液;
9.s2.激发:步骤s1结束后的1~8周,使比格犬吸入雾化的激发液,每周2次;所述激发液为含v/v%=0.1%~0.6%的甲苯二异氰酸酯溶液。
10.优选地,步骤s1中,所述致敏液为含v/v%=0.2%~0.3%的甲苯二异氰酸酯溶液。
11.更优选地,步骤s1中,所述致敏液为含v/v%=0.27%的甲苯二异氰酸酯溶液。
12.优选地,步骤s2中,所述激发液为含v/v%=0.2%~0.5%的甲苯二异氰酸酯溶液。
13.更优选地,步骤s2中,所述激发液为含v/v%=0.27%~0.45%的甲苯二异氰酸酯
溶液。
14.优选地,步骤s2中,步骤s1结束后的1~8周内使用的激发液浓度依次递增。
15.更优选地,所述依次递增具体是:步骤s1结束后的1~2周内使用的激发液中甲苯二异氰酸酯浓度为v/v%=0.2%~0.3%;步骤s1结束后的3~4周内使用的激发液中甲苯二异氰酸酯浓度为v/v%=0.3%~0.4%;步骤s1结束后的5~8周内使用的激发液中甲苯二异氰酸酯浓度为v/v%=0.4%~0.6%。
16.最优选地,所述依次递增具体是:步骤s1结束后的1~2周内使用的激发液中甲苯二异氰酸酯浓度为v/v%=0.27%;步骤s1结束后的3~4周内使用的激发液中甲苯二异氰酸酯浓度为v/v%=0.36%;步骤s1结束后的5~8周内使用的激发液中甲苯二异氰酸酯浓度为v/v%=0.45%。
17.优选地,步骤s1中,所述致敏液含有体积比为(450~550):(500~700):3的聚醚醇、植物油和甲苯二异氰酸酯。
18.更优选地,步骤s1中,所述致敏液含有体积比为500:600:3的聚醚醇、植物油和甲苯二异氰酸酯。
19.优选地,步骤s2中,所述激发液含有体积比为(250~350):(700~900):(3~5)的聚醚醇、植物油和甲苯二异氰酸酯。
20.更优选地,步骤s2中,所述激发液含有体积比为300:800:(3~5)的聚醚醇、植物油和甲苯二异氰酸酯。
21.最优选地,步骤s2中,所述步骤s1结束后的1~2周,通过雾化使比格犬吸入聚醚醇、植物油和甲苯二异氰酸酯体积比为300:800:3的激发液;步骤s1结束后的3~4周,通过雾化使比格犬吸入聚醚醇、植物油和甲苯二异氰酸酯体积比为300:800:4的激发液;步骤s1结束后的5~8周,通过雾化使比格犬吸入聚醚醇、植物油和甲苯二异氰酸酯体积比为300:800:5的激发液。
22.另外,上述植物油可为橄榄油、花生油等。
23.传统的卵清蛋白、豚草粉等过敏原致敏机制单一,往往需要在比格犬刚出生时进行早期致敏,并筛选过敏体质的比格犬,才能达到适宜的造模效果,且难以造出重症模型。本发明以含有甲苯二异氰酸酯的特定致敏液和激发液作为过敏原,采用两次致敏结合短期内(8周)多次特定给药激发,可以直接使用成年比格犬造模,不需要筛选过敏体质的比格犬进行造模,且造模步骤简化,可以有效的减少时间成本和动物饲养成本,可在较短的造模周期内构建稳定的比格犬重症哮喘模型。所述比格犬重症哮喘模型构建成功的判定标准为:比格犬有明显咳喘症状,并伴有大量气道分泌物咳出;在未受到呼吸道刺激的情况下,比格犬可出现明显的哮喘急性发作症状,呼吸困难,发绀,支气管镜下可见双肺气管明显痉挛缩窄,并伴有大量分泌物;血清及肺泡灌洗液检测提示为以中性粒细胞为主的混合型粒细胞炎症;气道反应性明显增加;肺组织病理学检测提示出现明显气道重构现象。
24.另外,本发明上述构建比格犬重症哮喘模型的方法中,优选地动物及给药量如下:
25.优选地,所述成年比格犬的年龄为8月龄~12月龄。
26.更优选地,所述成年比格犬的年龄为10月龄。
27.优选地,所述成年比格犬的体重为10~15kg。
28.更优选地,所述成年比格犬的体重为10kg。
29.优选地,所述成年比格犬的耳部为外耳。
30.更优选地,所述成年比格犬的耳部为耳廓。
31.优选地,步骤s1中,所述致敏液与比格犬的体积质量比为(150~200μl):10kg;步骤s2中,所述激发液与比格犬的体积质量比为(10ml~15ml):10kg。
32.更优选地,步骤s1中,所述致敏液与比格犬的体积质量比为200μl:10kg;步骤s2中,所述激发液与比格犬的体积质量比为10ml:10kg。
33.优选地,步骤s2中,所述雾化的时间为2h~2.5h。
34.更优选地,步骤s2中,所述雾化的时间为2h。
35.与现有技术相比,本发明具有以下有益效果:
36.本发明利用成年比格犬构建重症哮喘的动物模型,以含有甲苯二异氰酸酯的特定致敏液和激发液作为过敏原致敏比格犬,并使用特定给药以雾化法阶梯式连续进行多次激发,不仅造模的操作简便、耗费时间短,而且构建的动物模型成功表现出典型的重症哮喘病症,具备剧烈的哮喘症状以及显著的病理改变。本发明填补了重症哮喘动物模型的技术空白,对研制治疗重症哮喘的药物和方法具有重要的应用价值。
附图说明
37.图1为实施例2构建的比格犬重症哮喘模型的血清学检测结果;a为血清中免疫球蛋白e的elisa检测结果;b为血清中免疫球蛋白g的elisa检测结果。
38.图2为比格犬重症哮喘模型的不同乙酰甲胆碱浓度下气道阻力平均变化比例曲线;a为使用实施例2的方法处理的比格犬,在致敏前和激发8周后不同浓度乙酰甲胆碱刺激下气道阻力的平均变化比例的改变情况;b为使用实施例1、2及4的方法处理的比格犬,在不同浓度乙酰甲胆碱刺激下气道阻力的平均变化比例的改变情况。
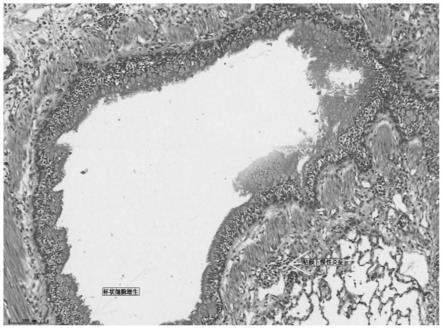
39.图3为实施例2构建的比格犬重症哮喘模型的肺脏病理切片图,可见气管粘膜呈现杯状细胞增生及粘膜下炎症细胞浸润。
40.图4为实施例2构建的比格犬重症哮喘模型的肺脏病理切片图,可见粘膜下小血管增生。
41.图5为实施例2构建的比格犬重症哮喘模型的肺脏病理切片图,可见小气道平滑肌增厚及小气道上皮脱落。
42.图6为实施例1构建的比格犬重症哮喘模型的肺脏病理切片图。
43.图7为实施例4构建的比格犬重症哮喘模型的肺脏病理切片图。
具体实施方式
44.下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。
45.下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
46.聚醚醇(市购):n-乙二醇单十二烷基醚(polidocanol),cas no.3055-99-0,分子式:c
30h62o10
。
47.实施例1一种构建比格犬重症哮喘模型的方法
48.1、实验材料的制备
49.(1)致敏液的制备
50.取1000μl聚醚醇、1200μl橄榄油和6μl甲苯二异氰酸酯(tdi),混合均匀,常温保存,现配现用。
51.(2)激发液的制备
52.取3ml聚醚醇、8ml橄榄油和30μl tdi,混合均匀,常温保存,现配现用。
53.(3)比格犬:挑选成年健康的比格犬(10月龄、体重10kg)。
54.2、构建比格犬重症哮喘模型,步骤如下:
55.(1)抗原致敏
56.在比格犬右耳耳廓滴加200μl致敏液;间隔一周后,在其右耳耳廓再次滴加200μl致敏液。至此,即完成比格犬的致敏。
57.(2)抗原吸入激发
58.雾化吸入激发液:将完成步骤(1)后的清醒状态的比格犬放入1m
×
1m
×
1m的雾化箱中,箱顶设置雾化输入口,四周设置多个通气孔。使用雾化机将10ml激发液雾化后,从雾化输入口将雾化的激发液充入箱中,箱中的比格犬自主吸入雾化的激发液,持续2小时,从而完成抗原吸入激发。
59.在比格犬完成致敏后的1~8周内,每周使用激发液进行2次抗原吸入激发。
60.实施例2一种构建比格犬重症哮喘模型的方法
61.1、实验材料的制备
62.(1)致敏液的制备:同实施例1;
63.(2)不同浓度激发液的制备
64.低浓度激发液:取3ml聚醚醇、8ml橄榄油和30μl tdi,混合均匀,常温保存,现配现用;
65.中浓度激发液:取3ml聚醚醇、8ml橄榄油和40μl tdi,混合均匀常温保存,现配现用;
66.高浓度激发液:取3ml聚醚醇、8ml橄榄油和50μl tdi,混合均匀,常温保存,现配现用。
67.(3)比格犬:同实施例1。
68.2、构建比格犬重症哮喘模型,步骤如下:
69.(1)抗原致敏
70.在比格犬右耳耳廓滴加200μl致敏液;间隔一周后,在其右耳耳廓再次滴加200μl致敏液。至此,即完成比格犬的致敏。
71.(2)抗原吸入激发
72.(2)雾化吸入激发液:将完成步骤(1)后的清醒状态的比格犬放入1m
×
1m
×
1m的雾化箱中,箱顶设置雾化输入口,四周设置多个通气孔。使用雾化机将10ml不同浓度的激发液雾化后,从雾化输入口将雾化的激发液充入箱中,箱中的比格犬自主吸入雾化的激发液,持续2小时,从而完成抗原吸入激发。
73.整个过程持续8周,即在比格犬完成步骤(1)致敏后的1~8周内,每周进行2次抗原吸入激发。具体是致敏后的1~2周内使用低浓度激发液对比格犬进行激发,3~4周内使用
中浓度激发液对比格犬进行激发,5~8周内使用高浓度激发液对比格犬进行激发。
74.实施例3
75.1、实验材料的制备
76.致敏液、比格犬的准备,同实施例2。
77.激发液同实施例2中的高浓度激发液。
78.2、构建比格犬重症哮喘模型,步骤如下:
79.(1)抗原致敏:同实施例1;
80.(2)气管滴注激发
81.气管滴注激发液:将完成步骤(1)后的比格犬麻醉后固定在手术台上,经口送入支气管镜,经支气管镜置入喷洒管,在比格犬左右主支气管各喷洒2ml激发液。
82.实施例4
83.1、实验材料的制备
84.(1)致敏液的制备:
85.2200μl橄榄油和6μl甲苯二异氰酸酯(tdi)混合均匀,常温保存,现配现用。
86.(2)不同浓度激发液的制备
87.低浓度激发液:11ml橄榄油和30μl tdi混合均匀,常温保存,现配现用;
88.中浓度激发液:11ml橄榄油和40μl tdi混合均匀,常温保存,现配现用;
89.高浓度激发液:11ml橄榄油和50μl tdi混合均匀,常温保存,现配现用。
90.(3)比格犬:同实施例1。
91.2、构建哮喘模型的操作步骤同实施例2。
92.应用例1比格犬重症哮喘模型的表征
93.1、实验方法
94.(1)造模分组:
95.如上选取6只成年健康的比格犬,分为三组,分别使用实施例1~3的方法构建模型。
96.(2)各组构建的模型的哮喘表征观测
97.观察比格犬症状,如出现咳嗽、喘息以及口吐分泌物等情况,则比格犬对激发液有反应,即判定为激发有效;如出现明显呼吸困难等哮喘急性发作症状,则判定比格犬形成哮喘表征。
98.支气管镜观察辅助上述判断,如比格犬出现广泛气道粘膜水肿充血、气道分泌物,则比格犬对激发液有反应,即判定为激发有效;如比格犬出现气道明显痉挛缩窄、伴有大量分泌物即哮喘急性发作表现,则进一步判定比格犬形成哮喘表征。
99.2、实验结果
100.使用实施例1的方法处理比格犬,可见比格犬出现明显的咳喘症状,伴有大量气道分泌物咳出,支气管镜见广泛气道粘膜充血水肿,伴有较多气道分泌物。即使用实施例1的方法处理的比格犬表现为重症哮喘。
101.使用实施例2的方法处理的比格犬,可见比格犬出现明显的咳喘症状,伴有大量气道分泌物咳出,支气管镜见广泛气道粘膜充血水肿,伴有较多气道分泌物。此外,在未受到呼吸道刺激的情况下,比格犬可出现明显的哮喘急性发作症状,呼吸困难,发绀,支气管镜
下可见气管明显痉挛缩窄,并伴有大量分泌物,雾化吸入支气管舒张剂无效,在呼吸机支持下最终可恢复正常呼吸功能。即使用实施例2的方法处理的比格犬表现为典型的重症哮喘。
102.使用实施例3的方法处理的比格犬,气管内滴注激发液后,比格犬气管出现明显的充血水肿,伴有剧烈咳嗽、缺氧症状,考虑滴注法会对气道造成过大的刺激,比格犬无法耐受气管内滴注激发液,滴注法完全无法让药液均匀的进入比格犬的肺内,而且局部药物浓度过高会引起不必要的炎症反应,比格犬明显无法耐受气管滴注激发液的造模方式,因此实施例3的方法不适合用于构建比格犬重症哮喘模型。
103.使用实施例4处理的比格犬,可见比格犬出现明显咳喘症状,伴有大量气道分泌物咳出,支气管镜见广泛气道粘膜充血水肿,伴有大量气道分泌物。认为实施例4的方法处理的比格犬表现为重症哮喘症状。
104.以上结果表明,使用实施例1、2及4的方法能够成功构建具有重症哮喘病症的比格犬重症哮喘模型。
105.应用例2比格犬重症哮喘模型的气道炎症
106.1、实验方法
107.(1)造模
108.如上选取8只成年健康的比格犬,使用实施例2的方法构建比格犬重症哮喘模型。
109.(2)静脉血的白细胞分类计数及ige与igg表达情况检测
110.分别于致敏前、激发第4周及激发第8周,使用采血管抽取所有比格犬静脉血。
111.一部分用于静脉血白细胞分类计数(使用全自动血液细胞分析仪进行分类计数),统计白细胞(wbc)、中性粒细胞(neu)、嗜酸性粒细胞(eos)、淋巴细胞(lymph)、单核细胞(mon)的数量。另一部分静脉血离心后分离血清,使用elisa试剂盒(abcam,canine ige elisa试剂盒(ab157700)、canine igg elisa试剂盒(ab157701)),检测比格犬血清中免疫球蛋白e及免疫球蛋白g的表达情况,以致敏前的血清中免疫球蛋白e(ige)及免疫球蛋白g(igg)的表达量作为“基线”。
112.(3)支气管肺泡灌洗液的白细胞分类计数
113.将收集的支气管肺泡灌洗液(balf),经1200rpm离心10分钟后,得到含有白细胞的沉淀细胞。
114.将所得沉淀细胞制成细胞涂片,使用苏木素伊红染色试剂盒(博士德)对细胞涂片进行he染色,显微镜下对balf的白细胞进行分类计数,统计包括中性粒细胞(neu)、嗜酸性粒细胞(eos)、淋巴细胞(lymph)、单核细胞(mon)在内的炎症细胞的数量,计算统计各炎症细胞的百分比。
115.2、实验结果
116.使用实施例2的方法构建比格犬重症哮喘模型,在致敏前、激发第4周及激发第8周的静脉血白细胞分类计数结果如表1所示,支气管肺泡灌洗液炎症细胞百分比的统计结果如表2所示。
117.表1静脉血白细胞分类计数结果
[0118] wbc(10^9)neu(10^9)eos(10^9)lymph(10^9)mon(10^9)致敏前13.169.790.013.320.04激发第4周18.0911.240.595.520.7
激发第8周21.3615.660.274.321.02
[0119]
从表1的结果可以看出,使用实施例2的方法构建的比格犬重症哮喘模型,与致敏前相比,抗原吸入激发第4周、第8周,比格犬血液中的中性粒细胞及嗜酸性粒细胞明显上升,表明雾化吸入激发液有效引发比格犬的全身性过敏性炎症;激发第8周,表明该动物模型成模后表现为中性粒细胞为主的全身性炎症。
[0120]
表2支气管肺泡灌洗液炎症细胞百分比统计结果
[0121] neu(%)eos(%)lymph(%)mon(%)致敏前18.188303.148303.5833072.91670激发后第4周72.2333023.333305.666703.44330激发后第8周91.432005.266000.466002.83400
[0122]
从表2的结果可以看出,使用实施例2的方法构建的比格犬重症哮喘模型,与致敏前相比,激发第4周时,比格犬的气道中表现出中性粒细胞及嗜酸性粒细胞混合性炎症,在激发完成后(激发第8周),气道炎症转为了中性粒细胞为主型炎症。
[0123]
以上结果表明,使用实施例2的方法构建的比格犬重症哮喘模型具有以中性粒细胞为主的混合性粒细胞炎症。
[0124]
如图1中的图a、图b所示,使用实施例2的方法构建的比格犬重症哮喘模型,与致敏前相比,抗原吸入激发后第4周,比格犬血液中的免疫球蛋白e(ige)及免疫球蛋白g(igg)的表达量均明显上升,虽然在激发后第8周略有下降,但仍然维持在较高水平。表明使用实施例2的方法构建的比格犬重症哮喘模型存在明显且持久的全身性炎症。
[0125]
应用例3比格犬重症哮喘模型的气道反应性
[0126]
1、实验方法
[0127]
(1)造模
[0128]
选取成年健康的比格犬12只,使用实施例1、2及4的方法构建比格犬重症哮喘模型。
[0129]
(2)乙酰甲胆碱激发试验
[0130]
分别于致敏前和激发第8周,对所有比格犬进行一次乙酰甲胆碱(mch)激发试验,具体方法如下:
[0131]
通过肌肉注射3%戊巴比妥钠0.5ml/kg及速眠新0.02ml/kg麻醉比格犬;
[0132]
以仰卧位固定比格犬,行气管插管及食道插管,并连接气体流速传感器、差压传感器和biopac生理记录仪;
[0133]
比格犬经气管插管依次雾化吸入pbs、0.1mg/ml、0.3mg/ml、1mg/ml、3mg/ml mch各10个呼吸。
[0134]
(3)气道阻力计算
[0135]
完成吸入10个呼吸后,立即记录5min内比格犬的呼吸流速和跨肺压(食道压近似代替跨肺压),最后使用生理记录仪自带软件功能计算气道阻力,并以pbs为基线数据,计算个mch各浓度刺激气道阻力的平均变化比例,同时计算气道阻力相较基线上升到200%以上所对应的mch浓度即pc200作为评估气道反应性的参照依据。
[0136]
2、实验结果
[0137]
如图2中的图a所示,使用实施例2的方法构建的比格犬重症哮喘模型,相较于致敏
前,激发第8周比格犬的气道阻力出现了明显上升的趋势。如图2中的图b所示,使用实施例1、2及4的方法构建的比格犬重症哮喘模型,均表现出明显的气道反应性提升,但实施例2在小剂量mch(0.1mg/ml)刺激下,即可表现出明显气道阻力增加的趋势,仅需0.1mg/ml的mch刺激即可使比格犬的气道阻力上升到200%以上,pc200为0.1mg/ml,而实施例1及实施例4其对应的pc200则为0.3mg/ml;表明使用实施例2的方法构建比格犬重症哮喘模型可以得到更显著的气道反应性升高。
[0138]
应用例4比格犬重症哮喘模型的肺脏病理表征
[0139]
1、实验方法
[0140]
(1)造模
[0141]
选取成年健康的比格犬12只,使用实施例1、2及4的方法构建比格犬重症哮喘模型。
[0142]
(2)肺脏病理检测
[0143]
激发第8周时,取比格犬的部分肺脏组织,经多聚甲醛固定后制作石蜡切片及苏木素伊红染色。
[0144]
2、实验结果
[0145]
如图3~4所示,使用实施例2的方法构建的比格犬重症哮喘模型的气道组织存在明显的炎症细胞浸润现象,与肺泡灌洗液结果相吻合,以中性粒细胞为主,同时可见气管上皮粘膜呈现明显的杯状细胞增生、粘膜下小血管增生、平滑肌增厚等气道重构的现象。如图5所示,使用实施例2的方法构建比格犬重症哮喘模型的小气道平滑肌呈现明显的增厚及上皮脱落的现象。
[0146]
如图6所示,使用实施例1的方法构建的比格犬重症哮喘模型的气道组织可见到杯状细胞增生、粘膜下小血管增生、平滑肌增厚等气道重构现象,与实施例2所对应的图3~4相比,其气道重构程度明显弱于实施例2。
[0147]
如图7所示,使用实施例4的方法构建的比格犬重症哮喘模型的气道组织可见到杯状细胞增生、粘膜下小血管增生、平滑肌增厚等重构现象,与实施例1和2所对应的图3~4及图6相比,实施例4的气道重构程度弱于实施例2,但强于实施例1。
[0148]
以上结果表明,使用实施例1,2,4的方法构建的比格犬重症哮喘模型存在明显的重症哮喘特征性病理改变,同时气道重构的程度与该模型所表现的哮喘症状严重程度相一致,同时实施例2的病理改变更为显著,是比格犬重症哮喘造模的优选方法。
[0149]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1