一种绿光代替部分红蓝光增强黄瓜幼苗抗旱性的方法
1.本发明涉及植物抗旱领域,尤其涉及一种绿光代替部分红蓝光增强黄瓜幼苗抗旱性的方法。
背景技术:
2.干旱对生态系统造成严重破坏,严重影响植物生长,减少粮食产量,而气孔调节是植物生产力和抗旱性的关键决定因素之一,气孔可以看作是叶片表面的液压阀,它的打开是为了光合作用吸收co2,同时关闭是为了防止水分的过度流失,这对植物在干燥条件下的生存至关重要;
3.气孔的运动受光照、co2和湿度等环境条件的调节,光照条件的各种因素,包括光强、光周期和光质量,都能引起植物的各种生理反应,特别是红光和蓝光作为光合作用最有效的光谱,led人工照明在的设施农业中得到了广泛的应用,尤其是红蓝光作为作为叶绿素吸收最多的光,较其他光质能更有效地促进植物叶片的光合作用,在设施农业中应用最为广泛,而绿光对植物生理活动的重要作用有待进一步研究。
技术实现要素:
4.本发明的目的是解决现有技术存在的以下问题:led人工照明在的设施农业中得到了广泛的应用,尤其是红蓝光作为作为叶绿素吸收最多的光,较其他光质能更有效地促进植物叶片的光合作用,在设施农业中应用最为广泛,而绿光对植物生理活动的重要作用有待进一步研究。
5.为解决现有技术存在的问题,本发明提供一种绿光代替部分红蓝光增强黄瓜幼苗抗旱性的方法,所述增强黄瓜幼苗抗旱性的方法如下:
6.a、选取至少具有两片真叶的黄瓜幼苗;
7.b、采用红光源、蓝光源、绿光源对所述黄瓜幼苗照射培养,绿光源的绿光相对量为25-75μmolm-2
s-1
。
8.优选的,所述红光源、蓝光源、绿光源作用在所述黄瓜幼珠表面的光合量子通量密度总值为250μmolm-2
s-1
。
9.优选的,所述红光、蓝光的相对量比为4:1。
10.优选的,所述红光峰值为660nm、蓝光峰值为450nm、绿光峰值为530nm。
11.优选的,采用不透明的白色塑料反射膜对所述步骤b中黄瓜幼珠遮挡,以避免光干扰。
12.与相关技术相比较,本发明提供的绿光代替部分红蓝光增强黄瓜幼苗抗旱性的方法具有如下有益效果:
13.本发明采用绿光代替部分红、蓝光照射黄瓜植株,提高了黄瓜幼苗的抗旱性,绿光部分替代红光和蓝光,通过上调csgad2的表达增加gaba含量,gaba含量的升高下调了csalmt9的表达,从而促使气孔关闭,提高水分利用效率,增强黄瓜幼苗的抗旱性。
附图说明
14.图1为本发明的光谱图;
15.图2为本发明的植物生长受光谱影响的形态图;
16.图3为本发明的叶片总含水量、自由水、束缚水含量,以及叶片水势受光谱影响图;
17.图4为本发明的pn、gs、tr、wue、iwue受光谱影响图;
18.图5为本发明的叶绿素a、b和类胡萝卜素含量受光谱影响图;
19.图6为本发明的电导率、mda、o
2-、h2o2受光谱影响图;
20.图7为本发明的气孔形态、气孔开度和气孔密度图;
21.图8为本发明的gaba、aba受光谱影响图;
22.图9为本发明的绿光对csgad2、csalmt9相对表达影响示意图;
23.图10为本发明的绿光对黄瓜幼苗抗旱性的调控途径模型图。
具体实施方式
24.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
25.以下结合具体实施例对本发明的具体实现进行详细描述。
26.一、植物材料选择
27.(1)选用若干黄瓜种子表面用高锰酸钾溶液(0.03%)消毒10min后,用蒸馏水浸泡8h,暗室培养48h,使种子发芽;
28.(2)将发芽种子播种在含基质穴盘中,放在人工培养架上生长,光源为白光led灯,光照强度为150μmol m-2
s-1
,昼夜温度为25/20℃,空气湿度为50%,光周期为12h;
29.(2)幼芽萌发后20天左右,将健康、大小相近、有两片真叶的幼苗移栽到填满基质的营养钵中浇水,直到达到饱和。
30.二、干旱处理
31.将幼苗移栽在有人工培养架中,其中白天/夜晚温度为25/20℃,相对湿度为40-50%,并开始干旱胁迫,干旱的方式是停止浇水。
32.三、光照处理
33.(1)如图1和表1所示,选用红、蓝、绿三种颜色的led面板安装在种植架上对幼苗进行照射,通过改变led面板与培养床的距离,调整光合量子通量密度,红光源、蓝光源、绿光源作用在幼苗表面的光合量子通量密度总值为250μmol m-2
s-1
,红光(660nm的峰值)、蓝光(450nm的峰值)和绿光(530nm的峰值)分别进行光处理,在led面板周围放置不透明的白色塑料反射膜,以确保培养床表面的均匀辐射,并防止来自邻近处理的光污染。
34.实施例一
35.红光、蓝光的相对量比为4:1,绿光相对量为0μmol m-2
s-1
(rb)。
36.实施例二
37.红光、蓝光的相对量比为4:1,绿光相对量为25μmol m-2
s-1
(rbg25)。
38.实施例三
39.红光、蓝光的相对量比为4:1,绿光相对量为50μmol m-2
s-1
(rbg50)。
40.实施例四
41.红光、蓝光的相对量比为4:1,绿光相对量为75μmol m-2
s-1
(rbg75)。
[0042][0043]
表1,不同处理下红光(660nm),蓝光(450nm),和绿光(530nm)的光合量子通量密度(ppfd)。
[0044]
样品收集:将光照9天后的四组植株,从植株底部收集第二片完全展开的叶子,立即用液氮冷冻,然后保存在-80℃。
[0045]
形态测定:从茎基部到主茎顶部测量植株长度;
[0046]
茎的直径是从茎基部以上约0.5cm处测量;
[0047]
用根扫描仪扫描叶片表面积和根系形态指标,包括根系总长度、根系表面积和根系体积获取数字图像,再进行数据采集;
[0048]
单位面积叶干质量的计算方法为hern
á
ndez和kubota,从每片样品叶片上取一定面积的叶盘,先置于105℃烘箱中15min,再置于80℃烘箱中保存至恒重,lma计算为叶面积与干质量的比值。
[0049]
地上部和地下部先在105℃烘箱中保存15min,然后在80℃烘箱中保存至恒重,用电子天平测定地上(下)部鲜重和干重(fw/dw)。
[0050]
叶片水分状况测定:叶片总含水量以鲜重与干重之差值与干重之比值计算,自由水和束缚水含量采用marlin chick法测定,用小流量法测定叶片水势。
[0051]
气体交换参数和光合色素的测定
[0052]
采用光合仪分别测定了从底部开始的第2片真叶在处理第3、6和9d的净光合速率(pn)、气孔导度(gs)和蒸腾速率(tr)等气体交换指标,光合量子通量密度(400μmol m-2
s-1
)、环境co2浓度(380μmol mol-1
)、叶片温度(25℃)、相对湿度(70%)均保持不变,此外,叶片的内在水分利用效率(wue)和瞬时水分利用效率(iwue)分别为pn与tr、pn与gs的比值,处理9天后,取植株底部第一片叶片测定光合色素,叶组织(0.1g fw)浸泡在10毫升80%(v/v)丙酮中直至叶子的颜色变白,用提取液测叶绿素含量,取663nm,645nm和440nm处的吸光度。
[0053]
相对电导率及丙二醛(mda)含量的测定
[0054]
从最下面的主叶上打孔的5片相同大小的叶片(约0.1g)放入装有10ml蒸馏水的试管中,在室温下浸泡12h后,用电导率仪测量电导率,记为r1,然后将试管煮沸30min,测量电导率,记录为r2,计算相对电导率(r1/r2)
×
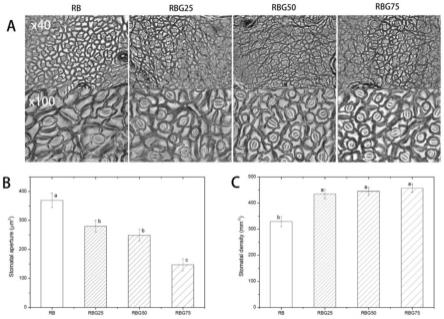
100%。
[0055]
mda含量采用mda含量检测试剂盒分光光度法测定,简单地说,在0.1g叶组织中加入1ml提取液进行冰浴匀浆,然后在4℃离心8000g 10分钟,提取上清,按照说明书加入药物,将混合物在100℃的水浴中保温60分钟(盖紧以防止水分流失),然后在室温冰浴中冷却,10000g离心10分钟,将上清液倒入1ml的玻璃比色皿中,取450nm、532nm和600nm处的吸
光度计算mda含量。
[0056]
过氧化氢(h2o2)和超氧阴离子(o
2-)含量的测定
[0057]
黄瓜叶片h2o2含量检测采用试剂盒分光光度法测定,简单地说,在0.1g叶组织中加入1ml提取液进行冰浴匀浆,然后离心8000g,4℃离心10分钟,提取上清,按照说明加入药物,用415nm处检测的吸光度计算h2o2的含量。
[0058]
采用o
2-含量检测试剂盒分光光度法测定黄瓜叶片中o
2-的含量,简单地说,在0.1g叶组织中加入1ml提取液进行冰浴匀浆,4℃离心12000g 20分钟,提取上清,按照说明加入药物,将混合物在25℃下离心8000g 5分钟,用415nm处检测的吸光度计算o
2-含量,将标准溶液稀释至0.125、0.0625、0.03125、0.015625、0.0078125、0.0039μmol/ml标准溶液,用这些标准管作为标准曲线。
[0059]
气孔形态指标的测定
[0060]
气孔形态采用指甲油印迹法,在不同处理相似位置完全展开的叶片上取样,将透明指甲油涂抹在叶片背面避开叶脉均匀刷一层薄薄的指甲油,待指甲油自然晾干用镊子直接油膜,在载玻片上,通过eclipse e200显微镜结合ds-fi3相机进行观察,气孔孔径和密度采用颗粒分析法进行分析。
[0061]
aba含量测定
[0062]
aba含量的分析采用高效液相色谱法(hplc),首先提取激素,0.5g叶组织用液氮快速磨成粉末,放入10ml离心管中,加入提取物5ml(正丙醇:蒸馏水:盐酸=2:1:0.002v:v)和在振动台100rpm,4℃震动30min,取出离心管,加上2ml二氯甲烷,并再次震动30min,之后放入离心机13000转4℃离心5min,吸收2ml的上层清液放入冻干瓶中,储存在-80℃下14h,再放入冷冻干燥机(24h)冷冻干燥成白色粉末,加入200μl的50%甲醇溶液,用0.22μm有机滤膜过滤,上机检测,柱温设置为35℃,溶剂为超纯水、10%甲酸水溶液、乙腈和甲醇,洗脱方式为等度洗脱。
[0063]
γ-氨基丁酸(gaba)含量的测定
[0064]
使用高效液相色谱(hplc)测定gaba浓度。首先,提取样本,将0.5g样本研磨后加入2ml 60%乙醇溶液振荡旋涡10min,在室温下超声萃取40min,4000r/min离心15min,将上清液被转移到另一个离心管,重复萃取1次,将2次上清混合,吹氮气至水相,最后用超纯水定容至4ml。其次,衍生化,取0.5ml样品溶液,加入1ml 0.5mol/l ph=9.0de碳酸氢钠溶液,再加入1ml dnfb解决方案,涡流搅拌1min,之后进行60℃恒温水浴,避免光反应60min,取出冷却至室温,取ph=7.0的磷酸盐缓冲定容至5ml涡旋搅拌1min,暗置15min,取1ml,通过0.22μm滤膜进行测试。柱温设置为40℃,溶剂为ph=5.31mol/l乙酸钠溶液和1:1(v/v)甲醇水溶液,洗脱方式为等度洗脱。
[0065]
总rna提取和实时qrt-pcr
[0066]
为了阐明绿色光照对gaba合成相关基因和气孔孔相关基因相对表达量的影响,随机选取9株植物(每个样品3株,每个处理3个样品)底部开始数的第二片真叶,使用总rna提取试剂盒(天根生物技术北京有限公司,中国北京)提取总rna,用superreal荧光定量预混试剂试剂盒(天根生物技术北京有限公司,中国北京)合成cdna,使用roche molecular systems公司的96系统(96,德国)进行逆转录pcr定量,采用2
‑△△
ct
法计算基因相对表达量。
[0067]
统计分析
[0068]
所有实验至少有3个独立重复,结果用平均值
±
标准误差表示。数据进行单因素方差分析,并运用duncan’s检验法对显著性差异(p《0.05)进行多重比较。。
[0069]
分析了处理第9天,不同处理(rb、rbg25、rbg50和rbg75)生长的影响,干旱条件下,除根鲜重外,植株生长受到光谱组成的显著影响(图2和表2),与对照(rb)相比,干旱条件下绿光部分替代红光和蓝光改善了植株生长,表现为较高的地上部鲜重、地上干重、根干重、株高、茎粗、叶面积和lma。
[0070]
rbg50和rbg75处理的地上鲜重显著高于rb,分别增加了10.61%和9.09%,但rbg25与rb差异不显著,各绿光补充处理的地上部干重均显著高于rb处理,与对照相比,rbg25、rbg50和rbg75处理下的地上干重增幅分别为1%、2%和3%。rbg50处理的根干重显著高于rb处理,比rb处理高66.13%,但与其他处理差异不显著。
[0071]
各绿光补充处理的株高均显著高于rb处理,尤其是rbg75,与rb相比,rbg25、rbg50和rbg75处理株高增加率分别为4.38%、6.22%和12.20%,rbg50处理的茎粗最大,其次为rbg25;与对照相比,rbg25和rbg50处理的茎粗增加率分别为5.13%和10.12%。rbg25与rb的茎粗无显著差异。
[0072]
叶面积以rbg25处理最高,rbg50次之,rb处理最低,与rb相比,rbg25和rbg50的叶面积分别增加了7.08%和4.10%,rbg25和rbg50处理的lma显著高于rb处理,与rb相比,rbg25和rbg50的叶面积分别增加了7.08%和4.10%。
[0073][0074]
表2,不同光谱条件下,干旱处理9天的黄瓜幼苗形态指标,数据表示为平均值
±
标准误差(n=3),各列不同字母表示各处理间差异显著(p《0.05)。
[0075]
以上结果表明,在干旱条件下,绿光部分替代红光和蓝光对黄瓜幼苗的生长有一定的促进作用。
[0076]
干旱胁迫下,绿光部分取代红光和蓝光促进黄瓜幼苗根系生长
[0077]
不同光照处理下第9天黄瓜幼苗的根长、平均根径、总根体积和根尖数见表3和图2,干旱条件下,rbg25、rbg50和rbg75处理的根系总体积比对照(rb)分别增加了33.33%、93.33%和111.11%。rbg50和rbg75处理的平均根径显著高于rb处理,分别增加了34.67%和26.67%。rbg25和rbg50处理的根尖数量显著高于rb处理,分别增加了106.67%和
78.35%;但不同处理间总根长无显著差异。
[0078][0079][0080]
表3,不同光谱条件下,干旱胁迫9天后对黄瓜幼苗根系总长度、平均根径、根系总体积和根尖数,数据表示为平均值
±
标准误差(n=3).各列不同字母表示各处理间差异显著(p《0.05)。
[0081]
绿光部分替代红光和蓝光改善了干旱胁迫下黄瓜幼苗的水分状况
[0082]
干旱胁迫下,与rb处理相比,rbg50和rbg75处理显著提高了叶片总含水量(图3a),各绿光处理下的自由水含量均显著高于rb,尤其是rbg50和rbg75,但各处理间束缚水含量无显著差异。
[0083]
结果表明,绿光部分替代红光和蓝光提高了植株的总含水量,尤其是自由水含水量,改善了叶片水分状况,缓解了干旱胁迫对植株水分的损失。
[0084]
绿光部分替代红光,蓝光通过降低gs和tr提高wue,同时保持较高的pn[0085]
净光合速率(pn)、气孔导度(gs)和蒸腾速率(tr)均随处理时间的延长而显著降低(图4a、b、c),干旱处理6d后,pn受光谱影响显著,适宜的绿光缓解了干旱对光合作用的不利影响,使光合作用保持在较高水平,而随着绿光含量的增加,pn呈现先增加后降低的趋势(图4a)。
[0086]
光谱对gs变化趋势的影响与对tr的影响相似,绿光在第6天和第9天降低了gs和tr(图4b,c),与rb相比,rbg50和rbg75显著降低了gs,rbg25对气孔导度的影响不显著,在第6天和第9天,rbg75下gs值最低,其次是rbg50,然后是rbg25和rb(图4b),rbg25、rbg50和rbg75处理第6天的tr均显著低于rb,rbg50和ebg75下的tr显著低于rbg25,在第6天和第9天,rbg75和rbg50处理下的tr值最低,其次是rbg25,然后是rb(图4c)。
[0087]
干旱胁迫导致水分利用效率(wue)和瞬时水分利用效率(iwue)增加(图4d、e),由于绿光的影响,叶片的wue和iwue在第6天和第9天显著提高,干旱处理6天后,rbg50处理的wue最高,其次是rbg25和rbg75,其次是rb(图4d),而iwue在rbg50和rbg75下最高,其次是rbg25,rb下最低(图4e),处理第9天,rbg25、rbg50和rbg75之间的wue和iwue差异不显著,但是以上处理均明显高于rb。
[0088]
与rb相比,rbg50显著增加了叶绿素a和b的含量(图5a),然而,不同处理之间的类胡萝卜素含量没有显著差异(图5b)。
[0089]
绿光部分取代红光,蓝光减弱干旱胁迫对黄瓜幼苗脂质过氧化的影响
[0090]
干旱处理9天后,光谱对相对电导率和mda含量有显著影响(图6a、b),与rb相比,绿光替代蓝光和红光的比例显著降低了黄瓜叶片的相对电导率和mda含量,相对电导率在rbg50中最低,其次是rbg75,然后是rbg25,rb最高(图6a),光谱对mda含量的影响与相对电导率的影响相似(图6b)。
[0091]
干旱条件下,随着光谱中绿光强度的增加,o
2-和h2o2含量急剧下降(图6c、d),干旱处理9天后,rbg25、rbg50和rbg75的o
2-和h2o2含量较rb显著降低(图6c、d)。
[0092]
这些结果表明,绿光通过减轻干旱胁迫对植物的危害,对提高植物的抗旱性具有积极作用。
[0093]
干旱胁迫下,绿光部分取代红光和蓝光影响黄瓜幼苗气孔形态,增加gaba和aba含量。
[0094]
干旱处理9d后,气孔形态(图7)、γ-氨基丁酸(gaba)和脱落酸(aba)含量受到光谱的显著影响(图8a、b),绿光的加入对气孔发育有显著影响,绿光替代蓝光和红光的比例诱导气孔关闭,气孔密度增加,气孔面积减小(图7),与rb相比,gaba和aba含量显著增加(图8a、b),rbg50的aba含量最高,其次是rbg25和rbg75,rb的aba含量最低(图8a),gaba含量随着光谱中绿光比例的增加而增加(图8b)。
[0095]
绿光部分取代红光,蓝光上调谷氨酸脱羧酶2(csgad2)转录水平,下调铝活化苹果酸转运蛋白9(csalmt9)转录水平
[0096][0097]
表4,用于基因表达分析的引物
[0098]
csgad2(glutamate decarboxylase 2,为gaba的主合成基因)和csalmt9(aluminium-activated malate transporter 9,为气孔打开调节基因)的相对表达量如图9所示,干旱处理9天后,绿光部分替代红光和蓝光,csgad2转录水平上调,csalmt9转录水平下调(图9a、b)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1