富含亚氨基糖类的N-酸类和/或2-哌啶酸类的桑提取物的制作方法
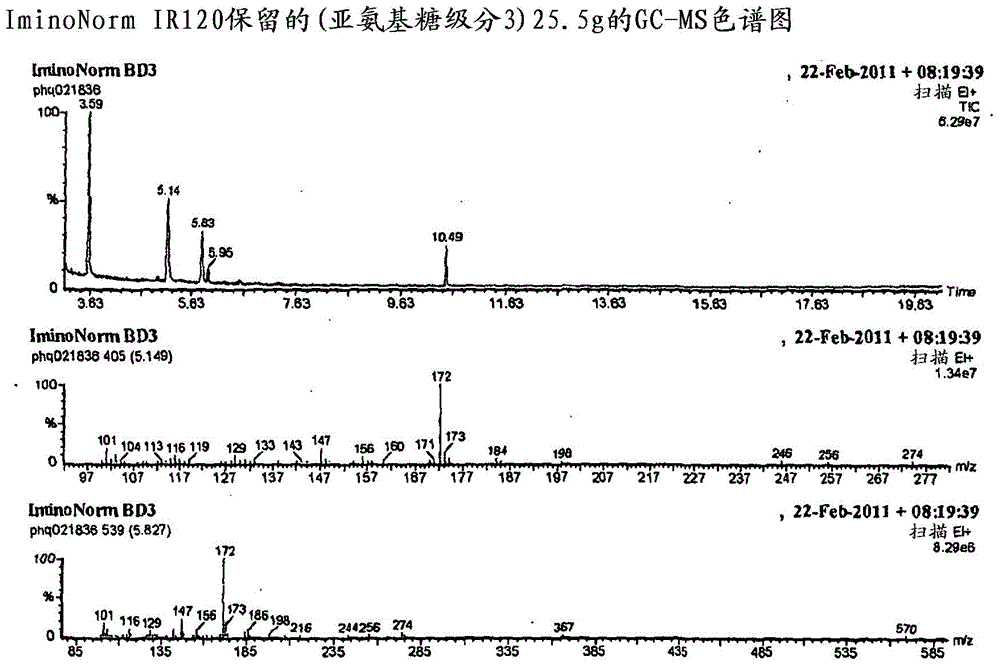
所述提取物已经显示出具有酶催化活性,这使该富含这些化合物的提取物,和从这些提取物分离的化合物成为用于治疗疾病,特别地而非排他性地治疗代谢障碍比如例如糖尿病的良好候选物。定义亚氨基糖类是一类广泛分布的植物和微生物的化合物,其具有与人糖苷酶、其它蛋白和糖受体相互作用的能力。在本说明书中,其被认为是多羟基化的仲胺和叔胺,其中所述分子类似于单糖糖类,但是其中环氧被氮代替。存在适合该类别的5种环结构,其是天然最常见的:a.吡咯烷,b.哌啶,c.吡咯双烷,d.吲哚里西啶,和e.降托烷(nor-tropane)。在自然中,这些水溶性次级植物化合物的存在主要被其它以更大量存在的水溶性初级化合物比如例如∶常见糖类、肽类和氨基酸类所掩盖,并且其它亚氨基糖酸类(ISA)也被如下占优势的碱性亚氨基糖所掩盖:比如:a.1脱氧野尻霉素(DNJ),b.桑叶生物碱(fagomine),c.1,4-二脱氧-1,4-亚氨基-D-阿拉伯糖醇(DAB),和d.打碗花精(calystegine)B2。本发明的新提取物富含前述亚氨基糖类的N-酸类,并且包括但不限于亚氨基糖类的N-烷链烷酸,比如N-乙酸、丙酸和丁酸DAB及N-乙酸、丙酸和丁酸DNJ。它们也富含2-哌啶酸类。富含指亚氨基糖类的N-酸类和/或2-哌啶酸类在提取物中的存在量为以重量计大于5%、更优选地大于10%、更优选地仍然大于15%(wt/wt)。优选地,包含亚氨基糖类的N-酸类和2-哌啶酸类的级分占大于10%、至20%,和30%至40%、50%、60%、70%、80%90%或以上(wt/wt)。提取物中存在的其它组分可以包括寡糖组分和氨基酸组分。对于提取物,典型的质量平衡为:a.亚氨基糖酸类5-25%,典型地为15%;b.2-哌啶酸类5-35%,典型地为20%;c.寡糖类5-25%,典型地为15%;和d.氨基酸类(中性和酸性)25-75%,典型地为50%。然而,可能的是,减少寡糖和氨基酸成分,以提高亚氨基糖酸类和2-哌啶酸类的相对量,从而使得它们含有提取物的初级成分,和/或由其中分离单独化合物。
背景技术:
:在1976年,Yagi等人研究了桑葚植物分离的DNJ的抗糖尿病活性,发现它是α和β葡糖苷酶的酶家族的有效抑制剂。接着,对DNJ骨架应用药物化学,产生N-羟乙基DNJ(米格列醇),其已经成功地开发为抗糖尿病药然而,其具有广泛糖苷酶活性,会引起副作用。本发明是WO2011/032502中公开的提取物的发展,WO2011/032502描述了从桑葚植物叶得到的提取物,其抑制α葡糖苷酶并且可用于控制血糖水平。说明书教导了所述提取物富含亚氨基糖类,包含至多40%重量。该提取物另外包含至多70%的氨基酸类。所描述的提取物是水易溶性的,颜色为浅黄色或接近白色,在1%水溶液中具有5.5-6.5的pH,并且在218和263nm处具有最大吸收峰。教导的是,该提取物适用于控制血糖水平。实例显示该组合物包括含量为提取物的5.2%-39%(w/w)的亚氨基糖类,初级亚氨基糖DNJ的存在量为总提取物的1.4%-18.6%(w/w),但是在所有情形中,DNJ含量占亚氨基酸含量的至少19%(w/w)(通过其DNJ、N-甲基DNJ和桑叶生物碱含量来测量)。提取物是通过如下制备的:a.进行水或乙醇提取;b.用强酸性阳离子交换树脂进行柱色谱,并且收集用氨水洗脱的被结合的级分;c.对洗脱液进行使用大孔树脂的柱色谱,收集洗脱液;和d.浓缩且干燥提取物。观察到在实施例1(5.8%DNJ,21%的总亚氨基糖类)中的IC50(抑制α葡糖苷酶)为13.6μg/ml,与之相比纯DNJ的IC50为70μg/ml。提取物中鉴别的其它亚氨基糖类包括1,4-双脱氧-1,4-亚氨基-D-阿拉伯糖醇(DAB)、2-Oα-D-吡喃半乳糖基-DNJ(GAL-DNJ)和打碗花精B2。而且,注意到DAB是糖原磷酸化酶抑制剂。得到的级分典型地包括约0.04-1.4%(w/w)的起始原料(桑叶)。包含大量DNJ(典型地为5-10%重量的DNJ)的这些及其它桑提取物的问题是DNJ不是任何一种α-葡糖苷酶的选择性抑制剂,因此,包含大量DNJ的提取物由于抑制多种葡糖苷酶(包括消化性二糖酶类)产生副作用。寻求采用单一药物实体治疗新陈代谢疾病的其它问题是这些药物通常经由单一机制起作用,而大多数代谢障碍的特征是多重效应,其将受益于通过多种机制治疗而不仅仅是减少消化道的葡萄糖摄取。本发明的一个目的是开发组合物或分离化合物,所述组合物或化合物可以以多种水平起作用或提供更多特异性,如此它们很可能被证实在治疗疾病比如代谢障碍中更有效和/或更安全,并且可以是预防剂或治疗剂。发明简述根据本发明的第一个方面,提供从桑叶可获得的纯化的提取物,特征在于其为a.水溶性的;b.抑制α-葡糖苷酶,和c.包括大于提取物重量的5%(w/w)的亚氨基糖的N-酸类和/或2-哌啶酸类。优选地,亚氨基糖的N-酸类和/或2-哌啶酸类占所述提取物的至少10%至15%、至20%、至30%(w/w)或以上。优选地,亚氨基糖类的N-酸类包括DAB、DNJ、桑叶生物碱或打碗花精B2的一种或多种的C1-C9烷链烷酸。这些包括乙酸、丙酸和丁酸。优选地,所述提取物进一步抑制糖原磷酸化酶。该活性可以在不存在DAB的情况下存在。优选地,所述提取物优选地且选择性地抑制稻米α葡糖苷酶。纯化的提取物可以进一步包含寡糖类和氨基酸类。在一个优选的实施方案中,纯化的提取物具有质量平衡,其中:a.亚氨基糖酸类占提取物重量的5-25%;b.2-哌啶酸类占提取物重量的5-35%;c.寡糖类占提取物重量的5-25%;和d.氨基酸类占提取物重量的25-75%。氨基酸主要地包括酸性氨基酸类,寡糖类包括含有脱氧糖类、芳基糖苷类和糖醛酸类的稀有的三糖类和更大糖类。大部分非酸性亚氨基糖类(比如DNJ和DAB)被除去,因此亚氨基糖类包括亚氨基酸含量的小于19%(w/w)的DNJ至小于15%的(w/w)至10%(w/w)、至5%(w/w)、至3%(w/w)、至1%(w/w)的DNJ。纯化的提取物为白色半结晶或无定形物质,并且相对于起始原料的重量纯化倍率(factor)为至少200,通常超过1000。纯化的提取物也可以起下述的一种或多种的抑制剂作用:柚苷酶、葡糖苷酶、或甘露糖苷酶;葡糖醛酸糖苷酶或氨基已糖苷酶;或α和β半乳糖苷酶或艾杜糖醛酸酶(I-d-uronidase)。提取物得自a.桑(MorusalbaL.),b.鲁桑(Morusalbavar.multicaulisL)c.黑桑(Morusnigra)或d.鸡桑(MorusaustralisPoir)。纯化的提取物是使用强酸性阳离子交换树脂获得的,并且可以在纯化过程中进一步使用强碱性阴离子交换树脂和/或弱碱性阴离子交换树脂。其中DNJ不是初级亚氨基糖的提取物的选择违背了常规思维。之前没有提出过使用从植物桑(Morus)的叶可获得的富含亚氨基糖类的N-酸类(与碱性亚氨基糖类相对的)和/或2-哌啶酸类的提取物。本发明的提取物是有效的桑叶提取物,其富含酸性亚氨基糖类和2-哌啶酸类(且包含极少的DNJ或DAB)。相反,大多数市售可获得的桑叶提取物具有其中DNJ是最大量亚氨基糖(通常占桑叶亚氨基糖的50%)的亚氨基糖含量(Asanoetal.2001J.Agric.FoodChem.49:4208-4213)。本发明的提取物富含亚氨基糖酸类(ISA)和/或2-哌啶酸类,其可以在有或没有其它组分比如寡糖类和氨基酸类的情况下存在。存在的ISA典型结构包括下述通式1至5的化合物:式1R-DAB其中R为C1-C9直链烷酸基,比如乙酸基、丙酸基或丁酸基。式2R-DNJ其中R为C1-C9直链烷酸基,比如乙酸基、丙酸基或丁酸基。式3R-桑叶生物碱其中R为C1-C9直链烷酸基,比如乙酸基、丙酸基或丁酸基。式4R-5-羟基2-哌啶酸类其中R为C1-C9直链烷酸基,比如乙酸基、丙酸基或丁酸基,和式5R-打碗花精B2其中R为C1-C9直链烷酸基,比如乙酸基、丙酸基或丁酸基。对于亚氨基糖DNJ是非选择性的、而反而对于ISA含量和/或2-哌啶酸是选择性的、且实质上富含ISA内容物和/或2-哌啶酸的提取物与任何报道的桑叶提取物截然不同。更特别地,它们在下述方面不同:(1)本发明的提取物是新的,与常规桑叶提取物具有完全不同的化学特性。本发明的提取物的最显著且重要的化学特性之一是提供多种N-取代的亚氨基糖,其被认为是来自亚氨基糖的有希望的药物候选物来源。取代的亚氨基糖的成功实例包括N-烷基化亚氨基糖,其仅有两种经批准的亚氨基糖基药,米格列醇(Glyset)-标明用于II型糖尿病,其是N-2-羟乙基烷基化的亚氨基糖,和美格鲁特(Zavesca),正丁基-DNJ,用于I型高歇氏病和C型NiemannPick疾病,然而本发明教导N-链烷酸取代。(2)本发明的提取物具有与常用桑叶提取物不同且可能有利的生物活性特性,例如,在增强治疗效果的酶抑制作用方面特异性更强,并且降低了副作用。由DNJ引起的GI副作用应归于其非选择性抑制葡糖苷酶,并且可以通过降低DNJ含量使GI副作用最小化。另外,N-烷基取代的ISA可改变活性分子的亲水性/疏水性,以改善它们的生物利用度和膜透性或结合亲和力。而且,富含ISA的组合物可提高活性化合物的立体结构(例如,手性)的易变性,允许伴侣(chaperon)介导的活性机制参与治疗相应疾病,比如溶酶体贮积症。(3)本发明的提取物由于其上述提及的独特性,可以具有扩展的治疗谱:代谢综合征、I型和II型糖尿病到抗病毒、抗炎或比如罕见疾病如I型高歇氏病。(4)本发明的提取物应当具有更好的安全特性。桑叶是一种自身非常安全的药用植物物质,是蚕的唯一食物,并且在传统医学中已经以未加工形式或水煎剂形式用于人类数千年。(5)本发明的提取物的制造方法可以容易地按比例放大,而无需使用有机溶剂。在常规植物化学研究和大多数目前的商业生产方法中,通常通过使用多种不同极性的有机溶剂比如乙醇、甲醇、乙酸乙酯、丙酮、二氯甲烷等获得并浓缩植物提取物。水溶性组分保留在植物物质中或者在纯化过程中被弃去。更通常地,该方法很难(即使不是不可能)按比例放大重复,并且最终提取物中的溶剂残留可能成为一个问题。因此,生产根据本发明富含亚氨基糖类的N-酸类和2-哌啶酸类的提取物,除了在WO2011/032502中教导的之外还包括分馏步骤。优选的方法包括使用多种离子交换技术,其包括使用::a.强酸性阳离子交换树脂,比如Dowex50或IR120;b.强碱性阴离子交换树脂,比如Dowex1、Dowex2或AmberliteCG400;和c.弱碱性阴离子交换树脂,比如AmberliteIR45。根据本发明的一个进一步的方面,提供一种包括本发明的提取物的药物制剂、食品补充剂或食物成分。根据本发明的一个仍然进一步的方面,提供使用本发明的纯化的提取物治疗代谢障碍的用途。提取物可以提供下述的一种或多种∶a.降低胰岛素抵抗;b.体重减轻;c.血脂控制;和d.β-细胞保护。在一个优选的实施方案中,所述提取物用于治疗糖尿病。根据本发明的一个仍然进一步的方面,提供一种制备本发明的纯化提取物的方法,包括如下步骤:a.从桑叶获得水溶性提取物;b.使用强酸性阳离子交换树脂结合期望级分,用水洗涤,然后用氨水洗脱期望级分来选择富含亚氨基的级分;和c.使用下述的一种或多种选择酸性级分:i.第二种强酸性阳离子交换树脂;ii.强碱性阴离子交换树脂;和iii.弱碱离子交换树脂。优选地,在步骤ci)中,选取未保留的级分,将所述级分通过使用cii)和ciii)的一种或多种进一步纯化。根据本发明的仍然一个进一步的方面,提供一种筛选用于治疗代谢障碍的化合物的方法,包括从本发明的提取物分离化合物和筛选其酶活性。附图简述参照下述实施例和与实施例4和5有关的附图进一步描述本发明,其仅仅作为举例,其中:图1为PhynoRadiance粗提取物的GC-MS色谱图;图2为IminoNorm粗提取物的GC-MS色谱图;图3在9.5分钟亚氨基糖的质谱(tms);图4为PhynoRadianceIR120保留的(亚氨基糖级分)1.38g的GC-MS色谱图;图5为IminoNormIR120保留的(亚氨基糖级分1)6.14g的GC-MS色谱图;图6a和b为来自IminoNorm还没有鉴别的两种亚氨基糖的质谱;图7a和b为IminoNormIR120保留的(亚氨基糖级分2)23g的GC-MS色谱图的桑叶生物碱的质谱;图8a、b和c为IminoNormIR120保留的(亚氨基糖级分3)25.5g的GC-MS色谱图和羟基化2-哌啶酸的两种质谱;图9为来自PhynoRadiance的DNJ的N-乙酸(tms)的质谱;图10为来自PhynoRadiance的DAB-N-乙酸(tms)的质谱;图11为来自IminoNorm的DNJ的N-乙酸(tms)的质谱;图12为来自IminoNorm的DAB-N-乙酸(tms)的质谱;图13为来自IminoNorm的DNJ的N-丙酸(tms)的质谱;和图14为显示本发明的提取物对小鼠血糖水平的影响的图。详细说明如下给出的实施例举例说明了,可以如何制备本发明要求保护的提取物和分离化合物以及如何用于治疗所述病症,该实施例仅提供作为举例。所述发明考虑的起始点为WO2011/032502中公开的提取物。与常规原理不同,本申请人注意到提取物的α苷酶活性大于纯DNJ,决定除去DNJ,并观察不同子级分的活性。这些实验鉴别了显示出良好的活性的富含亚氨基糖的N-酸和2-哌啶酸的级分,并且导致该发现的实验细节为如下列出的:实施例1起始提取物桑叶的干提取物,批次ML091210方法将样品溶于水中,通过强酸性阳离子交换(柱2×30cm中的IR120H+形式树脂)分馏,得到i.水转移的未保留的样品(预期主要包含糖类、类黄酮类等);ii.2M吡啶转移的结合级分(通常除去剩余糖类、酚类及中性和酸性氨基酸类);和iii.2M氨水溶液转移的结合级分(预期包含任何生物碱类[亚氨基糖类]和碱性氨基酸类)在未保留的物质中检测到某些DNJ(或许是由于样品过载或pH导致),因而使其通过第二个IR120柱(相同尺寸),得到新的未保留的样品和第二种氨水级分。第二种未保留的样品不包含DNJ。将级分列在下表1中:将该级分冷冻干燥并称重。通过GC-MS和500MHzNMR色谱(在D2O中)分析等分试样。通过GC-MS和NMR数据测定DNJ含量。GC-MS在衍生化之前,将所有样品冷冻干燥。使用六甲基二硅氮烷和三甲基氯硅烷在吡啶中的混合物(Pierce‘TriSil’硅烷化试剂,2:1:10比例的HMDS:TMCS:吡啶)制备三甲基甲硅烷基(TMS)衍生物。在60℃下加热样品15分钟,然后静置在室温下至少60分钟。通过离心沉降不溶性反应产物,并使用注射器将上清液转移到新小瓶中。通过GC-MS,采用高极性熔融-二氧化硅柱(Varian‘FactorFour’VF-5ms柱,25mx0.25mm内径(i.d.),0.25μm相厚度),使用PerkinElmerAutosystemXL气相色谱仪进行分析。载体气体(氦)流速为1ml分钟-1。使用温度程序分离三甲基甲硅烷基-(TMS)衍生物,其开始于160℃5分钟,接着以10℃分钟-1的速率线性递增至300℃。将温度再保持在300℃下10分钟;总分析时间为29分钟。使用PerkinElmerTurboMassGold质谱仪进行柱洗脱液的电子轰击质谱法,在分析期间其固定在250℃下进行,所述质谱仪具有四极离子过滤系统。检测器的质量范围设置在100至650amu。传输线(GC至MS)的温度保持在250℃。通过装有去活化(deactivated)石英毛的熔凝二氧化硅窄孔注射衬垫,经由分流出口(分流比50:1)将样品注入所述柱上;进样口温度保持在200℃。注射体积为1μl。使用PerkinElmerTurboMass软件(TurboMassv.4.4)进行系统控制、数据收集和质谱分析。通过比较样品的峰面积(在小瓶中每个样品1mg)进行DNJ定量,使用纯DNJ(每小瓶0.05-0.33mg)制备校准曲线。通过使用NMR数据估计样品的DNJ,确认定量。糖苷酶测定该测定使用购自Sigma-Aldrich的对-硝基苯基底物和市售酶。在27℃下,在0.1M柠檬酸/0.2M磷酸氢二钠缓冲液中、在酶的最适pH值,测定酶。培养混合物由10μl酶溶液、10μl的10mg/ml提取物的水溶液、和50μl在缓冲液(酶的最适pH值)中制备的合适的5mM对-硝基苯基底物组成。在反应的指数期期间,通过加入70μl的0.4M甘氨酸(pH10.4)终止反应,在开始时,使用其中水替代桑级分的未限制测定对所述反应进行测定。使用Versamax微板读数器(MolecularDevices)在405nm处读取最终吸光度。进行测定,一式三份,给出值为每次测定的三次重复的平均值。结果表示为抑制%。结果IR120级分的GC-MS色谱图(没有显示)全部由DNJ占重要的地位。在第二次IR120柱之后,未保留的物质主要是糖类,并且不包含DNJ或其它亚氨基糖。也通过其特征性质谱检测其它亚氨基糖和亚氨基糖酸(羟基化的非蛋白亚氨基酸)。测定三种保留级分b)、c)和d)-表1中的DNJ水平,并显示在表2中:通过GC-MS定量样品中的DNJ表2假定桑叶生物碱、DAB、2-哌啶酸类(合并的)和13.35分钟的亚氨基糖的检测器响应相同,则10g中这些化合物的含量估计为:NMR分析(没有显示)显示,在IR120上未保留的物质主要是糖类;阳离子交换之后,该级分占10g样品的约50%重量。含有DNJ的主要含氮组分测定为氨基酸(精确鉴别不可行,但是通过GC-MS试验性鉴别了苯丙氨酸和脯氨酸)。糖苷酶测定室内糖苷酶测定结果显示在表3中。鉴于存在显著量的DNJ,预期IR120保留级分抑制α-和β-葡糖苷酶。其它糖苷酶类比如葡糖醛酸糖苷酶和氨基已糖苷酶的抑制不能归因于DNJ、DAB或桑叶生物碱。可能的是,鉴别为2-哌啶酸的主要组分负责这些其它糖苷酶抑制。在包括糖尿病的许多疾病中观察到的是,升高的血清水平的葡糖醛酸糖苷酶和氨基已糖苷酶活性。讨论IR120保留级分都包含DNJ,但是分析和糖苷酶结果显示存在更宽范围的糖苷酶抑制剂。IR120未保留物质也显示令人惊奇的某些糖苷酶抑制,但是这可能归因于在该级分中主要的糖类,并且可受糖苷酶测定的干扰。DNJ、DAB和桑叶生物碱全部是葡糖苷酶抑制剂,令人感兴趣的是IR120保留级分得到良好的糖苷酶抑制,其不受DNJ影响。已知在包括糖尿病的多种疾病中,血清或尿液中这些酶活性物的一些比如氨基已糖苷酶和葡糖醛酸糖苷酶升高。在随后的实施例中,为了更确凿鉴别决定所述活性的更主要的化合物,将这些级分进一步分馏。特别感兴趣的是2-哌啶酸化合物。实施例2使用阳离子交换色谱(IR120H+形式),将实施例1的提取物分馏成四种级分。未保留的级分包含具有用吡啶和然后用氨水转移的含有亚氨基糖的糖类。某些DNJ存在于每个保留级分中,但是大多数存在于第一次氨水级分中。还检测了其它亚氨基糖类,包括试验性的桑叶生物碱、DAB、某些羟基化亚氨基酸类及其它可能的新亚氨基糖。下表4显示由实施例1中级分所观察到的酶抑制作用。实施例2中,目的为:a.进一步分解所有四种级分中的组分:b.通过GC-MS和500MHzNMR分析化合物,尽可能地鉴别许多组分;和c.对纯化化合物进行糖苷酶测定,以进一步辨别不同组分赋予的抑制作用。分析该实施例主要包括进一步分馏实施例1中使用的10g桑叶提取物。GC-MS其根据实施例1进行。NMR其根据实施例1进行。糖苷酶测定其根据实施例1进行。纯化方法a)糖组分(IR120未保留的)GC-MS显示来自实施例1的IR120未保留级分主要包含糖类,但是在糖苷酶(包括糖原磷酸化酶)测定中具有相当令人惊奇的活性。因此,进一步分馏该样品以分离常见糖类与更稀有的组分(可能产生活性),并且除去一些褐色物质(可能是酚类)。将5g溶于最小体积的蒸馏水中,并应用于OH-型的AmberliteCG400阴离子交换树脂的柱(2×10cm)。收集十一个2ml的水级分,之后用1MHOAc除去保留物质。干燥样品,并通过GC-MS、NMR分析,基于该分析,提供一些物质进行糖苷酶和糖原磷酸化酶测定。一些褐色物质永久性地结合树脂。获得的糖级分是无色或淡黄色。将一些物质再混合进行之后的进一步分离。所述级分显示在下表5中:来自CG400的级分重量,mg1-1076511364HOAc1100HOAc21,2697因此,在10g样品中,糖类的总重量似乎为3.728g左右,但是可能通过GC或NMR不能检测某些无机物质。b)吡啶和氨水级分进一步分馏IR120吡啶和氨水级分1和2,以减少存在的DNJ与其它组分,以允许通过NMR解析其结构。为了实现该目的,使用下述色谱运行一组柱:a.阴离子交换色谱(OH-和Ac-形式的AmberliteCG400),和b.使用弱酸性树脂的阳离子交换色谱(铵形式的AmberliteCG50)。结果a)糖分馏糖类(来自实施例1的IR120未保留物质)的CG400分馏显示之前级分中的糖醇。在所有级分中存在某些常见单糖(呋喃糖和吡喃糖)。二糖类增加,然后在主要乙酸级分中显示其它单糖类(某些可能是由于酸性水解)。有趣地是,测试的所有级分都出现糖苷酶和糖原磷酸化酶抑制。检测到一些稀有组分。b)亚氨基糖分馏(来自IR120吡啶和氨水级分)从实施例1中得到的IR120结合级分,部分地纯化一些组分,进行进一步表征。通过GC-MS,保留时间10.37分钟的化合物与来源于DAB的结构具有良好的匹配。保留时间12.91和13.31分钟的化合物与可以来源于DNJ的哌啶N-酸类型化合物具有良好的匹配。纯化GC保留时间19.36分钟的组分-3.3mg。该组分得到与糖苷一致的质谱数据,但是其是含有结合IR120树脂的糖苷类的稀有组分。尝试进一步纯化桑叶生物碱和DAB类型化合物。以2.0mg的单个级分最终获得其中一些化合物。在级分JH0806/101/23中鉴别出2-哌啶酸类。除了糖级分和葫芦巴碱(在NMR谱的式6中观察到的)和6-羟基葫芦巴碱(式7)(在NMR光谱中可观察到,但是是非常微量的组分)之外,使所有五种级分都进行酶测定。式6葫芦巴碱式76-羟基葫芦巴碱化合物和级分的糖苷酶测定表6中给出了所述级分的测定结果。糖原磷酸化酶测定结果下表7中给出了这些测定结果:讨论和结论鉴别包括某些新天然化合物的亚氨基糖类是可能的,试验性地鉴别为DAB和DNJ的N-酸类。样品的糖级分也同时显示出糖苷酶和糖原磷酸化酶抑制作用。糖类比如葡萄糖和蔗糖没有抑制糖原磷酸化酶或糖苷酶类。通过GC-MS鉴别糖级分中存在的某些稀有组分,推测这些物质决定糖苷酶类和糖原磷酸化酶的抑制作用。糖级分是高比例的未分馏的提取物,因此可能对样品活性有显著的贡献。尽管DAB被报道具有糖原磷酸化酶抑制作用,但是未分馏的提取物显然具有一些亚氨基糖组分,其具有该抑制作用。提取物中鉴别的2-哌啶酸类和葫芦巴碱不会极大地抑制糖原磷酸化酶。DNJ和桑叶生物碱不会抑制该酶。很可能的是DAB和DNJ的N-酸类是活性组分。在除去DNJ、DAB和桑叶生物碱之后,提取物中的许多组分也抑制糖苷酶类。实施例3对实施例2中描述的级分进行分析,得到关于样品的亚氨基糖和糖的其它信息。糖级分占样品的几乎一半,显示出对于多种糖苷酶和糖原磷酸化酶的有活性。糖类比如蔗糖、海藻糖和葡萄糖不会显著地抑制这些酶。在该实施例中,尝试表征糖级分的活性组分,并且进一步观察其活性。在这点上,使用一组离子交换柱将其进一步分馏。方法将来自实施例1的IR120未保留级分在阴离子交换树脂CG400(OH-型)上进行色谱分析,得到水级分(1-11)和两种乙酸级分(表5-实施例2)。在该实施例中仍然将这些级分进一步分馏,并且进一步研究所述级分的活性。分析GC-MS其根据实施例1进行。NMR其根据实施例1进行。糖苷酶测定其根据实施例1进行。纯化方法糖样品的进一步分馏包括使用以OH-型和以乙酸盐型使用的强碱性阴离子交换树脂CG400。将各级分收集在水中,并冷冻干燥。使用1M乙酸除去保留的物质,并且通过旋转蒸发将这些级分蒸发至几乎无水,然后冻干。结果为了进一步纯化糖样品和除去任何可能的无机物质,将所有样品通过CG400(OH-型)再次进行色谱分析。将糖级分1-11合并成样品1-11,并且也将两种乙酸样品再合并。将两种样品都装在CG400OH-2×20cm柱上,并且收集水级分,之后用1MHOAc进行最后洗涤以除去保留物质。级分的重量显示在下表8中。令人惊奇地是在第一个CG400OH-柱上未保留的样品1-11现在得到显著重量的保留。这表明第一个柱的pH影响或可能过载。样品1-11的未保留级分为白色半结晶物质,如前所述。不出所料,酸样品占保留级分的大部分重量,但是少量物质未保留,并且样品3-7具有大部分糖苷酶抑制活性。初期的1-11级分具有白色固体半结晶物质,其没有得到GC峰,表明是比二糖类更大的糖类。更迟的级分显示为一些糖醇类,但是量很少。使表8中编号为A-F的样品进行NMR分析。使A、B、E和F也进行糖苷酶测定,将其结果制表在下表9中。使用乙酸盐型的CG400进一步分馏CG400OH-保留的物质样品(C和D)。样品C(HS0804/119)与样品D(HS0804/120)都得到了良好的分离。C中的化合物类似于单糖和二糖糖类,但是常见糖类不会保留在CG400上。样品D显示某些类似的化合物,但是某些更大分子的保留时间为约24-25分钟。下表中给出了级分C和D的量和活性:表10-来自在CG400乙酸盐型上分馏的酸样品C的级分重量级分重量mg备注HS0804/119/1437测定119/231119/34.4119/42119/59.9表11-来自在CG400乙酸盐型上分馏的酸样品D的级分的重量级分重量mg备注HS0804/120/1125测定120/2643测定120/311.4测定120/46.5120/576.2测定样品C和D在乙酸盐柱上分馏良好。在CG400乙酸盐型树脂的2×10cm柱上,使用5ml水级分,接着使用1MHOAc,进一步分馏样品HS120/2,得到样品HS0804/122。表12-来自HS0804/120/2的级分的重量级分重量,mg备注HS0804/122/1-30122/4204122/5189测定122/6141122/755122/822测定122/915122/1015测定122/118122/123.4122/12-1719122/18HOAc11.9测定这些样品的GC-MS分析显示出分离良好和一些感兴趣的组分。使级分5、8、10和18进行测定。这些样品显示出令人感兴趣的稻米(rice)葡糖苷酶的选择性,其在实施例2中制备的第一个HOAc样品中也很明显。来自样品1-11的级分倾向于不仅赋予对稻米葡糖苷酶的良好抑制作用,而且赋予对酵母菌酶和杆菌属酶的良好抑制作用。HS0804/122级分的GC-MS分析显示一些可能的新组分。122/18中的一个组分得到了亚氨基糖相当典型的质谱,并且一些其它化合物在裂解为亚氨基糖类方面具有某些相似性。讨论和结论从10gPhynoRadiance样品获得5.026g的糖级分。在阴离子交换色谱之后,通过可能的除去无机或芳香族物质之后,其减少为3.728g。包括37%的PhynoRadiance样品的该级分具有显著的糖原磷酸化酶抑制活性,以及有效地抑制三种α-葡糖苷酶。该实施例证实了PhynoRadiance糖类的活性,并且确定存在一些具有活性的更大的糖类,某些可能的糖酸类(亚氨基糖酸类)更强选择性抑制稻米α-葡糖苷酶。葡糖苷酶类之中活性的选择性被证实对于治疗某些病症很重要,因为在哺乳动物系统存在许多葡糖苷酶活性,综合抑制所有葡糖苷酶类可引起一些脱靶效应。也应当注意葡糖苷酶类的抑制剂通过伴侣活性对于产生有缺陷的糖蛋白的细胞也可以具有有益作用;据推测这种作用可能与抗老化性质有关(Bestetal.,2010)。继续来自实施例2的初级糖级分的糖苷酶测定,表明PhynoRadiance糖级分显示出对大量α-葡糖苷酶类的良好抑制作用,但是对于广泛的其它糖苷酶类没有进行试验。该抑制特性有点类似于DNJ,但是DNJ也不抑制糖原磷酸化酶。糖分馏和测定倾向于表明保留的组分特别地抑制稻米葡糖苷酶,而未保留的组分抑制测定的所有三种α-葡糖苷酶。在CG400OH-保留的和未保留的级分中都发现了糖原磷酸化酶抑制作用。来自样品1-11的CG400OH-未保留的级分的GC-MS分析没有提供非常有用的信息,但是NMR显示看上去是相当纯的糖类,推定为比二糖类更大的糖类。CG400保留的组分得到了良好的GC-MS数据,似乎相当复杂;存在某些二糖类(非蔗糖),以及稀有糖类或亚氨基糖类(推测具有最初保留在CG400上的羧基基团或芳香族单元)。得出结论:糖级分包含具有有效的糖苷酶和糖原磷酸化酶活性的某些新糖类。很可能的是,在未保留的CG400OH-级分中看到的更大糖类是新的,并且具有结合其以赋予活性的亚氨基糖类。CG400OH-上保留的化合物可以是从较大糖类释放的较小的单元,或者是新糖酸类。从样品A(一种来自样品1-11的高活性未保留的CG400OH-级分)收集的NMR数据显示良好的纯度,但是对这种较大糖类得到极少的结构信息。实施例4实施例4寻求证实提取物的非亚氨基糖级分的活性.概述该实施例证实桑提取物中存在的DNJ和DAB的N-酸类比DAB和DNJ对α-葡糖苷酶具有更强选择性抑制作用,并且这些化合物也对哺乳动物β-葡糖醛酸糖苷酶、氨基已糖苷酶和α-L-艾杜糖苷酸酶良好的抑制作用。在包括糖尿病的一些疾病中血清β-葡糖醛酸糖苷酶和氨基已糖苷酶类升高。β-葡糖醛酸糖苷酶的增加可引起作为葡糖苷酸的毒素分泌较少,从而抑制该酶,可有益于健康。据报道,亚氨基糖类可以同时作为糖苷酶类的抑制剂和伴侣分子,从而,也可以在低于抑制浓度下,提高被所述亚氨基糖类抑制的糖苷酶类的活性。DNJ和DAB的N-酸是新的分离的天然产物。也试验性鉴别了具有脱氧糖和芳基糖苷的稀有三糖。研究的物质IminoNorm200ml粗提取物;和PhynoRadiance50g批料,如在表13中列出的表13。样品IR120保留的重量,gIR120未保留的重量,gIminoNorm54.64(太粘不能完全干燥)28PhynoRadiance1.3832分析GC-MS其根据实施例1进行。NMR其根据实施例1进行。糖苷酶测定其根据实施例1进行。纯化方法糖样品的进一步分馏包括使用以OH-型和以乙酸盐型使用的强碱性阴离子交换树脂CG400。如实施例3描述的,将各级分收集在水中,并冷冻干燥。使用1M乙酸除去保留的物质,并且通过旋转蒸发将这些级分蒸发至几乎无水,然后冷冻干燥。结果下表14提供IminoNorm和PhynoRadiance阴离子交换树脂(CG400)未保留的和保留的级分的α-葡糖苷酶结果(在2mg/ml的抑制%)使样品IminoNorm和PhynoRadiance(如在WO2011/032502中所述稀释的提取物)另外进行:1)阳离子交换色谱;和2)阴离子交换色谱,如上述实施例中描述的。阴离子交换保留的物质赋予对稻米α-葡糖苷酶的更特异性抑制作用。两种样品的阴离子交换树脂未保留的物质赋予更宽的α-葡糖苷酶抑制作用。亚氨基糖DAB和DNJ的N-酸类似乎决定特异性稻米α-葡糖苷酶抑制(参见表16的糖苷酶)。来自IminoNorm的阴离子交换树脂保留的物质(表15)相应地更重(71%)可能是由于其对糖类的稀释度更大。因此,将糖类加入到PhynoRadiance中对样品的阴离子交换未保留的级分的重量有贡献。然而,两种样品都具有抑制活性,从而向PhynoRadiance中加入的糖类不必具有似乎来自桑本身的活性。表15DNJ为两种预分馏的提取物的主要组分。GC-MS色谱图(和质谱)提供在图1-13中。关于这些附图,提及下述:图1和2为PhynoRadiance和IminoNorm粗提取物的GC-MS色谱图。应当注意,在IminoNorm色谱图中,某些亚氨基糖以相对较高浓度出现。一种是具有如图3所示质谱的化合物(9.5分钟)。图4和5分别是PhynoRadianceIR120保留的(亚氨基糖级分)1.38g和IminoNormIR120保留的(亚氨基糖级分1)6.14g的GC-MS色谱图。由于亚氨基糖含量高,iminoNorm样品使阳离子交换树脂(IR120)过载两次。结合级分(2和3)显示在图7和8中,亚氨基糖类的某些优先转移是显然的。碱性亚氨基糖比中性或酸性亚氨基糖类更易于转移。在PhynoRadiance中仅仅勉强看到的两种相关的亚氨基糖在IminoNormIR120结合级分1中是相当多的。这可用于纯化和鉴别那些亚氨基糖类(8.72和9.49分钟)。选择性转移也允许进一步表征DAB和DNJ的三种N-酸类,其为新天然产物。这些N-酸类也出现在PhynoRadiance中。图6a和b为来自IminoNorm还没有鉴别的两种亚氨基糖的质谱。图7a为IminoNormIR120保留的(亚氨基级分2)23g的GC-MS色谱图,图7b为桑叶生物碱的质谱。DNJ目前是IR120上第二个IminoNorm保留的级分中主要的亚氨基糖。在7.4分钟的亚氨基糖是桑叶生物碱。图8a为IminoNormIR120保留的(亚氨基级分3)25.5g的GC-MS色谱图。图8B和8C为羟基化2-哌啶酸的两种质谱。在IminoNorm的第三个IR120保留的级分中,羟基化的2-哌啶酸比DNJ更多。它们的质谱及实施例2中鉴别的一种显示如下。在3.59分钟的主要组分可以是苯丙氨酸。图9为PhynoRadiance中DNJ的N-乙酸(tms)的质谱;图10为来自PhynoRadiance的DAB-N-乙酸(tms)的质谱;图11为在IminoNorm的DNJ的N-乙酸(tms)的质谱;.图12为来自IminoNorm的DAB-N-乙酸(tms)的质谱;和图13为IminoNorm中DNJ的N-丙酸(tms)的质谱。这些酸的分子式为下述式8至10中图解的:式8DAB的N-乙酸式9DNJ的N-乙酸式10DNJ的N-丙酸DAB和DNJ的N-酸类在没有浓缩的PhynoRadiance提取物中可见,但是在IminoNorm中更不明显。然而,它们在两种样品中都存在。这些新分离的酸类的活性显示在下表14中。亚氨基糖N酸类的糖苷酶结果(0.8mM的抑制%)DNJ-N-丙酸对于牛类动物肝β-葡糖醛酸糖苷酶具有的IC50为340uM,且对于人重组α-L-艾杜糖苷酸酶具有的IC50为383uM。DAB-N-乙酸对于β-葡糖醛酸糖苷酶具有的IC50为523uM,且对于艾杜糖苷酸酶具有的IC50为196uM。DNJ-乙酸对于牛类动物β-葡糖醛酸糖苷酶具有的IC50为208uM,但是仅仅在0.8mM下很弱地抑制艾杜糖苷酸酶。讨论和结论实施例4证实一旦除去DNJ,PhynoRadiance和IminoNorm的糖苷酶抑制特性存在很大的类似性。在两种样品中都存在DNJ和DAB的N-酸类,与DAB和DNJ相比,这两种样品赋予对α-葡糖苷酶的更强选择性抑制作用,但是这些化合物也赋予对哺乳动物β-葡糖醛酸糖苷酶、氨基已糖苷酶和α-L-艾杜糖苷酸酶的良好抑制作用。包含这些化合物的选择性级分显然可用作药物和食物成分。在包括糖尿病和阿尔茨海默病的一些疾病中,血清β-葡糖醛酸糖苷酶和氨基已糖苷酶类升高了。β-葡糖醛酸糖苷酶的升高可导致作为葡糖苷酸类的毒素的分泌较少,因而抑制该酶可有益于健康。据报道,亚氨基糖类可以同时作为糖苷酶类的抑制剂和伴侣分子,从而也可以在低于抑制浓度下,提高被所述亚氨基糖类抑制的糖苷酶类的活性。DNJ和DAB的N-酸类是新天然产物。根据实施例可以得出结论:在PhynoRadiance和IminoNorm中都存在一些有助于糖苷酶抑制的化合物。这些化合物包括DNJ、DAB、桑叶生物碱、羟基化2-哌啶酸、DAB和DNJ的N-酸类,以及至今仍未表征的其它亚氨基糖类。芳基糖苷和包括三糖的糖类也可赋予糖苷酶类和糖原磷酸化酶的抑制作用。因此,选择性水溶性的桑提取物富含羟基化2-哌啶酸类、DAB和DNJ的N-酸类,并且其包含显著降低水平的亚氨基酸DNJ、DAB和桑叶生物碱,或者基本上纯的羟基化2-哌啶酸类、DAB和DNJ的N-酸类可用于药物中。所述酸类包括N-乙酸化DAB和N-乙酸化DNJ。实施例5方法学∶在急性糖激发ddy小鼠模型中评价本发明的提取物(PYN8)降低进食后血糖波峰的功效。将十只小鼠分成两组,处理组和安慰剂组。动物口服接受2.5g/kg体重的麦芽糖,与500mg/kg的PYN8(活性组)或生理盐水(对照)。在时间点0、15分钟、30分钟、60分钟和120分钟测量血糖浓度以评价对麦芽糖摄入之后降低血糖的任何作用。结果∶本发明的提取物显示出显著地降低麦芽糖激发之后的血糖水平,如图14中图解的。结论∶体内研究证实了体外发现:本发明的提取物可以显著地降低进食后血糖水平。所述提取物抑制多种参与葡萄糖代谢的葡糖苷酶酶类。体内研究表明提取物是生物可利用的,并且不会被胃酸、胃酶或活性代谢所灭活。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1