用于治疗眼部疾病的前房内植入物的制作方法
本申请要求2013年12月06日提交的U.S.临时申请No.61/912,867、和2014年1月10日提交的U.S.临时申请No.61/926,112,和2014年5月02日提交的U.S.临时申请No.61/987,902的优先权,其每一个的整体内容在此引入作为参考。
技术领域:
本发明涉及的领域为药物组合物,由该药物组合物形成的植入物,形成植入物的方法,和治疗眼部疾病的方法。
背景技术:
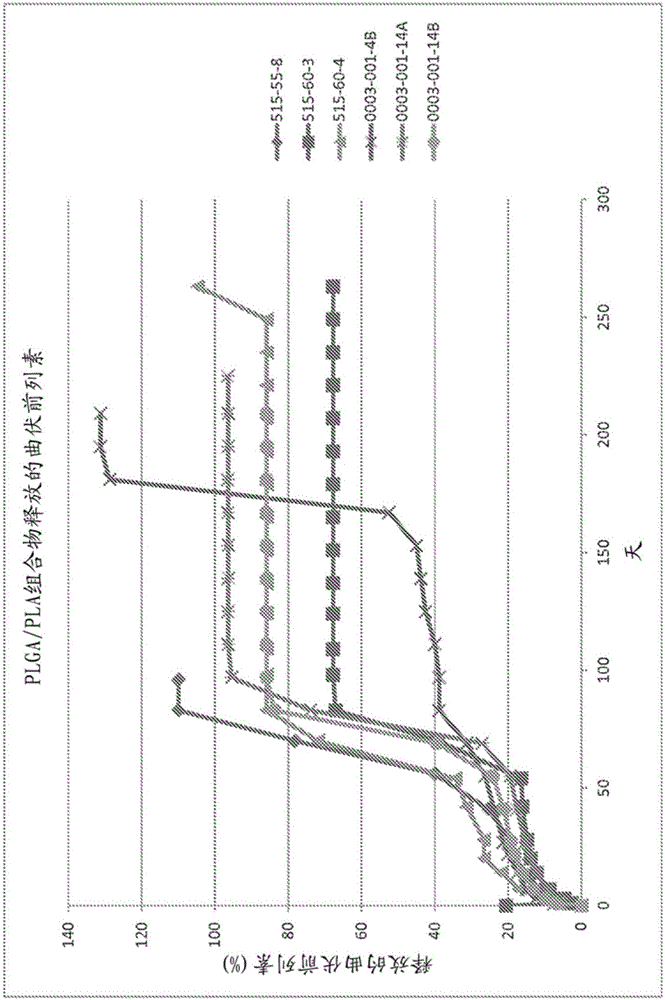
:青光眼为影响超过三百万年龄大于39岁的美国人的进行性视神经病,且为造成年龄大于60岁的成人失明的主要原因。根据NationalEyeInstitute,超过120,000个美国人由于青光眼而失明(QuigleyHA,VitaleS.“Modelsofopen-angleglaucomaprevalenceandincidenceintheUnitedStates,”InvestOphthalmol&VisualSci.1997,38(1):83-91.)。眼内压升高(IOP)是青光眼发展的最重要风险因素且为对房水引流通过小梁网(TM)的抗性异常高的结果,该小梁网为内皮状细胞覆盖的胶原束的多层阵列。由于对青光眼的视神经病特征的病理生理学理解有限,目前的青光眼治疗聚焦于减少IOP。前列腺素类似物(PGA)目前为美国高眼压或青光眼局部治疗最常开具的处方类。然而,其使用受多种缺点所限制。首先,现有青光眼局部治疗的顺应性通常较低,其中30%至60%患者在治疗的第一年内停止治疗。第二,目前使用的局部眼用药物具有局部和全身的副作用。例如,这些药物具有相对高的充血发生率,且伴随在房水和周围组织的药物水平峰值和低谷,其潜在导致24小时IOP波动,可造成易感患者的视野加速丧失(CaprioliJ,RohtV.“IntraocularPressure:ModulationastreatmentforGlaucoma,”AmJOphthalmol.2011;152(3):340-344.)。最后,已显示这些因素的组合增加患者护理的成本,这是由于更快的疾病进展。因此,医疗领域对于使用具有改善的安全性和功效的缓释递送系统的替代治疗存在很大需求。迄今,还没有美国食品及药物管理局(FDA)批准的青光眼治疗能提供直接给予至所需作用位点的缓释的药理学药物。因此,直接给予至眼的前房的缓释药物制剂将很可能改善目前降低IOP的治疗的顺应性和不利事件。而且,任何延长释放的植入物高度依赖于聚合物、共聚物,药物-聚合物相互作用、负载均匀性、多孔性、尺寸、表面积与体积的比等的选择,以提供其药物释放和降解特征,而现有植入物中使用的制备技术可诱发这些参数中的每一个的内在缺点。技术实现要素:本发明通过提供缓释药物制剂解决了本领域的关键需求,该药物制剂可直接给药于眼的前房且不具有本领域目前的缺点。而且,本发明提供的植入物具有高均匀性、可调节和可重现的尺寸、形状、负载、组成和负载分布,这提供了具有所需的药物延长释放性质(extendeddrugreleaseprofile)且适合治疗所需适应症的植入物。在一个具体实施方案中,该植入物用于治疗眼压增加的眼部适应症。在某些实施方案中,本发明涉及精确设计的生物可降解的药物递送系统和制备和使用该系统的方法。在一些实施方案中,本文教导的生物可降解的药物递送系统,使用非润湿模板中的粒子复制技术设计的。在一些实施方案中使用的该技术使本文公开的药物递送系统具有均匀的尺寸、形状和剂量浓度。而且,本发明提供使用该教导的精确设计的生物可降解的药物递送系统尤其治疗眼部病症的方法。根据本发明可治疗的病症包括青光眼、眼内压升高(elevatedintraocularpressure)和高眼压(ocularhypertension)。在某些实施方案中,本发明涉及治疗眼部疾病的药物组合物,其包含:生物可降解的聚合物基质和至少一种治疗剂。在某些实施方案中,本发明提供用于治疗眼部疾病的药物组合物,其包括:眼植入物。在多个方面,该眼植入物包含生物可降解的聚合物基质,该基质包含在其中均匀分散的治疗剂。在一些实施方案中,该眼植入物为“非挤出的”眼植入物,例如模制的植入物。在一个具体实施方案中,本发明提供治疗眼部疾病的药物组合物且其包含:A)生物可降解的聚合物基质;和B)均匀分散在该聚合物基质中的至少一种治疗剂;其中该生物可降解的聚合物基质包含聚合物的混合物,该混合物包含:i)酯封端的生物可降解的聚(D,L-丙交酯-共-乙交酯)共聚物,其具有的固有粘度为0.16至0.24dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;和ii)酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃以0.1%w/vCHCl3测量。而且,在具体实施方案中,该聚(D,L-丙交酯-共-乙交酯)共聚物包含约73%至约77%摩尔D,L-丙交酯和约23%至约27%摩尔乙交酯。在某些实施方案中,基于该药物组合物的%w/w,该生物可降解的聚合物基质占该药物组合物的约10%至约90%w/w,或约10%至约80%,或约10%至约70%,或约10%至约60%,或约20%至约90%,或约20%至约80%,或约20%至约70%,或约20%至约60%,或约30%至约90%,或约30%至约80%,或约30%至约70%,或约30%至约60%,或约40%至约90%,或约40%至约80%,或约40%至约70%,或约40%至约60%,或约50%至约90%,或约50%至约80%,或约50%至约70%,或约50%至约60%,或约60%至约90%,或约60%至约80%,或约60%至约75%,或约60%至约70%,或约65%至约75%,或约68%至约71%,或约70%,w/w。在一个实施方案中,该生物可降解的聚合物基质包含约10%至约30%的酯封端的生物可降解的聚(D,L-丙交酯-共-乙交酯)共聚物,其具有的固有粘度为0.16至0.24dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量,和约70%至约90%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃以0.1%w/vCHCl3测量。在另一实施方案中,该生物可降解的聚合物基质包含约10%至约20%的酯封端的生物可降解的聚(D,L-丙交酯-共-乙交酯)共聚物,其具有的固有粘度为0.16至0.24dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量,和约80%至约90%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃以0.1%w/vCHCl3测量。在另一实施方案中,该生物可降解的聚合物基质包含约15%的酯封端的生物可降解的聚(D,L-丙交酯-共-乙交酯)共聚物,其具有的固有粘度为0.16至0.24dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量,和约85%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃以0.1%w/vCHCl3测量。在某些方面,该药物组合物的至少一种治疗剂占该药物组合物的:约20%至约50%w/w,或约20%至约40%w/w,或约20%至约30%,或约20%至约35%w/w,或约25%至约35%w/w,或约25%,或约26%,或约27%,或约28%,或约29%,或约30%,或约31%,或约32%,或约33%,或约34%,或约35%,或约29%至约32%。在一些实施方案中,该至少一种治疗剂选自前列腺素、前列腺素前药、前列腺素类似物和前列腺胺(prostamide),其药物可接受的盐,及其混合物。在具体实施方案中,该至少一种治疗剂选自拉坦前列素、曲伏前列素、比马前列素、他氟前列素和乌诺前列酮异丙酯。在一个实施方案中,该至少一种治疗剂包括曲伏前列素。而且,在一些实施方案中,该药物组合物包括眼植入物,其中所述眼植入物包含:A)生物可降解的聚合物基质;和B)均匀分散在该聚合物基质中的至少一种治疗剂;其中该生物可降解的聚合物基质包含聚合物的混合物,该混合物包含:i)酯封端的生物可降解的聚(D,L-丙交酯-共-乙交酯)共聚物,其具有的固有粘度为0.16至0.24dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;和ii)酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃以0.1%w/vCHCl3测量。在一些实施方案中,该眼植入物为杆状植入物,其在长度上的最短尺寸为约150至约225μm且最长尺寸为约1,500至约3,000μm。在其它实施方案中,该眼植入物为选自以下的杆状植入物:尺寸约150μm×约150μm×约1,500μm的杆状植入物,大小为约160μm×约180μm×约3,000μm的杆状植入物,和大小为约225μm×约225μm×约2,925μm的杆状植入物。在一些方面,本发明提供治疗眼部疾病的药物组合物,其中该组合物制造为杆状眼植入物,其包括的最短尺寸长约145-245μm且最长尺寸长约1,500-3,000μm。在一些方面,本发明提供治疗眼部疾病的药物组合物,其中该组合物制造为具有以下大小的杆状眼植入物:150μm×180μm×1,500μm(W×H×L),各维度±50μm,或具有以下大小的杆状眼植入物:225μm×240μm×2,925μm(W×H×L),各维度±50μm。在一些方面,本发明提供治疗眼部疾病的药物组合物,其中该组合物制造为具有以下大小的杆状眼植入物:150μm×180μm×1,500μm(W×H×L),各维度±40μm,或具有以下大小的杆状眼植入物:225μm×240μm×2,925μm(W×H×L),各维度±40μm。在一些方面,本发明提供治疗眼部疾病的药物组合物,其中该组合物制造为具有以下大小的杆状眼植入物:150μm×180μm×1,500μm(W×H×L),各维度±30μm,或具有以下大小的杆状眼植入物:225μm×240μm×2,925μm(W×H×L),各维度±30μm。在一些方面,本发明提供治疗眼部疾病的药物组合物,其中该组合物制造为具有以下大小的杆状眼植入物:150μm×180μm×1,500μm(W×H×L),各维度±20μm,或具有以下大小的杆状眼植入物:225μm×240μm×2,925μm(W×H×L),各维度±20μm。在一些方面,本发明提供治疗眼部疾病的药物组合物,其中该组合物制造为具有以下大小的杆状眼植入物:150μm×180μm×1,500μm(W×H×L),各维度±10μm,或具有以下大小的杆状眼植入物:225μm×240μm×2,925μm(W×H×L),各维度±10μm。在一些方面,本发明提供治疗眼部疾病的药物组合物,其中该组合物制造为具有以下大小的杆状眼植入物:150μm×180μm×1,500μm(W×H×L),各维度±5μm,或具有以下大小的杆状眼植入物:225μm×240μm×2,925μm(W×H×L),各维度±5μm。在一些方面,本发明提供治疗眼部疾病的药物组合物,其中该组合物制造为具有以下大小的杆状眼植入物:约150μm×180μm×1,500μm(W×H×L)±,或具有以下大小的杆状眼植入物:约225μm×240μm×2,925μm(W×H×L)。在一个实施方案中,该眼植入物可具有的宽度与长度的纵横比为1:1至大于1:30。在一些实施方案中,该眼植入物的宽度与长度的纵横比为1:2至1:25。在一些实施方案中,该眼植入物的宽度与长度的纵横比为1:5至1:20。在一些实施方案中,该眼植入物的宽度与长度的纵横比为1:10至1:20。在一些实施方案中,该眼植入物的宽度与长度的纵横比为1:15至1:20。在一些实施方案,颗粒技术可用于本发明以制造最宽维度上尺寸范围为10微米或更大的植入物,取决于设计为模具腔的尺寸(如本文和在此引入作为参考的现有技术所进一步描述的)。重要的是,对于眶内眼部应用,将植入物的密度制造为大于待在其中放置植入物的流体环境(例如房水等)的密度,使得植入物沉降且保持在患者视野之外,且该植入物也保留在眼中。而且,具有较小总体尺寸的颗粒较大表面积与体积比,例如,10立方微米相比于100立方微米,将降解更快。同样,具有总体体积等于100x100x2000微米植入物的10立方微米颗粒的集合将比100x100x2000微米植入物更密切符合它们所植入的空间的形状。在一些实施方案中,该植入物具有的最大横截面尺寸为10微米且密度大于房水、玻璃体液等的密度,使得该植入物由于重力而沉降。在一些实施方案中,该植入物具有的最大横截面尺寸为20微米且密度大于房水、玻璃体液等的密度,使得该植入物由于重力而沉降。在一些实施方案中,该植入物具有的最大横截面尺寸为50微米且密度大于房水、玻璃体液等的密度,使得该植入物由于重力而沉降。在一些实施方案中,该植入物具有的最大横截面尺寸为100微米且密度大于房水、玻璃体液等的密度,使得该植入物由于重力而沉降。在一些实施方案中,该植入物具有的最大横截面尺寸为200微米且密度大于房水、玻璃体液等的密度,使得该植入物由于重力而沉降。在一些实施方案中,该植入物具有的最大横截面尺寸为500微米且密度大于房水、玻璃体液等的密度,使得该植入物由于重力而沉降。本发明治疗或预防眼科病症的方法包括眶内植入多于5个基于负载缓释药物的生物可降解的聚合物的植入物以治疗或预防该眼科病症达多于2周。本发明治疗或预防眼科病症的方法包括眶内植入多于10个基于负载缓释药物的生物可降解的聚合物的植入物以治疗或预防该眼科病症达多于2周。本发明治疗或预防眼科病症的方法包括眶内植入多于25个基于负载缓释药物的生物可降解的聚合物的植入物以治疗或预防该眼科病症达多于2周。本发明治疗或预防眼科病症的方法包括眶内植入多于50个基于负载缓释药物的生物可降解的聚合物的植入物以治疗或预防该眼科病症达多于2周。本发明治疗或预防眼科病症的方法包括眶内植入多于100个基于负载缓释药物的生物可降解的聚合物的植入物以治疗或预防该眼科病症达多于2周。本发明治疗或预防眼科病症的方法包括眶内植入多于500个基于负载缓释药物的生物可降解的聚合物的植入物以治疗或预防该眼科病症达多于2周。本发明治疗或预防眼科病症的方法包括眶内植入多于1,000个基于负载缓释药物的生物可降解的聚合物的植入物以治疗或预防该眼科病症达多于2周。本发明治疗或预防眼科病症的方法包括眶内植入多于10,000个基于负载缓释药物的生物可降解的聚合物的植入物以治疗或预防该眼科病症达多于2周。本发明治疗或预防眼科病症的方法包括眶内植入多于100,000个基于负载缓释药物的生物可降解的聚合物的植入物以治疗或预防该眼科病症达多于2周。本发明治疗或预防眼科病症的方法包括眶内植入多于1,000,000个基于负载缓释药物的生物可降解的聚合物的植入物以治疗或预防该眼科病症达多于2周。聚合物组成和这些小植入物集合中各植入物的比例在单剂量范围内在植入物之间可以发生变化,这样得到的植入物集合的聚集物降解分布使活性剂的递送超过2周,超过1个月,超过3个月,超过4个月,超过6个月,超过9个月和超过12个月。本文公开的植入物的递送包括通过27号针或更小的针递送。在一个示例性递送方法中,所述针为28号、29号、30号、31号、32号、33号或34号针。此外,还公开了治疗眼部疾病的药物组合物,其包含:A)生物可降解的聚合物基质;和B)均匀分散在该聚合物基质中的至少一种治疗剂;其中该生物可降解的聚合物基质包含聚合物的混合物,该混合物包含:i)酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;和ii)酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为1.8至2.2dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量。在一些实施方案中,聚合物i)占该植入物的12-32wt%,且聚合物ii)占该植入物的35-55wt%,该植入物的其余部分为活性药物成分。在一些实施方案中,聚合物i)占该植入物的17-27wt%,且聚合物ii)占该植入物的40-50wt%,该植入物的其余部分为活性药物成分。在一些实施方案中,聚合物i)占该植入物的19-25wt%,且聚合物ii)占该植入物的42-48wt%,该植入物的其余部分为活性药物成分。在一些实施方案中,聚合物i)占该植入物的20-24wt%,且聚合物ii)占该植入物的42-46wt%,该植入物的其余部分为活性药物成分。在一些实施方案中,聚合物i)占该植入物的21-23wt%,且聚合物ii)占该植入物的43-45wt%,该植入物的其余部分为活性药物成分。在一些实施方案中,聚合物i)占该植入物的22+/-0.5wt%,且聚合物ii)占该植入物的44.5+/-0.5wt%,该植入物的其余部分为活性药物成分。在一些实施方案中,聚合物i)占该植入物的22.1wt%,且聚合物ii)占该植入物的44.9wt%,该植入物的其余部分为活性药物成分。在一些实施方案中,聚合物i)占该植入物的21.8wt%,且聚合物ii)占该植入物的44.2wt%,该植入物的其余部分为活性药物成分。在一个实施方案中,该生物可降解的聚合物基质包含:i)约15%至约35%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;和ii)约65%至约85%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为1.8至2.2dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量。在另一实施方案中,该生物可降解的聚合物基质包含:i)约25%至约35%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;和ii)约65%至约75%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为1.8至2.2dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量。在另一实施方案中,该植入物基质包含:i)22+/-3%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;ii)45+/-3%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为1.8至2.2dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;和iii)33+/-3%活性药物曲伏前列素。在另一实施方案中,该植入物基质包含:i)22+/-0.5%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;ii)44.5+/-0.5%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为1.8至2.2dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;和iii)33+/-0.5%活性药物曲伏前列素。在一个具体实施方案中,该生物可降解的聚合物基质包含:i)约33%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;和ii)约67%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为1.8至2.2dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量。在一方面,本公开提供,包括眼植入物的药物组合物,其中所述眼植入物包含:A)生物可降解的聚合物基质;和B)均匀分散在该聚合物基质中的至少一种治疗剂;其中该生物可降解的聚合物基质包含聚合物的混合物,该混合物包含:i)酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;和ii)酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为1.8至2.2dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量。在某些实施方案中,本公开提供治疗眼部疾病的药物组合物,其包含:包括含至少一种聚合物的聚合物基质的生物可降解的植入物;和均匀分散在该聚合物基质中的治疗剂;其中该植入物包括:3000微米的长度,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%、0.1%;160微米的宽度,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%、0.1%of;且180微米的高度,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%、0.1%。在一些方面,该植入物在眼的前房中在不少于90天内降解且释放该治疗剂至少90天,从而在90天持续期内维持眼压降低。本文公开的另一实施方案为治疗眼部疾病的药物组合物,其包含:包括含至少一种聚合物的聚合物基质的生物可降解的植入物;和均匀分散在该聚合物基质中的治疗剂;其中该植入物包括:1500微米的长度,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%、0.1%;150微米的宽度,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%、0.1%;且150微米的高度,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%、0.1%。在一些方面,该植入物在眼的前房中在不少于90天内降解且释放该治疗剂至少90天,从而在90天持续期内维持眼压降低。在另一方面,本文教导了治疗眼部疾病的药物组合物,其包含:包括含至少一种聚合物的聚合物基质的生物可降解的植入物;和均匀分散在该聚合物基质中的治疗剂;其中该植入物包括:2925微米的长度,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%、0.1%;225微米的宽度,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%、0.1%;且225微米的高度,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%、0.1%。在一些方面,该植入物在眼的前房中在不少于90天内降解且释放该治疗剂至少90天,从而在90天持续期内维持眼压降低。在其它实施方案中,本发明提供治疗眼部疾病的药物组合物,其包含:包括含至少一种聚合物的聚合物基质的生物可降解的植入物;和均匀分散在该聚合物基质中的治疗剂;其中该植入物包括:治疗剂重量百分比为植入物总重量的30%,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%、0.1%;和聚合物基质重量百分比为植入物总重量的70%,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%、0.1%。本文提供的另一实施方案为治疗眼部疾病的方法,包括:将至少一种植入物植入患有眼内压升高的患者的眼,其中各植入物具有的体积为86,400,000立方微米,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%、0.1%。在一方面,1、2、3、4、5、6、7、8、9或更多个植入物在该方法中提供且被植入。多个植入物可同时被植入患者的眼内,在同一治疗中相继植入,或在多个治疗中在一段时间相继植入。在一些方面,患者每年接受植入物。另一实施方案提供治疗眼部疾病的方法,包括:将至少一种植入物植入患有眼内压升高的患者的眼种,其中各植入物具有的体积为33,750,000立方微米,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%或0.1%。另一实施方案提供治疗眼部疾病的方法,包括:将至少一种植入物植入患有眼内压升高的患者的眼中,其中各植入物具有的体积为40,500,000立方微米,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%或0.1%。还提供了治疗眼部疾病的方法,包括:将至少一种植入物植入患有眼内压升高的患者的眼中,其中各植入物具有的体积为148,078,125立方微米,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%或0.1%。还提供了治疗眼部疾病的方法,包括:将至少一种植入物植入患有眼内压升高的患者的眼中,其中各植入物具有的体积为154,659,375立方微米,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%、0.1%。而且,在一方面,本发明提供治疗眼部疾病的方法,包括:在向眼的前房植入以下植入物之后降低患有眼内压升高的眼的眼压达至少90天:一个植入物,其具有的体积为154,659,375立方微米,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%或0.1%且治疗剂含量为约20%至约45%;或两个植入物,各自具有的体积为86,400,000立方微米,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%或0.1%且治疗剂含量为约20%至约40%;或三个植入物,各自具有的体积为40,500,000立方微米,±10%、7.5%、5%、2.5%、2%、1.5%、1%、0.5%、0.25%或0.1%且治疗剂含量为约20%至约40%。在一些实施方案,植入物可具有的体积为40,500,000立方微米,或86,400,000立方微米,或154,659,375立方微米。在一些实施方案中,不同植入物的体积可相差约0.1%至约10%,0.1%至约5%,0.5%至约2%,或0.5%至约1%。本发明提供包含该植入物的组合物、包含该植入物的试剂盒、和使用上述具有所述立方微米体积的植入物的方法。本文还提供了治疗眼部疾病的药物组合物,其包含:A)生物可降解的聚合物基质;和B)均匀分散在该聚合物基质中的至少一种治疗剂;其中该生物可降解的聚合物基质包含聚合物的混合物,该混合物包含:i)酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为0.25至0.35dl/g;和ii)酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为1.8至2.2dl/g,其中该聚(D,L-丙交酯)均聚物i)和该聚(D,L-丙交酯)均聚物ii)以约1:2至1:3的比例存在。在某些实施方案中,上述聚合物基质将其它聚合物排除在该组合物之外。例如,在一些方面PEG不存在。在一些实施方案中,不使用热熔融挤出制造该植入物。在一些实施方案中,不使用原位凝胶制造该植入物。在某些实施方案中,该药物制剂排除不为以下体积的植入物:148,078,125±10%立方微米,或86,400,000±10%立方微米,或33,750,000±10%立方微米。本发明药物制剂的一些实施方案排除不为以下尺寸的植入物:225μm×225μm×2,925μm,或180μm×160μm×3,000μm,或150μm×150μm×1,500μm。在某些实施方案中,该药物制剂排除不为以下体积的植入物:225μm×235μm×2,925μm即154,659,375±10%立方微米和150μm×180μm×1,500μm植入物即40,500,000±10%立方微米。本文教导的一些实施方案排除不是以基于模的方法制造的植入物,如通过例如Technology制造。在一些方面,该组合物包含一种二聚合物基质,其包含比例为约1:2至约1:3的R203S/R208S。在一些实施方案中,该组合物包含23.29±2.0wt%的量的R203S和47.30±2.0wt%的量的R208S。在一个实施方案中,该聚合物基质包含:i)约25%至约35%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为0.25至0.35dL/g;和ii)约65%至约75%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为1.8至2.2dL/g。在某些实施方案中,该药物组合物的聚合物共混物包含:i)约33%的R203S;和ii)约67%的R208S。本文还提供治疗眼部疾病的药物组合物,其包含:A)生物可降解的聚合物基质;和B)均匀分散在该聚合物基质中的至少一种治疗剂;其中该生物可降解的聚合物基质包含聚合物的混合物,该混合物包含:i)酯封端的生物可降解的聚(D,L-丙交酯-共-乙交酯)共聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为0.16至0.24dL/g且包含73-77mol%D,L-丙交酯和23-27mol%乙交酯;和ii)酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为0.25至0.35dL/g。在某些实施方案中,上述聚合物基质将其它聚合物排除在该组合物之外。例如,在一些方面,PEG不存在。在一些实施方案中,该聚(D,L-丙交酯-共-乙交酯)共聚物和聚(D,L-丙交酯)均聚物以约1:5至1:6,或1:5至1:7的比例存在。在一些方面,该组合物包含一种二聚合物基质,其包含比例为约1:5至约1:6的RG752S/R203S。在一些实施方案中,该组合物包含10.5±2.0wt%的量的RG752S和59.5±2.0wt%的量的R203S。在某些实施方案中,该药物组合物的聚合物共混物包含:i)约15%的RG752S;和ii)约85%的R203S。在一些实施方案中,该聚合物基质包含约10%至约20%的酯封端的生物可降解的聚(D,L-丙交酯-共-乙交酯)共聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为0.16至0.24dL/g且包含73-77mol%D,L-丙交酯和23-27mol%乙交酯,和约80%至约90%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为0.25至0.35dL/g。本文另一方面包括治疗眼部疾病的药物组合物,其包含:A)生物可降解的聚合物基质;和B)均匀分散在该聚合物基质中的至少一种治疗剂;其中该生物可降解的聚合物基质包含聚合物的混合物,其选自以下:i)聚合物基质,包含:a)第一酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为0.25至0.35dl/g;和b)第二酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为1.8至2.2dl/g,其中所述第一和第二聚(D,L-丙交酯)均聚物以约1:2至1:3的比例存在;或,ii)聚合物基质,包含:a)酯封端的生物可降解的聚(D,L-丙交酯-共-乙交酯)共聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为0.16至0.24dL/g且包含73-77mol%D,L-丙交酯和23-27mol%乙交酯;和b)酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为0.25至0.35dL/g,其中该聚(D,L-丙交酯-共-乙交酯)共聚物和聚(D,L-丙交酯)均聚物以约1:5至1:6的比例存在。在一些方面,本发明提供在人受试者治疗眼内压升高的方法,其通过前房内注射向受试者给药固体的、生物可降解的、杆状前房内植入物。在多个方面,该植入物直接递送至受试者眼的前房,其中该植入物停留在下虹膜角膜角。在一些方面,该植入物位于眼的6:00点钟位置。在一个具体方面,本发明的植入物基本上从其初始位置不移动。在其它方面,该植入物未迁移离开其初始位置。在公开的方法的一些实施方案中,通过前房内注射植入物,人的眼压在植入后被控制4至6个月,该植入物具有的初始治疗剂含量范围为约:1至500μg每眼,1至400μg每眼,1至300μg每眼,1至200μg每眼,1至150μg每眼,1至140μg每眼,1至130μg每眼,1至120μg每眼,1至110μg每眼,1至100μg每眼,1至90μg每眼,1至80μg每眼,1至70μg每眼,1至60μg每眼,1至50μg每眼,1至40μg每眼,1至30μg每眼,1至20μg每眼,或1至10μg每眼。在一些实施方案中,该药物为曲伏前列素。该曲伏前列素随时间从植入物释放以治疗眼部疾病。在具体实施方案中,3个植入物被给予至患者的眼,其中所述植入物各具有的体积为148,078,125立方微米,从而在治疗过程中向患者给予了每眼约130μg的总曲伏前列素剂量。在该实施方案中,各具有体积为148,078,125立方微米的植入物包含约43.3μg的曲伏前列素。在其它实施方案中,3个植入物被给予至患者的眼,其中所述植入物各具有的体积为148,078,125立方微米,从而在治疗过程中向患者给予了每眼约121μg的曲伏前列素剂量。在该实施方案中,各具有体积为148,078,125立方微米的植入物包含约40.4μg曲伏前列素。在具体实施方案中,1个植入物被给予至患者的眼,其中所述植入物具有的体积为148,078,125立方微米,从而在治疗过程中向患者给予了每眼约40.4μg的曲伏前列素剂量。在其它实施方案中,3个植入物给予至患者的眼,其中所述植入物各具有的体积为33,750,000立方微米,从而在治疗过程中向患者给予了每眼总共约24μg的曲伏前列素剂量。在该实施方案中,各具有体积为33,750,000立方微米的植入物包含约8μg曲伏前列素。在具体实施方案中,1个植入物给予至患者的眼,其中所述植入物具有的体积为33,750,000立方微米,从而每眼约8μg的总曲伏前列素剂量在治疗过程中给予至患者。本文还公开了药物组合物,其包含:至少一种眼植入物,其中所述至少一种眼植入物具有的体积为33,750,000±10%立方微米;且包含:A)生物可降解的聚合物基质;和B)均匀分散在该聚合物基质中的至少一种治疗剂;其中该生物可降解的聚合物基质包含聚合物的混合物,该混合物包含:i)酯封端的生物可降解的聚(D,L-丙交酯-共-乙交酯)共聚物,其具有的固有粘度为0.16至0.24dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;和ii)酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃以0.1%w/vCHCl3测量。一些实施方案包括将体积为33,750,000±10%立方微米的一个眼植入物给予至眼。其它实施方案包括将各具有的体积为33,750,000±10%立方微米的2个眼植入物给予至眼。其它实施方案包括将各具有的体积为33,750,000±10%立方微米的3个眼植入物给予至眼。其它实施方案包括将各具有的体积为33,750,000±10%立方微米的3个或更多个眼植入物给予至眼。在一些实施方案中,上述每一个体积为33,750,000±10%立方微米的眼植入物含有的曲伏前列素的量为1μg至10μg。在一个具体实施方案中,上述每一个体积为33,750,000±10%立方微米的眼植入物含有的曲伏前列素的量为8μg±2μg。本发明还提供药物组合物,其包括:至少一种眼植入物,其中所述至少一种眼植入物具有的体积为148,078,125±10%立方微米;且包含:A)生物可降解的聚合物基质;和B)均匀分散在该聚合物基质中的至少一种治疗剂;其中该生物可降解的聚合物基质包含聚合物的混合物,该混合物包含:i)酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;和ii)酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为1.8至2.2dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量。一些实施方案包括将体积为148,078,125±10%立方微米的一个眼植入物给予至眼。其它实施方案包括将各自体积为148,078,125±10%立方微米的2个眼植入物给予至眼。其它实施方案包括将各自体积为148,078,125±10%立方微米的3个眼植入物给予至眼。其它实施方案包括将各自体积为148,078,125±10%立方微米的3个或更多个眼植入物给予至眼。在一些实施方案中,上述体积为148,078,125±10%立方微米的眼植入物的每一个含有的曲伏前列素含量为1μg至50μg,或20μg至50μg,或30μg至50μg。在一个具体实施方案中,上述体积为148,078,125±10%立方微米的眼植入物的每一个含有的曲伏前列素含量为43.3μg±2μg。在另一具体实施方案中,上述体积为148,078,125±10%立方微米的眼植入物的每一个含有的曲伏前列素含量为40.4μg±2μg。本文教导的一些实施方案提供生物可降解的缓释眼植入物,包含:均匀分散在生物可降解的聚合物基质中的至少一种治疗剂;其中所述生物可降解的缓释眼植入物被配制以在给予患者后释放治疗有效量的至少一种治疗剂达至少约180天的时间;且其中所述至少一种生物可降解的缓释眼植入物表现出的体外释放性质为在第0天至第160天期间释放该至少一种治疗剂的约1%至最大约35%。在一些实施方案中,该生物可降解的缓释眼植入物表现出的体外释放性质为在第0天至第84天期间释放该至少一种治疗剂的少于约30%。在一些实施方案中,该眼植入物包含约25%至约35%的聚(D,L-丙交酯)R203S和约65%至约75%的聚(D,L-丙交酯)R208S。本文教导的其它实施方案提供生物可降解的缓释眼植入物,包含:均匀分散在生物可降解的聚合物基质中的至少一种治疗剂;其中所述生物可降解的缓释眼植入物被配制以在给予患者后释放治疗有效量的至少一种治疗剂达至多约70至90天的时间,此时约100%的至少一种治疗剂已被释放;且其中所述至少一种生物可降解的缓释眼植入物表现出的体外释放性质为在第0天至第28天期间释放该至少一种治疗剂的约1%至最大约25%。在一些实施方案中,该缓释眼植入物表现出的体外释放性质为在第0天至第56天期间释放该至少一种治疗剂的少于约45%。在一些实施方案中,该缓释眼植入物表现出的体外释放性质为在第56天至第84天期间释放该至少一种治疗剂的至少50%。在一些实施方案中,该眼植入物包含约10%至约20%的聚(D,L-丙交酯-共-乙交酯)RG752S和约80%至约90%的聚(D,L-丙交酯)R203S。在具体实施方案中,本发明提供缓释眼植入物,其表现出的体外释放性质对应于图2A-2F的植入物所示的体外释放性质。而且,本发明提供聚合物基质组合物,其表现出本文公开的附图或表中任一个所示的释放性质,或展示可从所述附图和表的数据算数推导出的释放性质。在一些方面,该眼植入物配制为用于治疗特征为眼内压升高的眼部疾病。在一些方面,该眼植入物配制为用于治疗青光眼。在一些方面,该眼植入物配制为用于治疗高眼压。在一个实施方案中,该眼植入物被制定尺寸和结构以使得该植入物植入眼的前房的下虹膜角膜角。在一些方面,该眼植入物配制为在初始给予患者到给予患者180天后的整个期间内尺寸不增加超过5%。在一些方面,该眼植入物被制定尺寸和结构以使得使用用于递送的针给药。在一些实施方案中,所述针为27号。本发明一些实施方案的一个重要方面为均匀性和控制总尺寸至本文讨论的容许限度内以尽可能使用最小的针号。植入物在总体最大植入物横截面宽度和针内径之间将具有10-50微米间隙(clearance)。在其它实施方案中,在总体最大植入物横截面宽度和针内径之间的植入物-针间隙将为20-40微米。在其它实施方案中,在总体最大植入物横截面宽度和针内径之间植入物-针间隙将为不小于40微米。在其它实施方案中,在总体最大植入物横截面宽度和针内径之间植入物-针间隙将为不小于30微米。在其它实施方案中,在总体最大植入物横截面宽度和针内径之间植入物-针间隙将为不小于20微米。在其它实施方案中,在总体最大植入物横截面宽度和针内径之间植入物-针间隙将为不小于10微米。本领域技术人员应理解植入物的三维形状可被设计以使针的内开口的体积最大或促进植入物或治疗所需的负载、插入、组织沉积或其它参数。在一些实施方案中,本发明的模具和植入物被设计为圆柱状植入物。在一些实施方案中,该圆柱状植入物被制造为横截面直径比针的内径小不低于30微米。在一些实施方案中,该植入物、模具或制备该模具的底版(master)使用累积制造技术制造。在本发明一个实施方案中,将27号超薄壁针用于本发明的150x150x1500微米的植入物。本领域技术人员应理解能使用小的针尺寸是本发明一些实施方案的重要特征,以最小化组织损伤。在一个实施方案中,该眼植入物包含:i)约30%w/w的至少一种治疗剂;和ii)约70%w/w的生物可降解的聚合物基质。在一个具体实施方案中,该眼植入物包含:i)活性剂曲伏前列素(30%负载w/w);和ii)生物可降解的聚合物基质,其包括:R203S和R208S(70%w/w)聚合物的聚(D,L-丙交酯)(PLA)共混物,其中所述眼植入物具有的尺寸为225μm×225μm×2,925μm且体积为148,078,125±5%立方微米。在一个实施方案中,该眼植入物包含:i)活性剂曲伏前列素(33%负载w/w);和ii)生物可降解的聚合物基质,其包括:R203S(22.11%w/w)和R208S(44.89%w/w)聚合物的聚(D,L-丙交酯)(PLA)共混物,其中所述眼植入物从尺寸为225μm×240μm×2,925μm的模具腔模制。在另一实施方案中,该眼植入物包含:i)活性剂曲伏前列素(34%负载w/w);和ii)生物可降解的聚合物基质,其包括:R203S(21.78%w/w)和R208S(44.22%w/w)聚合物的聚(D,L-丙交酯)(PLA)共混物,其中所述眼植入物从尺寸为150μm×180μm×1,500μm的模具腔模制。在另一实施方案中,该眼植入物包含:i)活性剂曲伏前列素(30%负载w/w);和ii)生物可降解的聚合物基质,其包含:RG752S和R203S(70%w/w)聚合物的聚(D,L-丙交酯-共-乙交酯)/聚(D,L-丙交酯)(PLGA/PLA)共混物,其中所述眼植入物具有的尺寸为150μm×150μm×1,500μm且体积为33,750,000±5%立方微米。在一个具体实施方案中,该眼植入物通过以下方法制备,包括:1)提供模具,其中该模具包含形成于其中的多个凹陷区域;2)将一定体积的液体材料安置在凹陷区域中;3)形成多个基本上均匀的植入物;和4)从该有图案的模板收集植入物,其中各所述植入物基本上模拟该凹陷区域。一些实施方案包括用于给予生物可降解的缓释眼植入物的试剂盒,其包含:(a)至少一种生物可降解的缓释眼植入物;其中所述至少一种生物可降解的缓释眼植入物包含均匀分散在生物可降解的聚合物基质中的至少一种治疗剂;和(b)包含针或针状装置的一次性使用的眼植入物施药器。在一些实施方案中,该针或针状装置为22号或更小。在一个实施方案中,该针状装置具有的针内径比植入物的最大横截面直径大不少于40微米。在一个实施方案中,该针状装置具有的针内径比植入物的最大横截面直径大不少于30微米。在一个实施方案中,该针状装置具有的针内径比植入物的最大横截面直径大不少于20微米。在一些方面,根据本发明制备的植入物显示的治疗剂释放性质具有非常低的植入物内的变异性。本发明一些植入物显示的该治疗剂释放性质在不同植入物之间是一致的且表现出的变化不是统计学显著的。因此,通过植入物的实施方案表现出的药物释放性质具有的变异系数在置信区间内且不是生物相关的。在一些方面,在给定构造的植入物中的治疗剂含量高度一致。在具体实施方案中,本发明的植入物具有的治疗剂含量在给定构造的植入物之间没有显著改变。在一个实施方案中,具有给定构造的植入物的治疗剂含量不以统计学显著的方式彼此变化。在具体实施方案中,本发明的植入物在具有给定构造的不同成员之间具有治疗剂的含量变异,如FIG3A-3C的治疗剂含量均匀性图所示。在某些方面,本发明提供治疗眼部疾病的药物组合物,其包含:A)生物可降解的聚合物基质;和B)均匀分散在该聚合物基质中的至少一种治疗剂;其中该生物可降解的聚合物基质包含聚合物的混合物,该混合物包含:i)22+/-5%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;和ii)45+/-5%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为1.8至2.2dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量。在某些方面,本发明提供治疗眼部疾病的药物组合物,其包含:A)生物可降解的聚合物基质;和B)均匀分散在该聚合物基质中的至少一种治疗剂;其中该生物可降解的聚合物基质包含聚合物的混合物,该混合物包含:i)22+/-3%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;和ii)45+/-3%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为1.8至2.2dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量。在某些方面,本发明提供治疗眼部疾病的药物组合物,其包含:A)生物可降解的聚合物基质;和B)均匀分散在该聚合物基质中的至少一种治疗剂;其中该生物可降解的聚合物基质包含聚合物的混合物,该混合物包含:i)22+/-1%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为0.25至0.35dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量;和ii)45+/-1%的酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其具有的固有粘度为1.8至2.2dL/g,该固有粘度使用Ubbelhode的0c号玻璃毛细管粘度计在25℃在CHCl3中以0.1%w/v测量。在一方面,本文教导的治疗眼部疾病的药物组合物具有的生物可降解的聚合物基质占该药物组合物65%±5%w/w,或该药物组合物65%±3%w/w,或该药物组合物65%±1%w/w。在一方面,本文教导的治疗眼部疾病的药物组合物具有均匀分散在该聚合物基质中的至少一种治疗剂,其选自:前列腺素、前列腺素前药、前列腺素类似物、前列腺胺,及它们的组合。在一方面,本文教导的治疗眼部疾病的药物组合物具有均匀分散在该聚合物基质中的至少一种治疗剂,其选自:拉坦前列素、曲伏前列素、比马前列素、他氟前列素,乌诺前列酮异丙酯,及它们的组合。在一方面,本文教导的治疗眼部疾病的药物组合物具有至少均匀分散在聚合物基质中的曲伏前列素。在一方面,本文教导的治疗眼部疾病的药物组合物被制造为眼植入物。在一方面,本文教导的治疗眼部疾病的药物组合物被制造为眼植入物且所述制造不包括热熔融挤出。在一方面,本文教导的治疗眼部疾病的药物组合物被制造为眼植入物且所述制造在约340°F至约350°F的温度范围发生。在一些方面,眼植入物的制造不在250°F至300°F的温度范围发生。在一方面,本文教导的治疗眼部疾病的药物组合物被制造为眼植入物且其中该植入物在人眼的前房中在不少于90天内降解且释放该治疗剂超过90天。在一方面,本文教导的治疗眼部疾病的药物组合物被制造为眼植入物且用于治疗青光眼、或眼内压升高或高眼压的方法。附图简述图1为置于眼的虹膜角膜角中的植入物的示意图,以及描绘了位于眼的虹膜角膜角中的房水流出。图2A显示体外研究中释放的曲伏前列素的百分比作为时间(天)的函数。图2B显示体外研究中释放的曲伏前列素的量(μg)作为时间(天)的函数。图2C显示曲伏前列素的体外释放速率(ng/天)作为时间(天)的函数。图2D显示体外研究中释放的曲伏前列素的百分比作为时间(天)的函数。图2E显示体外研究中释放的曲伏前列素的量(μg)作为时间(天)的函数。图2F显示曲伏前列素的体外释放速率(ng/天)作为时间(天)的函数。图3A显示图2A-2F所示的植入物的治疗剂含量均匀性图。图3B显示针对所选择的植入物使用R208S/R203S聚合物基质的治疗剂含量均匀性图。图3C显示针对所选择的植入物使用的R203S/RG752S聚合物基质的治疗剂含量均匀性图。图4A显示在180天的期间植入物515-55-8(2个植入物)和515-47-11(3个植入物)体外随时间释放的曲伏前列素(%)。图4B显示在180天的期间植入物515-55-8(2个植入物)和515-47-11(3个植入物)体外随时间释放的累积曲伏前列素(μg)。图4C显示在180天的期间植入物515-55-8(2个植入物)和515-47-11(3个植入物)体外随时间的曲伏前列素释放速率(ng/天)。图5显示对于体内研究PRE004经224天,515-47-11(3个植入物)和515-55-8(2个植入物)在血压正常的比格犬中的IOP,其为时间的函数。图6显示对于体内研究PRE004经84天,515-55-8(2个植入物)在血压正常的比格犬中的IOP降低作用。图7显示对于体内研究PRE004经84天,植入物515-47-11(3个植入物)在血压正常的比格犬中的IOP降低作用。图8显示对于体内研究PRE006经168天,515-60-4(3个植入物);515-60-5(1个植入物);和515-60-5(3个植入物)在血压正常的比格犬中的IOP,其为时间的函数。图9显示对于体内研究PRE006经84天,515-60-4(3个植入物);515-60-3(1个植入物);和515-60-3(3个植入物)在血压正常的比格犬中的IOP降低作用。图10A显示对于体内研究PRE006经84天,515-60-5(1个植入物)和515-60-5(3个植入物)在血压正常的比格犬中的IOP降低作用(作为未审核的示例性数据)。图10B显示对于体内研究PRE006经280天,515-60-5(1个植入物)和515-60-5(3个植入物)在血压正常的比格犬中的IOP降低作用。图11A显示对于体内研究PRE009(PLA/PLA基质)经126天,003-001-6B(3个植入物);003-001-6A(3个植入物);和003-001-8A(3个植入物)在血压正常的比格犬中的IOP作为时间的函数(作为未审核的示例性数据)。图11B显示对于体内研究PRE009(PLA/PLA基质)经126天,003-001-6B(1个植入物);003-001-6A(1个植入物);003-001-7A(1个植入物);和003-001-8A(1个植入物)在血压正常的比格犬中的IOP作为时间的函数(作为未审核的示例性数据)。图11C显示对于体内研究PRE009(PLA/PLA基质)经126天,003-001-14B(3个植入物);003-001-14A(1个植入物);003-001-4B(1个植入物);和003-001-4B(3个植入物)在血压正常的比格犬中的IOP作为时间的函数(作为未审核的示例性数据)。图11D显示对于体内研究PRE009经189天,0003-001-6B(1个植入物)和0003-001-6B(3个植入物)在血压正常的比格犬中的IOP作为时间的函数。图12显示植入物在比格犬中的瞳孔缩小作用。(图12A(PRE004研究)、FIG.12B(PRE006研究)、FIG.12C和图12D(PRE009研究)。图13显示在140天期间曲伏前列素植入物的眼安全性指数,其中排除狗特异性的降低的瞳孔光反射。图14显示在前房内植入后的第28天和56天体内回收的曲伏前列素的量(μg)。图15显示在前房内植入后的第28天和56天体内回收的曲伏前列素(%)。图16显示在前房内植入后的第28天和56天体内释放的曲伏前列素(%)。图17显示在前房内植入后的第28天和56天体内曲伏前列素释放速率(ng/天)。图18示出给予1个月后曲伏前列素的体内释放速率vs.房水浓度。该图描绘了在x-轴的体内释放速率(ng/天)和在y-轴的房水中的曲伏前列素游离酸浓度(pg/mL)。图19示出给予2个月后曲伏前列素的体内释放速率vs.房水浓度。该图描绘了在x-轴的体内释放速率(ng/天)和在y-轴的房水中的曲伏前列素游离酸浓度(pg/mL)。图20示出曲伏前列素的体内释放速率vs.房水浓度,其组合了给予1个月和2个月后的数据。该图描绘了在x-轴的体内释放速率(ng/天)和在y-轴的房水中的曲伏前列素游离酸浓度(pg/mL)。图21示出给予1个月后IOPvs.曲伏前列素的房水浓度。该图描绘了在x-轴的房水中的曲伏前列素游离酸浓度(pg/mL)和在y-轴的IOP处理作用(mmHg)。图22示出给予2个月后IOPvs.曲伏前列素的房水浓度。该图描绘了在x-轴的房水中的曲伏前列素游离酸浓度(pg/mL)和在y-轴的IOP处理作用(mmHg)。图23示出IOPvs.曲伏前列素房水浓度,其组合了给予1个月和2个月后的数据。该图描绘了在x-轴的房水中的曲伏前列素游离酸浓度(pg/mL)和在y-轴的IOP处理作用(mmHg)。图24A为电子显微照片,其示出在27G薄壁针中的150μmx150μmx1,500μm植入物。图24B为电子显微照片,其示出在27G薄壁针中的225μmx225μmx2,925μm植入物。图25显示负载在27号超薄壁针中的植入物以及在针的内径和植入物之间的间隙的图。图26显示负载在27号超薄壁针中的植入物以及在针的内径和植入物之间的间隙的另一图。发明详述本文提供了用于治疗眼部疾病的药物组合物。在一些实施方案,该药物组合物包含:生物可降解的聚合物基质和包含在该聚合物基质中的治疗剂。在一些实施方案,该治疗剂均匀分散在整个聚合物基质中。如本文所述,已制造和/或考虑到植入物形式的多种药物组合物,得到高度有效的药物活性产物,该产物包括眼部治疗物(包括缓释眼植入物)。在不同实施方案中,这些药物组合物包含分散在整个聚合物基质中的治疗剂,该聚合物基质成形为眼植入物。在一个具体实施方案中,本发明的药物组合物包含:i)生物可降解的聚合物或生物可降解的聚合物的混合物,和ii)治疗剂,例如,有效用于治疗眼部疾病,如眼内压升高(IOP)的药物。定义“约”是指如此限定的数值、参数或特征加或减一个百分比(例如,±5%),本领域技术人员将理解从使用该术语的科学语境看这是合适的。而且,由于所有涉及本文使用的量的数、值和表示方式会经历本领域遇到的多种测量的不确定性,因此除非另有所述,所有提供的值可理解为用术语“约”修饰。如本文所述,冠词“一个”、“一种”和“所述”可包括复数含义,除非明确表示限制为单数,或如果对于本领域技术人员来说从上下文可明显看出该冠词是指单数。在此处公开数值范围的情况下,这一范围是连续的,包括该范围的最小值和最大值二者以及在这一最小值和最大值之间的每一数值。再进一步地,在范围是指整数的情况下,包括在这一范围的最小值和最大值之间的每一整数。另外,在提供多个范围描述一个特征或特性的情况下,可结合这些范围。也就是说,除非另有说明,此处公开的所有范围要理解为包括此处纳入的任何和所有子范围。例如,“1-10”的所述范围应当被视为包括在最小值1和最大值10之间的任何和所有子范围。范围1-10的例举的子范围包括,但不限于,1至6.1,3.5至7.8,和5.5至10。如本文所述,术语“聚合物”包括均聚物(仅具有一种重复单元的聚合物)和共聚物(具有多于一种重复单元的聚合物)二者。“生物可降解的聚合物”是指一种或多种聚合物,其在体内生理条件下降解。治疗剂的释放随时间与生物可降解的聚合物的降解一起发生,或在其之后发生。术语“生物可降解的”和“生物可蚀解的”在此可互换使用。生物可降解的聚合物可为均聚物、共聚物,或包含多于两种不同聚合物单元的聚合物。如本文所述,术语“聚合物基质”是指聚合物的均匀混合物。换句话说,该基质不包括以下混合物,该混合物其中的一部分在成分、密度等方面不同于另一部分。例如,该基质不包括以下组合物,该组合物包含核和一个或多个外层,也不包括以下组合物,该组合物包含药物贮库和一个或多个围绕该药物贮库的部分。聚合物的混合物可为相同类型,例如两种不同的PLA聚合物,或不同类型,例如PLA聚合物与PLGA聚合物的混合物。“眼部疾病”是指疾病、不适或病症,其影响或涉及眼部区域。术语“热熔融挤出”或“热熔融挤出的”在本文用于描述一种方法,其中共混的组合物被加热和/或压制成熔融(或软化)状态,随后迫使其通过孔口,由此挤出产物(挤出物)成形为其最终形状,其中其在冷却后固化。术语“非挤出的植入物”或“非热熔挤出的植入物”是指不在使用挤出步骤的方法中制备的植入物,例如,通过在模具腔中模制。“缓释”或“控释”是指以持续速率从植入物释放至少一种治疗剂或药物。缓释意味着该治疗剂不是以不可预测的方式从植入物偶发性地释放。术语“缓释”可包括部分的与展开(deployment)相关的“突发现象”。在一些示例性实施方案,期望的是至少一种治疗剂的初始爆发,然后是更加缓慢的释放。释放速率可为稳态(通常称为“定时释放”或0级动力学),即至少一种治疗剂经预定的时间以平稳量释放(有或没有初始爆发期),或可为梯度释放。例如,缓释在给定的时期或相比于局部给药可具有基本恒定的释放。“治疗有效量”是指治疗眼部疾病所需的治疗剂的水平或量;在被给予治疗剂的受试者中产生治疗响应或所需效果的治疗剂的水平或量。因此,治疗剂,如曲伏前列素的治疗有效量,为有效减少至少一种眼部疾病症状的量。眼科解剖学在具体实施方案中,本文所述的植入物为制备的前房内植入物,其放置在人眼的虹膜角膜角处或置于人眼的虹膜角膜角内。在这些实施方案,治疗剂从植入物的缓释实现了在患者眼的房水中的药物浓度在缓释期间显著地使IOP降低。而且,在一些实施方案,放置在人眼的虹膜角膜角处或置于其内的前房内植入物实现的房水中的药物浓度在植入物的缓释期间在48小时或更久的任何连续期不会波动至低于治疗水平,从而克服与局部给药范例和现有技术的植入物相关的固有问题。眼的前房和后房充满眼房水,这是一种主要由睫状体分泌的与血液具有相似离子组成的流体。眼房水的功能为:a)供应养分至眼的无血管结构,如晶状体和角膜,和b)维持IOP。眼房水主要地通过睫状体的睫状突分泌至眼的后房,并且眼房水产生的次要机制是通过从动脉血中超滤。眼房水通过穿过瞳孔而抵达前房,并且存在对流,其中与虹膜相邻的房水流是向上的并且与角膜相邻的房水流向下流动(图1)。存在房水流出的两条不同途径,二者均存在于眼的虹膜角膜角中(图1)。葡萄膜巩膜途径或非常规途径指眼房水扩散通过睫状肌纤维之间的细胞间空隙离开前房。虽然这似乎在人体内是次要流出途径,但是葡萄膜巩膜途径是特异性抗高血压药物如降压脂质的靶标。眼房水呈360°流出并进入小梁网,所述小梁网在人体内起初具有范围从10微米至不足30微米的孔径直径。眼房水经施莱姆管(Schlemm’scanal)流出并且经25条至30条收集通道离开眼进入房水静脉,并最终进入巩膜上脉管系统和静脉眼眶。从如本文所述植入物流出的治疗剂通过对流进入前房的房水。治疗剂随后分散遍及前房并且经虹膜根部区域进入靶组织如小梁网和睫状体区域。在上述小梁网和葡萄膜巩膜组织二者中,已发现多种前列腺素类受体,其表明前列腺素类涉及房水产生和/或引流的调节,从而影响眼压。在小梁网中,编码EP、FP、IP、DP和TP受体家族的基因被表达,而EP和FP受体家族在葡萄膜巩膜组织中占主导(Toris等人,SurvOphthalmol.2008;53,Suppl.1,S107-S120)。前列腺素类为代表类花生酸亚类的生理脂肪酸衍生物。它们包括前列腺素、前列腺胺、血栓烷和前列腺环素,这些化合物都为多种生理过程涉及的介质。天然前列腺素如PGF2a、PGE2、PGD2和PGI2对其各自受体(FP,EP,DP,IP)表现出特殊的亲和力,但也对其它前列腺素受体具有一些非选择性亲和力。前列腺素还对基质金属蛋白酶具有直接作用。这些为小梁网中表达的中性蛋白酶,其通过降解细胞外基质在控制房水流出抗性方面起作用。已发现多种前列腺素类似物能有效作为局部给药的药物以降低眼压,如拉坦前列素、比马前列素、他氟前列素、曲伏前列素和乌诺前列酮。据一些专家所言,比马前列素应理解为前列腺胺而非前列腺素衍生物。拉坦前列素、曲伏前列素、他氟前列素,且有可能还有比马前列素,为有效且选择性的PGF2a激动剂。它们的净效应为降低眼压,其主要由房水引流的大量增加而引起,经由葡萄膜巩膜途径。它们也可能在一定程度上增加小梁流出。乌诺前列酮有时也被分类为PGF2a类似物,即使其功效和选择性比之前提及的化合物小得多。其与PGF2a的肺代谢物最密切相关。其也能降低眼压,但似乎主要通过刺激小梁引流途径而起作用,然而其对葡萄膜巩膜流出具有很小作用。注射和前房内安置本文中描述的生物可降解性植入物的优点在于前房是身体内免疫赦免部位并且较不可能与外来物质如聚合治疗药递送系统反应。生物可降解的聚合物在某些实施方案中,本文所述的植入物在尺寸、形状、组成及它们的组合方面是经设计的,以提供植入物与人眼的虹膜角膜角的最大接近。在某些实施方案中,该植入物由聚合物材料制成。在一些实施方案,用于形成本文所述的植入物的聚合物材料为生物可降解的。在一些实施方案,该聚合物材料可为聚乳酸、乙醇酸和其共聚物(它们随时间向眼睛提供治疗剂的持续释放)的任何组合。用于植入物中的合适聚合材料或组合物包括这些材料,它们与眼相容,即与眼生物相容,从而不导致严重干扰眼的功能或生理学。此类聚合物材料可为生物可降解的、生物可侵蚀的或既是生物可降解的又是生物可侵蚀的。在具体实施方案中,有用的聚合材料的实例包括,而不限于源自和/或包括有机酯和有机醚的这类材料,它们在降解时产生生理可接受的降解产物。另外,本发明也可以使用源自和/或包括酐、酰胺、原酸酯等的聚合材料,这些材料本身或与其他单体的组合。所述聚合材料可以是加聚物或缩聚物。聚合材料可以是交联的或非交联的。对于一些实施方案,除碳和氢之外,聚合物可包括氧和氮的至少一种。氧可以作为氧基存在,例如羟基或醚、羰基,例如,非氧代羰基,如羧酸酯等。氮可以作为酰胺、氰基和氨基存在。在一个实施方案中,羟基脂族羧酸的聚合物(均聚物或共聚物)和多糖用于植入物中。聚酯可以包括D-乳酸、L-乳酸、外消旋乳酸、乙醇酸、聚己内酯、其共聚物、及它们的组合的聚合物。用于本发明一些实施方案的聚合物或聚合材料的一些优选特征可以包括生物相容性、与所选择治疗药的相容性、易于在制备本文所述的治疗药递送系统中使用所述聚合物、在生理环境中合乎需要的半衰期和亲水性。在一个实施方案中,用于制备植入物的生物可降解的聚合物基质为合成脂族聚酯,例如,乳酸和/或乙醇酸的聚合物,且包括聚-(D,L-丙交酯)(PLA),聚-(D-丙交酯),聚-(L-丙交酯),聚乙醇酸(PGA),和/或共聚物聚-(D,L-丙交酯-共-乙交酯)(PLGA)。PLGA和PLA聚合物已知通过主链水解(骨架溶蚀)而降解,且最终降解产物为乳酸和乙醇酸,其为无毒的且视为天然代谢化合物。乳酸和乙醇酸经由Krebs循环通过转化为二氧化碳和水而安全地消除。PLGA通过乙醇酸和乳酸的环状二聚体的无规开环共聚合而合成。乙醇酸或乳酸的连续单体单元通过酯连接基而连接在一起。丙交酯与乙交酯的比例可变化,以改变产物的生物降解特征。通过改变该比例,可定制聚合物降解时间。重要的是,药物释放特征受药物递送系统中的生物降解速率、分子量和结晶度的影响。通过改变和定制该生物可降解的聚合物基质,可改变药物递送分布。PLA、PGA和PLGA主要通过在周围组织中在水的存在下,在整个聚合物基质中其酯连接基的非酶水解而裂解。PLA、PGA和PLGA聚合物为生物相容的,因为它们在体内经历水解以产生原始单体、乳酸和/或乙醇酸。乳酸和乙醇酸是无毒的且经由Krebs循环通过转化为二氧化碳和水而安全地消除。PLA、PGA和PLGA聚合物的生物相容性已在动物和人的非眼和眼组织中进一步检测。该发现表明这些聚合物是良好耐受的。可在本发明一个实施方案中使用的PLA聚合物的实例包括可获自EvonikIndustries的产品系列,其被命名为但不限于,R207S、R202S、R202H、R203S、R203H、R205S、R208、R206和R104。合适的PLA聚合物的实例包括固有粘度范围为约0.15至约2.2dL/g的酸和酯封端的聚合物,该固有粘度以0.1%w/v在CHCl3中在25℃使用Ubbelhode0c号玻璃毛细管粘度计测量。合成多种分子量的PLA是可能的。在一个实施方案,可使用固有粘度为约1.8至约2.2dl/g的PLA,如R208S。在另一实施方案中,可使用固有粘度为约0.25至约0.35dl/g的PLA,如R203S。Resomer的R203S和R208S为具有以下通式结构(1)的聚(D,L-丙交酯)或PLA酯-封端的聚合物可在本发明一个实施方案中使用的PLGA聚合物的实例,包括EvonikIndustries的产品系列,其被命名为但不限于,RG502、RG502H、RG503、RG503H、RG504、RG504H、RG505、RG506、RG653H、RG752H、RG752S、RG753H、RG753S、RG755、RG755S、RG756、RG756S、RG757S、RG750S、RG858和RG858S。这些PLGA聚合物包括酸和酯封端的聚合物,其固有粘度范围为约0.14至约1.7dl/g,当在0.1%w/v在CHCl3中在25℃使用Ubbelhode0c号玻璃毛细管粘度计测量。本发明各种实施方案使用的聚合物的实例可包括的D,L-丙交酯与乙交酯的摩尔比的变化为约50:50至约85:15,包括,但不限于,50:50、65:35,75:25和85:15。合成具有不同D,L-丙交酯-乙交酯比例的多种分子量的PLGA是可能的。在一个实施方案中,可使用固有粘度为约0.16至约0.24dl/g的PLGA,如RG752S。ResomerRG752S为聚(D,L-丙交酯-共-乙交酯)或酯-封端的PLGA共聚物(丙交酯:乙交酯比例为75:25),具有以下通式结构(2):用于形成本发明的植入物的聚合物具有与其相关的独立的性质,当组合时,提供将治疗有效量的治疗剂持续释放所需的性质。一些控制治疗剂释放速率的主要聚合物特征为分子量分布、聚合物端基(即,酸或酯),和聚合物基质中聚合物和/或共聚物的比例。本发明提供具有所需的治疗剂释放特征的聚合物基质的实例,其通过操控一种或多种上述性质以开发合适的眼植入物。被包括以形成植入物的聚合基质的生物可降解性聚合材料经常遭受酶促或水解不稳定作用。水溶性聚合物可以采用水解或生物可降解性不稳定的交联键交联,以提供有用的水不溶性聚合物。稳定性的程度可以大幅度变动,这取决于单体的选择、是否使用均聚物或共聚物、使用聚合物的混合物和聚合物是否包括酸端基。对于控制聚合物的生物降解并且因此延长植入物的释放性质同等重要的是植入物中所用的聚合组合物的相对平均分子量。可以包括不同分子量的相同或不同的聚合组合物以调节至少一种治疗药的释放曲线。在本发明一个实施方案中,本发明植入物的聚合物选自本文公开的生物可降解的聚合物,其在存在房水时不明显膨胀。作为实例但不限于,PLGA聚合物当用作药物递送植入物的基质材料时膨胀,而基于PLA的聚合物混合物在房水存在时不明显膨胀。因此,PLA聚合物基质材料在本发明一些实施方案中为聚合物基质材料。药物释放性质操控药物从生物可降解的植入物的释放速率取决于多种因素。例如,植入物的表面积、治疗剂含量和治疗剂的水溶性以及聚合物的降解速度。对于均聚物如PLA,药物释放也通过(a)丙交酯立体异构体组成(即L-vs.D,L-丙交酯的量)和(b)分子量确定。确定PLGA共聚物的降解速率的三种另外的因素为:(a)丙交酯:乙交酯比例,(b)丙交酯立体异构体组成(即,L-vs.DL-丙交酯的量),和(c)分子量。丙交酯:乙交酯比例和立体异构体组成通常认为是对于PLGA降解最重要的,因为它们确定聚合物亲水性和和结晶性。例如,乳酸与乙醇酸比例为1:1的PLGA比PLA或PGA降解更快,且降解速率可通过增加丙交酯或乙交酯含量而降低。降解时间为几周至几年的聚合物可简单地通过调节丙交酯:乙交酯的比例和丙交酯立体异构体的组成来制备。PGA、PLA和PLGA的多样性使得可构造递送系统以调节药物释放,从而治疗多种眼部疾病。当PGA、PLA和PLGA聚合物的多样性与本发明的制备技术(即技术(EnvisiaTherapeuticsInc.)颗粒制造)相结合时,则可创造许多定制的和高度一致和可预测的药物释放性质,其根据现有技术(例如挤出)是不可能实现的。也就是说,使用本发明的基于模具的颗粒制造技术,可制备植入物,该植入物彼此之间具有的药物释放性质具有高度重现性特征。本发明多种植入物表现出的药物释放性质在不同植入物之间是一致的,且表现出非统计学显著的变异。因此,所述植入物的实施方案表现出的药物释放性质具有的变化系数在一置信区间内且不影响治疗剂递送。制备具有如此高程度的药物负载或释放一致性的植入物的能力是相对现有技术的改进。药物释放动力学药物从基于PLA和PLGA的聚合物基质药物递送系统的释放通常符合假一级或平方根动力学。药物释放受多种因素影响,包括:聚合物组成、治疗剂含量、植入物形态学、多孔性、曲折度、表面积、制备方法、和从漏槽状态(sinkcondition)的偏离,仅举一些例子。本发明的基于模子的制备技术—在本发明一些实施方案中使用—能够以现有技术方法不能达到的方式操控植入物的形态学、多孔性、曲折度和表面积。例如,本发明方法可达到的高度一致的药物释放性质、高度一致的植入物形态、和高度一致的均匀药物分散体,是不能通过现有技术操作者使用基于挤出的制备方法来得到的。通常,治疗剂释放分3个阶段发生:(a)从表面初始爆发释放治疗剂,(b)然后是一段扩散释放期,其通过治疗剂的固有溶解而控制(扩散穿过内部孔进入周围介质),和最后,(c)与聚合物基质的生物降解相关的治疗剂释放。快速实现高治疗剂浓度,然后是较长的连续较低剂量释放期,这使得这些递送系统理想地适合急性发作疾病,该急性发作疾病需要负荷剂量的治疗剂,然后在1天至3个月的期间内逐渐减少的剂量。最近的基于PLGA的药物递送系统的改进允许两阶段的释放特征,具有初始高的(爆发)治疗剂释放速率,然后是基本上持续的0-级(线性)动态释放(即,从聚合物基质释放治疗剂的速率在较长时期是稳定的且不依赖于周围环境中的治疗剂浓度)。此外,当需要治疗慢性疾病如升高的IOP时,这些治疗剂递送系统可设计为在开始的0级动力学后具有基本上稳态的释放。治疗剂用于本发明各种实施方案的合适的治疗剂可参见食品和药物管理局颁布的OrangeBook,其列出了批准用于治疗眼部疾病的(包括青光眼)和/或降低IOP的治疗剂。在一些实施方案中,根据本发明可使用的治疗剂包括:前列腺素、前列腺素前药、前列腺素类似物、前列腺胺、其药物可接受的盐,及它们的组合。实例包括前列腺素受体激动剂,包括前列腺素E1(前列地尔)、前列腺素E2(地诺前列酮)、拉坦前列素和曲伏前列素。拉坦前列素和曲伏前列素为前列腺素前药(即前列腺素的I-异丙基酯);然而,它们被称为前列腺素,因为它们在水解为1-羧酸后作用于前列腺素F受体。前列腺胺(也称为前列腺素-乙醇酰胺)为前列腺素类似物,其为源自前列腺素的药理学独特的物质(即因为前列腺胺相比前列腺素作用于不同细胞受体[前列腺胺受体]),且作为内源性大麻素(如花生四烯乙醇胺)的环氧合酶-2(“COX-2”)氧合产物而形成的中性脂质。此外,前列腺胺不原位水解为1-羧酸。前列腺胺的实例为比马前列素(合成制备的17-苯基前列腺素F2α的乙基酰胺)和前列腺胺F2α。其它可用作治疗剂的前列腺素类似物包括,但不限于,乌诺前列酮和EP2/EP4受体激动剂。本文使用的前列腺素还包括一种或多种类型的前列腺素衍生物,前列腺素类似物(包括前列腺胺和前列腺胺衍生物),其前药、盐,及其混合物。上述药物的合适的实例包括,但不限于,拉坦前列素、曲伏前列素、比马前列素、他氟前列素和乌诺前列酮异丙酯。在一个实施方案中,本发明使用曲伏前列素、拉坦前列素和比马前列素。在另一实施方案中,本发明使用曲伏前列素和拉坦前列素。在一个具体实施方案中,本发明使用曲伏前列素。曲伏前列素具有的分子式为C26H35F3O6和分子量为500.548g/mol。曲伏前列素的化学结构(3)如下所示:IUPAC名:7-[3,5-二羟基-2-[3-羟基-4-[3-(三氟甲基)苯氧基]-丁-1-烯基]-环戊基]庚-5-烯酸丙-2-基酯曲伏前列素,活性部分(+)-氟前列醇的前列腺素类似物酯前药,目前作为0.004%无菌防腐的(或无防腐剂的)、等张的多剂量眼用溶液销售,其使用众所周知的赋形剂。该制剂每mL溶液包含40μg曲伏前列素且以每天一滴给药,其中患有原发性开角型青光眼或高眼压的患者每天给药约1μg曲伏前列素以降低眼压(TRAVATAN曲伏前列素眼用溶液,PackageInsert.AlconLaboratories,Inc.FortWorth,TX2004;和曲伏前列素眼用溶液,PackageInsert.AlconLaboratories,Inc.FortWorth,TX.2013)。曲伏前列素首先在2001年由FDA批准作为局部滴眼剂,商标名最近在2006年商标名为TRAVATAN曲伏前列素为合成的前列腺素类似物且为其游离酸活性形式的异丙基酯前药,该游离酸活性形式为前列腺素FP受体的选择性和有效的全激动剂,其EC50为3.2nM(SharifNA,KellyCR,CriderJY.“AgonistActivityofBimatoprost,Travoprost,Latanoprost,UnoprostoneIsopropylEsterandOtherProstaglandinAnalogsattheClonedHumanCiliaryBodyFPProstaglandinReceptor,”JOculPharmacolTher.2002;18:313-324)。当作为局部滴眼液给药时,曲伏前列素水解且在房水中作为游离酸出现。认为曲伏前列素通过增强房水的葡萄膜巩膜流出而降低IOP,且已在多种动物模型中对该作用进行研究,包括猴、狗和猫(GelattKN,MacKayEO.“GelattKN,MacKayEO.“EffectofdifferentdoseschedulesoftravoprostonintraocularpressureandpupilsizeintheglaucomatousBeagle,”VetOphthalmol.2004;7(1):53-57;和BeanGW,CamrasCB.“Commerciallyavailableprostaglandinanalogsforthereductionofintraocularpressure:similaritiesanddifferences,”SurvOphthalmol.2008;53Suppl1:S69-S84)。在眼组织中,已知曲伏前列素快速水解为游离酸。曲伏前列素游离酸对FP受体高度有效和具有选择性,且为在该种类之中最有效的之一。参见,同上,Sharif等人。对前列腺素类似物种类中不同的成员的母体和游离酸的功效进行相对比较,示于表1。表1:前列腺素类似物在克隆的人睫状体FP前列腺素受体上的激动剂活性化合物功能性效力,EC50曲伏前列素酸EC50=3.2±0.6nM比马前列素酸EC50=5.8±2.6nM拉坦前列素酸EC50=54.6±12.4nM曲伏前列素EC50=42.3±6.7nM比马前列素EC50=694±293nM拉坦前列素EC50=126±34.2nM药物组合物在一些实施方案,该药物组合物由生物可降解的聚合物基质和至少一种治疗剂组成。该生物可降解的聚合物基质包含满足所需特征的聚合物。例如,所需特征可包括具体的治疗剂释放速率或具体的作用持续时间。该生物可降解的聚合物基质可包含一种聚合物、两种聚合物或多种聚合物,如三种、四种、五种聚合物,或更多种聚合物。在一些实施方案中,该组合物可包含使用相同单体的聚合物,如包含多种聚(D,L-丙交酯)均聚物的组合物,或包含多种聚(D,L-丙交酯-共-乙交酯)共聚物的组合物。然而,即使该组合物的聚合物使用相同单体,该聚合物也可在其它特征方面不同,例如,固有粘度或D,L-丙交酯与乙交酯的摩尔比。在其它实施方案中,该组合物可包含使用不同单体的聚合物,如包含聚(D,L-丙交酯-共-乙交酯)共聚物和聚(D,L-丙交酯)均聚物的组合物。然而,即使该组合物的聚合物使用不同单体,该聚合物也可在其它特征方面类似,例如,固有粘度。在一个实施方案中,该药物组合物包含生物可降解的聚合物基质和均匀分散在整个聚合物基质中的至少一种治疗剂。例如,该聚合物基质包含聚合物的混合物,该混合物包含酯封端的生物可降解的聚(D,L-丙交酯-共-乙交酯)共聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为约0.16至约0.24dL/g,和酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为约0.25至约0.35dL/g。在该实施方案中,D,L-丙交酯与乙交酯的比例可为,例如,约73-77摩尔%的D,L-丙交酯和23-27摩尔%乙交酯。在该实施方案中,聚合物基质中聚(D,L-丙交酯-共-乙交酯)与聚(D,L-丙交酯)的比例可为约15:85至约30:70。而且,本文讨论的包含生物可降解的聚合物基质和至少一种治疗剂的药物组合物,在某些实施方案中,还可排除其它聚合物。即,在一些实施方案中,上述聚合物基质仅包含上述聚(D,L-丙交酯-共-乙交酯)共聚物和聚(D,L-丙交酯)均聚物且无其它聚合物。在第二实施方案,该药物组合物包含生物可降解的聚合物基质和均匀分散在整个聚合物基质中的至少一种治疗剂。例如,该聚合物基质包含聚合物的混合物,该混合物包含酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为约0.25至约0.35dL/g,和酯封端的生物可降解的聚(D,L-丙交酯)均聚物,其在25℃在0.1%w/vCHCl3中具有的固有粘度为约1.8至约2.2dL/g。聚合物基质中均聚物的比例可从约15:85变化至约35:65(较低的固有粘度至较高的固有粘度)。而且,本文讨论的包含生物可降解的聚合物基质和至少一种治疗剂的药物组合物,在某些实施方案中,还可排除其它聚合物。即,在一些实施方案中,上述聚合物基质仅包含上述两种聚(D,L-丙交酯)均聚物且无其它聚合物。在一个实施方案中,该药物组合物包含生物可降解的聚合物基质和均匀分散在整个聚合物基质中的至少一种治疗剂。例如,该聚合物基质包含R203S和R208S的混合物。聚合物基质中均聚物的比例可从约15:85变化至约35:65(较低固有粘度至较高固有粘度)。而且,本文讨论的包含生物可降解的聚合物基质和至少一种治疗剂的药物组合物,在某些实施方案中,还可排除其它聚合物。在一个实施方案中,该聚合物基质仅包含R203S和R208S。在一个实施方案中,该眼植入物包含:i)活性剂曲伏前列素(负载33%w/w);和ii)生物可降解的聚合物基质,其包括:R203S(22.11%w/w)和R208S(44.89%w/w)聚合物的聚(D,L-丙交酯)(PLA)共混物,其中所述眼植入物从尺寸为225μm×240μm×2,925μm的模具腔模制。在另一实施方案中,该眼植入物包含:i)活性剂曲伏前列素(负载34%w/w);和ii)生物可降解的聚合物基质,其包括:R203S(21.78%w/w)和R208S(44.22%w/w)聚合物的聚(D,L-丙交酯)(PLA)共混物,其中所述眼植入物从尺寸为150μm×180μm×1,500μm的模具腔模制。在多个方面,上述用于制造眼植入物的模具腔可偏离所述尺寸±50μm,或±40μm,或±30μm,或±20μm,或±10μm,或±5μm。在一些实施方案,该治疗剂与生物可降解的聚合物基质共混以形成药物组合物。该药物组合物使用的治疗剂的量取决于多种因素,如:生物可降解的聚合物基质选择、治疗剂选择、释放速率、所需的释放持续时间、药物组合物构造、和眼的PK,仅举几例。例如,总植入物的治疗剂含量可占总植入物药物组合物的约0.1重量%至约60.0重量%。在一些实施方案中,该治疗剂占药物组合物的约10.0重量%至约50.0重量%。在其它实施方案中,该治疗剂占药物组合物的约20.0重量%至约40.0重量%。在其它实施方案中,该治疗剂占药物组合物的约30.0重量%至约40.0重量%。在其它实施方案中,该治疗剂占药物组合物的约30.0重量%至约35.0重量%。在其它实施方案中,该治疗剂占药物组合物的约30.0重量%。或在其它实施方案中该治疗剂占药物组合物的约33.0重量%。在一些实施方案,该药物组合物通过将一种或多种聚合物和治疗剂溶解在合适的溶剂中以生成均匀均匀溶液而制备。例如,丙酮,醇,乙腈,四氢呋喃,氯仿和乙酸乙酯可用作溶剂。也考虑使用本领域已知的其它溶剂。该溶剂然后蒸发,留下均匀膜。该溶液可无菌过滤然后蒸发溶剂。眼植入物的制造多种方法可用于制备植入物。方法包括,但不限于,溶剂铸造、相分离、界面方法、模制、加压塑型、注射成型、挤出、共挤压、热挤出、模切、热压,及它们的组合。在某些实施方案中,该植入物是模制的,优选在聚合物模具中。在具体实施方案中,本发明的植入物通过Technology(LiquidiaTechnologies,Inc.)颗粒制造进行制造。特别是,该植入物通过将用来制备植入物的材料在模具腔中模制来制备。该模具可为基于聚合物的模具,且该模具腔可成形为任何所需形状和尺寸。独特地,由于植入物在模具腔中形成,该植入物在形状、尺寸和组成方面是高度均匀的。由于本发明药物组合物的各植入物在物理方面和组成方面的一致性,本发明的药物组合物提供高度均匀的释放速率和剂量范围。制备本发明的植入物的方法和材料进一步描述和公开于本申请人的授权专利和同时待审的专利申请,其每一篇以其整体在此引入作为参考:美国专利Nos.8,518,316;8,444,907;8,420,124;8,268,446;8,263,129;8,158,728;8,128,393;7,976,759;美国专利申请公开Nos.2013-0249138,2013-0241107,2013-0228950,2013-0202729,2013-0011618,2013-0256354,2012-0189728,2010-0003291,2009-0165320,2008-0131692;和2013年3月28日提交的待审的美国申请Nos.13/852,683,和2013年7月25日提交的13/950,447。该模具腔可成形为多种形状和尺寸。例如,该腔可成形为棱柱形、矩形棱柱、三棱柱、锥体、正方锥体、三角锥体、圆锥体、圆柱形、圆环、或杆。模中的腔可具有相同形状或不同形状。在本发明某些方面,植入物的形状为圆柱状、矩形棱柱或杆状。在一个具体实施方案中,该植入物为杆状。该模具腔的尺寸可为纳米至微米至毫米尺寸和更大。对本发明某些实施方案,模具腔的尺寸为微米至毫米范围。例如,腔可具有最小尺寸为约50纳米至约750μm。在一些方面,最小的模具腔尺寸可为约100μm至约300μm。在其它方面,最小的模具腔尺寸可为约125μm至约250μm。模具腔还可具有最大尺寸约750μm至约10,000μm。在其它方面,模具腔最大尺寸可为约1,000μm至约5000μm。在其它方面,模具腔最大尺寸可为约1,000μm至约3,500μm。在一个实施方案中,具有大体为杆状且尺寸为225μm×240μm×2,925μm(W×HxL)的模具腔用于制造本发明的植入物。在另一实施方案中,具有大体为杆状且尺寸为150μm×180μm×1,500μm(W×HxL)的模具腔用于制造本发明的植入物。在另一实施方案中,具有杆状且尺寸为180μm×160μm×3,000μm(W×HxL)的模具腔用于制造本发明的植入物。制造后,该植入物可保留在阵列上加以储存,或可立即收集以用于储存和/或使用。植入物可使用无菌方法制造,或可在制造后灭菌。因此,本发明涵盖包含储存阵列的试剂盒,该储存阵列在其上附着有经制造的植入物。这些储存阵列/植入物试剂盒提供方便的方法以大量运输和分配所制造的植入物。在其它实施方案中,该植入物可通过使用累积制造技术(additivemanufacturingtechnique)制造。累积制造,如公开于美国申请US2013/0295212等中的技术可用于制备PRINT方法中使用的主模板,用于制备本文另外公开的PRINT方法中使用的模具,或用于直接制造植入物。在一个具体实施方案中,该植入物通过以下方法制造:i)将聚合物和活性剂溶于溶剂,例如丙酮中;ii)将溶液浇在薄膜中;iii)干燥所述薄膜;iv)将该薄膜对折;v)在底物上加热经折叠的薄膜以形成底物;vi)将该底物上的薄膜置于具有模具腔的模具上;vii)向该模具-薄膜-底物组合施加压力,且在一些实施方案中,进行加热,使得薄膜进入所述模具腔;ix)冷却;x)从模具去除底物以提供植入物,该植入物基本上模拟了模具腔的尺寸和形状。递送装置在一些实施方案,递送装置可用于将植入物植入眼中以治疗眼部疾病。合适的装置可包括针或针状施加器。在一些实施方案中,植入物最小的尺寸可为约50μm至约750μm,因此可使用规格为约22号至约30号的针或针状施加器。该递送植入物可为具有合适尺寸的针的注射器或可为具有针状施加器的注射器-样植入物。在一个实施方案中,该装置使用内径为300+/-10微米的27号超薄壁针。如图24A所示,植入物2410负载在针2400中。图24A的植入物2410为150μmx150μmx1,500μm且在所有方向在植入物2410和针2400内径之间具有的间隙为50μm或更大。在另一实施方案中,如图24B所示,27号针2450包括尖端2480和装载在针2450的内部开口中的植入物2460。植入物2460为225μmx225μmx2,925μm且在植入物2460和针2450内径之间的间隙为30+/-10μm。重要的是,发现植入物内径间隙少于10微米引起植入物的损害,其可引起递送不同药物剂量至患者或其它不良事件。图25显示装载在针2500中且在植入物2510周边和针2500内径之间具有35+/-5微米间隙的另一植入物2510。图26显示装载在针2600中且在植入物2610周边和针2600内径之间具有40+/-2微米间隙的另一植入物2610。递送途径包括泪小管(punctual)、玻璃体内、结膜下、晶状体、巩膜内、穹窿、眼球筋膜囊下球部(anteriorsub-Tenon’s)、脉络膜上、眼球筋膜囊下后部(posteriorsub-Tenon’s)、视网膜下、前房、和后房,仅举几例。在一些实施方案,一个或多个植入物递送至患者眼的前房以治疗青光眼和/或眼内压升高。试剂盒在一些实施方案,该植入物和递送装置可组合且作为试剂盒形式使用。该植入物可与递送装置分开包装且在临使用之前装载在递送装置中。或者,该植入物可在包装之前装载在递送植入物中。在该情况下,一旦打开试剂盒,则该递送植入物随时可用。可将组件单独灭菌且组合在试剂盒中,或可在组合在试剂盒中之后灭菌。而且,如上所述,试剂盒可包含其中植入物连于其上的阵列。眼植入物在治疗中的用途在本发明一个方面,提供了治疗青光眼和/或升高的IOP的方法。该方法包括将生物可降解的植入物置于眼中,植入物降解,释放有效降低IOP的治疗剂,从而治疗青光眼和/或高眼压。在本发明多个方面,所述眼睛为动物眼睛。例如,狗,猫,马,牛(或任意农业牲畜),或人。治疗过程在治疗过程中,生物可降解的聚合物基质降解以释放治疗剂。一旦治疗剂被完全释放,预期该聚合物基质也消失。聚合物基质完全降解可比治疗剂完全释放花费更长的时间。聚合物基质降解可以与治疗剂释放以相同的速率发生。目前对青光眼和/或眼内压升高的治疗需要患者在其眼睛中每天滴液。本发明的药物组合物设计为持续释放有效量的治疗剂,从而避免每天滴液的需要。例如,该药物组合物可设计为释放有效量的治疗剂达约1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月,或更久。在多个方面,该药物组合物设计为释放有效量的治疗剂达1个月、2个月、3个月、4个月、5个月或6个月。在其它方面,该药物组合物设计为释放有效量的治疗剂达3个月、4个月、5个月或6个月。在一个实施方案中,该药物组合物以重复的方式给药。该给药方案提供第二剂的药物组合物植入物,其在第一剂释放其药物负载之后给予。该给药方案还规定第四剂的药物组合物植入物直到第一剂的植入物的聚合物基质充分降解之后才给予。在一个实施方案中,第一剂的植入物完全降解后给予第三剂。以下非限制性实例阐明本发明的某些方面。实施例实施例1:聚合物基质/治疗剂共混物的制备制备一系列聚合物基质/治疗剂共混物,然后制造植入物。使用丙酮将聚合物和治疗剂溶解以产生均匀混合物。所有共混物包含曲伏前列素作为治疗剂。将所得溶液无菌过滤。过滤后,蒸发丙酮得到均匀材料的薄膜。表2详述了多种共混物的组成。表2:聚合物基质/治疗剂混合比实施例2:模具的制造从LiquidiaTechnologies,Inc,NorthCarolina获得一系列不同尺寸的模具。使用的模具包括:a)尺寸为225μm×225μm×2,925μm的杆状模具,b)尺寸为150μm×150μm×1,500μm的杆状模具,和c)尺寸为180μm×160μm×3,000μm的杆状模具。实施例3:植入物制造使用实施例1的聚合物基质/治疗剂共混物和实施例2的模具制造一系列植入物。在无菌条件,将一部分聚合物基质/治疗剂共混物在PET片上铺展且加热约30至90秒直到液化。一旦加热,将共混物用具有所需尺寸的实施例2的模具覆盖。使用辊子施加轻压以将共混物在模具区域上铺展。然后使该模具/共混物层压物穿过可商购的热层压机,使用下表3的参数。该共混物流入模具腔且形成模具腔的形状。将该共混物冷却至室温且在模具腔中制造单独的植入物。然后去除模具以得到静置在膜上的二维植入物阵列。使用镊子将各个植入物从PET膜取出。表3:植入物制造条件工艺参数R203S/R208S基质RG752S/R203S基质热板温度,℃120-14040-50热板时间,秒30-9030-90层压机温度,°F320-360100-150层压机速度,ft/min0.1-1.00.1-1.0层压机压力,psi60-8060-80穿过次数5-81-3表4详述了使用实施例3的制造方法由实施例1的共混物和实施例2的模具制备的植入物。用于该共混物的相同ID也用于所得植入物。表4:植入物构造ID植入物尺寸515-47-11225μmX225μmX2,925μm515-55-8225μmX225μmX2,925μm515-60-3225μmX225μmX2,925μm515-60-4150μmX150μmX1,500μm515-60-5225μmX225μmX2,925μm0003-001-4B150μmX150μmX1,500μm0003-001-6A180μmX160μmX3,000μm0003-001-6B150μmX150μmX1,500μm0003-001-7A180μmX160μmX3,000μm0003-001-8A180μmX160μmX3,000μm0003-001-14A180μmX160μmX3,000μm0003-001-14B150μmX150μmX1,500μm实施例4:曲伏前列素含量的分析将各植入物置于2mLHPLC小瓶中且添加乙腈以达到近似浓度为200μg/mL曲伏前列素,基于所计算的曲伏前列素含量。溶液用等体积的水稀释,在50/50v/v乙腈/水中使曲伏前列素浓度降低至约100μg/mL。通过使用以下实施例5所述的HPLC检测曲伏前列素-异丙基酯测定曲伏前列素浓度。针对每种构造总共分析10个植入物。表5详述了测试结果。表5:植入物的曲伏前列素含量实施例5:测定曲伏前列素-异丙基酯的HPLC方法通过混合约900mL水、约100mL乙腈和约1mL三氟乙酸来制备流动相A。通过混合约900mL乙腈、约100mL水和约1mL三氟乙酸制备流动相B。通过稀释USP曲伏前列素标准品制备一系列标准品。标准品在70/30水/乙腈中以约0.5mg/mL提供,因此其使用30/70乙腈/水稀释以得到在50/50乙腈/水中的稀释物。标准品的合适范围为约0.1μg/mL至约100μg/mL。对于分析条件,该柱为WatersSymmetryC18,4.6X75mm,3.5μm,流速为1.5mL/分钟,波长为210nm,温度为30℃,注射体积为80μL,且运行时间为5分钟。梯度详述于表6。在2.95分钟时可进行瓶预取。表6:曲伏前列素分析的HPLC梯度时间(分钟)流动相A(%)流动相B(%)040602.240602.35952.75952.84060为测定植入物中的治疗剂含量,将从与标准曲线相关的响应测定的测量结果(μg/mL)与用于溶解植入物的体积(乙腈和水的总体积)相乘。实施例6:体外曲伏前列素释放研究测定实施例3的植入物的曲伏前列素的体外释放。在该研究中,将单独的植入物置于2mLHPLC瓶中且在37℃在含有0.1%w/wTritonX-100表面活性剂的0.75mL1XPBS(磷酸盐缓冲盐水)媒介中培养。在感兴趣的各时间点,取出媒介进行分析。然后将媒介用0.75mL新鲜媒介替换。通过实施例5的HPLC方法对取出的媒介进行分析,分析释放的曲伏前列素。图2A、2B和2C详述了使用PLGA/PLA聚合物基质的植入物的具体研究结果。图2D、2E和2F详述了使用PLA/PLA聚合物基质的植入物的具体研究结果。图2A显示释放的曲伏前列素的百分比(%),其为时间(天)的函数。图2B显示释放的曲伏前列素的量(μg),其为时间(天)的函数。图2C显示曲伏前列素的释放速率(ng/天),其为时间(天)的函数。该研究的进一步细节示于图2D、2E和2F。图2D显示释放的曲伏前列素百分比(%),其为时间(天)的函数。图2E显示随时间(天)释放的曲伏前列素的量(μg)。图2F显示曲伏前列素的释放速率(ng/天),其为时间(天)的函数。该数据证实对于研究的PLA/PLGA混合物,例如0003-001-14A和0003-001-14B,较小的植入物比较大的植入物更快地释放治疗剂,以百分比计。而且,该数据证实随着PLGA含量的增加,治疗剂的释放速率增加(参见,例如,0003-001-4B和0003-001-14B)。比较PLA/PLGA基质和PLA/PLA基质,对于相同的近似治疗剂负载和相同的植入物构造,PLA/PLGA基质更快地释放治疗剂(参见,例如,0003-001-6A和0003-001-14A)。该数据证实可调节治疗剂的释放速率。该研究的进一步的细节可获自图3A、3B和3C。图3A-3C显示来自之前图2A-2F的植入物的治疗剂剂量含量均匀性的图。FIG.3A中的数据证实使用本发明的植入物可实现高度一致的治疗剂含量(低变异性)。图3B和3C显示其它所选植入物的治疗剂含量均匀性的图。这些图证实本发明植入物在植入物尺寸和聚合物基质组成两方面的治疗剂含量高度一致性。而且,表7示出所选植入物在263天期间体外释放的曲伏前列素(μg)、释放的曲伏前列素%、和曲伏前列素释放速率(ng/天)。而且,表8示出所选植入物在263天期间体外曲伏前列素释放(μg)、释放的曲伏前列素%、和曲伏前列素释放速率(ng/天)。其它释放速率数据可从图4A-4C确认。FIG.4A示出在180天期间植入物515-55-8(2个植入物)和515-47-11(3个植入物)随时间的体外释放的曲伏前列素%。图4B示出在180天期间植入物515-55-8(2个植入物)和515-47-11(3个植入物)随时间的体外累积释放的曲伏前列素。图4C示出在180天期间植入物515-55-8(2个植入物)和515-47-11(3个植入物)随时间的体外曲伏前列素释放速率。显然,515-55-8植入物的R203S/RG752S聚合物基质实现的药物释放比515-47-11植入物的R208S/R203S快得多。表7:在263天期间体外释放的曲伏前列素表7续:在263天期间体外释放的曲伏前列素515-55-8T=0ug天28415670839640.2ug7.810.216.131.444.244.2%19.4%25.4%40.0%78.1%110.0%110.0%ng/天278.6248.8287.5448.6532.5460.4515-60-3T=0ug天28425470839830.4ug4.54.95.011.920.420.6%14.8%16.1%16.4%39.1%67.1%67.8%ng/天160.7116.792.6170.0245.8210.2515-60-4T=0ug天2842547083986.4ug1.72.02.24.65.55.5%26.6%31.3%34.4%71.9%85.9%85.9%ng/天60.747.640.765.766.356.1515-001-4BT=0ug天2741556983978.0ug1.71.92.12.53.13.1%21.3%23.8%26.3%31.3%38.8%38.8%ng/天63.046.338.236.237.332.00003-001-14AT=0ug天27415569839722.2ug3.43.94.36.016.421.2%15.3%17.6%19.4%27.0%73.9%95.5%ng/天125.995.178.287.0197.6218.60003-001-14BT=0ug天2741556983979.9ug1.92.12.43.98.38.5%19.2%21.2%24.2%39.4%83.8%85.9%ng/天70.451.243.656.5100.087.6表7续.:在263天研究期间体外释放的曲伏前列素515-60-3T=0ug天10912413715116517930.4ug20.620.620.620.620.620.6%67.8%67.8%67.8%67.8%67.8%67.8%ng/天189.0166.1150.4136.4124.8115.1515-60-4T=0ug天1091241371511651796.4ug5.55.55.55.55.55.5%85.9%85.9%85.9%85.9%85.9%85.9%ng/天50.544.440.136.433.330.7515-001-4BT=0ug天1111251391531671818.0ug3.23.43.53.64.210.3%40.0%42.5%43.8%45.0%52.5%128.8%ng/天28.827.225.223.525.156.90003-001-14AT=0ug天11112513915316718122.2ug21.421.421.421.421.421.4%96.4%96.4%96.4%96.4%96.4%96.4%ng/天192.8171.2154.0139.9128.1118.20003-001-14BT=0ug天1111251391531671819.9ug8.58.58.58.58.58.5%85.9%85.9%85.9%85.9%85.9%85.9%ng/天76.668.061.255.650.947.0表7续.:在263天研究期间体外释放的曲伏前列素表8:在263天期间体外释放的曲伏前列素515-47-11T=0ug天0137142143.3ug0.00.92.23.44.45.8%0.0%2.1%5.1%7.9%10.2%13.4%ng/天NA900.0733.3485.7314.3276.2515-60-5T=0ug天0137142040.4ug0.00.40.61.42.32.9%0.0%1.0%1.5%3.5%5.7%7.2%ng/天NA400.0200.0200.0164.3145.00003-001-6AT=0ug天0137142225.7ug0.00.50.60.60.91.3%0.0%1.9%2.3%2.3%3.5%5.1%ng/天NA500.0200.085.764.359.10003-001-6BT=0ug天0137142212.5ug0.00.20.30.40.50.6%0.0%1.6%2.4%3.2%4.0%4.8%ng/天NA200.0100.057.135.727.30003-001-7AT=0ug天0137142232.3ug0.00.81.01.42.84.6%0.0%2.5%3.1%4.3%8.7%14.2%ng/天NA800.0333.3200.0200.0209.10003-001-8AT=0ug天0137142224.6ug0.00.60.80.91.21.8%0.0%2.4%3.3%3.7%4.9%7.3%ng/天NA600.0266.7128.685.781.8表8续.:在263天期间体外释放的曲伏前列素表8续.:在263天期间体外释放的曲伏前列素表8续.:在263天期间体外释放的曲伏前列素实施例7:用于体内研究的植入物进行了一系列体内研究以确定对眼压的作用。表9详述了用于研究的植入物的ID,用于给予的植入物的数量,和被给药的眼睛的数量。之前实施例的表提供了所述植入物组成和尺寸的信息。表9:体内植入物实施例8:血压正常的比格犬中的体内研究进行了三个单独的非-GLP研究以评估多种药物组合物。在各研究中使用血压正常的纯种比格犬。使用22-号至27-号的合适尺寸的针将植入物植入前房。定期监测眼压。改变植入物数量且为1、2或3个植入物。实施例8A:体内研究PRE004图5描绘了在224天的过程中植入物515-47-11(3个植入物)和515-55-8(2个植入物)的IOP与时间的函数。该数据证实单独使用22-号至27-号针穿刺前房产生IOP降低作用,IOP在手术后第28天恢复至基线(图中安慰剂)。两种药物组合物都提供了IOP降低作用,从基线降低超过30%,保持约84天。515-47-11提供了约30%的IOP降低作用(在标准偏差以内),保持224天(超过7个月)。由于通过施加的针(applicationneedle)穿刺前房产生IOP降低作用,IOP在第28天恢复至基线,该IOP治疗作用计算为在第28天至第84天之间从基线的平均IOP变化,或在上述图5的情况下,在第28天至第224天从基线的变化。515-55-8(2个植入物)和515-47-11(3个植入物)在6个月期间观察到的治疗作用可见于下表10。表10:来自血压正常的比格犬模型的IOP治疗作用数据而且,如图6所示,单一前房内给予2个尺寸为225μm×225μm×2,925μm的植入物(包含剂量为80μg的曲伏前列素)产生稳健的IOP降低作用。图6中的数据证实曲伏前列素剂量为80μg的515-55-8使IOP降低了7.9±1.4mmHg,历经84天。而且,图7证实曲伏前列素剂量为130μg的515-47-11(3个植入物)产生IOP降低达8.8±1.3mmHg,历经84天。实施例8B:体内研究PRE006图8描绘了植入物515-60-5(1个植入物),515-60-5(3个植入物)和515-60-4(3个植入物)的IOP与时间的函数。两种包含20%w/w乳糖和80%w/wRG752S且尺寸为150μmX150μmX1,500μm和225μmX225μmX2,925μm的安慰剂植入物也被植入作为对照。如第一研究中所述,使用无治疗剂植入物的手术产生的短暂IOP降低在约28天内恢复至基线。在所收集的数据中,两种安慰剂的IOP都保持在基线(126-140天)。该数据证实所研究的所有三种构造在约84天内提供的IOP降低作用为从基线降低大于30%。约84天后,515-60-4和515-60-5(1个植入物)似乎都具有降低的功效,其中短暂偏移至基线。在所有收集的168天数据(超过5个月)中,515-60-5(3个植入物)似乎保持IOP降低作用,自基线降低约30%。515-60-4(3个植入物);515-60-5(1个植入物);和515-60-5(3个植入物),以及另外测试的植入物515-60-3(1和3个植入物),历经5个月期间所观察到的治疗作用可见于下表11。表11:血压正常的比格犬模型的IOP治疗作用数据而且,图9证实:总曲伏前列素剂量为19μg的515-60-4(3个植入物)使IOP降低了6.4±1.0mmHg;而曲伏前列素剂量为30μg的515-60-3(1个植入物)使IOP降低了7.6±1.1mmHg;且总曲伏前列素剂量为91μg的515-60-3(3个植入物)使IOP降低了8.9±0.6mmHg,历经84天。而且,图10A证实:曲伏前列素剂量为40μg的515-60-5(1个植入物)使IOP降低了6.8±1.6mmHg,而总曲伏前列素剂量为121μg的515-60-5(3个植入物)使IOP降低了7.8±1.2mmHg,历经84天。图10B证实,在单剂量给予后的8个月中,每眼给予一个或三个植入物的动物显示从基线的平均IOP降低分别为26.0%和34.5%。安慰剂给药导致与注射过程相关的IOP短暂降低,然后在第28天IOP恢复至基线。实施例8C:体内研究PRE009在该研究中评价了多种药物组合物。一种包含7%w/w乳糖和93%w/w聚合物基质(70%R203S/30%RG752S)且尺寸为180μmX160μmX3,000μm的安慰剂植入物也被植入作为对照。图11A描绘植入物0003-001-6A(3个植入物)、0003-001-6B(3个植入物)和0003-001-8A(3个植入物)的IOP与时间的函数。该数据证实使用包含与单一植入物相同的总治疗剂含量的多个植入物,可提供同等的IOP降低作用,如之前实施例所示。图11B描绘植入物0003-001-6A(1个植入物)、0003-001-6B(1个植入物)、0003-001-7A(1个植入物)和0003-001-8A(1个植入物)的IOP与时间的函数。该数据证实,对于给定形状和近似治疗剂含量,增加PLGA/PLA共混物中的PLA含量能增强IOP降低作用(比较0003-001-8A与0003-001-7A与0003-001-6A)。然而,对于给定的PLGA/PLA共混物,较小的形状以及较低的治疗剂含量在降低IOP方面可能同样有效或更有效(比较0003-001-6A与0003-001-6B)。在2.5个月期间,从图11A和11B的植入物、以及另外测试的植入物观察到的治疗作用可见于下表12。表12:血压正常的比格犬模型的IOP治疗作用数据图11C描绘植入物0003-001-4B(1个植入物)、0003-001-4B(3个植入物)、0003-001-14A(1个植入物)和0003-001-14B(3个植入物)的IOP与时间的函数。该数据证实使用1个植入物或3个植入物递送给定量的治疗剂,至少在约98天内为同等有效的(比较0003-001-14A和0003-001-14B)。在2.5个月期间,从图11C的植入物、以及另外测试的植入物观察到的治疗作用可见于下表13。表13:血压正常的比格犬模型的IOP治疗作用数据图11D描绘植入物0003-001-6B(1个植入物)和0003-001-6B(3个植入物)的IOP与时间的函数。在单次给予后的7个月中,每眼给予一个或三个植入物的动物显示IOP从基线平均降低分别为19.8%和27.8%。实施例9:血压正常的比格犬中的瞳孔缩小曲伏前列素对瞳孔的药理作用(导致瞳孔缩小)之前已有描述且本发明的制剂也观察到该作用,如图12A-12D所示。本发明曲伏前列素前房内植入物的安全性使用血压正常的犬类模型在非-GLP评估中进行评估。该比格犬是评估前房内植入物的安全性的可接受的模型,这是由于眼的尺寸、前房和角的解剖学和生理学,以及对该类药物的药理学类似响应(DorairajS,LiebmannJM,RitchR.“Quantitativeevaluationofanteriorsegmentparametersintheeraofimaging,”TransAmOphthalmolSoc.2007;105:99-108;discussion108-10;和TsaiS,AlmazanA,LeeSS,LiH,ConfortiP,BurkeJ,MillerPE,RobinsonMR.“Theeffectoftopicallatanoprostonanteriorsegmentanatomicrelationshipsinnormaldogs,”VetOphthalmol.2013;16(5):370-376)。各动物的双眼都使用手提裂隙灯和间接检眼镜根据改良的显微镜眼部分级系统进行检测(HackettRB,McDonaldTO.“OphthalmicToxicologyandAssessingOcularIrritation,”Dermatoxicology,5thEdition.Ed.F.N.MarzulliandH.I.Maibach.Washington,DC:HemispherePublishingCorporation.1996,299-305and557-566;andDraizeJH.“Appraisalofthesafetyofchemicalsinfoods,drugs,andcosmetics,”AssociationofFoodandDrugOfficialsoftheUnitedStates,Austin,TX,1959:46-59;以及McDonaldTO,ShadduckJA.“Eyeirritationindermatoxicology,”MarzulliFN,HemispherePublishingcorp.NewYork,NY,1977:579-582)。复合眼睛耐受性评分(compositeoculartolerabilityscore)使用McDonald-Shadduck评分系统评估。眼睛耐受性用于提供眼睛安全性的初始评估且耐受性为所有领域的所有评分的总和。“完美分数”等于0,然而,不等于0的分数不意味着临床不可接受的药物组合物。多种制剂的安全性和耐受性在血压正常的比格犬中根据如上解释的眼睛安全性指数进行评估。前房内曲伏前列素植入物制剂通过单次植入一个至三个植入物至前房而给予(研究PRE004、PRE006和PRE009),且剂量和释放速率如上针对PRE004、PRE006和PRE009研究。安慰剂植入物制剂用作对照且22至27-号针用于前房内给予植入物。已显示曲伏前列素和其它PGA引发狗的物种-特异性虹膜缩小,其在人受试者中不存在。在本发明的植入物中也显示该现象(参见图12A(PRE004研究)、12B(PRE006研究)、12C&12D(PRE009研究))。狗特异性的瞳孔缩小最终导致降低的瞳孔光反射,其在改良的显微镜眼睛分级系统中被分级为异常。出于该原因,安全性数据被提供作为复合指数,而没有瞳孔光反射评分,排除了最终减少瞳孔光反射的狗特异性的瞳孔缩小(图13)。在血压正常的比格犬中进行PRE006研究,曲伏前列素剂量范围为19至121μg曲伏前列素,且配制为RG752S/R203S和R203S/R208S植入物制剂。该植入物证实总体良好的眼睛安全性和耐受性,其中在第1天和第3天在植入物通过穿刺植入至前房紧接之后的安慰剂和曲伏前列素植入物的峰值眼睛刺激评分相等(图13,研究PRE006)。曲伏前列素植入物的复合眼睛安全性和耐受性评分保持较低,且在研究期间通常等于或相当于安慰剂植入物评分。PRE004研究的安全性数据导致类似的安全性和耐受性(数据未显示)。PRE009研究的数据也未显示,但证实了与PRE006类似的耐受性评分。最常见的发现为结膜充血、结膜红肿和由于瞳孔缩小削弱的瞳孔光反射。在曲伏前列素剂量和安慰剂植入物之间在结膜充血和红肿方面是相当的。减少的瞳孔光反射对于曲伏前列素植入物是显著的。如上所述,后一作用直接是由于犬类眼睛中曲伏前列素预期的药理学。基于曲伏前列素和其它前列腺素类似物的之前的研究,这些发现认为是暂时药理学响应,而非毒性事件。总之,被植入比格犬前房的曲伏前列素前房内植入物在三个月内看上去是良好耐受的。植入物植入之后紧跟着就观察到眼睛安全性评分暂时增高,这可能只是由穿刺手术本身引起的。实施例11:多种植入物制剂除了在多个实验中使用的上述植入物制剂,还衍生出许多其它制剂并进行了分析,如表17所述。表14:多种植入物制剂实施例12:体内释放性质进行了体内研究PRE008以直接测量本申请的植入物的曲伏前列素释放性质。将植入物经前房内给予新西兰白兔(NZW)且在不同间隔取出以分析回收的植入物中包含的残余曲伏前列素。释放的曲伏前列素的量计算为植入物中包含的曲伏前列素的初始量减去回收的植入物中包含的曲伏前列素的量。表15示出对于所选植入物在实验中第28天和第56天体内回收的曲伏前列素。图14显示随时间回收的曲伏前列素(μg)。图15显示随时间回收的曲伏前列素%。图16显示随时间释放的曲伏前列素%。图17显示随时间的释放速率。表15:体内回收的曲伏前列素实施例15:体内和体外给药后药代动力学相关性对上述体内和体外实验的数据进行统计分析以确定植入物药代动力学行为之间的相关性。图18示出给予1个月后曲伏前列素的体内释放速率vs.房水浓度。该图描绘了在x-轴的体内释放速率(ng/天)和在y-轴的房水中的曲伏前列素游离酸浓度(pg/mL)。图19示出给予2个月后曲伏前列素的体内释放速率vs.房水浓度。该图描绘了在x-轴的体内释放速率(ng/天)和在y-轴的房水中的曲伏前列素游离酸浓度(pg/mL)。图20示出曲伏前列素的体内释放速率vs.房水浓度,其组合给予1个月和2个月后的数据。该图描绘了在x-轴的体内释放速率(ng/天)和在y-轴的房水中的曲伏前列素游离酸浓度(pg/mL)。图21示出给予1个月后IOPvs.曲伏前列素房水浓度。该图描绘了在x-轴的房水中的曲伏前列素游离酸浓度(pg/mL)和在y-轴的IOP治疗作用(mmHg)。图22示出给予2个月后IOPvs.曲伏前列素房水浓度。该图描绘了在x-轴的房水中的曲伏前列素游离酸浓度(pg/mL)和在y-轴的IOP治疗作用(mmHg)。图23示出IOPvs.曲伏前列素房水浓度,其组合给予1个月和2个月后的数据。该图描绘了在x-轴的房水中的曲伏前列素游离酸浓度(pg/mL)和在y-轴的IOP治疗作用(mmHg)。实施例15:体内研究的房水药代动力学数据收集并分析了体内比格犬实验PRE006B的房水数据。表16示出在第14、28和60天获得的房水(酯+酸)数据结果。表16:比格犬房水PK结果,曲伏前列素酯+酸实施例16:前房内给予植入物上述实验使用23-号至27-号的合适尺寸的针。图24A为电子显微镜图,示出了在27号薄壁针中的150μm×150μm×1,500μm植入物。图24B为电子显微镜图,示出了在27号超薄壁针中的225μm×225μm×2,925μm植入物。观察到225μm×225μm×2,925μm植入物紧密配合在27号超薄壁(UTW)针中。同样,150μm×150μm×1,500μm植入物配合在27号薄壁(TW)针且松散配合在27号UTW针中。而且,150μm×150μm×1,500μm植入物不配合在30号UTW针中。因此,在某些实施方案中,临界尺寸少于~200μm的植入物设计可配合(fit)在常规制造的28号或29号UTW针中。在一些实施方案中,临界尺寸大于~200μm的植入物设计不可能配合在常规制造的28号或29号UTW针中。本文描述了实施例实施方案。如其它地方所述,所描述的这些实施例仅用于说明目的,而不是限制性的。其它实施方案也是可能的,并为本发明所覆盖,从本文所包含的教导中将容易得出这些其它实施方案。因此,本发明的宽度和范围不应被上述任何实施方案限制,而是应仅根据由本公开内容及其等同形式支持的权利要求而限定。此外,本发明主题的实施方案可包括制剂、化合物、方法、系统和装置,其还可包括来自任何其它所公开的制剂、化合物、方法、系统和装置的任何和所有元件/特征,包括其制备和用途。换言之,来自一个和/或另一个公开实施方案的特征能与来自其它所公开实施方案的特征互换,这又对应于其它实施方案。另外,所公开实施方案的一个或多个特征/元件可省去,仍能产生具有专利性的主题(且因此,导致本发明的另一实施方案)。而且,本发明一些实施方案与现有技术的区别可为具体缺少现有技术中包含的一个和/或另一个特征、功能、成分或结构(即,涉及这些实施方案的权利要求可包括“排除限定”或“排除条件”)。引入的参考本文引用的所有文献、文章、出版物、专利、专利公开和专利申请出于所有目的以其整体在此引入作为参考。然而,任何对任何文献、文章、出版物、专利、专利公开和专利申请的引用不是,也不应被视为,承认或任何形式的暗示其在全球任何国家构成有效的现有技术或形成公知常识的一部分。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1