药物组合物及其制法的制作方法
本发明关于一种药物组合物及其制法,尤其关于一种以两亲性壳聚糖包覆疏水性药物及亲水性药物的药物组合物及其制法。
背景技术:
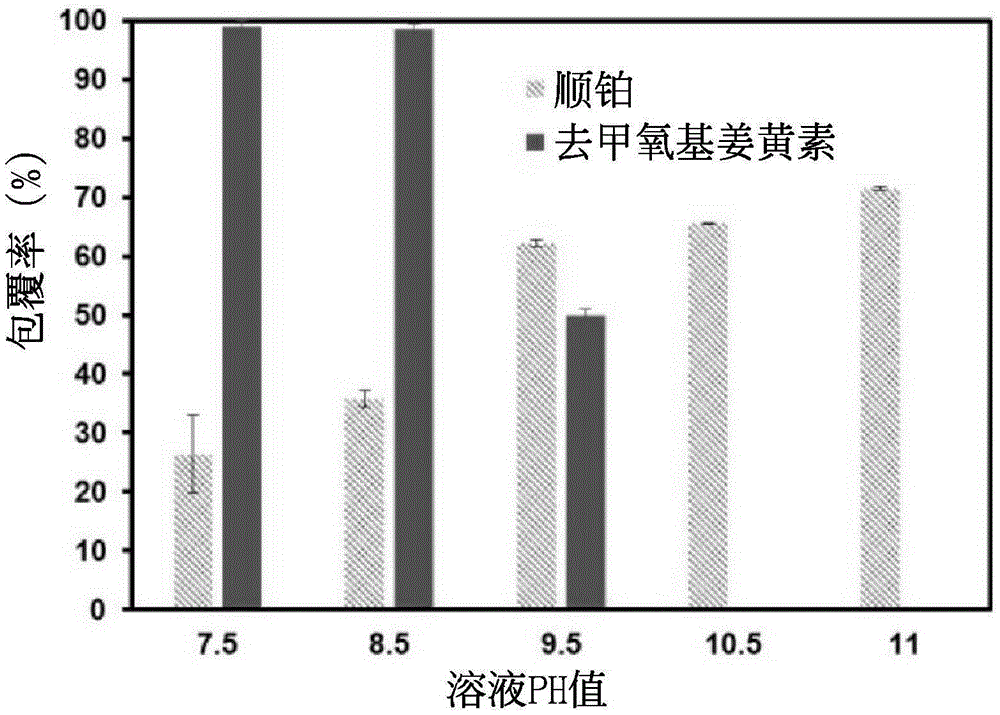
:甲壳素(chitin)在自然界中分布很广,除了存在于甲壳类动物(如虾、蟹、昆虫的外壳)之外,还包括了微生物界(细菌的细胞壁或菇类)及植物界的藻类等。壳聚糖(chitosan)[聚(β-1,4-葡萄糖胺)][poly(β-1,4-glucosamine)]又称脱乙酰壳多糖,是由甲壳素经由不同程度的脱乙酰基反应而得的非均一性聚合体。壳聚糖为N-乙酰葡萄糖胺与N-葡萄糖胺为结构单元的共聚合体,而N-葡萄糖胺结构单元在聚合体中的含量通常高于60%以上。由于壳聚糖良好的生物相容性(biocompatibility)、无毒性、可生物体内分解(溶菌酶)、价格便宜以及生产原料不虞匮乏等优点,使得壳聚糖成为近年来高分子生医材料中颇受重视的材料。在已知药物载体包覆技术中,皆以多壳层的方式包覆两种以上的抗癌药物(例如,亲水性药物及疏水性药物)以形成纳米粒子,或在此纳米粒子上连结具专一性辨识的抗体/蛋白质/胜肽/多糖类,或加入可以显影的物质,使该纳米粒子在癌症治疗上具有多功能。然而,以多壳层的方式包覆两种药物容易产生药物渗漏、包覆率不佳、制程繁复等问题。另外,如欲以高分子自组装方式包覆药物,则难以同时包覆亲水性与疏水性的药物。因此,如何解决已知的纳米粒子包覆多种药物需要多个步骤及多种环境的制程问题,提供一个于单一步骤同时包覆亲水性与疏水性药物,以制备载药粒子,实为一重要课题。技术实现要素:本发明提供一种药物组合物的制法,包括:将两亲性壳聚糖衍生物、至少一种疏水性药物、至少一种亲水性药物分散于溶剂中,以形成混合溶液,其中,该两亲性壳聚糖衍生物经复数亲水基和复数疏水基改性,且将该混合溶液的pH调配为该亲水性药物及该疏水性药物不沉淀的范围;以及搅拌该混合溶液至少12小时后,待该混合溶液的pH介于6至7时,收取该药物组合物。本发明进一步提供一种药物组合物,包括:两亲性壳聚糖衍生物,经复数亲水基和复数疏水基改性;至少一种亲水性药物,包埋于该两亲性壳聚糖衍生物中,且该至少一种亲水性药物通过静电力吸引该复数亲水基;以及至少一种疏水性药物,包埋于该两亲性壳聚糖衍生物中,且集中于该复数疏水基之间。由上可知,本发明使用具有高度生物相容性的两亲性壳聚糖高分子作为基底,通过调整该两亲性壳聚糖高分子自组装的溶液环境,达到同时包覆一种或多种相同/不同亲疏水性的药物的目的,并且透过交联剂将抗体等具有专一性辨识的标靶物质修饰在该药物粒子的表面,或可以在包覆药物的同时,包覆具有显影效果的化合物,使该纳米粒子成为有辨识,显影及治疗等多功能的医疗平台,有效毒杀癌症细胞。附图说明图1显示在不同pH(pH7.5、pH8.5、pH9.5、pH10.5及pH11)溶液下的包覆双药的纳米粒子的顺铂(CDDP)及去氧甲基姜黄素(DMC)包覆率;图2显示在不同pH(pH8、pH8.5及pH9)溶液下的包覆双药的纳米粒子的顺铂及去氧甲基姜黄素包覆率;图3显示包覆双药的纳米粒子的透射电子显微镜图;图4显示以自由态DMC-CDDP组合、CHC/DMC-CDDP纳米粒子以及CHC/DMC-CDDP/抗-CD133纳米粒子三种不同药物/载体组合对细胞存活率的影响;以及图5显示以CHC/DMC-CDDP纳米粒子以及CHC/DMC-CDDP/抗-CD133纳米粒子对细胞存活率的影响,其中,X轴显示纳米粒子中的DMC及CDDP含量。具体实施方式以下通过特定的具体实施例说明本发明的实施方式,该领域技术人员可由本说明书所揭示的内容轻易地了解本发明的优点及功效。本发明亦可通过其它不同的实施方式加以施行或应用,本说明书中的各项细节亦可基于不同观点与应用,在不悖离本发明所揭示的精神下赋予不同的修饰与变更。于本说明书中,术语“一锅合成法(one-potsynthesis)”意指在一个自组装反应中,使反应物(例如:两亲性壳聚糖)包覆亲水性与疏水性药物,以提高反应效率,此法可以避免冗长的分离和纯化后处理过程,从而节省时间与资源并且提高收率。本发明提供一种药物组合物的制法,包括:将两亲性壳聚糖衍生物、至少一种疏水性药物、至少一种亲水性药物分散于例如水的溶剂中,以形成混合溶液,其中,该两亲性壳聚糖衍生物经复数亲水基和复数疏水基改性,且将该混合溶液的pH调配为该亲水性药物及该疏水性药物不沉淀的范围;以及搅拌该混合溶液12小时后,且待该混合溶液的pH介于6至7时,收取该药物组合物。根据本发明的一具体实施例,搅拌该混合溶液12至24小时。根据本发明的一具体实施例,本发明制法中,两亲性壳聚糖衍生物的重量百分比范围为0.01wt%至2wt%,所使用的疏水性药物的浓度范围为大于0至3mM,所使用的亲水性药物的浓度范围为大于0至3mM。壳聚糖的羟基(-OH)及胺基(-NH2)官能团是一个相当容易进行修饰的区块。通常,以壳聚糖为骨架(backbone),将其羟基端修饰成具有亲水性,将其胺基端修饰成具有疏水性。由于修饰改性的技术已知,故不再赘述其改性方法。于前述制法的一实施例中,将该混合溶液的pH调配为该亲水性药物及疏水性药物不沉淀的范围。通常,令该混合溶液微碱性,具体而言,通过添加碱性水溶液,亦即添加pH在8以上的碱性水溶液,例如,pH在8.5至12.5,其中,以pH在9至10的范围为优选,以将该混合溶液的pH调配为该亲水性药物及该疏水性药物不沉淀的范围。于前述制法的一实施例中,先将疏水性药物加入两亲性壳聚糖衍生物的水溶液,再加入碱性水溶液,最后加入亲水性药物,以将该混合溶液的pH调配该亲水性药物及该疏水性药物不沉淀的范围,其中,该碱性水溶液pH在8.5至12.5的范围,以pH在9.0至10.0的范围为优选。调配该混合溶液在碱性下,或添加碱可使该两亲性壳聚糖衍生物结构上的亲水基上的H+游离出,而该两亲性壳聚糖衍生物结构上的亲水基,例如,COO-会因静电力吸引而连结带正电荷的药物,例如亲水性药物顺铂,同时,因该静电力吸引亲水性药物,相对地,则由该两亲性壳聚糖衍生物结构上的疏水基,例如,己酰基团包覆如去甲氧基姜黄素的疏水性药物;最后,根据此自组装反应形成复数粒子形式的药物组合物。在包覆药物完成后,整体溶液的pH值为6至7,优选为pH6.7,所制备的药物载体粒子为中性,不须额外进行中和反应或纯化步骤即可使用。根据本发明的一具体实施例,该药物组合物为复数粒子。此外,本发明的制法还可包括使用交联剂将标靶物质连接于该复数粒子表面。在非限制性实例中,该标靶物质可选自抗体、胜肽及蛋白质所组成组的至少一者。于一具体实施例中,该交联剂可选自下列所组成群组的至少一种化合物:1-乙基-(3-二甲基胺基丙基)碳二酰亚胺(EDC)及羟基琥珀酰亚胺。根据本发明制法的一具体实施例,还包括使显影化合物分散于该溶液中,而该显影化合物是荧光化合物或有机金属显影剂。根据本发明的一具体实施例,该两亲性壳聚糖衍生物具有下式(I)结构的复数重复单元:其中,R1各自独立为氢、C1至C4烷基或C1至C6羧基,R2各自独立为氢、C1至C12烷基、C1至C6羧基或C2至C12酰基,且m为介于 100至2000间的整数。其中,具有R1选自C1至C4烷基及C1至C6羧基的重复单元数量为20至2000;具有R2选自C1至C12烷基、C1至C6羧基或C2至C12酰基的重复单元数量为20至2000。根据本发明的一具体实施例,本发明所使用的壳聚糖衍生物如下式(II)所示:其中,R3各自独立为C5~C11烷基,且x、y、z、n、及p各自独立为介于20至2000的整数。根据本发明的一具体实施例,本发明所使用的疏水性药物选自,但不限于,下列所组成组的至少一者:紫杉醇(Taxol)、喜树碱(Camptothecin)、去甲氧基姜黄素(Demethoxycurcumin,DMC)、托泊替康(Topotecan)、环胞素A(CyclosporineA)、表柔比星(Epirubicin)及雷帕霉素(Rapamycin)。根据本发明的一具体实施例,本发明所使用的亲水性药物选自,但不限于,下列所组成组的至少一者:顺铂(Cisplatin,CDDP)、阿霉素(Doxorubicin)、奥沙利铂(Oxaliplatin)、卡铂(Carboplatin)、奈达铂(Nedaplatin)及赛特铂(Satrapiatin)。本发明还提供一种药物组合物,包括:两亲性壳聚糖衍生物,经复数亲水基和复数疏水基改性;至少一种亲水性药物,包埋于该两亲性壳聚糖衍生物中,且该至少一种亲水性药物通过静电力吸引该复数亲水基;以及至少一种疏水性药物,包埋于该两亲性壳聚糖衍生物中,且集中于该复数疏水基之间。根据本发明的一具体实施例,该药物组合物为复数粒子。根据本发明的另一具体实施例,该复数粒子的粒径大小为50nm至300nm范 围内。根据本发明的一具体实施例,本发明的药物组合物用于抑制癌细胞生长,其中,用于抑制非小细胞肺癌细胞、卵巢癌细胞、睪丸癌细胞、膀胱癌细胞、子宫颈癌细胞及肺癌细胞所组成组的至少一种癌细胞生长。根据本发明的一具体实施例,本发明的药物组合物可使用冷冻干燥、减压浓缩、真空干燥的方式去除溶剂及水分。本发明将以下述实施例来作进一步说明,但应了解到该等实施例仅用于例示说明,而不应被解释为限制本发明的实施。实施例实施例1:制备疏水性己酰基修饰及亲水性羧甲酸修饰的两亲性壳聚糖衍生物首先,于室温下将5克(g)壳聚糖(Mw=215,000g/mol,去乙酰度为80至90%,购自Adrich-Sigma)悬浮于异丙醇(50毫升(mL))中,并搅拌30分钟。将所得的悬浮液缓慢地与氢氧化钠水溶液(12.5mL)混合得一混合溶液,且通过调整混合溶液中氢氧化钠浓度可控制亲水性官能团的嫁接量。在此,混合溶液中含有13.3M的氢氧化钠。接着,将此混合溶液与氯乙酸(chloroaceticacid)反应,以制得水溶性的亲水性羧甲酸修饰的壳聚糖(carboxymethyl-modifiedchitosan),并干燥。取2g干燥的亲水性羧甲酸修饰的壳聚糖溶解于纯水(50mL)中,并搅拌24小时。接着,将所得溶液与甲醇(50mL)混合,再添加0.2M的己酸酐得一反应溶液。于室温下反应20小时后,收集反应溶液并以乙醇水溶液(25%v/v)透析24小时,干燥后收集产物可得到疏水性己酰基修饰及亲水性羧甲酸修饰的两亲性壳聚糖衍生物,其结构如下式(II)所示。同时,利用1HNMR光谱及N含量的元素分析,以确认壳聚糖衍生物中取代基的位置及己酰基嫁接量。于本实施例中,己酰基嫁接量为13%。实施例2利用两亲性壳聚糖衍生物包覆药物称取0.5毫克(mg)的实施例1所制备的两亲性壳聚糖粉末,加入200微升(μL)0.1%的去氧甲基姜黄素(溶于甲醇),利用震荡器稍做混合后,加入540μL的二次蒸馏水,再加入60μL的pH10.5的二次蒸馏水,最后加入200μL的0.1%的顺铂(cisplatin)(溶于水),搅拌12个小时以制备包覆双药(包含去氧甲基姜黄素以及顺铂)的纳米粒子。实施例3包覆双药的纳米粒子的包覆率测试将合成好的包覆双药的纳米粒子放入浓缩离心管中,以转速4000rpm离心30分钟。(1).顺铂包覆率将浓缩离心管下层清液稀释20倍,与0.14%邻苯二胺的二甲基甲酰胺溶液以1:1的比例混合,以100℃加热30分钟后,放入-20℃冰箱内10分钟进行冷却,最后将溶液以UV-可见光检测波长705nm处的峰值,换算后得知未包覆的顺铂含量,进而得知顺铂包覆率。(2).去氧甲基姜黄素包覆率测试将浓缩离心管滤膜上的纳米粒子以二次蒸馏水回溶,将此溶液和甲醇以1:1的比例混合,利用HPLC进行分析。在流速1mL/min下利用C18做为固定相,乙腈和0.3%FA(50:50,v/v)做为流动相,在波长为425nm的条件下进行检测,并且换算去氧甲基姜黄素的浓度来得知包药率。如图1所示,其结果显示当混合有两亲性壳聚糖衍生物、亲水性 药物及该疏水性药物的水溶液的pH值越高,增加顺铂的包覆率,但去氧甲基姜黄素的包覆率则随pH值越高,包覆率则降低。由于去氧甲基姜黄素在碱性环境下容易失去药物活性而沉淀,因此,将水溶液的pH值调配在pH8.0至9.0之间为佳。如图2所示,其结果显示当水溶液的pH值在9.0时有最佳的双药包覆率,并且测量在包覆完成后整个溶液的pH值为6.7。实施例4将抗体连结于包覆双药的纳米粒子将适量抗体(抗-CD133)与0.01%50μL交联剂(EDC)加入上述包覆双药的纳米粒子溶液中,搅拌五小时,将抗体连结至上述包覆双药的纳米粒子表面上,所制备完成的包覆双药的纳米粒子的直径为190nm。如下表1所示为两亲性壳聚糖纳米粒子(以下简称CHC)、包覆双药的纳米粒子(以下简称CHC/DMC-CDDP)以及连接抗体的包覆双药的纳米粒子(以下简称CHC/DMC-CDDP-抗体)的直径大小以及表面电位(zetapotential)。如图3所示,进一步以透射电子显微镜观察连接抗体的包覆双药的纳米粒子。表1本发明的各种纳米粒子的直径及表面电位样品名称直径(nm)表面电位(mV)CHC55±2.3-22.5±0.91CHC/DMC-CDDP140±7.3-13.0±3.5CHC/DMC-CDDP-抗体190±6.1-5.1±0.6实施例5以本发明的CHC/DMC-CDDP以及CHC/DMC-CDDP-抗体的纳米粒子毒杀癌细胞的细胞存活率试验于24孔盘上培养肺癌干细胞(A549-ON),每孔有1×105个细胞,并将配置好不同剂量的自由态DMC-CDDP组合(freedrug)(图4中由左至右的剂量为:3.25-75g/mL、7.5-150g/mL、7.5-300g/mL、15-300g/mL及20-600g/mL)、CHC/DMC-CDDP纳米粒子(图4中由左至右的剂量为:1.25-95g/mL、3-125g/mL、5-200g/mL、6-250g/mL及9-265g/mL)及CHC/DMC-CDDP/抗-CD133纳米粒子(图4中由左至右的剂量为: 1.25-95g/mL、3-125g/mL、5-200g/mL、6-250g/mL及9-265g/mL)给予肺癌干细胞并培养24小时后,以3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四氮唑(3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide),以下简称MTT)分析细胞存活率。图4为三种不同药物/载体组合对细胞存活率的影响,如图4所示,Y轴为组合指数(combinationindex,以下简称CI),当该CI值小于1时,代表有协同效应;Fa代表细胞死亡率,当数值越接近1时代表细胞死亡率越高,可以达到更好的毒杀癌细胞效果。由图4可知,没有经过CHC包覆的药物(即自由态DMC-CDDP组合)并没有协同效应,无法同时使用双药来提升毒杀癌细胞的效果;再经由CHC包覆的双药,明显在部分剂量(CHC/DMC-CDDP:6-250g/mL及9-265g/mL;CHC/DMC-CDDP/抗-CD133:5-200g/mL、6-250g/mL及9-265g/mL)上有双药协同效应出现,并且提供好的毒杀癌细胞效果。图5为以CHC/DMC-CDDP纳米粒子以及CHC/DMC-CDDP/抗-CD133纳米粒子对细胞存活率的影响,即,以CHC包覆双药有接上/未接上抗体纳米粒子毒杀肺癌干细胞的效果;由图5可知,CHC/DMC-CDDP/抗-CD133纳米粒子(嫁接上抗体)可以有效地降低肺癌干细胞存活率。上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何该领域技术人员均可在不违背本发明的精神及范畴下,对上述实施例进行修饰与改变。因此,举凡该领域技术人员在未脱离本发明所揭示的精神与技术原理下所完成的一切等效修饰或改变,仍应由权利要求书所涵盖。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1