眼科外科手术中活体染料可视化及相关设备、系统和方法与流程
本文公开的实施例涉及眼科手术成像。更具体地,本文所述的实施例涉及在外科手术过程中利用对活体染料的受控激发以及所发射的荧光的收集进行荧光成像。
背景技术:
眼科外科手术可以涉及对眼睛中的极薄且透明的组织(包括晶状体、角膜和视网膜以及其他组织)进行操作。例如,作为重要手术目标的视网膜、晶状体囊和内界膜(ilm)分别为200微米、100微米和3微米厚。外科医生必须能够容易地识别薄的、透明的组织,以便在外科手术中使用器械安全地抓住组织。例如,剥离ilm是黄斑手术中的常见手术方法。由于器械与黄斑极为贴近并且由此需要外科医生的灵巧性,它也是最难完成的手术操作之一。
可以将活体染料应用于眼睛以帮助观察一个或多个手术目标。例如,用吲哚菁绿(icg)染色的ilm可以比不是染色的ilm更容易可视化。当选择染料施用于眼睛时,可以考虑若干因素,包括对视网膜的毒性、染色组织的可见性、施用时对组织的亲和力、化学特性(例如稳定性、浓度、ph等)及其他因素。例如icg,虽然对ilm染色有效,但已经显示是有毒的。其他毒性较小的染料可能与低可见性和/或低亲和力相关,因此当考虑使用时不予考虑。这可能导致患者的健康风险增加。
在没有容易地使手术目标可视化的能力的情况下,可能会存在患者的其他健康风险。例如,全视网膜光凝术(prp)可以用于对外周视网膜中表达促使新血管形成的因子(如血管内皮生长因子(vegf))的位点进行治疗。通常,不能直接使表达位点可视化。因此,外科医生必须做出数千个视网膜灼斑,以便实现足够的覆盖以破坏表达部位。大面积的灼斑可能损伤周边视觉,并且可能不能有效治疗疾病。当使用太强或太弱的灼烧时,还会出现其它并发症。
眼科外科手术通常使用具有宽带白光(例如卤素、氙等)的眼内照明器来对手术区进行照明。此外,外科医生可以仅仅依靠光的反射(例如通过手术显微镜)来使手术目标可视化。在眼科手术中使用荧光通常局限于眼睛中的脉管系统的诊室内研究。例如,荧光素染料和icg已经用于识别异常的视网膜血管。当施加并吸收能量(例如光)时,荧光材料的电子被激发。一旦被激发,在电子返回到其基态时,该材料发射光或荧光。在眼科外科手术中没有使用荧光来增加手术目标的可视化。
技术实现要素:
所提出的解决方案用唯一的解决方案填补了未满足的医疗需求,以提供一种眼科手术成像系统,该眼科手术成像系统具有用于控制荧光染料的激发并收集所发射的荧光以使生物组织可视化的光学元件。对荧光的有效、受控激发和收集可以提高外科医生在眼科外科手术中分辨患者眼睛的细节的能力。本披露还描述了使用增加活体染料的视觉对比度的(多个)光波长对手术区进行选择性照明,从而使得目标生物组织被强调。
与一些实施例一致的是,一种在眼科外科手术中进行成像的方法可以包括:确定与置于手术区中的活体染料相关联的光激发波长;将具有所述激发波长的光发射到所述手术区;确定与所述活体染料相关联的光发射波长;使用第一光学元件对来自所述手术区的光进行滤波,以允许透射具有所述发射波长的光并且阻止透射具有所述激发波长的光。
与一些实施例一致的是,一种眼科手术成像系统可以包括:光源,所述光源可控制用于发射具有与布置于手术区中的活体染料相关联的激发波长的光;第一光学元件,所述第一光学元件布置于从手术区发射的光的光学通路中,所述第一光学元件可控制用于选择性地对从所述手术区接收的光进行滤波,以允许透射具有与所述活体染料相关联的发射波长的光并且阻止透射具有所述激发波长的光;图像传感器,所述图像传感器布置于从所述手术区发射的光的所述光学通路中,所述图像传感器被配置成用于从所述第一光学元件接收具有所述发射波长的所述经滤波的光;计算设备,所述计算设备与所述图像传感器通信并被配置成用于处理所述接收的光以生成图像数据,包括修改所述图像数据的特征以增强所述目标生物组织在视觉表示中的可视化;以及显示设备,所述显示设备与计算设备通信并且被配置成用于显示所述视觉表示。
与一些实施例一致的是,一种眼科成像的方法可以包括:确定增加布置于手术眼中的活体染料的视觉对比度的光波长;将具有所述确定的波长的光发射到所述手术眼,包括以下各项中的至少一项:控制可调光源以发射具有所述确定的波长的所述光;以及使用位于由所述光源发射的光的光学通路中的光学元件来对来自光源的光进行滤波,以透射具有所述确定的波长的所述光;并且接收对发射到所述手术眼的所述光的反射,使得与所述手术眼的其他部分相比,被所述活体染料染色的目标生物组织被强调。
本发明的另外的方面、特征和优点将从以下详细描述变得明显。
附图说明
图1是流程图,示出了一种在眼科外科手术中进行成像的方法。
图2是简图,示出了一种眼科成像系统。
图3是简图,示出了一种眼科成像系统。
图4是简图,示出了一种眼科手术器械。
在附图中,具有相同标号的元件具有相同或类似的功能。
具体实施方式
在以下描述中,阐明具体细节以便描述特定的实施例。然而,本领域的技术人员将清楚的是可以在不具有这些具体细节中的一些或全部的情况下实践所披露的实施例。所呈现的具体实施例意在为说明性的,而非限制性的。本领域的技术人员可认识到,虽然在本文中未明确描述,但其他材料也在本披露的范围和精神内。
本披露描述了对用于在眼科外科手术中使目标生物组织可视化的荧光活体染料进行受控窄带照明的装置、系统和方法。可以由光源和光学元件提供照明。可以使用光学元件以受控方式收集荧光。可以使用手术显微镜光学器件直接使荧光目标生物组织可视化。还可以在图像传感器/相机处接收荧光。可以处理图像数据以增强被活体染料染色的目标生物组织。可以向显示设备提供增强的图像数据。
本披露的装置、系统、和方法提供了大量优点,包括:(1)通过为外科医生提供对手术目标的改善的可视化来提高外科手术的疗效;(2)通过允许使用具有低亲和力和/或低可见度的毒性较小的活体染料来提高患者的安全性;(3)通过允许使用较低剂量的已知染料来降低毒性来提高患者的安全性;以及(4)通过使所有外科医生的手术区最大化来增加手术显微镜的效用。
图1提供了在眼科外科手术中进行成像的方法10的流程图。可以参考图2-4进一步理解方法10。可以在使用活体染料来改进手术目标的可视化的外科手术期间实施方法10。在一些实施例中,可以玻璃体内注射或以其它方式玻璃体内施用活体染料,用于对手术眼和/或手术区中的目标生物组织进行染色。在一些实施例中,可以将活体染料通过静脉引入到手术眼和/或手术区中的目标生物组织。在一些实施例中,可以将活体染料递送到手术区,使得该活性染料注入手术眼和/或目标生物组织中。在步骤12,方法10可以包括:确定与活体染料相关联的(多个)光激发波长。活体染料的激发波长可以用于有效地照亮手术区,使得活组织染料发出荧光并增加目标生物组织的可见性。所述(多个)激发波长可以包括波长范围内的单个波长,如峰值激发波长。波长范围可以以特定波长(例如在峰值激发波长+/-25nm内的所有波长)为中心。对于所有活体染料,该范围的跨度可以是固定的,或者根据在外科手术期间使用的特定的活性染料而变化。
确定所述(多个)激发波长,可以包括接收对在眼科手术期间使用的染料进行识别的用户输入。可以在用户界面120处接收用户输入,下面将对此进行更加详细的描述。计算设备122可以确定与输入的活体染料相关联的所述(多个)激发波长,同样将在下面进行更加详细的描述。例如,计算设备122可以访问活体染料及其相应的所述(多个)激发波长的数据库,并使用该数据库确定输入的活体染料的所述(多个)激发波长。在一些实施例中,可以在用户界面120处接收直接识别所述(多个)激发波长的用户输入。
在步骤14,方法10可以包括:将具有所述(多个)激发波长的光发射到手术区。可以对手术区进行照亮,来自光源114和/或光学元件116的光波长对应于在步骤12中确定的活体染料所述的(多个)激发波长。当发射到手术区的光被吸收时,这种照明可以使得活体染料被有效激发。其结果是,活体染料可以更有效地发出荧光,并且施用了染料的目标生物组织可以更好地可视化。
光源114可以被配置成用于发射光以激发施用到手术区中的目标生物组织的活体染料。在一些实施例中,光源108可以是可调光源,使得基于在步骤12中确定的所述(多个)激发波长,所述(多个)发射波长是可选择的。光源108可以包括超级发光二极管、超短脉冲激光器、超连续激光器、钛-蓝宝石激光器、白炽灯泡、卤素灯泡、金属卤化物灯泡、氙气灯泡、水银蒸气灯泡、发光二极管(led)等。光源114可以与计算设备122通信。计算设备122可以向光源114提供控制信号,以基于所述(多个)激发波长将光发射到手术区。
光学元件116可以是位于由光源108发射的光的光学通路中的光谱滤波元件。光学元件116可以被配置成用于基于活体染料的所述(多个)激发波长来滤波发射到手术区的光。例如,光学元件116可以阻止透射除了对应于所述(多个)激发波长的(多个)波长之外的光。光学元件116可以是二向色滤光器、衍射光栅、光声可调滤光器(aotf)、液晶可调滤光器(lctf)、线性可变滤光器(lvf)、微机电系统(mems)可调滤光器、干涉滤光器等。光学元件116可以与计算设备122通信。计算设备122可以向光学元件116提供控制信号,以基于所述(多个)激发波长来对光进行滤波。
控制光源和/或光学元件(步骤14)可以包括用窄带宽光(与宽带白光相反)对手术区进行照明。发射到手术区的光的发射带可以在1nm到100nm之间、1nm到50nm之间、1nm到25nm之间、1nm到20、1nm到10nm之间等,但是可以考虑更大的和更小的带宽。窄带宽可以对应于在步骤12中确定的所述(多个)激发波长。在一些实施例中,光源114的发射频带是可控的,使得光源114发射窄带宽光。在一些实施例中,可以控制光学元件116以仅允许窄带宽光通过。
光源114和/或光学元件116可以包括在手术成像系统150(图2-4)的一个或多个部件中。例如,光源114和/或光学元件116可以集成在眼科手术显微镜100(图2)、不同于但耦合到显微镜100的光学块128(图3)和/或眼科手术器械140(图4)中。
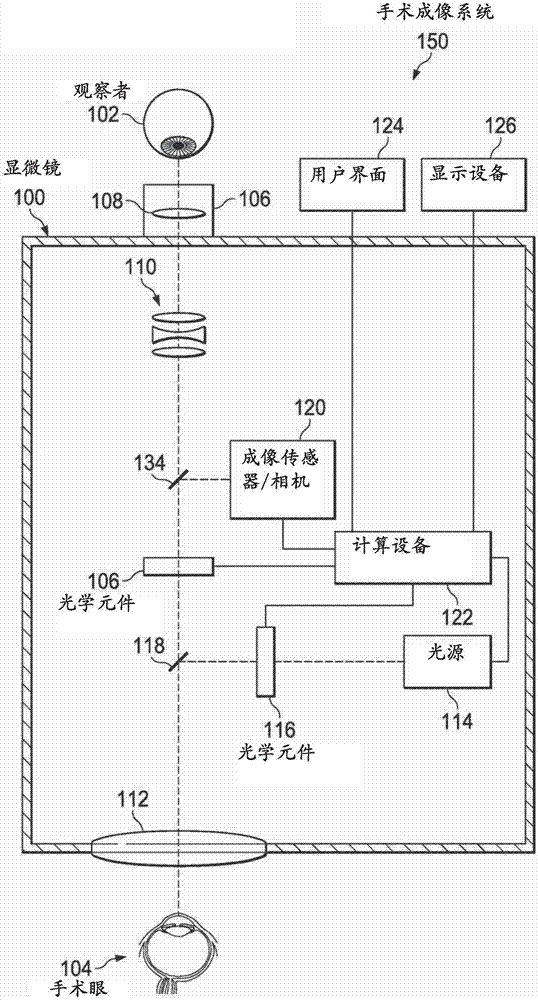
图2-3示出了眼科手术显微镜100。观察者102可以使用显微镜100观察手术区,如手术眼104。观察者102可以是医疗保健专业人员,如执行诊断、手术和/或其他医学治疗的医生或外科医生。手术眼104可以是承受医学治疗的患者的手术眼。目标生物组织可以是手术眼104中的组织。一个或多个透镜、反射镜、滤光器、光栅和/或其他光学部件可以包括显微镜100的光具组。光学部件可以位于从手术区发射的光的光学通路中。例如,目镜106可以包括光学部件108,并且显微镜100的主体可以包括光学部件110和物镜112。光学部件108和110以及物镜112是示例性的,并且在各种实施例中,显微镜100可以包括更多的或更少的透镜和/或用于对光进行聚焦和/或放大图像的其它光学部件。眼科手术显微镜100可以位于从手术区发射的光的光学通路中。
在一些实施例中,光源114和/或光学元件116可以直接或间接地耦合到显微镜100,使得光源114和/或光学元件116与手术显微镜100具有限定的光学/光学机械关系。例如,如图2所示,光源114和/或光学元件116可以集成在显微镜100中。手术显微镜100可以包括光学元件118,用于将来自光源114和/或光学元件116的光引导到手术区。光学元件118可以包括二向色镜、陷波滤光器、热镜、分束器和/或冷光镜。
例如,如图3所示,光源114和/或光学元件116可以集成在光学块102中。光学块102可以直接或间接耦合到显微镜100,使得光源114和/或光学元件116具有与显微镜100之间的限定的光学/光学机械关系。可以相对于显微镜100和/或手术眼104独立地操作光学块128。光学块128可以是手持式设备、透镜固持件、自稳定部件或其它部件。光学块128可以不同于但是耦合到显微镜100。例如,光学块128与手术显微镜100之间的直接或间接耦合138可以包括悬架系统、机械框架、突出臂、锥体结构、磁性构件、弹性构件和塑料构件中的一个或多个。光学块128可以包括光源114、光学元件116和光学元件106中的一个或多个。在一些实施例中,光源114、光学元件116和光学元件106中的一个或多个从光学块128中省略,并且包括在例如显微镜100和器械140中。
在一些实施例中,光源114和/或光学元件116与手术成像系统150中的一个或多个部件(如手术显微镜100)之间不具有限定的光学/光学机械关系。如图4所示,光源114和/或光学元件116可以包括在眼科手术器械140中。器械140可以是眼内照明器、枝形吊灯、受照输注插管、受照玻璃体视网膜工具、受照插管、受照激光探针、受照剪刀、受照镊子等。例如,器械140可以相对于手术眼104和手术成像系统150的其他部件(如显微镜100)保持分离并且可独立定位。器械140可以被配置成用于侵入性地穿透手术眼104的眼球。器械140可以与控制台136处于光学通信和/或电气通信。控制台136可以包括计算设备122,下面将对此进行更加详细的描述。器械140可以包括光源114和/或光学元件116。在一些实施例中,光源114和/或光学元件116可以从器械140中省略,并且包括在例如控制台136中。在这类实施例中,来自光源114的光可以被引导到器械140,并且器械140可以用于将光引导到手术区。
再次参考图1,在步骤16,方法10可以包括:确定与活体染料相关联的(多个)发射波长。在活体染料的荧光下发射的光可用于使目标生物组织可视化。所述(多个)发射波长可以包括单个波长(例如峰值发射波长)或一系列波长。波长范围可以以特定波长(例如在峰值发射波长+/-25nm内的所有波长)为中心。对于所有活体染料,该范围的跨度可以是固定的,或者根据在外科手术期间使用的特定的活性染料而变化。
可以基于对在眼科手术期间使用的染料进行识别的用户输入来确定所述(多个)发射波长。如以上关于步骤12类似地描述的,计算设备122可以访问活体染料及其相应的(多个)发射波长的数据库,并且使用该数据库确定所输入的活体染料的所述(多个)发射波长。在一些实施例中,可以在用户界面124处接收直接识别(多个)发射波长的用户输入。
在步骤18,方法10可以包括使用光学元件来滤波来自手术区的光,以允许透射具有所述(多个)发射波长的光并且阻止透射具有所述(多个)激发波长的光。可以在手术成像系统150的一个或多个部件处接收从手术区发射的光。从手术区发射的光可以包括发射光和反射光。可以由活体染料发出荧光。也可以从手术区反射光。控制光学元件106以基于在步骤16中确定的所述(多个)发射波长来对光进行滤波可以允许有效地收集荧光。当控制光学元件106允许荧光透射时,可以更好地使已经施加了染料的目标生物组织可视化。也可以使用手术成像系统150的一个或多个部件(如显微镜光学器件和/或图像传感器/相机120)收集由自发荧光生物组织发射的光并使所述光可视化。
光学元件106可以是位于从手术区发射的光的光学通路中的光谱滤波元件。光学元件106可以被配置成用于基于活体染料的所述(多个)发射波长来滤波从手术区发射的光。例如,光学元件106可以阻止对应于来自光源114的(多个)激发波长的光的透射。光学元件106可以是二向色滤光器、衍射光栅、光声可调滤光器(aotf)、液晶可调滤光器(lctf)、线性可变滤光器(lvf)、微机电系统(mems)可调光学滤光器、干涉滤光器等。光学元件106可以与计算设备122通信。计算设备122可以向光学元件106提供控制信号以基于所述(多个)发射波长来对光进行滤波。
光学元件106可以包括在手术成像系统150(图2-3)的一个或多个部件中。例如,光学元件106可以集成在眼科手术显微镜100(图2)和/或不同于但耦合到显微镜100的光学块128(图3)中。
光学元件106可以直接或间接地耦合到显微镜100,使得其与手术显微镜100之间具有限定的光学/光学机械关系。例如,如图2所示,光学元件106可以集成在显微镜100中。光学元件106可以相对于显微镜100不同地定位。例如,元件106可以布置在手术眼104与物镜112之间、手术眼104与目镜106之间、手术眼与图像传感器/相机120之间等的光学通路中。
例如,如图3所示,光学元件106可以集成在光学块102中。光学块102可以直接或间接耦合到显微镜100,使得光学元件106具有与显微镜100之间的限定的光学/光学机械关系。可以相对于显微镜100和/或手术眼104独立地操作光学块128。光学块128可以包括光源114、光学元件116和光学元件106中的一个或多个。在一些实施例中,光学块128仅包括光学元件106。在这类实施例中,光学元件106可以集成在基于非接触的光学元件中。光学元件106可以以类似于非接触间接可视化系统(如双目间接眼科显微镜或biom、zeissresight、
可以使用手术成像系统150的一个或多个部件来使施加了活体染料的目标生物组织可视化。例如,可以在包括光学部件108和110的显微镜光学器件处接收从手术区发射的荧光。因此,当观察者102(如外科医生)在眼外科外科手术过程中通过目镜106观察手术区时,可以使用显微镜光学器件来直接使荧光目标生物组织可视化。
例如,可以在图像传感器/相机120处接收从手术区发射的荧光。方法10可以包括:在图像传感器/相机120处接收由光学元件106滤波的光。图像传感器/相机120可以位于从手术区发射的光的光学通路中。在一些实施例中,图像传感器/相机是显微镜100的一部分。在这类实施例中,显微镜100可以包括一个或多个分束器134,用于将光的至少一部分引导到成像传感器/相机120。在一些实施例中,图像传感器/相机120可以是单独部件,该单独部件不是显微镜100本身的一部分,而是与计算设备118、显微镜100和/或光学块128通信。例如,通过在光纤夹持器130处耦合到光学块128的光纤132,可以将来自手术区的光引导到图像传感器/相机120。图像传感器/相机120可以包括电荷耦合器件(ccd)传感器、互补金属氧化物半导体(cmos)传感器或其他合适的图像传感器。例如,cmos传感器可以用于在图像处理过程中实现感兴趣区域增益控制,以选择性方式减少来自手术器械的镜面反射并以低荧光或可见度增强手术区的可视化。光学元件106可以位于从手术区发射的光的光学通路中,使得不在显微镜光学器件和/或图像传感器/相机120处接收与所述(多个)激发波长相关联的光。图像传感器/相机120可以包括用于从接收到的光生成电数据和/或图像数据的电路。
图像传感器/相机120可以与计算设备122通信。图像传感器/相机120可以将图像数据提供给计算设备122。在一些实施例中,当从图像传感器/相机120接收到电数据时,计算设备122生成图像数据。方法10可以包括:对在图像传感器/相机120处接收的光进行处理,以生成图像数据。处理图像数据可以包括:用于经由显示设备126准备用于显示的图像数据的任何一个或多个信号处理步骤。例如,处理图像数据可以包括降噪、滤波、锐化、对比度操作等。
在一些实施例中,处理图像数据可以包括图像增强,以利于施加了活体染料的目标生物组织的可视化。方法10可以包括:确定与所述(多个)发射波长相关联的图像数据的部分。例如,计算设备122可以实现一个或多个用于对表示荧光目标生物组织的图像数据进行识别的处理步骤。方法10可以包括修改图像数据的特征以增强目标生物组织经由显示设备126在视觉表示显示中的可视化。例如,计算设备122可以实现一个或多个用于增强由显示设备126显示的荧光目标生物组织的图像数据的处理步骤。例如,与使用显微镜光学器件的直接可视化相比,可以修改荧光目标生物组织的一个或多个图像特征(例如强度、颜色、对比度、锐度、边界等)以增强显示设备126上的可视化。在一些实施例中,可以修改除了荧光目标生物组织之外的图像数据的部分。计算设备122可以基于从用户界面124接收的一个或多个用户特定的图像特征来完成图像处理。
方法10可以包括:向显示设备126提供图像数据的视觉表示。例如,计算设备122可以处理图像数据并将处理后的图像数据提供给显示设备126。显示设备126可以与计算设备122通信。显示设备126可以显示由图像传感器/相机120捕获的手术区的图像,包括从计算设备122接收的经处理的图像数据。在一些实施例中,显示设备126是显微镜100的一部分。例如,显示设备126可以是布置在或耦合到显微镜100上以允许观察者102和/或其他观察者进行观察的监视器。在一些实施例中,显示设备126可以是不是显微镜100本身的一部分的单独部件,而是与计算设备122和显微镜100通信。在各种实施例中,显示设备126可以是液晶显示器(lcd)、发光二极管液晶显示器(led-lcd)、数字微镜器件(dmd)、平视显示器、近眼显示器和/或其他合适的显示设备。例如,显示设备126可以包括透射元件(例如背光led-lcd)或前照式反射元件。
计算设备122可以与光源114、光学元件116、光学元件106、图像传感器/相机120、显示设备126和/或用户界面124中的一个或多个直接或间接通信。计算设备122还可以与显微镜100、光学块128和/或器械140直接或间接通信。在一些实施例中,计算设备122是显微镜100和/或控制台136的一部分。在一些实施例中,计算设备122可以是不是显微镜100和/或控制台136的一部分的单独部件。相反,计算设备122可以与集成在显微镜100、光学块128和/或器械140中和/或与显微镜100、光学块128和/或器械140通信的一个或多个部件通信。
计算设备118可以包括用于执行本文所描述的步骤的任何合适的处理器、存储器或处理电路。例如,计算设备122可以被配置成用于基于(多个)激发波长产生并提供用于光源114和/或光学元件116的控制信号以将光发射到手术区。计算设备122可以被配置成用于生成控制信号并将其提供给光学元件106,用以基于(多个)发射波长来接收光。计算设备122可以被配置成用于从图像传感器/相机120接收电数据和/或图像数据。计算设备122可以被配置成用于生成和/或处理图像数据。计算设备122可以被配置成用于向显示设备126提供经处理的图像数据。计算设备122可以被配置成用于接收来自用户界面120的用户输入。计算设备122可以被进一步配置成用于执行本文描述的或者完成本文描述的步骤所必需的其他步骤。
计算设备122可以与用户界面124通信。在一些实施例中,用户界面104可以是计算设备122的面向用户的组件,使得用户界面124是显微镜100和/或控制台136的一部分。在一些实施例中,用户界面124是不是显微镜100和/或控制台136的一部分的单独部件。相反,用户界面124可以与计算设备118和/或控制台136通信。用户界面104可以包括输入设备或系统,通过非限制性示例的方式包括键盘、鼠标、操纵杆、刻度盘、按钮以及其他输入设备。用户界面124可以是被配置成用于向用户呈现图像或其他数据(例如显微镜设置、显示设置等)的显示器(包括例如触摸屏显示器),如在外科手术过程中的手术区的图像。观察者102可以经由用户界面104指定用于手术成像系统150的活体染料、(多个)激发波长、(多个)发射波长、图像特征和/或其他输入。
在一些实施例中,光源114可以被配置成用于发射光以更广泛地照亮手术区,与激发荧光活体染料的照明相反。由光源114提供的照明可以实现目标生物组织(例如未被活体染料染色的组织)的自发荧光。当来自入射光的能量被吸收时,可以激发目标生物组织,如晶状体、玻璃疣等。目标生物组织可以在其返回到基态时发出荧光。因此,使用方法10,即使不使用活体染料,也可以改善手术目标的可视化。
在一些实施例中,光源114还可以为被荧光和/或非荧光活体染料染色的目标生物组织提供对比度增强。例如,当使用宽带白光对手术区进行照明时,一些活体染料可具有低可见性。外科医生有时可以选择不使用低可见度染料,尽管它们具有低视网膜毒性,因为难以实现对目标生物组织的可视化。本披露的窄带宽照明可以为低可见度活体染料提供增加的视觉对比度。这可以通过允许使用更安全的但可见度较低的没有被使用的活体染料来增加患者的安全性。对比度增强可以独立于或除了本文所述的荧光可视化之外另外地实现。
可以选择增加活体染料的视觉对比度的(多个)波长的光来对手术区进行照明。可以以类似于选择上述(多个)激发波长的方式或其他合适的方式来选择(多个)波长。在一些实施例中,增加对比度的(多个)波长是与活体染料相关联的(多个)激发波长(例如步骤12)。在一些实施例中,活体染料可以将目标生物组织染色成与活体染料的相关(多个)激发波长的颜色显著不同的颜色。例如,可以在例如约100nm的数量级上分离(多个)波长。在其他实施例中,选择改进视觉对比度的(多个)波长而不管(多个)激发波长。例如,可以选择红光以对被染成绿色的目标生物组织进行照明。
可以基于对比度最大化波长将光(如窄带宽光)发射到手术区(例如步骤14)。可以以与上述类似的方式将光发射到手术区。例如,可以控制可调光源以发射具有(多个)对比度增加的波长的光。例如,可以用位于由光源发射的光的光学通路中的光学元件对来自光源的光进行滤波,使得所透射的光具有(多个)对比度增加的波长。在一些实施例中,可以用附加光对手术区进行受照,用于向外科医生提供态势感知。例如,除了窄带宽光之外,还可以提供低强度的、均匀的和/或宽带的光。可以从包括在显微镜100、器械140和/或手术成像系统150的其他部件中的光源来提供均匀光。
可以使用外科成像系统150的一个或多个部件(如显微镜光学器件和/或图像传感器/相机120)收集对发射到手术区的光(例如包括窄带宽光)的反射并使其可视化。与手术区的其他部分相比,被活体染料染色的目标生物组织可以被强调。可以增强目标生物组织的对比度,因为被染色的目标生物组织的颜色显著不同于发射到手术区的窄带宽光的颜色。例如,将目标生物组织染成蓝色的活体染料可以在黄色波长范围内具有吸收峰。光源114可以用窄带宽的黄光照亮手术区。使用至少部分地用窄带宽黄光照明的手术区,可以更容易地识别染成蓝色的目标生物组织。
在图像传感器/相机120处接收从手术区反射的光的实施例中,计算设备122可以实施一个或多个用于增强由显示设备126显示的染色的目标生物组织的图像数据的处理步骤,如上所述。例如,与使用显微镜光学器件的直接可视化相比,可以修改染色的目标生物组织的一个或多个图像特征(例如强度、颜色、对比度、锐度、边界等)以增强显示设备126上的可视化。在一些实施例中,可以修改图像数据的除了染色的目标生物组织之外的部分,以增加活体染料和手术区之间的对比度。
本文讨论的显微镜100可以是单目显微镜或双目显微镜。应当理解,显微镜100可以包括用于一个或多个观察者102的每只眼睛的一个目镜(例如用于外科医生和助手中每个人的两个目镜)。可以实施本披露的教导,使得可以通过一个或多个目镜看到荧光目标生物组织。显微镜100可以是复式显微镜、立体显微镜或数字显微镜。本披露的教导可以在显微镜100的一个或多个光学通路中实现。例如,可以控制光学元件106以基于观察者102与复式显微镜或数字显微镜中的手术区之间的单个光学通路中的(多个)发射波长来对光进行滤波。例如,可以控制光学元件106以基于观察者102与立体显微镜中的手术区之间的两个光学通路中的(多个)发射波长来对光进行滤波。在一些实施例中,为与观察者102的眼睛相关联的每个光学通路提供光学元件106。在一些实施例中,单独的图像数据在被提供给显微镜光学器件和/或显示设备126之前被组合。在一些实施例中,对多个观察者102中的每一个(例如对每个观察者的一只眼睛、对每个观察者的两只眼睛、对每个观察者的每只眼睛等)单独生成图像数据。
如本文所述的实施例可以提供通过有效地激发活体染料以发出荧光并控制荧光收集来促进目标生物组织的可视化的设备、系统和方法。本文所述的实施例还通过使用增加染色的目标生物组织的对比度的窄带宽光对手术区进行选择性照明来促进可视化。尽管本文中将一种或多种特定染料或特定种类的染料称为实例,但应当理解,本披露的教导可以应用于任何染料、染剂和/或其它着色剂。类似地,尽管本文中将外科手术称为实例,但应理解,本披露的教导可以在任何眼科手术过程中应用,包括在临床和/或诊室内诊断、治疗、检查、随访过程中应用。以上提供的实施例仅为示例性的,并且无意进行限制。本领域的技术人员可容易设想出与所公开的实施方案一致的其它系统,所述其它系统既定在本公开的范围内。因此,本申请仅受所附权利要求书限制。
- 还没有人留言评论。精彩留言会获得点赞!