一种沉香树籽萃取物、制备方法及其应用于抗过敏的用途与流程
本发明为一种沉香树(aquilariamalaccensis)籽萃取物的制备方法,及该萃取物应用于抗过敏的用途。
背景技术:
由于全球环境随工业的发展使污染随的增加,且因土地开发的因素,造成绿地、森林(如:巴西的雨林)大幅减少,使环境气候改变,造成罹患过敏性疾病的患者逐年增加,其罹病年龄层也有下降的趋势;而过敏性疾病是免疫系统接触环境中部分对一般人影响不大的过敏原因子后,所引发的一系列超敏反应现象;而人体对于某些因子过度反应的现象,包含过敏性鼻炎、食物过敏、荨麻疹、异位性皮肤炎、哮喘与全身型过敏性反应等,症状可能有红眼、引起搔痒的皮疹、流鼻水、呼吸困难与肿胀等。
而过敏反应中由免疫球蛋白e(ige)为媒介的过敏,是一种常见的免疫系统失调的反应,其会与过敏原结合,并释放组织胺等引起发炎的化学物质,过敏的治疗包括避开已知的过敏原和使用皮质类固醇与抗组织胺药;当严重过敏时,则会于静脉注射肾上腺素,借以抑制细胞的过敏反应,特别的是,在ige媒介的过敏反应中,例如过敏性鼻炎、急性气喘和异位性湿疹,肥大细胞的去颗粒(β-葡萄糖醛酸酶与组织胺的释放)扮演着关键的角色;在体外过敏反应试验中,活化的肥大细胞(rbl-2h3细胞)会释出β-葡萄糖醛酸酶与组织胺。虽然目前过敏症状可以治疗,但可用的药物在长期使用的情况下会容易引起不良反应,而因天然物不仅容易取得且成份组成较合成药物安全,因此寻找有活性的天然物作为治疗过敏的替代药物,实为目前业界所欲解决的课题。
就以沉香树(aquilariamalaccensis)而言,其是属于瑞香科植物,为珍贵的芳香树脂来源,该树脂作用为植物的防御机制,用来抵御病原体的入侵,其可作为强心剂、驱风、平喘、壮阳药和涩补之用,而且对治疗腹泻、痢疾、痛风、风湿、瘫痪以及寄生虫有效,亦对治疗皮肤病有益;另外,沉香亦被发现具有抗忧郁、抗神经发炎、镇痛、抗发炎、抗氧化、抗菌等活性,而在体内试验中亦具有降血糖以及缓泻效果。
尤其,沉香树的茎与树干的酒精萃取物具有强心的作用、对人类表皮癌细胞与p-388淋巴白血球细胞的试管内实验具有细胞毒杀效果;而其水萃物则显示具有抗锥虫、抗菌以及体内体外抗过敏的功效;过去曾由沉香(a.malaccensis)树干分离出一个佛波酯化合物,名为12-o-(2z,4e,6e)-deca-2,4,6-trienoylphorbol-13-acetate,被认为具有刺激性、促炎性和促癌性者,但其并未针对其抗过敏的活性深入研究,故该化合物抗过敏的活性并不可知。
另外,由于利用沉香树的茎与树干作萃取,且因沉香树的生长速度较为缓慢,其并无法大量、有效率提供茎、树干来萃取;有鉴于此,本发明人等遂以可较易取得且不影响沉香树生长的沉香树(aquilariamalaccensis)籽来试验研究,使其可提供治疗过敏替代药物的天然物,终于构思出本案且确已得相关研究成果,而完成本发明。
技术实现要素:
本发明所要解决的主要技术问题在于,克服现有技术存在的上述缺陷,而提供一种沉香树籽萃取物、制备方法及其应用于抗过敏的用途,其可有效制备可抗过敏药物的沉香树籽萃取物及其制备方法;拥有将沉香树籽萃取物应用于抗过敏的用途。
本发明解决其技术问题所采用的技术方案是:
一种应用于抗过敏药物的沉香树籽萃取物的制备方法,包括如下的步骤:
(a)将沉香树(aquilariamalaccensis)籽经阴干、磨粉后以90%乙醇萃取3次,并经减压浓缩抽干后获得乙醇萃取物(etoh);
(b)以水(water)及乙酸乙酯(etoac)对乙醇萃取物(etoh)进行3次等比例的液液层析进行,以获得乙酸乙酯划分层(etoaclayer)及水层(h2olater);
(c)以正己烷(n-hex)和90%甲醇水溶液(meoh)对乙酸乙酯划分层(etoaclayer)进行液液层析,以获得正己烷划分层(n-hexlayer)与甲醇划分层(meohlayer);
(d)将甲醇划分层(meohlayer)以硅胶管柱层析,借由正己烷(n-hex)∶二氯甲烷(dcm)∶甲醇(meoh)以6∶3∶1、6∶4∶1、6∶6∶1、6∶8∶1、6∶10∶1、6∶10∶2的比例所组成的冲提液进行梯度冲提,从而获得6个划分层am1、am2、am3、am4、am5、am6;
(e)将am4划分层以1∶1比例的二氯甲烷(dcm)∶甲醇(meoh)的葡聚醣凝胶lh-20(sephadexlh-20)管柱进行分离,从而获得8个次划分层am4-1、am4-2、am4-3、am4-4、am4-5、am4-6、am4-7、am4-8;
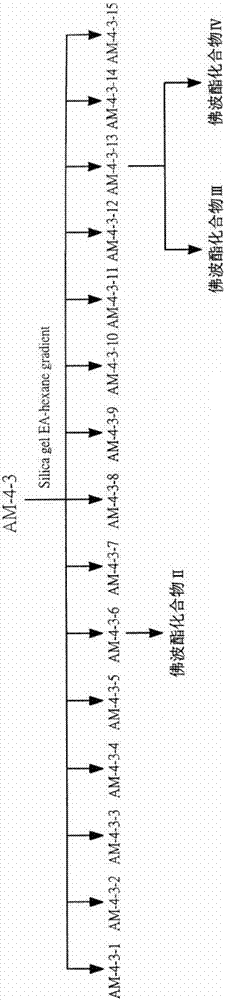
(f)将am4-3次划分层经由硅胶管柱层析,以1∶10至4∶1比例的乙酸乙酯∶正己烷进行梯度冲堤,从而分离出15个子划分层am4-3-1、am4-3-2、am4-3-3、am4-3-4、am4-3-5、am4-3-6、am4-3-7、am4-3-8、am4-3-9、am4-3-10、am4-3-11、am4-3-12、am4-3-13、am4-3-14及am4-3-15;
(g)将am4-4次划分层经由硅胶管柱层析以1∶15~4∶1比例的乙酸乙酯∶正己烷进行梯度冲堤,从而分离出12个子划分层am4-4-1、am4-4-2、am4-4-3、am4-4-4、am4-4-5、am4-4-6、am4-4-7、am4-4-8、am4-4-9、am4-4-10、am4-4-11、am4-4-12;
借由上述的步骤,即可由am4-4-9子划分层获得一新佛波酯化合物i,其如下式(i)的结构,
而由上述am4-3-6子划分层及am4-4-3子划分层获得一新佛波酯化合物ii,其结构如下式(ii):
再,由上述am4-3-13子划分层获得一新佛波酯化合物iii,其结构如下式(iii):
另,由上述am4-3-13子划分层获得一新佛波酯化合物iv,其结构如下式(iv):
再,由上述am4-4-7子划分层及am4-4-8子划分层可获得已知佛波酯化合物v及佛波酯化合物vi,该佛波酯化合物v的结构如下式(v),该佛波酯化合物vi的结构如下式(vi):
故,借由上述结构的佛波酯化合物,即可用以制备抗过敏药物,以应用于抗过敏用途。
本发明的有益效果是,其可有效制备可抗过敏药物的沉香树籽萃取物及其制备方法;拥有将沉香树籽萃取物应用于抗过敏的用途。
附图说明
下面结合附图和实施例对本发明进一步说明。
图1是本发明的流程图。
图2是本发明am4-3次划分层分离以获得15个子划分层的流程图。
图3是本发明am4-4次划分层分离以获得12个子划分层的流程图。
图4是乙醇萃取物(etoh)、甲醇划分层(meoh)、am4划分层以及am4-4次划分层的核磁共振光谱的氢谱比较图。
图5是本发明佛波酯化合物i的核磁共振的氢谱。
图6是本发明佛波酯化合物i的核磁共振的碳谱。
图7是本发明佛波酯化合物ii的核磁共振的氢谱。
图8是本发明佛波酯化合物ii的核磁共振的碳谱。
图9是本发明佛波酯化合物iii的核磁共振的氢谱。
图10是本发明佛波酯化合物iii的核磁共振的碳谱。
图11是本发明佛波酯化合物iv的核磁共振的氢谱。
图12是本发明佛波酯化合物iv的核磁共振的碳谱。
图13是本发明佛波酯化合物v的核磁共振的氢谱。
图14是本发明佛波酯化合物v的核磁共振的碳谱。
图15是本发明佛波酯化合物vi的核磁共振的氢谱。
图16是本发明的抗过敏活性实验结果表。
图17是本发明的抑制率实验结果表。
图18是本发明的细胞毒性筛选实验结果表。
图19是本发明的去颗粒活性试验结果。
具体实施方式
有关本发明为达到目的所运用的技术手段及其方法,兹谨再配合图1~图3所示的流程图、图4~图15所示的核磁共振分析图,及图16~图19的实验结果表,详细说明如下:
如图1~图3所示的流程图,其是用以制备沉香树(aquilariamalaccensis)籽萃取物的制备方法,详细说明如下:
(a)将沉香树(aquilariamalaccensis)籽经阴干、磨粉后以90%乙醇萃取3次,并经减压浓缩抽干后获得乙醇萃取物(etoh);取阴干、磨粉后的沉香树籽462公克,在室温下以5公升的90%乙醇萃取3次,并经由减压浓缩抽干后获得27.7公克的乙醇萃取物(etoh)。
(b)以水及乙酸乙酯(etoac)对乙醇萃取物(etoh)进行3次等比例的液液层析进行,以获得乙酸乙酯划分层(etoaclayer)及水层(h2olater);以1公升的水和乙酸乙酯(etoac)对乙醇萃取物(etoh)进行3次等比例的液液层析,并获得25.6公克的乙酸乙酯划分层(etoaclayer)及水层(h2olater)。
(c)以正己烷(n-hex)和90%甲醇水溶液(meoh)对乙酸乙酯划分层(etoaclayer)进行液液层析,以获得正己烷划分层(n-hexlayer)与甲醇划分层(meohlayer);以正己烷(n-hex)和90%甲醇水溶液(meoh)对25.6公克的乙酸乙酯划分层(etoaclayer)进行液液层析,以划分获得7.1公克的正己烷划分层(n-hexlayer)和16.2公克的甲醇划分层(meohlayer);又,该水层(h2olater)可分离纯化出正丁醇划分层(n-butanollayer)及水划分层(waterlayer)。
(d)将甲醇划分层(meohlayer)以硅胶管柱层析,借由正己烷(n-hex)∶二氯甲烷(dcm)∶甲醇(meoh)以6∶3∶1、6∶4∶1、6∶6∶1、6∶8∶1、6∶10∶1、6∶10∶2的比例所组成的冲提液进行梯度冲提,从而获得6个划分层am1、am2、am3、am4、am5、am6;将甲醇划分层(meohlayer)经由硅胶管柱层析(23cm×4cm,silicagel60,0.063-0.200mm,merck),借由正己烷(n-hex)∶二氯甲烷(dcm)∶甲醇(meoh)以6∶3∶1、6∶4∶1、6∶6∶1、6∶8∶1、6∶10∶1、6∶10∶2的比例所组成的冲提液进行梯度冲提,从而获得2917毫克的am1划分层、1320毫克的am2划分层、6834毫克的am3划分层、3212.2毫克的am4划分层、1703毫克的am5划分层及97.9毫克的am6划分层。
(e)将am4划分层以1∶1比例的二氯甲烷(dcm)∶甲醇(meoh)的葡聚醣凝胶lh-20(sephadexlh-20)管柱进行分离,从而获得8个次划分层am4-1、am4-2、am4-3、am4-4、am4-5、am4-6、am4-7、am4-8;将上述步骤中am4划分层以1∶1比例的二氯甲烷(dcm)∶甲醇(meoh)的葡聚醣凝胶lh-20(sephadexlh-20)管柱进行分离,从而获得688毫克的am4-1次划分层、688毫克的am4-2次划分层、762毫克的am4-3次划分层、173.7毫克的am4-4次划分层、609毫克的am4-5次划分层、253.5毫克的am4-6次划分层、80毫克的am4-7次划分层及80毫克的am4-8次划分层;其中该am4-3及am4-4次划分层含有丰富的佛波酯。
(f)将am4-3次划分层经由硅胶管柱层析,以1∶10至4∶1比例的乙酸乙酯∶正己烷进行梯度冲堤,从而分离出15个子划分层am4-3-1、am4-3-2、am4-3-3、am4-3-4、am4-3-5、am4-3-6、am4-3-7、am4-3-8、am4-3-9、am4-3-10、am4-3-11、am4-3-12、am4-3-13、am4-3-14及am4-3-15;将上述步骤(e)中762毫克的am4-3次划分层硅胶管柱层析(17cm×4cm,geduransi60,0.040-0.063mm,merck),以1∶10至4∶1比例的乙酸乙酯∶正己烷进行梯度冲堤,从而分离出3.4毫克的am4-3-1子划分层、25.3毫克的am4-3-2子划分层、345.6毫克的am4-3-3子划分层、49.2毫克的am4-3-4子划分层、16.4毫克的am4-3-5子划分层、39.5毫克的am4-3-6子划分层、8.4毫克的am4-3-7子划分层、3.8毫克的am4-3-8子划分层、42.7毫克的am4-3-9子划分层、23毫克的am4-3-10子划分层、42.5毫克的am4-3-11子划分层、43.5毫克的am4-3-12子划分层、23.5毫克的am4-3-13子划分层、7.9毫克的am4-3-14子划分层及38.3毫克的am4-3-15子划分层(如图2所示),且该4-3-13子划分层中含有丰富的佛波酯。
(g)将am4-4次划分层经由硅胶管柱层析以1∶15~4∶1比例的乙酸乙酯∶正己烷进行梯度冲堤,从而分离出12个子划分层am4-4-1、am4-4-2、am4-4-3、am4-4-4、am4-4-5、am4-4-6、am4-4-7、am4-4-8、am4-4-9、am4-4-10、am4-4-11、am4-4-12;将上述步骤(e)中173.7毫克的am4-4次划分层经由硅胶管柱层析(30cm×1.5cm,geduransi60,0.040-0.063mm,merck)以1∶15~4∶1比例的乙酸乙酯∶正己烷进行梯度冲堤,从而分离出2.2毫克的am4-4-1子划分层、16.3毫克的am4-4-2子划分层、3.5毫克的am4-4-3子划分层、5.7毫克的am4-4-4子划分层、7.7毫克的am4-4-5子划分层、11.5毫克的am4-4-6子划分层、37.6毫克的am4-4-7子划分层、6.8毫克的am4-4-8子划分层、43.9毫克的am4-4-9子划分层、3.3毫克的am4-4-10子划分层、3.5毫克的am4-4-11子划分层及23.5毫克的am4-4-12子划分层(如图3所示),且该4-4-7及4-4-9子划分层中含有丰富的佛波酯。
(h)取得am4-4-9子划分层中的萃取物,获得佛波酯化合物i(12-o-(2z,4e,6e)-tetradeca-2,4,6-trienoylphorbol-13-acetate);取得上述am4-4-9子划分层中的萃取物,而其含有43.9毫克的新佛波酯化合物i
(12-o-(2z,4e,6e)-tetradeca-2,4,6-trienoylphorbol-13-acetate),其分子式为c36h50o8,其结构如下式(i):
(i)取得am4-3-6子划分层及am4-4-3子划分层中的萃取物,从而获得新佛波酯化合物ii;将am4-4-3子划分层中的萃取物,而其共含有8.8毫克新佛波酯化合物ii
(12-deoxy-13-o-acetoylphorbol-20-octadec-9-enoate),其分子式为c40h62o7,其结构如下式(ii):
(j)取得am4-3-13子划分层中的萃取物,其含有新佛波酯化合物iii及新佛波酯化合物iv;取得23.5毫克am4-3-13子划分层中的萃取物,而其含有0.7毫克新佛波酯化合物iii(12-o-(2e,4e)-6-oxohexa-2,4-dienoylphorbol-13-acetate)及0.9毫克的新佛波酯化合物iv
(12-o-(2e,4e)-6,7-dihydroxytetradeca-2,4-dienoylphorbol-13-acetate),该新佛波酯化合物iii分子式为c28h34o9,其结构如下式(iii);而该新佛波酯化合物iv分子式为c36h52o10,其结构如下式(iv):
(k)取得am4-4-7子划分层及am4-4-8子划分层中的萃取物,从而获得已知的佛波酯化合物v(12-deoxyphorbol13-decanoate)与佛波酯化合物vi(12-deoxyphorbol13-octanoate);取得am4-4-7子划分层与am4-4-8子划分层中的萃取物,而其内共含有8.5毫克已知的佛波酯化合物v与1.4毫克已知的佛波酯化合物vi,该佛波酯化合物v分子式为c30h46o6,其结构如下式(v),而该佛波酯化合物vi分子式为c28h42o6,其结构如下式(vi):
又,请参阅图4所示的核磁共振光谱的氢谱比较图,其可看出乙醇萃取物(etoh)、甲醇划分层(meoh)、am4划分层以及am4-4次划分层确实均含有佛波酯化合物,且发现抗过敏的活性与佛波酯化合物讯号的增加成正比例关系。
有关上述佛波酯化合物i(12-o-(2z,4e,6e)-tetradeca-2,4,6-trienoylphorbol-13-acetate),经分析后,其分子量为hresimsm/z633.33980[m+na]+(calcdforc36h50o8na,633.33979);旋光度为[α]d25:-3.75±1.97(c0.0667,chcl3);其紫外光谱为uv(meoh)λmax(logε):303(2.78),233(2.75)nm;其红外光谱ir(neat)νmax:3413,2965,2922,1710,1615,1377,1258,1092,802cm-1;其核磁共振氢谱如图5所示,其核磁共振碳谱则如图6所示。
有关上述佛波酯化合物ii(12-deoxy-13-o-acetoylphorbol-20-octadec-9-enoate),经分析后,其分子量为hresimsm/z677.43884[m+na]+(calcdforc40h62o7na,677.43878);旋光度为[α]d25:+2.91±0.49(c0.3333,chcl3);紫外光谱为uv(meoh)λmax(logε):285(2.78),250(2.83)nm;红外光谱为ir(neat)νmax:3409,2922,2855,1717,1375,1332,1152,1021cm-1;其核磁共振氢谱如图7所示,其核磁共振碳谱则如图8所示。
有关上述佛波酯化合物iii(12-o-(2e,4e)-6-oxohexa-2,4-dienoylphorbol-13-acetate),经分析后,其分子量为hresimsm/z537.20959[m+na]+(calcdforc28h34o9na,537.20950);旋光度为[α]d25:+4.20±0.82(c0.1667,chcl3);紫外光谱为uv(meoh)λmax(logε):295(2.80),249(2.84)nm;红外光谱为ir(neat)νmax:3413,2925,2855,2360,2339,1625,1597,1261,1184,755cm-1;其核磁共振氢谱如图9所示,其核磁共振碳谱则如图10所示。
有关上述佛波酯化合物iv
(12-o-(2e,4e)-6,7-dihydroxytetradeca-2,4-dienoylphorbol-13-acetate),经分析后,其分子量为hresimsm/z667.34515[m+na]+(calcdforc36h52o10na,667.34527);旋光度为[α]d25:+10.44±1.45(c0.1667,chcl3);紫外光谱为uv(meoh)λmax(logε):289(2.79),249(2.83)nm;红外光谱为ir(neat)νmax:3392,2925,2851,1710,1632,1455,1375,1261,1024,802,755cm-1;其核磁共振氢谱如图11所示,其核磁共振碳谱则如图12所示。
有关上述佛波酯化合物v(12-deoxyphorbol13-decanoate),经分析后,其分子量为hresimsm/z525.31921[m+na]+(calcdforc30h46o6na,525.31921);旋光度为[α]d25:+8.55±0.63(c0.200,chcl3);紫外光谱为uv(meoh)λmax(logε):325(0.14),249(1.31)nm;红外光谱为ir(neat)νmax:3392,2925,2356,1710,1629,1335,1155cm-1;其核磁共振氢谱如图13所示,其核磁共振碳谱则如图14所示。
有关上述佛波酯化合物vi(12-deoxyphorbol13-octanoate),经分析后,其分子量为475[m+h]+(calcdforc28h43o6);旋光度为[α]d25:+4.75±1.27(c0.200,chcl3);紫外光谱为uv(meoh)λmax(logε):311(0.01),250(2.85)nm;红外光谱ir(neat)νmax:3377,2922,2858,1710,1625,1332,1018cm-1;其核磁共振氢谱如图15所示。
另,在本说明书和申请专利范围中,提供的化学式名称应涵盖其所有光学异构物和立体异构物,因此,所有此等异构物均包括在本发明范围内。
而为研究试验本发明沉香树籽萃取物抗过敏的效率及活性分析,本发明进行下列实验:
细胞培养:本发明取得由黏膜肥大细胞分离出来的大鼠嗜碱性细胞株(rbl-2h3)。细胞生长于添加了10%胎牛血清(fbs)、100u/ml青霉素和100μg/ml链霉素的dulbecco改良式eagle(dmem)培养基的10公分细胞培养皿中,在培养箱中设37℃、空气含5%二氧化碳的条件下培养。
样品准备:将经上述沉香树籽萃取物制备方法所制备出的沉香树籽萃取物,如:乙醇萃取物(etoh)、正丁醇划分层(buoh)、水划分层(water)、乙酸乙酯划分层(etoac)、正己烷划分层(hexane)、甲醇划分层(meoh)及经分离的am4划分层、am4-4次划分层、am4-4-7子划分层、am4-4-8子划分层及am4-4-9子划分层等物质作为样品;而其中该am4-4-9子划分层的物质即属新佛波酯化合物i。
细胞存活率试验:细胞存活率试验是以显色剂噻唑蓝(mtt,四甲基偶氮唑盐(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)来测量样品对rbl-2h3肥大细胞造成的潜在毒性作用,简而言之,在96孔微量盘中接种rbl-2h3肥大细胞(2×104细胞/孔)静置过夜后,添加不同浓度的样品(10-100μg/ml)并静置24小时。在每孔加入80μl噻唑蓝溶液(0.5mg/ml)一小时后,以80μl二甲基亚砜冲洗掉甲瓒(formazan)结晶,将微量盘分析仪(multiskanascent,thermoscientific)设定在595nm波长,测量吸光度。各样品的细胞存活率是实验组(添加样品细胞)除以对照值(无添加样品细胞)的百分比来计算。对二甲基亚砜最大的耐受剂量为0.5%,且所有实验至少重复二次以上;借此,即可得如图16所示的抗过敏活性结果表。
以卡西霉素a23187或抗原诱导的β-葡萄糖醛酸酶去颗粒试验:以卡西霉素a23187和抗原诱导rbl-2h3肥大细胞去颗粒的程度,是由β-葡萄糖醛酸酶释放试验,经由下列方式改良的方法来测定:接种rbl-2h3肥大细胞(2×104cells/well)在96孔微量盘和rbl-2h3肥大细胞(3×104cells/well)在48孔微量盘中,分别供给卡西霉素a23187诱导实验和抗原诱导实验所用,在细胞中加入各种浓度的样品,静置20小时;使用迪皮质醇(10nm)作为正对照组。在抗原诱导实验中,细胞首先以抗-二硝基苯酚ige单克隆抗体(anti-dinitrophenolige,anti-dnpige)(5μg/ml)被动高敏至少2小时,将细胞以预热的台罗德氏缓冲液(135mm氯化钠,5mm氯化钾,1.8mm氯化钙,1.0mm氯化镁,5.6mm葡萄糖,20mm4-羟乙基呱嗪乙磺酸,ph7.4)彻底冲洗后,各别以台罗德氏缓冲液配制的钙离子载体a23187(卡西霉素,1μm)或抗原二硝基苯-胎牛血清共轭物(100ng/ml)刺激一小时。为测量β-葡萄糖醛酸酶释放的总量,将未受刺激的细胞以0.5%的tritonx-100溶液裂解,或者不进行处理使细胞自发性的释放β-葡萄糖醛酸酶;分装上清液(50μl)与等量的1μm聚氮-乙酰葡萄糖胺(抗原)配制于0.1m柠檬酸盐缓冲液(ph4.5)中,用作释放β-葡萄糖醛酸酶的基底。在37℃下培养1小时后,加入100μl的终止缓冲液(0.1mna2/nahco3,ph10.0)猝灭反应。将微量盘分析仪(multiskanascent,thermoscientific)设定在405nm波长,测量吸光度;β-葡萄糖醛酸酶释放的抑制百分比是实验组除以对照值(未处理细胞)的百分比来计算;对二甲基亚砜最大的耐受剂量为0.5%,且所有实验重复三次;借此,即可得如图16所示的抗过敏活性结果表。
β-葡萄糖醛酸酶的酵素活性影响:为测试样品是否可能直接影响酵素活性,因此进行以下试验,将含有细胞悬浮液(2×106cells)的台罗德氏缓冲液(2ml)以超音波震荡5分钟后进行离心,将上清液以8ml台罗德氏缓冲液稀释成酵素溶液;取该酵素溶液(45μl)和样品溶液(5μl)于96孔微量盘中,依照前述方式(materialsandmethods3.6)测量酵素活性,所有实验重复三次以上;借此,即可得如图16所示的抗过敏活性结果表。
样品诱导的β-葡萄糖醛酸酶直接去颗粒试验:在rbl-2h3肥大细胞中,由样品引发的β-葡萄糖醛酸酶的释放量是以改良过的β-葡萄糖醛酸酶释放实验来决定;简单地说,将rbl-2h3肥大细胞(4×104cells/well)接种于48孔微量盘中,加入样品后静置10小时。将台罗德氏缓冲液加入5.6mm葡萄糖、2mg/ml牛血清白蛋白(bsa)和2mm谷氨酸以制备样品和细胞所用。50μl的上清液转移至96孔微量盘,依照前述方式(materialsandmethods3.6)测量β-葡萄糖醛酸酶的释放量,卡西霉素a23187(1μm)做为正对照组,所有实验进行重复三次以上;借此,即可得如图16所示的抗过敏活性结果表。
人类嗜中性粒细胞的备制:从健康成年志愿者(20~30岁)的静脉血液,以ficoll-hypaque聚蔗糖泛影葡胺分层液密度梯度离心法、低渗裂解红血球以及葡聚醣沉淀等标准方法,分离出人类嗜中性粒细胞;纯化的嗜中性粒细胞,经过台盼兰排除法测定后,仍有超过98%嗜中性粒细胞存活可用,将细胞悬浮于ph7.4的无钙离子hank’s缓冲盐溶液(hbss)中,保持在4℃的情况下备用。
抑制超氧阴离子生成试验与弹性蛋白酶释放的抑制试验:嗜中性粒细胞超氧阴离子的生成,是以超氧化物歧化酶(sod)抑制细胞色素还原法来测定,而嗜苯胺蓝颗粒的去颗粒反应则是经由弹性蛋白酶释放测定方法来测定;借此,即可得如图17所示的抑制率结果表。
细胞毒杀试验:细胞毒杀试验是依据过去文献的方法来进行的,将人类肝癌细胞株hepg2(1×104cells)、人类肺癌细胞株a549(5×103cells)以及人类乳腺癌细胞株mda-mb231(1×104cells)等三种癌细胞株接种于96孔微量盘中,各别加入浓度20μg/ml的沉香树籽样品;静置72小时后,将培养盘去除培养基并在每个孔中加入100μl噻唑蓝显色剂溶液(0.5mg/ml),并在37℃下培养一小时;以二甲基亚砜(100μl)冲洗掉甲瓒(formazan)结晶,将微量盘分析仪(multiskanascent,thermoscientific)设定在595nm波长,测量吸光度;阿霉素作为正对造组;借此,即可得如图18所示的细胞毒性筛选结果。
借由上述实验的试验结果,可得如图16所示的卡西霉素a23187与抗原诱导的β-葡萄糖醛酸酶释放实验(抗过敏活性)试验结果,及图17所示抗过敏活性试验(在人类嗜中性粒细胞fmlp/cb诱导超氧阴离子的产生与弹性蛋白酶的释放的抑制作用)结果;另外,在佛波酯丰集的am4划分层和佛波酯化合物i对无添加刺激剂的肥大细胞rbl-2h3的去颗粒活性试验中,在肥大细胞rbl-2h3中,施予am4(10μg/ml)和佛波酯化合物i(10μg/ml)后静置10小时,以添加葡萄糖、牛血清白蛋白(bsa)和谷氨酸的台罗德氏缓冲液作为培养基,卡西霉素a23187(1μm)作为阳性控制组,则可得如图19所示的去颗粒活性试验结果。
接着,由图16所示的沉香树籽萃取物、划分层以及佛波酯化合物i的抗过敏活性结果可知,其沉香树籽的乙醇萃取物(etoh)于以卡西霉素a23187与抗原诱导的β-葡萄糖醛酸酶释放实验(抗过敏作用分析)中,结果分别为ic50值:0.92和3.9μg/ml;而为阐明实验样品的抗过敏活性是来自于抑制β-葡萄糖醛酸酶的释放,而不是来自于直接抑制β-葡萄糖醛酸酶活性所造成的假阳性结果,其分离出β-葡萄糖醛酸酶并与活性样品进行测试,结果显示没有样品会抑制β-葡萄糖醛酸酶的酵素活性;而因该甲醇划分层(meoh)具有最佳的抗过敏活性(以卡西霉素a23187与抗原诱导的β-葡萄糖醛酸酶释放实验中,结果分别为ic50值:0.0089和0.069μg/ml),因此,进一步将该划分层以硅胶管柱层析进行分离,得到六个划分层am1~am6;其中,am4划分层在肥大细胞中以卡西霉素a23187诱导β-葡萄糖醛酸酶的抑制结果为ic50值:0.0034μg/ml,而以抗原诱导的诱导β-葡萄糖醛酸酶的抑制结果为ic50值:0.0065μg/ml,因此该am4划分层具有最显著的抗过敏活性。
而由图17所示的抗发炎试验结果可知,沉香树籽的乙醇萃取物(etoh)对于超氧阴离子的产生与弹性蛋白酶的释放分别有90.1%和85.3%的抑制效果;而除了沉香树籽萃取物的水划分层以外,其余的划分层均具有显著的抗过敏和抗发炎活性。
而由图18可知,在对人类肝癌细胞株hepg2、人类肺癌细胞株a549以及人类乳腺癌细胞株mda-mb231等进行细胞毒杀试验中,仅有一些沉香树籽萃取的划分层,在浓度为20μg/ml时具有细胞毒杀活性,正丁醇划分层(buoh)对人类肺癌细胞株a549具有57.1%的毒杀效果,前述的am4划分层对人类肺癌细胞株a549和人类乳腺癌细胞株mda-mb231各别具有56.5%和79.3%的致死率,而另一个am6划分层对人类乳腺癌细胞株mda-mb231具有56.0%的毒杀效果;同时,由于沉香树籽对于rbl-2h3肥大细胞的弱毒性,使得具抗过敏活性的am4划分层的治疗指数达到28000(如图16所示)。为了进一步排除am4划分层直接造成肥大细胞活化的可能性,针对am4划分层本身引发肥大细胞去颗粒(β-葡萄糖醛酸酶释放)的能力进行研究,结果显示,与控制组相比的下,am4划分层的施予不会引起显著的去颗粒作用,即am4划分层的施予不会导致β-葡萄糖醛酸酶释放(如图16所示)。
特别的是,由图16可知,该am4-4次划分层(其对以卡西霉素a23187与抗原诱导的β-葡萄糖醛酸酶释放的抑制结果,ic50值分别为4.8×10-5μg/ml和6.8×10-4μg/ml,而治疗指数分别为1477328和103776)分离出活性最佳的am4-4-8子划分层(其对以卡西霉素a23187与抗原诱导的β-葡萄糖醛酸酶释放的抑制结果,ic50值分别为7.6×10-6μg/ml和8.0×10-5μg/ml,而治疗指数分别为9645374和9645374)以及一个新的佛波酯化合物i,其对以卡西霉素a23187与抗原诱导的β-葡萄糖醛酸酶释放的抑制结果,ic50值分别为0.0017μm和0.011μm,而治疗指数分别为71538和10550。
因此,由上述试验可知,本发明的新佛波酯化合物i确具有可有效抑制过敏的活性,实可应用于制备抗过敏药物的用途;同理,该含有佛波酯化合物i的am4-4-9子划分层则同样具有抑制过敏的活性,亦可应用于制备抗过敏药物的用途,因此,同样含有丰富佛波酯的am4-3-13、am4-4-3及am4-4-7子划分层则亦同样具有抑制过敏的活性;综上而言,本发明沉香树籽的萃取物及划分层可制备抗过敏用途的药物,且具有显著的抑制效果,实可应用于抗过敏的用途;尤其,本发明是利用沉香树籽来制备佛波酯化合物,其不仅有别于现有以沉香树茎干的来制备抗发炎药物的技术手段,且取得方便、简单,亦不致影响沉香树的生长,实可为具高度新颖性与进步性的发明;另本发明经由对沉香树籽萃取后并获得四种新佛波酯化合物,实为难能可贵的发明。
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,凡是依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
综上所述,本发明在结构设计、使用实用性及成本效益上,完全符合产业发展所需,且所揭示的结构亦是具有前所未有的创新构造,具有新颖性、创造性、实用性,符合有关发明专利要件的规定,故依法提起申请。
- 还没有人留言评论。精彩留言会获得点赞!