用于图像引导治疗规划的自动解剖结构描绘的制作方法
本申请是2010年03月02日提交的申请号为201080015576.5、名称为“用于图像引导治疗规划的自动解剖结构描绘”的发明专利申请的分案申请。
本申请在医学成像系统方面尤其具有实用性。但是,要认识到,所描述的技术也可以应用到其他类型的成像系统、其他治疗规划系统和/或其他医学应用中。
背景技术:
对解剖结构的描绘是诸如放射治疗规划(rtp)等的治疗规划中的先决条件。rtp中通常使用的主要成像模态是计算机断层摄影(ct)。最近,将磁共振成像(mri)用于rtp得到了关注,因为与ct相比这一模态提供了更好的软组织对比度。
当前可以在市面上得到用于mr检查的自动扫描规划系统。这样的系统的一个示例是philipssmartexamtm,其中,采集低分辨率侦察图像,执行患者特异性解剖界标的自动识别,基于所识别的界标以及由先前的采集记录的界标和取向信息估计诊断扫描中的切片的取向。
无论是在ct还是在mri中,自动解剖结构描绘都是一项具有挑战性的任务。ct图像一般不提供良好的软组织对比度,从而难以得到可靠的器官边界判别。与ct相比,mr数据显示出了好得多的软组织分化,并且,在治疗规划中,mr数据的使用有利于实现对目标以及某些应用中的关键结构的更加精确的描绘。但是,由于所使用的各种不同的对比度导致了不可复现的灰度值分布,mri数据的自动分割也很困难。
在本领域中存在未满足的对这样的系统和方法的需求,即,其促进图像引导治疗规划中的解剖结构的描绘、使用解剖界标来传递用于治疗规划的描绘等,从而克服了上述缺陷。
技术实现要素:
根据一个方面,一种对患者解剖特征进行描绘以限定用于图像引导治疗规划的患者图像中的轮廓的系统包括处理器,所述处理器从成像设备接收患者体内的解剖结构的初始图像,并检测初始图像中的解剖界标。此外,所述处理器还将所检测到的解剖界标的位置与参考轮廓中对应于解剖结构的参考界标进行比较,将所检测到的解剖界标映射至参考界标,并基于经映射的界标对将参考轮廓调整成患者空间内的经调整的轮廓。所述处理器还使用所述经调整的轮廓调整所述患者图像中的解剖结构的轮廓,将经调整的患者图像存储至存储器,并向治疗规划部件提供所述经调整的患者图像。
根据另一方面,一种对患者解剖特征进行描绘以限定用于图像引导治疗规划的患者图像中的轮廓的方法包括检测初始图像中的解剖界标,将所检测到的解剖界标的位置与参考轮廓中对应于解剖结构的参考界标进行比较。所述方法还包括将所检测到的解剖界标映射至参考界标,并基于经映射的界标对将所述参考轮廓调整成患者空间内的经调整的轮廓。此外,所述方法还包括使用所述经调整的轮廓调整所述患者图像中的解剖结构的轮廓,以及至少部分基于经调整的患者图像生成治疗计划。
根据另一方面,一种为患者生成放射治疗计划的方法包括使用磁共振成像(mri)设备和计算机断层摄影(ct)扫描器中的至少一个生成低分辨率图像以及检测低分辨率图像中的解剖结构上的界标。所述方法还包括将所检测到界标映射至存储器中存储的参考轮廓中的参考界标,并利用样条内插或近似来调整参考轮廓,以利用经映射的界标拟合解剖结构的轮廓。此外,所述方法包括将经调整的参考轮廓应用至解剖结构的高分辨率图像,以调整所述高分辨率图像,并至少部分基于经调整的高分辨率图像生成放射治疗计划。
根据另一方面,一种对患者解剖特征进行描绘以限定用于图像引导治疗规划的患者图像中的轮廓的装置,其包括:用于检测初始图像中的解剖界标的模块;用于将所检测到的解剖界标的位置与参考轮廓中对应于所述解剖结构的参考界标进行比较的模块;用于将所检测到的解剖界标映射至所述参考界标的模块;用于基于经映射的界标对将所述参考轮廓调整成患者空间内的经调整的轮廓的模块;用于使用所述经调整的轮廓调整所述患者图像中的所述解剖结构的轮廓的模块;以及用于至少部分基于经调整的患者图像生成治疗计划的模块。
一个优点在于提高用于治疗规划的图像质量。
另一个优点在于缩短了图像适配时间。
在阅读并理解了下述详细说明的情况下,本领域技术人员将认识到本创新的更多优点。
附图说明
附图的作用仅在于对各个方面进行图示,而不应被解释为构成限制。
图1示出了促进将轮廓或描绘从医学图像传播至用于治疗规划的高分辨率图像的系统;
图2示出了使用mri设备生成的脑部图像的自动描绘的屏幕快照,可以在显示器上将其显示给用户;
图3示出了使用mri设备生成的脑部图像的自动描绘的另一屏幕快照,可以在显示器上将其显示给用户;
图4示出了根据本文描述的一个或多个方面对患者解剖结构进行描绘以限定用于图像引导患者治疗的患者图像中的轮廓的方法;
图5示出了示例性医院系统,其包括多个成像设备,例如mr成像设备、ct扫描器、核(例如pet或spect)扫描器等,所述成像设备生成成像数据,由独立的或共享的重建处理器重建所述成像数据以生成3d图像表示。
具体实施方式
根据本文介绍的各种特征,描述了促进图像引导治疗规划中的解剖结构的描绘的系统和方法。所描述的框架基于由扫描规划软件(例如philipssmartexamtmmr扫描规划系统)自动识别的患者特异性界标。使用这些界标以支持自动解剖结构描绘以及自适应治疗规划背景下的描绘的传播。
类似地,通过检测低剂量侦察扫描中的可复现界标来执行自动ct扫描规划。使用所检测到的侦察图像中的界标以通过产生接近的初始化来对自动分割算法加以引导,并且还通过基于界标的非刚性配准来将描绘传播至后续图像。
本文描述的系统和方法解决了为治疗规划提供可复现的解剖点界标的问题。例如,诸如philipssmartexamtm的自动扫描规划算法通常对3d标准化低分辨率侦察图像进行操作,并且能够可靠地识别具有可复现的解剖点界标的形式的目标解剖结构。因而,不管对比度如何,由侦察图像获得的有关下层解剖结构的空间信息被传递到了全分辨率扫描,并被用于支持自动描绘。
图1示出了促进将轮廓或描绘从医学图像传播至用于治疗规划的高分辨率图像的系统10。例如,可以结合smartexamtm启用的mr扫描器将系统10与一个或多个放射治疗规划工作站一起采用。而且,可以将传播轮廓或治疗计划的方法与在3d低剂量ct侦察图像中具有对应界标的ct图像一起使用。根据其他特征,系统10采用了多模态系统(例如,组合的ct-mr以及与诸如正电子发射断层摄影(pet)扫描器、单光子发射计算机断层摄影(spect扫描器)等的核成像系统组合的mr和/或ct。
系统10包括耦合至工作站16、处理器18和存储器20的mri设备12和ct扫描器14中的一者和两者。所述处理器可以是工作站16的部分,或者可以是与多个工作站共享的资源。所述存储器存储用于执行各种任务以及执行本文描述的各种方法的计算机可执行指令,而所述处理器执行所述指令。
在一个实施例中,ct扫描器14生成3d低剂量侦察图像22,处理器18自动检测低剂量侦察图像中的可复现界标组24。将所检测到的界标输出(例如,使用医学数字成像通信(dicom)数据交换协议26等)至处理器,从而与存储在存储器内的用于一个或多个轮廓的已知界标28进行比较。所述处理器执行比较算法30,以对所检测到的界标和已知界标进行比较,并从存储在存储器内的图表集32中检索一个或多个体轮廓。所述处理器使用所检测到的界标对所述轮廓进行转换,由此通过将所检测到的界标映射至用于所述轮廓的已知界标而对一个或多个预生成的轮廓进行调整。例如,所述处理器确定将引航图像界标24转换至覆盖图表集界标28的位置的转换。可以对图表集轮廓应用所确定的这一转换的反演,以将其转换为患者空间内的经调整的轮廓34。
在另一实施例中,mri设备12生成低分辨率侦察图像22,处理器18自动检测低分辨率侦察图像中的可复现的界标组24。将所检测到的界标输出(例如,使用dicom数据交换协议26等)至处理器,从而与存储在存储器内的用于一个或多个轮廓的已知软组织界标33进行比较。所述处理器执行比较算法30,以对所检测到的界标24和已知界标28进行比较,并从存储在存储器内的图表集32中检索一个或多个体轮廓。所述处理器使用所检测到的界标24对所述图表集轮廓进行转换,由此通过将所检测到的界标映射至用于所述轮廓的已知界标而将一个或多个预生成的图表集轮廓调整成经调整的轮廓34。
在任一方案(例如,ct或mri)中,将图表集转换至从低剂量侦察图像导出的新的患者特异性数据集。也就是说,处理器执行转换,以将经调整的轮廓34移动到用于rtp的高分辨率图像36。此外,在同一患者的后续图像中使用经调整的轮廓和描绘,以便监测治疗进展并促进自适应治疗规划。
在一个实施例中,处理器18采用一个或多个薄板样条38以对轮廓进行转换,但是所描述的系统和方法不限于此。在f.l.bookstein:principalwarps:thin-platesplinesandthedecompositionofdeformations.ieeetrans.pattern.anal.machintell.11:567-586,1989中描述了薄板样条技术的示例。
在另一实施例中,工作站16包括显示器40,在所描述的方法和过程的各个阶段,在所述显示器上将低分辨率图像22、高分辨率图像36、所检测到的界标24、已知界标28、图表集32中的轮廓和/或经调整的轮廓34中的一个或多个呈现给用户。此外,所述工作站还包括输入设备42(例如,鼠标、键盘、方向触控板、指示笔等),用户通过所述输入设备将数据和/或指令输入至工作站,对界标进行调整,等等。
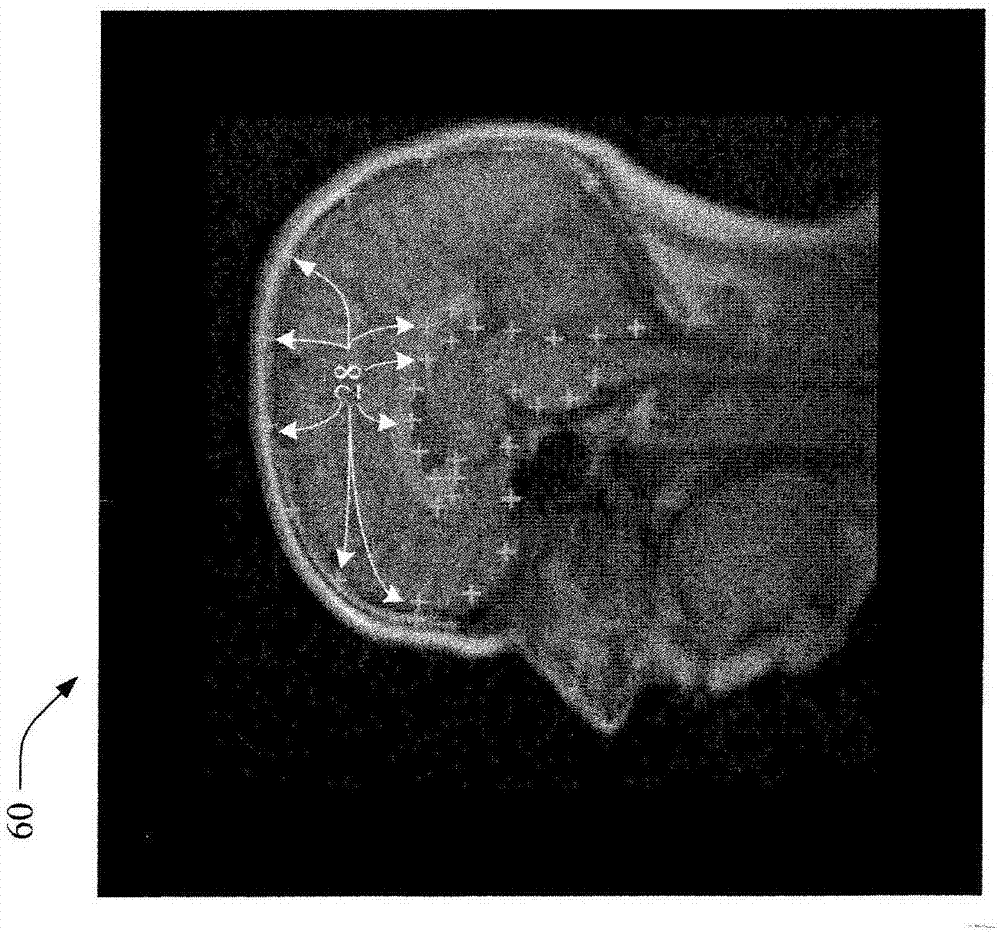
继续参考图1,图2和图3分别示出了使用mri设备生成的脑部图像的自动描绘的屏幕快照60和70,可以在显示器40上将其显示给用户。图2示出了多个已知或参考界标28,图3示出了多个检测到的界标24。例如,采用图1的系统10以支持对有风险的结构的描绘,以及自动将来自原始数据集的完整描绘传播至后续图像。
如在young等人:automatedplanningofmrineuroscans.proc.ofspiemedicalimaging,sandiego,ca,usa(2006)61441m–1–61441m–8中讨论的,可将诸如smartexamtm的解剖结构识别软件用于很多型号的philipsmr扫描器中的脑部检查。作为所述解剖结构识别软件的输出,识别或检测可复现的解剖界标组24。可以使用标准的dicom数据交换协议26输出所述界标的位置,并且所述界标的位置可以被放射治疗规划工作站16的解剖结构描绘模块(未示出)或者任何独立的自动描绘软件所使用。
根据一个实施例,用户手动描绘参考数据集中的感兴趣结构,对于所述感兴趣结构而言,可以得到界标位置。之后,例如,使用薄板样条等将这些已知界标28与特定患者数据集中的检测界标24进行配准。将所得到的转换应用于参考数据集中的解剖结构,从而将其传递至患者数据集(例如,高分辨率患者图像等当中的)。用户可以使用其他的自动方法获得提高的精确度,或者对所传递的描绘进行手动微调以将其拟合至患者图像。
在相关实施例中,在自适应放射治疗规划的背景下将所述描绘传播至同一患者的后续图像。再一次,将原始数据集中的检测界标24与参考数据集中的已知界标28进行配准,并将所得到的转换应用于原始患者图像中的可用描绘。由于在这种情况下存在少得多的解剖结构可变性,因而在通过界标给定感兴趣区域的最佳覆盖范围的情况下所述方法只需要最少的手动调整。
图4示出了根据本文描述的一个或多个方面对患者解剖结构进行描绘以限定用于图像引导患者治疗的患者图像中的轮廓的方法。在80中,生成患者或患者局部的低分辨率图像。在一个实施例中,所述图像是低剂量ct图像。在另一实施例中,所述图像是低分辨率mr图像。在82中,检测患者图像中的界标。在84中,输出检测界标24(例如,使用dicom数据传输协议26等),并将其与解剖结构的预生成图表集32中的用于轮廓的已知界标26进行比较。如果初始患者图像是低剂量ct图像,那么将所检测到的界标与已知的硬结构(例如,骨骼等)界标进行比较。如果初始患者图像是低分辨率mr图像,那么将所检测到的界标与软组织参考界标进行比较。
在86中,从参考轮廓的图表集检索包括参考界标的参考轮廓,并通过将参考界标28映射至检测界标24而将参考轮廓调整(例如,使其翘曲、形态化(morphed)、适形)至患者图像。可以将经调整的轮廓存储到存储器中,以供以后调用。在88中,对经调整的轮廓进行转换(例如,使用薄板样条或一些其他适当的内插技术),以拟合高分辨率患者图像,所述高分辨率患者图像适于在例如放射治疗规划程序的治疗规划程序中使用。此外,用户可以使用已知技术对经适配的轮廓进行微调。
要认识到,可以使用任何成像模态生成所述高分辨率图像,例如使用ct、mri、正电子发射断层摄影(pet)、单光子发射计算机断层摄影(spect)、x射线、上述选项的变体等。在这样的方案当中,处理器提供具有用于映射至检测界标的模态特异性界标的轮廓。图表集32兼备硬结构界标、软组织界标、pet界标、spect界标、x射线界标等,因而ct、mr、pet、spect、x射线以及其他图像和界标中的任何一者或全部均能够映射至图表集轮廓或者与其配准。
在另一实施例中,除了参考轮廓的图表集之外或者作为其的替代,在第一成像会话期间获得患者的多个初始界标。之后,将初始界标用于后续成像会话中的比较,以评估治疗进展等。
参考图5,示例性医院系统150可以包括多个成像设备,例如mr成像设备12、ct扫描器14、核(例如pet或spect)扫描器151、上述选项的组合(例如,多模态系统)等,所述成像设备生成成像数据,由独立的或者共享的重建处理器152重建所述成像数据以生成3d图像表示。通过网络154将图像表示传送至中央存储器156或本地存储器158。
在与网络连接的工作站16处,操作者使用用户接口170以将选定项目(例如,低分辨率3d图像或轮廓等)移动至中央存储器156和本地存储器158或者在中央存储器156和本地存储器158之间移动选定项目。视频处理器166在显示器40的第一视口1721内显示选定项目。在第二视口1722内显示患者图像(例如,由mr成像器12、ct扫描器14和核扫描器151之一生成的高分辨率图像)。第三视口1723可以显示经调整的轮廓和高分辨率图像的重叠。例如,可以允许用户将在患者的低分辨率(例如,ct或mr)图像中检测到的界标配准至从图表集中选出的参考轮廓中的参考界标,从而使参考轮廓适形于患者解剖结构。例如,操作者通过接口170选择参考轮廓中对应于低分辨率图像中的检测界标的参考界标(例如,使用鼠标、指示笔或其他适当的用户输入设备)。或者,可以通过由处理器18和/或166执行的存储在存储器20中的程序使参考界标核检测界标自动对准。之后,用户接口170中的处理器18(图1)执行翘曲或形态化算法,以利用对准的界标使参考轮廓的形状适形于患者解剖结构的形状。此外,处理器18执行转换(例如,使用薄板样条或一些其他适当的内插技术),以将经调整或适形的轮廓映射至患者的高分辨率图像。
一旦所述高分辨率图像包含了经调整的轮廓的信息,就将其提供给治疗规划部件180,以用于治疗规划(例如,放射治疗规划、超声治疗规划、物理治疗规划、近距治疗规划、高强度聚焦超声(hifu)、mri引导治疗、粒子束规划、消融规划等)。任选地,将治疗设备182耦合至治疗规划设备180,以执行由其生成的一个或多个治疗计划。
在另一实施例中,视口1723中显示的重叠是可调整的,以设置低分辨率图像和/或轮廓相对于高分辨率图像的权重,反之亦然。例如,可以调整滑动杆或旋钮(未示出)以改变视口1721和1722中的图像的权重,所述滑动杆或旋钮可以是机械的或呈现在显示器168上并利用输入设备进行操纵。在一个示例中,操作者可以将视口1723中的图像,从纯粹高分辨率图像数据(视口1722中所示的),经过高分辨率和低分辨率图像数据的多个和/或连续组合,调整成纯粹低分辨率图像数据(视口1721中所示的)。例如,可以采取离散或连续的方式将高分辨率图像数据与低分辨率图像数据的比值从0:1调整到1:0。作为另一选项,可以以灰度级显示高分辨率图像数据,并且使低分辨率图像数据着色,反之亦然。
一旦用户向中央存储器156下载和/或安装了图表集或轮廓库,就可以通过网络访问所述图表集,以促进向高分辨率图像的轮廓调整转换,以及本文所述的其他方面。根据这一示例,多个工作站或用户接口可以根据特定患者或各种治疗规划程序的成像会话的需要而访问轮廓库或图表集。
- 还没有人留言评论。精彩留言会获得点赞!