一种碘代氟硼二吡咯高负载率纳米棒的制备及应用的制作方法
本发明属于纳米材料制备和生物医学领域,具体涉及一种碘代氟硼二吡咯高负载率纳米棒的制备及应用。
背景技术:
α-乳白蛋白(简称α-la)是由123个氨基酸组成的,是一种结构紧实的球蛋白,在其二级结构中大约有26%为α-螺旋,14%为β-折叠,其它60%为无序结构。通过酶解后的乳白蛋白,会存在显著的两亲性肽链,由此可知酶解后的两亲性肽链可以作为两亲性单体聚集形成胶束。另一方面,α-乳白蛋白有四个二硫键,通过打破二硫键能够得到游离的巯基,进而在多肽分子间交错形成新的二硫键,可以提高胶束作为药物载体的稳定性。
新型光敏剂碘代氟硼二吡咯因为具有高消光系数,高单线态氧产生率、高稳定性等优点被广泛关注,被视作一种理想的光动力治疗剂。但碘代氟硼二吡咯分子疏水性的特性阻碍了其在生物医学上的进一步应用。因此,本发明试图利用la肽链的两亲性和能形成胶束的特性,对疏水性的光敏剂bodipy-2i进行组装转相,发展一种具有高负载率且光动力治疗效果显著的bodipy-2i-la纳米棒。
技术实现要素:
本发明的目的在于提供一种碘代氟硼二吡咯高负载率纳米棒的制备及应用。本发明所制得bodipy-2i-la纳米棒可以实现对疏水性光敏剂bodipy-2i的高负载,在光照作用下产生高的单线态氧产生率,并在肿瘤部位受ph及gsh双重响应药物释放特性等优点,可作为一种优良的光动力治疗剂。
为实现上述目的,本发明采用如下技术方案:
一种碘代氟硼二吡咯高负载率纳米棒的制备方法:首先由α-乳白蛋白(α-la)经酶水解成两亲性的肽链,然后加入dtt将肽链上的二硫键切断形成裸露的巯基,疏水性的光敏剂bodipy-2i通过疏水作用力和两亲性乳白蛋白肽链的疏水端自组装,形成bodipy-2i-la纳米棒,然后通入氧气氧化,使巯基重新错位交联,使纳米棒更加稳定。
更具体的,所述的制备方法包括如下步骤:
(1)α-la两亲性肽链的合成:
将一定量的乳白蛋白溶解在pbs溶液中,加入蛋白水解酶,在室温条件下反应并对所得产物进行离心、过滤后,获得酶解后的乳白蛋白两亲性肽链材料;再经二硫苏糖醇处理将肽链上的二硫键切断形成裸露的巯基,制得反应液;
(2)bodipy-2i-la纳米棒的合成:
将bodipy-2i分子分散在四氢呋喃溶液中,加入步骤(1)制得的反应液中,搅拌,静置一定时间后,产物经离心、洗涤处理,获得bodipy-2i-la纳米棒;
(3)将bodipy-2i-la纳米棒重新分散于去离子水中,然后往溶液中通氧气,使二硫键重新交联,得到更稳定的交联化的bodipy-2i-la纳米棒。
步骤(1)中α-乳白蛋白与酶的反应质量比是25:1。
步骤(2)中bodipy-2i与α-la的质量比是0.04:1~1:1,最优选比例是0.2:1。
步骤(2)中反应液与thf的体积比为10:1~5:1,最优选比例是10:1。
步骤(2)中bodipy-2i与la搅拌时间是10min,搅拌速度是1000rpm,然后静置反应12h。
步骤(3)中通氧气氧化时间是30min。
一种如上所述的制备方法制得的碘代氟硼二吡咯高负载率纳米棒,其直径为50±5nm,表面带负电,极易分散于水溶液中;bodipy-2i在纳米棒中的负载率随bodipy-2i与la的反应质量比不同而变化,其中,bodipy-2i在纳米棒中的最高负载率可达到97%;与自由的bodipy-2i分子相比,bodipy-2i-la纳米棒的单线态氧产生率更高。
一种如上所述的光敏剂碘代氟硼二吡咯高负载率纳米棒的应用:在ph≤6、gsh浓度为10mm的双重刺激下,bodipy-2i-la纳米棒解离释放出bodipy-2i,并在一定的光照作用下产生单线态氧,实现光动力治疗应用。
与其他光动力诊疗剂体系相比,本发明的显著优点在于:
(1)本发明的bodipy-2i-la纳米棒制备方法简单,条件温和可控;对光敏剂bodipy-2i的负载率可高达97%,可有效降低治疗过程中药物载体的使用剂量,达到减少副作用的目的;
(2)本发明的bodipy-2i-la纳米棒具有针对低ph和高gsh双重刺激响应特性;在光照下,与自由的bodipy-2i分子相比,可产生较高浓度的单线态氧,从而可以高效的抑制癌细胞;
(3)本发明所述的bodipy-2i-la纳米棒生物相容性好,易于在肿瘤环境内解离,是可降解型药物载体。
附图说明
图1为bodipy-2i-la纳米棒的tem表征图;
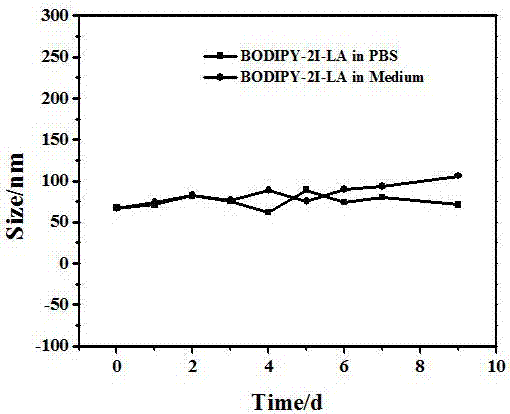
图2为实施例1制备的bodipy-2i-la纳米棒分别在pbs和培养基中的粒径变化图;横坐标为时间,纵坐标为粒径尺寸;
图3为按照bodipy-2i和la不同的质量比合成的bodipy-2i-la纳米棒在体外的单线态氧产生率变化图;横坐标为时间,纵坐标为单线态氧产生率(用i/i0来评估,i为初始单线态氧捕获剂dpbf在410nm处紫外吸收值,i0为不同时间点单线态氧捕获剂dpbf在410nm处紫外吸收值);
图4为bodipy-2i和la按照0.2:1的质量比合成的bodipy-2i-la纳米棒以及不同对照组的体外单线态氧产生率变化图;横坐标为时间,纵坐标为单线态氧产生率(用i/i0来评估,i为初始单线态氧捕获剂dpbf在410nm处紫外吸收值,i0为不同时间点单线态氧捕获剂dpbf在410nm处紫外吸收值);
图5为实施例1制备的bodipy-2i-la纳米棒在不同条件下对bodipy-2i的释放图;横坐标为释放时间,纵坐标为释放百分率;
图6为考察不同浓度的bodipy-2i-la纳米棒的生物相亲性;横坐标为bodipy-2i-la浓度,纵坐标为细胞存活率;
图7为考察不同组纳米棒在未经光照及光照后的细胞抑制图;横坐标为不同样品组,纵坐标为细胞存活率。
具体实施方式
下面以具体实施示例对本发明的技术方案做进一步说明,但是不能以此限制本发明的范围。
实施例1
一种制备具有高负载率新型光敏剂的纳米棒的方法,具体步骤为:
1)α-乳白蛋白两亲性多肽链的合成:
取6mgα-乳白蛋白溶解于200μl,ph=7.5,75mmtris-hcl缓冲液中,再加入12μl,0.3u/ml蛋白水解酶,用1ml注射器吸取溶液,于0.22μm聚醚砜针头式过滤器过滤溶液一次,于50℃水浴中加热20min,离心后取上清液,冷冻干燥,所得产物重新分散在ph=7.5,75mmtris-hcl缓冲液中,从而得到两亲性的多肽链溶液;
2)dtt处理:
取52μl、1mg/ml二硫苏糖醇(dtt),将其加入步骤1)所得α-乳白蛋白的两亲性多肽链溶液中,1000rpm搅拌10min,使肽链上的二硫键切断形成裸露的巯基,从而获得处理液;
3)bodipy-2i-la纳米棒的自组装:
将bodipy-2i分散于5mlthf中,加入步骤2)制得的0.5mg/mlα-乳白蛋白两亲性多肽链中,其中bodipy-2i与la的质量比是0.2:1,室温搅拌10min,静置12h,离心处理后,将沉淀重新分散于去离子水中,通氧气处理30min,得到bodipy-2i-la纳米棒溶液。
实施例2
一种制备具有高负载率新型光敏剂的纳米棒的方法,具体步骤为:
1)α-乳白蛋白两亲性多肽链的合成:
取6mgα-乳白蛋白溶解于200μl,ph=7.5,75mmtris-hcl缓冲液中,再加入12μl,0.3u/ml蛋白水解酶,用1ml注射器吸取溶液,于0.22μm聚醚砜针头式过滤器过滤溶液一次,于50℃水浴中加热20min,离心后取上清液,冷冻干燥,所得产物重新分散在ph=7.5,75mmtris-hcl缓冲液中,从而得到两亲性的多肽链溶液;
2)dtt处理:
取52μl、1mg/ml二硫苏糖醇(dtt),将其加入步骤1)所得α-乳白蛋白的两亲性多肽链溶液中,1000rpm搅拌10min,使肽链上的二硫键切断形成裸露的巯基,从而获得处理液;
3)bodipy-2i-la纳米棒的自组装:
将bodipy-2i分散于5mlthf中,加入步骤2)制得的0.5mg/mlα-乳白蛋白两亲性多肽链中,其中bodipy-2i与la的质量比从0.04:1、0.1:1、0.6:1和1:1混合,室温搅拌10min,静置12h,离心处理后,将沉淀重新分散于去离子水中,通氧气处理30min,得到bodipy-2i-la纳米棒溶液。
实施例3
bodipy-2i-la-rgd纳米棒的合成:
将实施例1制备的bodipy-2i-la纳米棒溶液加入rgd分子,bodipy-2i-la纳米棒和rgd的质量比为2:1,反应12h后,离心得到bodipy-2i-la-rgd纳米棒。
性能检测:
1、将实施例1的溶液滴在铜网上,晾干后进行tem表征,结果如图1所示。从图1可看出,bodipy-2i-la复合颗粒的形貌为单分散的纳米棒状,直径为50±5nm,纳米棒长短不一。
2、分别取bodipy-2i-la纳米棒加入至pbs(ph=7.4)缓冲溶液和培养液中,配制浓度为1mg/ml,混匀,分别于不同时间取样测粒径变化,结果如图2所示。zeta粒度分析仪数据表明:在pbs缓冲液和细胞培养液中,在9天内,bodipy-2i-la纳米棒的粒径都在80nm左右,由此可知bodipy-2i-la纳米棒在一定时间内,不会溶胀及解离,热稳定性良好;另一方面,由于la肽链还起到分散剂作用,因此由zeta粒度分析仪得到的光动力学粒径尺寸会比tem数据偏大。
3、将bodipy-2i和la按不同的质量比从0.04:1、0.1:1、0.2:1、0.6:1、1:1合成bodipy-2i-la纳米棒,通过荧光数据分析得bodipy-2i在纳米棒中的负载率分别为64%、77%、83%、96%、97%。考察负载率不同时,纳米棒在光照下单线态氧变化情况。取不同质量比合成的纳米棒(所含bodipy-2i的浓度均为5μm)与100μmdpbf均匀混合,加水至总体积为1ml,用波长为518nm,功率为80mw/cm2的灯照射,在不同的时间点测单线态氧捕获剂dpbf在410nm处紫外吸收值。测试结果如图3所示,当纳米棒中bodipy-2i浓度相同时(均为5μm),不同负载率的bodipy-2i-la纳米棒单线态氧产生率几乎相同,没有太大差别,这进一步说明bodipy-2i在la形成的胶束棒中是以自由分散的单分子形式存在,而不是聚集状态,因而高负载率不影响单线态氧的产生。同时也说明可以通过提高bodipy-2i的负载率,减少bodipy-2i-la纳米棒载体的使用剂量,达到降低副作用的目的。
4、取0.014mg/ml纳米棒(所含bodipy-2i浓度为5μm)与100μmdpbf均匀混合,加水至总体积为1ml。用波长为518nm,功率为80mw/cm2的灯照射,在不同的时间点测单线态氧捕获剂dpbf在410nm处紫外吸收值;对照组为dpbf及单独bodipy-2i+dpbf,用同样实验条件照射,测试结果如图4所示。i/i0的值越小,表明单线态氧产生率越高。由图可知bodipy-2i-la纳米棒比自由的bodipy-2i分子单线态氧产生率显著提高,这主要是因为bodipy-2i分子是疏水性,在水溶液中易因为π-π堆积作用聚集成二聚体或低聚体,从而影响单线态氧产生;而bodipy-2i分子在纳米棒中是单分散而不是聚集状态存在,且bodipy-2i-la纳米棒在水中分散性很好,在光照作用下缓慢的释放bodipy-2i,从而有比较高的单线态氧产生。
5、将实施例1制得的bodipy-2i-la纳米棒分散到不同条件下(ph=7.4,ph=7.4+10mmgsh,ph=5.0,ph=5.0+10mmgsh)的溶液中,置于37℃下避光保存,于不同的时间点取样离心。利用紫外分光光度计测528nm处紫外吸收值,并根据bodipy-2i标准曲线计算分析不同条件下的释放情况。如图5所示,在ph=7.4缓冲液中,bodipy-2i的释放百分比仅为18%,说明经过通氧交联后的bodipy-2i-la纳米棒很稳定;而在ph=7.4+10mmgsh条件下,bodipy-2i的释放量达到71.5%,说明高gsh可以有效解离bodipy-2i-la纳米棒结构,从而释放出bodipy-2i。另一方面,在ph=5.0缓冲液中,bodipy-2i的释放百分比为60%,说明酸性也可以诱导bodipy-2i-la纳米棒结构发生解离;而在ph=5.0+10mmgsh条件下,bodipy-2i的释放百分比增加到88%,说明经低ph及高gsh的双重刺激,bodipy-2i-la纳米棒结构迅速发生解离,从而释放出更多的bodipy-2i。
6、用hela细胞作为目标细胞考察bodipy-2i-la纳米棒的生物相亲性实验:取已消化成单分散的hela细胞悬浊液用培养液稀释,以100μl/孔的密度接种到96孔板,每孔的细胞个数控制约为105个。将96孔板置于37℃,5%co2的培养箱中培养24h后,移去培养液,加入含有不同浓度bodipy-2i-la纳米棒培养液,每组设置4个重复孔。继续培养4h后,移去培养液,用pbs缓冲液(ph=7.4)清洗两次,加入100μl培养液继续培养20h后,每孔分别加入10μl浓度为5mg/ml的mtt,继续孵育4h,小心移去培养液,加入150μldmso,37oc培养15min,震荡均匀后,在酶标仪上测490nm处的吸收值,计算细胞存活率。图6显示当bodipy-2i-la纳米棒的浓度在12μg/ml以内,其生物相亲性较好,达到80%以上,因此可以选择bodipy-2i-la纳米棒的浓度为1-12μg/ml,作光动力治疗剂应用。
7、用hela细胞作为目标细胞考察bodipy-2i-la纳米棒的光动力抑制效果。取已消化成单分散的hela细胞悬浊液用培养液稀释,以100μl/孔的密度接种到96孔板,每孔的细胞个数控制约为105个,每组设置4个复孔作为重复组。将96孔板置于37℃,5%co2的培养箱中培养24h后,移去孔中培养液,分别加入1、control2、freebodipy-2i3、bodipy-2i-la4、bodipy-2i-la-rgd组,其中bodipy-2i的浓度均为1.0μg/ml,bodipy-2i-la纳米棒的浓度均为6.0μg/ml,另外设如上四组加波长为528nm,80mw/cm2照射10min。培养4h后,移去培养液,用pbs缓冲液清洗两次,加入100μl培养液继续培养20h后,每孔分别加入10μl浓度为5mg/ml的mtt,继续孵育4h,移去培养液,加入150μldmso,37℃培养15min,振荡均匀后,在酶标仪上测490nm处的吸收值,计算细胞存活率。从图7可以看出光照组比无光照组的细胞死亡率要高,bodipy-2i-la组经光照后对hela细胞的抑制率为70%,有靶分子修饰的bodipy-2i-la-rgd组对细胞的抑制率可达到85%,说明该体系可以有效的用于肿瘤细胞的光动力治疗。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!