组织修复用组合物、组织修复用材料及其制造方法与流程
本发明涉及一种组织修复用组合物、使用该组织修复用组合物的组织修复用材料的制造方法以及组织修复用材料,更为具体地,涉及一种不要求化学交联的安全的、生物材料适用性优秀的组织修复用组合物及其制造方法。
背景技术:
随着社会结构的变化和人口的增加,烧伤、褥疮、外伤、整形、难治性溃疡、糖尿病性皮肤坏死等患者数量也逐渐增加,与此对应的皮肤损伤的治疗方法也在发展。例如,如果由于烧伤造成体表面积60%以上损伤,一般会由于败血症而死亡。但是,最近由于人造皮肤的发展,可以防止水分损失和感染,从而大大减小死亡率。并且,随着对美容的关心越来越高,美容用填充物被广泛使用。
现在,透明质酸填充物作为最广泛使用的填充物,占有世界填充物市场的90%以上,但是具有体内的半衰期在1到3日以内而持续性非常低,并且在生物体内非常快速发生再吸收的问题。对此,如韩国公开专利第10-2004-0072008号的将透明质酸和交联物质互相交联连接从而延长再吸收时间的产品正在被销售。但是,现实中有报告指出这种交联产品也会由于交联物质的毒性而产生问题。
对此,为了将透明质酸用作填充物,需要通过化学交联方法增加持续性并且制造为具有与皮肤类似的粘弹性的形态,但是,这种化学交联所使用的bdde(1,4-butanedioldiglycidylether)是具有毒性的致癌物质,因此需要在化学反应后通过透析工艺去除残留物,这种透析工艺一般需要一周左右的长时间,所以具有产生工艺费用增加、微生物污染导致的产品废弃、残留物检测而导致的产品废弃等的损失的问题。
虽然也大量开发了使用在生物体内可分解的高分子的组织修复用产品,作为使用现有的生物适用性高分子的填充物剂型,被开发为将不溶于水的高分子加工为微小尺寸的粒子之后通过具有粘度的介质(media)进行分散的剂型。使用了将20μm至50μm的聚乳酸(polylacticacid,pla)粒子分散到羧甲基化纤维素(carboxymethylcellulose,cmc)水溶液的剂型或者将20μm至50μm的聚已酸内酯(polycaprolactone,pcl)粒子分散到cmc和甘油水溶液的剂型,但是,这样具有在注射时微小尺寸的粒子堵住针头的手术上的不便,和粒子分散不均匀从而达不到一致的组织修复效果的问题。
因此,目前迫切需要开发一种无需担心由于化学交联工艺等产生毒性,并且确保适合组织修复用生物材料的功能性、物性和安全性的组织修复用产品。
技术实现要素:
本发明一方面提供一种包括交联聚谷氨酸的组织修复用组合物。
本发明的另一方面提供一种使用本发明的组织修复用组合物制造组织修复用材料的方法。
本发明的另一方面还提供一种由本发明的组织修复用组合物得到的组织修复用材料。
根据本发明的一方面,提供一种将聚谷氨酸盐以0.5至25重量%溶解到溶剂中的组织修复用组合物。
根据本发明的另一方面,提供一种组织修复用材料的制造方法,所述组织修复用材料的制造方法包括向本发明的组织修复用组合物照射放射线的步骤。
根据本发明的另一方面,还提供一种组织修复用材料,所述组织修复用材料包括向本发明的组织修复用组合物照射放射线而得到的聚谷氨酸盐交联体。
根据本发明可以得到一种不要求化学交联的安全性优秀的,不需要单独的灭菌工艺的,并且确保了适合组织修复用生物材料的功能性、物性和安全性的组织修复用产品。
附图说明
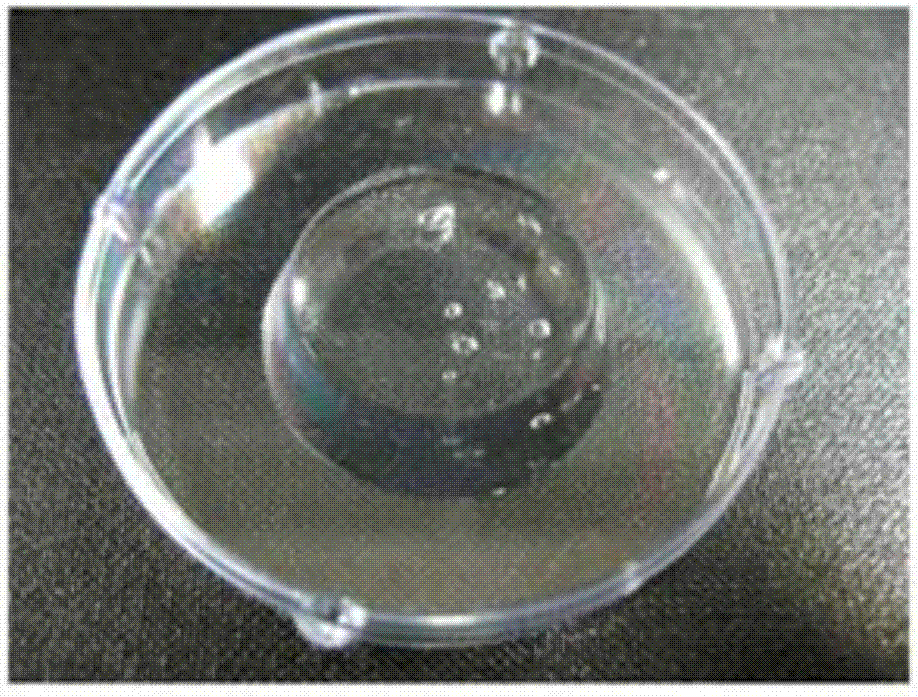
图1示出了根据实施例1制造的聚谷氨酸盐交联体的图片。
图2示出了根据实施例2制造的聚谷氨酸盐交联体的图片。
图3示出了根据实施例3制造的聚谷氨酸盐交联体的图片。
图4示出了根据实施例4制造的聚谷氨酸盐交联体的图片。
图5示出了根据实施例7制造的聚谷氨酸盐交联体的图片。
图6示出了根据实施例8制造的聚谷氨酸盐交联体的图片。
图7示出了根据实施例9制造的聚谷氨酸盐交联体的图片。
图8示出了根据实施例11制造的聚谷氨酸盐交联体的图片。
图9示出了根据实施例13制造的聚谷氨酸盐交联体的图片。
图10示出了根据比较例1制造的聚谷氨酸盐交联体的图片。
图11示出了通过细泡毒性检测(wst)得到的安全性确认结果图。
图12示出了根据实施例14、17、19、20、21和23制造的聚谷氨酸盐交联体的图片。
具体实施方式
以下,参考附图说明本发明的优选实施例。但是,本发明的实施方式可以进行多种变形,因此本发明的范围并不限于以下说明的方式。
根据本发明可以得到一种不要求化学交联的安全性优秀的,不需要单独的灭菌工艺的,并且确保了适合组织修复用生物材料的功能性、物性和安全性的组织修复用材料,以及该材料的制造方法和用于该材料的组织修复用组合物。
本发明的“组织修复用”包括用作美容用填充物、整形用假体等,但是不限于此,只要可以用作生物材料,其用途就不受特别限制。
另外,本发明的“组织修复用组合物”表示制造组织修复用材料时作为原料物质使用的聚谷氨酸盐的放射线交联之前的形态,“组织修复用材料”表示可用作生物材料的照射放射线之后的聚谷氨酸盐交联体的形态。
本发明提供一种将聚谷氨酸盐以0.5至25重量%,优选以1至20重量%的浓度溶解到溶剂中的组织修复用组合物。本发明的组织修复用组合物可以通过照射放射线制造为组织修复用材料,聚谷氨酸盐的浓度小于0.5重量%时,聚谷氨酸盐的浓度过低从而发生通过放射线不能进行交联的问题,超过25重量%时,聚谷氨酸盐的浓度过高从而发生不能全部溶解等问题。
此时,本发明的聚谷氨酸优选使用γ(伽马)-聚谷氨酸。
本发明中可使用的所述溶剂优选为从水、食盐水、乙醇和甲醇组成的组中选择的至少一个。但是,对此不进行特别限制,也可以使用能确保生物适用性和安全性的其它溶液。
所述聚谷氨酸盐的分子量(mw)为10至3000kda,优选为50至2000kda,所述分子量小于10kda时,具有从微生物生产困难的问题,超过3000kda时,还是会有商业性生产困难的问题,但是不限于此。
所述聚谷氨酸盐优选为从钠盐、钾盐、钙盐、铵盐和锌盐组成的组中选择的至少一种盐形态,例如可以使用聚谷氨酸钠盐。
而且,本发明的所述组织修复用组合物包括0.1至1重量%的,优选包括0.1至0.5重量%的、更为优选地包括0.2至0.4重量%的其它添加剂,所述其它添加剂只要是在用作组织修复用时对体内具有有利效果的成分的话,就不受限制,例如可以为从保湿剂、抗氧化剂、美白剂、胶原蛋白合成剂、皱纹改善剂、抗老化剂和防晒剂组成的组中选择的至少一个。
所述其它添加剂小于0.1重量%时,其它添加剂所要的效果趋于微弱,超过1重量%时,随后照射放射线时会有不容易形成交联的问题。
更为具体地,所述其它添加剂可以为从透明质酸、海带多糖、多糖类、皂素、胶原蛋白、多元醇类、氨基酸类、糖类、油类、天然提取物和发酵物组成的组中选择的至少一个,但是不限于此。
并且,根据本发明的另一方面,提供一种组织修复用材料的制造方法,包括向如上所述的本发明的组织修复用组合物照射放射线的步骤。
根据本发明的组织修复用材料的制造方法制造的组织修复用材料不要求使用化学交联剂,也不需要在制造后进行单独的灭菌工艺。
所述放射线优选为从伽马射线、电子射线和x射线组成的组中选择的一个,例如可以通过伽马射线进行。
所述照射放射线的步骤以1至500kgy的射线剂量进行,优选地以3至100kgy的射线剂量进行,更优选地以4至30kgy的射线剂量进行。
所述射线剂量小于1kgy时,具有自由基的产量不足,聚谷氨酸内的交联结合不充分,从而导致交联体无法形成的问题,当超过500kgy时,交联结合过度地形成,形成g’和g”过高的坚固的交联体,从而在用作组织修复用材料时,有物性不适当的问题。此时,所述g’系数(storagemodulus)以储能模量表示弹性,所述g”系数(lossmodulus)以损耗模量表示粘性,都使用pa或dyne/cm2单位。
而且,根据本发明的另一方面,还提供一种组织修复用材料,包括向如上所述的本发明的组织修复用组合物照射放射线而得到的聚谷氨酸盐交联体。
更详细地,本发明的组织修复用材料包括0.5至25重量%的聚谷氨酸盐交联体,该聚谷氨酸盐交联体通过向聚谷氨酸盐以0.5至25重量%溶解到溶剂中的组织修复用组合物照射1至500kgy的射线剂量的放射线而得到,其储能模量g’为0.1至1500pa。
所述本发明的组织修复用材料为所得到的聚谷氨酸盐交联体本身或包括该聚谷氨酸盐交联体的材料,此时,所述聚谷氨酸盐交联体的g’为0.1至1500pa,优选为5至1000pa,更优选为10至500pa。所述g’小于0.1pa时,由于g’非常低而没有抗变形能力,所以在用作组织修复用生物材料时有物性不足的问题,超过1500pa时,g’非常高的另一方面g”不足,从而有由于变僵硬(stiffness)而不适合用作生物材料的问题。
并且,所述聚谷氨酸盐交联体根据下列公式1的tanδ值为0.05至40,更优选为0.1至0.5.
tanδ=g”(损耗模量)/g’(储能模量)【公式1】
此时,所述tanδ表示g’(储能模量)除g”(损耗模量)的值,g”/g’的比叫做损耗比(tanδ),δ表示变形和应力相位值。因此,损耗比大的具有粘性性质,损耗比小的具有弹性性质。
本发明的所述聚谷氨酸盐交联体的tanδ值小于0.05时,g’过高,所以有坚固僵硬的问题,当超过40时,由于g”过高而没有抗变形能力,所以有不适合用作组织修复用生物材料的问题。
本发明的组织修复用材料可以是用作美容用填充物、整形用假体或者美容用填充物和整形用假体的组合,但不限于此,只要可用作生物材料,就不受特别限制。
根据本发明可以得到一种不要求化学交联的安全性优秀的,不需要单独的灭菌工艺的,并且确保了适合组织修复用生物材料的功能性、物性和安全性的组织修复用材料。
以下,通过具体实施例对本发明进行详细说明。下列实施例只是用于帮助理解本发明的实施例,本发明的范围并不限于此。
实施例
1.组织修复用生物材料的制造
(1)包括聚谷氨酸盐的组织修复用组合物
将干燥γ-聚谷氨酸钠盐(bioleaders,bacillussubtilis)放入烧杯并加入pbs(phosphatebuffersaline)后,用搅拌机以200rpm搅拌2小时使其溶解。分别用伽马射线、x射线、电子射线照射所述水溶液从而得到γ-聚谷氨酸盐。
此时,所述照射伽马射线使用射线源为11.1pbq的60co伽马射线照射设备(ir-70gammairradiator,mdsnordion,canada),从10kgy/h改变射线剂量进行照射,照射电子射线和x射线使用10mevlinac-electronaccelerator(modelelv-4,1mev,eb-tech,daegeon,korea),同时,束电流的大小为1ma,电子射线和x射线的能量分别为10mev和7.5mev。
照射后确认总吸收射线剂量时使用丙氨酸剂量计(alaninedosimeter;cericcerousdosimeter,brukerinstruments,germany),射线剂量测量(dosimetry)系统按照国际原子能机构(iaea)的规定进行标准化后使用,并且总吸收射线剂量的误差为5%以内。
此时,所用的所述γ-聚谷氨酸盐的分子量、浓度、照射放射线的射线剂量分别如下列表1所示。
【表1】
其结果,所得到的材料中的部分如图1至图10所示。照射放射线的射线剂量变大时,交联结合趋于变多并且含水率趋于变低,与实施例13相关的图9的左侧是不进入交联体内部的剩余溶液。
(2)包括聚谷氨酸盐和其它添加剂的组织修复用组合物
将干燥γ-聚谷氨酸钠盐(bioleaders,bacillussubtilis)放入烧杯并加入pbs(phosphatebuffersaline)后,用搅拌机以200rpm搅拌2小时使其溶解。此时,将下表1-1所示的种类和含量的其它添加剂溶解到pbs后与γ-聚谷氨酸钠盐溶液混合。分别用16kgy的电子射线照射所述水溶液从而得到γ-聚谷氨酸盐。
此时,照射所述电子射线时使用10mevlinac-electronaccelerator(modelelv-4,1mev,eb-tech,daegeon,korea),同时,束电流的大小为1ma,电子射线的能量为10mev。
照射后确认总吸收射线剂量时使用丙氨酸剂量计(alaninedosimeter;cericcerousdosimeter,brukerinstruments,germany),射线剂量测量(dosimetry)系统按照国际原子能机构(iaea)的规定进行标准化后使用,并且总吸收射线剂量的误差为5%以内。
【表1-1】
通过上表1-1的结果可以确认的是,即使追加添加了诸如透明质酸(hyaluronicacid)、海带多糖(laminarin)、l-苏氨酸(threonin)和皂素(saponin)的添加剂,也可以顺利地进行交联。
2.确认组织修复用生物材料的物性
对于通过上述1.(组织修复用生物材料的制造)得到的各γ-聚谷氨酸盐交联体,使用流变仪(aresrheometer)进行动态扫描测试(dynamictimesweeptest)来确认g’(storagemodulus,储能模量)、g”(lossmodulus,损耗模量)和tanδ的物性特性,结果如表2所示。
此时,所述tanδ根据下列公式1计算。
tanδ=g”(损耗模量)/g’(储能模量)【公式1】
【表2】
通过上表2可以确认的是,随着照射放射线的射线剂量和γ-聚谷氨酸的浓度的增加,交联体的g’和g”增加。这是因为通过照射放射线生成自由基,从而γ-聚谷氨酸的交联结合增加并且与浓度成比例。
因此,根据本发明,可以改变γ-聚谷氨酸的浓度和照射放射线的射线剂量从而可调整g’和g”,并且从需要低粘弹性的生物材料乃至需要高粘弹性的生物材料都可以根据需要得到。
当实施例1的照射放射线的射线剂量过低时,自由基的生成量不足,在γ-聚谷氨酸内不产生交联结合从而不能形成交联体,进而如图10所示地无法形成凝胶体,相反地,照射的射线剂量超过本发明的范围而过度增加时,γ-聚谷氨酸的交联结合过度发生而形成g’和g”过高的坚固的交联体,从而降低保湿能力。
另外,在比较例2中可以确认的是,由于γ-聚谷氨酸为无法进一步溶解的饱和浓度,所以有γ-聚谷氨酸粉末残留。
并且,在没有照射放射线的比较例3和4中可以确认出一种完全没有γ-聚谷氨酸的交联结合的例如水的溶液状态。
3.组织修复用生物材料的毒理学安全性确认测试
为了了解在上述1.中制造的实施例1至7的γ-聚谷氨酸交联体的毒理学安全性评价结果,用wst分析测试方法测量3t3-l1细胞的生存率。
另外,为了进行比较,分别处理比较例4中所得的产物、细胞培养液(比较例5)和广泛用作生物修复用材料的玻尿酸(juvederm)(比较例6)从而进行毒性评价,其结果在图11中示出。图11中的图表数值是以所述比较例5为基准的百分比值。
此时,3t3-l1细胞的培养是在向dmem(dulbecco’smodificationofeaglesmedium)添加10%bcs(bovinecalfserum)和1%的青霉素/链霉素下进行的。为了wst分析测试,在96孔板(96-wellplate)接种,并在37℃和5%co2的培养器中使细胞粘着24小时,之后处理上述1.中制造的γ-聚谷氨酸交联体,并且再培养24小时。然后,向各个孔(well)分别放入10μl的wst溶液培养2个小时,接着使用elisa板检测仪(platereader)在570nm下测量吸光度。
在图11中可以确认的是,根据本发明得到的生物修复材料与目前商业上所消费的透明质酸填充物(juvederm)在毒理学方面一样地安全。因此,可用于组织修复用生物材料和假体用生物材料。
虽然上面对本发明的实施例进行了相信的说明,但是本发明的权利范围并不局限于此,本领域的普通技术人员应该清楚地理解在不脱离权利要求书中记载的本发明的技术思想的范围内可以实现多样的修改及变形。
- 还没有人留言评论。精彩留言会获得点赞!