口服大麻药物的制造方法、组合物和医学应用与流程
本申请要求2016年5月6日提交的序列号为62/332,513以及2017年3月3日提交的序列号为62/467,060的美国临时申请的权益,它们的全部内容均以引用方式并入本文。
本文公开了用于生产大麻提取物的制造方法和装置。
背景技术:
现有技术业已公开了一些大麻的提取方法。然而,保留所有大麻化合物的同时去除副产物的大麻提取方法已证明是难以开发的。
技术实现要素:
在一些实施例中,提供了一种提取大麻的方法。该方法包括(i)向反应腔室中加入任何量的至少一种大麻植物或任何量的至少一种大麻植物的提取物,(ii)可选地通过从所述腔室中的所述量的至少一种大麻植物中提取大麻来生产大麻提取物,(iii)从所述反应腔室中去除由提取大麻产生的副产物,和(iv)将源自大麻的化合物保留在腔室中,其中,所述反应腔室包括过滤器,所述过滤器包括孔,所述孔允许从反应腔室中去除来自大麻提取过程的副产物并且阻止从腔室中去除来自大麻的化合物。
在一些实施例中,提供了一种用于提取大麻的装置,其包括气密性容器,该气密性容器包括(i)内表面、(ii)外表面、(iii)反应腔室以及(iv)尺寸排阻过滤器,其中,所述尺寸排阻过滤器包括具有足够尺寸的孔,以允许提取过程和脱羧过程的副产物通过过滤器但阻止源自大麻的化合物通过过滤器。
在一些实施例中,提供了一种使用本文公开的任一大麻提取设备的大麻提取方法,该方法包括以下步骤:(i)向反应腔室中加入任何量的至少一种大麻植物或任何量的至少一种大麻植物的提取物,(ii)可选地通过从腔室中的所述量的至少一种大麻植物中提取大麻来生产大麻提取物,(iii)从所述反应腔室中去除由提取大麻产生的副产物,和(iv)将源自大麻的化合物保留在所述腔室中,其中,所述反应腔室包括过滤器,所述过滤器包括孔,所述孔允许从反应腔室中去除来自大麻提取过程的副产物并且阻止从所述腔室中去除源自大麻的化合物。
在一些实施例中,提供了化合物的混合物,该混合物包括至少一种源自大麻的萜烯化合物和至少一种源自大麻的大麻素化合物。
在一些实施例中,提供了一种源自大麻的化合物的混合物,该混合物包括大麻素、含氮化合物、氨基酸、蛋白质、酶、糖蛋白、碳氢化合物、简单醇、醛、酮和酸、脂肪酸、简单酯和内酯、甾类化合物、萜烯、非大麻酚、类黄酮、维生素和色素。
在一些实施例中,提供了一种治疗方法,包括向有需要的患者施用药学上可接受量的本文公开的任一药物组合物。
在一些实施例中,提供了一种治疗方法,包括施用本文公开的任一药物组合物以治疗以下疾病中任一种或多种:恶心和呕吐、消耗综合征(艾滋)、食欲不振(表现在癌症和艾滋患者以及神经性厌食症患者中)、多发性硬化症、脊髓损伤、癫痫、疼痛、关节炎(和其他肌肉骨骼疾病)、运动障碍、青光眼、哮喘、高血压、精神障碍、阿尔茨海默病和痴呆、全身炎症、胃肠道疾病。
附图说明
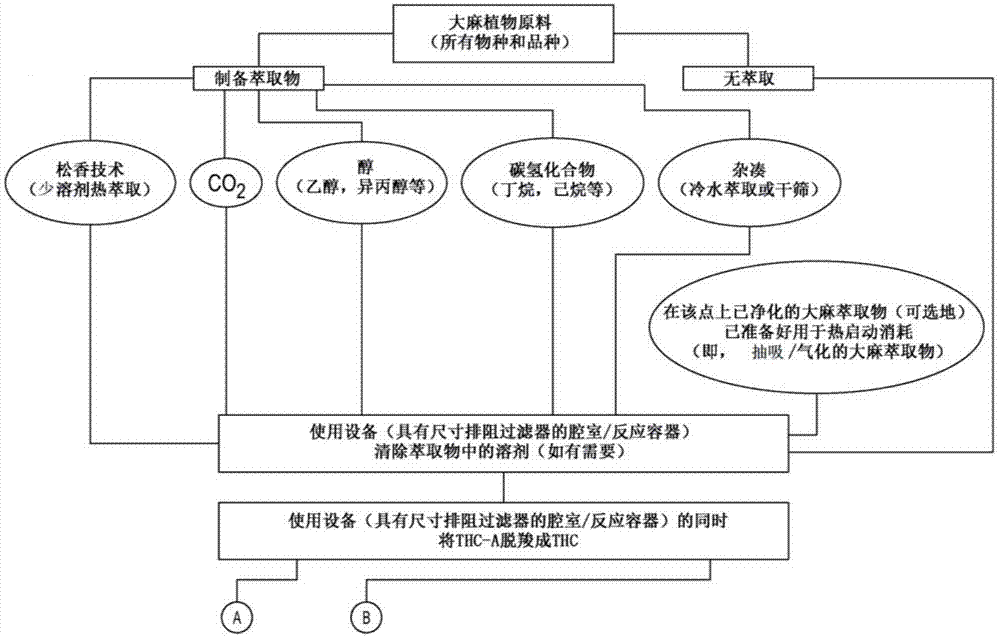
图1描绘了从大麻植物原料到最终产品(大麻制剂)的整个过程的一个实施例。
图2a描绘了大麻提取装置的一种实施例的前视图。
图2b描绘了大麻提取装置的一种实施例的侧视图。
图2c描绘了大麻提取装置的一种实施例的顶视图。
图3描绘了利用尺寸排阻过滤器的装置的一种实施例的示意图。
图4描绘了四氢大麻酚(大麻中的主要有精神活性的成分)的分子结构。
图5描绘了四氢大麻酚酸的分子结构。
图6描绘了大麻二酚的分子结构。
图7描绘了大麻二酚酸的分子结构。
图8描绘了大麻酚的分子结构。
图9描绘了大麻环萜酚的分子结构。
图10描绘了四氢次大麻酚的分子结构。
图11描绘了次大麻二酚的分子结构。
图12描绘了大麻萜酚的分子结构。
图13描绘了α-蒎烯的分子结构.
图14描绘了芳樟醇的分子结构。
图15描绘了月桂烯的分子结构.
图16描绘了β-石竹烯的分子结构。
图17描绘了柠檬烯的分子结构。
图18描绘了最终产品(大麻可食用药物和大麻注入的药物)的一种实施例的视觉展示。
图19描绘了由northwestcannabissolutions提供的的thcaps(类似屈大麻酚(marinol)的仅有thc的制剂)的大麻素分析。
图20描绘了由northwestcannabissolutions提供的thcaps(类似屈大麻酚的仅有thc的制剂)的萜烯分析。
图21描绘了harvestdirectenterprises提供的weedpillz(由完全/代表性/总大麻提取制备的口服药物制剂)的大麻素分析。
图22描绘了harvestdirectenterprises提供的weedpillz(由完全/代表性/总大麻提取制备的口服药物制剂)的萜烯分析。
图23描绘了使用尺寸排阻过滤器和盘管来浓缩萜烯、有药物价值化合物和有感官价值的化合物而生产大麻提取物的一个实施例。
图24描绘了大麻提取试验的结果,其中提取物在250°f下加热并持续1.5小时。
图25描绘了大麻提取试验的结果,其中提取物在整个提取过程期间暴露在环境温度下。
具体实施方式
本文公开了代表性/总/完全大麻制剂的制造方法、组合物和医学应用。这些代表性/总/完全大麻制剂允许“随行效应(entourageeffect)”;其中在大麻中发现的各种医学上可行的化合物(例如但不限于大麻素和萜烯)在哺乳动物内源性大麻素系统中相互作用从而产生更强的医疗效果和安全性。
在一些实施例中,通过在使用如图2a、2b和2c所示的装置分离大麻提取物,在大麻提取物净化过程和脱羧过程中实现保留这些医学上可行的化合物。这些制剂还能可选地使用表面活性剂和营养物质,以提高这些医学上可行的化合物在哺乳动物胃肠道中的生物利用度和随后的吸收。提取可来源于所有形式的大麻植物材料,包括但不限于雄性和雌性品种的火麻(cannabissativa)、印度大麻(cannabisindica)、莠草大麻(cannabisruderalis)-以及任何/所有亚种及其任何/所有杂交品种。
本文公开了一种代表性/总/完全提取,使用各种提取介质,包括但不限于:冷水提取和干筛(杂凑(hash))、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇,异丙基,甲醇),并描述了大麻和大麻中发现的任何/所有医学上可行的化合物(包括但不限于大麻素、含氮化合物、氨基酸、蛋白质、酶、糖蛋白、碳氢化合物、简单醇、醛、酮和酸、脂肪酸、简单酯和内酯、甾类化合物、萜烯、非大麻酚、类黄酮、维生素和色素)及其物种(包括但不限于火麻、印度大麻、莠草大麻-以及它们的任何/所有亚种及任何/所有杂交种以及任何/所有已建立的品系-既有雄性也有雌性品种-使用活的和干燥的大麻植物原料)的松香技术(热提取))、以及将这些提取物变成丸剂形式用于口服给药(立即和缓慢释放)的后续转化。在一些实施例中,本文公开的制剂将利用一种或多种表面活性剂/一种或多种乳化剂和营养化合物,以便提高这些口服给药的大麻丸/胶囊以及由总大麻提取而在其中发现的医学上可行的化合物在哺乳动物胃肠道内的生物利用度和随后的吸收(有效绕过肝脏的首过效应)。种类将包括但不限于:符合素食(vegan)、符合犹太教(kosher)、符合伊斯兰教(halal)、无麸质(glutenfree)、效力极强、富含cbd、低效力、非脱羧(无精神活性)、活植物材料、无过敏原、缓慢释放、低钠或无钠、已建立的大麻品系等等。
在屈大麻酚中,只利用了火麻。这完全忽略了大麻属植物的多样性和发现的独特变异性。目前的研究表明大麻属有七个亚种,包括但不限于火麻、印度大麻和莠草大麻-它们的任何/所有亚种及任何/所有杂交种和任何/所有已建立的品系。
此外,现有技术(屈大麻酚)只利用了雌性品种。目前的研究还表明,大麻hemp(大麻的雄性形式)由于其低thc和高cbd化学型而特别有医学价值。这种比例因为其低精神活性和增加的医学可行性而特别有利于医疗应用。
此外,屈大麻酚是使用thc(唯一提取物)配制的。这完全忽略了大麻和其他草本药物/制剂所表现出的随行效应,其中,次要化合物提高了主要成分的药效和安全性,同时帮助减轻其负面/不良副作用。在一些实施例中,作为代表性/总/完全的大麻提提取的结果,本文公开的方法和组合物通过包括尽可能多的这些医学上可行的化合物(主要是大麻素和萜烯)来利用随行效应。应当指出,大麻由至少545种不同的化合物组成,这些化合物跨越20个化学类别,包括大麻素、萜烯/类萜、氨基酸、含氮化合物、简单醇、醛、酮、酯、内酯和酸、脂肪酸、甾类化合物、非大麻酚、色素、类黄酮、维生素、蛋白质、酶、糖蛋白和碳氢化合物。大麻素和萜烯尤其在药用价值方面显示出巨大的潜力。
而且,现有技术只提到火麻。大麻属:包括雌性和雄性品种的火麻、印度大麻和莠草大麻(以及七个亚种)以及它们的杂交品种(包括已建立的品系),已显示含有具有精神和药物双重作用的化学化合物。
大麻
大麻属(大麻(marijuana,weed))是一种风媒雌雄异株开花植物,属于大麻科(cannabaceae)家族。目前的研究表明,大麻属有7个亚种,包括但不限于火麻(cannabissativa)、印度大麻(cannabisindica)和莠草大麻(cannabisruderalis)-它们的任何/所有亚种及任何/所有杂交种和任何/所有已建立的品系。大麻的治疗作用可以追溯到古代,大约在公元前4000年在中国种植,并被收录在本草经(pents’aoching)这一世界上最古老的药典中。大麻有三种常见的亚种:火麻(两年生)、印度大麻(一年生)和莠草大麻(变化),但共有七个亚种。目前的研究表明,已有超过3000种已确定的大麻品系。生长条件和遗传学影响发育中的植物的特性和随后的大麻成品的化学特性。
被称为大麻hemp的成熟雄性植物,含有微量大麻素成分,并通常用于制造产品和作为替代能源。大麻hemp由于其能够产生低精神活性和增强的医学可行性的低thc和高cbd化学型态而具有医学价值。
收取自成熟雌性大麻植物的花朵的特点在于具有高含量的植物大麻素并通常具有显著浓度的诸如萜烯的其它植物化学物质,这些也是药物价值所在。大麻素和萜烯是由雌性大麻植物的花萼和苞片上大量存在的腺毛分泌的。大麻干花是大麻最基本的形式。其他更有效的大麻制剂包括印度大麻制剂(hashish,通常四氢大麻酚(thc)的范围为20-65%)和大麻油(hashoil,通常thc的范围为50-90%)。
大麻含有至少545种不同的化合物,跨越20个化学类别,包括大麻素、萜烯/类萜、氨基酸、含氮化合物、简单醇、醛、酮、酯、内酯和酸、脂肪酸、甾类化合物、非大麻酚、颜料、类黄酮、维生素、蛋白质、酶、糖蛋白和碳氢化合物。特别是大麻素和萜烯在药用价值方面显示出巨大的潜力。
内源性大麻素系统
内源性大麻素系统(ecs)由两个已知的大麻素受体(cb1和cb2)、cb受体配体(2-ag和aea)以及内源性大麻素合成和降解酶faah和magl组成。其他受体,如trpv1,与cb受体密切相关,可解释所表现出的变构/协同效应。这些变构/协同作用是大麻植物中发现的各种大麻素和萜烯的直接结果。ecs参与了广泛的各种生理和病理生理过程,包括神经发育、免疫功能、炎症、食欲、新陈代谢和能量平衡、心血管功能、消化、骨骼发育和骨密度、突触可塑性和学习、疼痛、生殖、精神病、精神运动行为、记忆、苏醒/睡眠周期、以及压力和情绪状态的调节。因此,大麻素(和其他变构化合物,如萜烯)理论上可以用作任何任何上述过程受到影响的疾病的新疗法。这些疾病和不适包括但不限于:恶心和呕吐、消耗综合征(艾滋)、食欲不振(见于癌症和艾滋患者以及神经性厌食患者)、多发性硬化、脊髓损伤、癫痫、疼痛、关节炎(和其他肌肉骨骼疾病)、运动障碍、青光眼、哮喘、高血压、精神疾病、阿尔茨海默病和痴呆、全身炎症、胃肠道疾病、以及很可能更多其它疾病。
植物类大麻素(如thc和cbd)是靶向到遍布全身的大麻素受体的分子,从而为包括疼痛、恶心和炎症在内的一系列症状提供缓解。大麻中最常见的大麻素有四氢大麻酚(thc)、大麻二酚(cbd)和大麻酚(cbn)。遍布全身的大麻素受体网络就是所知的内源性大麻素系统。植物大麻素(即来源于植物的大麻素)模仿体内天然合成的大麻的内源性大麻素的作用。例如,花生四烯酸乙醇胺(anandamide)是一种内源性大麻素,在锻炼后释放,并发现是造成“跑步者兴奋”的原因。这是因为花生四烯酸乙醇胺类似于thc和cbd通过与内源性大麻素系统的相互作用而产生。
四氢大麻酚(thc)、大麻二酚(cbd)和大麻酚(cbn)
四氢大麻酚(thc)是大麻中发现的主要精神活性化合物。这种分子是迄今为止研究得最多和最了解的大麻成分。从毒理学角度来看,它是极其安全的;尽管thc被广泛使用,但没有一例过量用药的例子被归咎于thc(或整个大麻)。效果包括止痛、肌肉松弛、抗痉挛、支气管扩张剂、神经保护性抗氧化剂、止吐剂、抗胆汁淤积性黄疸的止痒剂、抗炎(效果20倍于阿司匹林,2倍于氢化可的松,另外的好处是:不抑制cox-1或cox-2)。thc诱导欣快感和食欲刺激。极高剂量会引起不利作用,如妄想、听觉和视觉的幻觉和暂时性精神病。应当指出的是,这些不利作用常常通过大麻中的植物化学物质(例如萜烯和其他较少流行的大麻素)的随行/协同作用而被抵消。thc还显示出有助于降低抽动秽语综合征的抽动症严重程度,并显示出治疗青光眼(降低眼内压)的潜力。
大麻二酚(cbd)是大麻中发现的主要大麻素中的一种并广泛被认为是医学上最重要的。cbd是非精神活性的,这意味着不像thc,cbd不会产生快感。cbd间接地刺激内源性大麻素系统,造成广泛和复杂的作用,已显示减轻thc和其他大麻素的一些负面作用,有助于随行/协同效应。效应:调节thc相关的副作用(例如,焦虑、心动过速、饥饿和镇静)、镇痛、神经保护性抗氧化剂、抗惊厥(与标准抗癫痫药物狄兰汀(dilantin)效果相当)、止吐、镇静、抗焦虑、抗精神病、抗抑郁、抗炎、抗肿瘤(阻止乳腺癌和许多其他细胞系的扩散并同时保留健康细胞),显示出有助于类风湿性关节炎,改善情绪,显示出对耐甲氧西林金黄色葡萄球菌(mrsa)的强大活性,降低中风的风险,影响认知改善的能力、减少痤疮,并作为免疫调节剂。cbd在治疗多发性硬化症、帕金森病、阿尔茨海默病、睡眠障碍、精神分裂症的精神症状和减少恐惧方面也表现出潜力。还应注意的是,许多这些疾病和病症预后很差。至少,大麻可以用来改善这些患者的生活质量。
植物大麻素(比如thc和cbd)是靶向到全身发现的大麻素受体的分子,以减轻包括疼痛、恶心和炎症等一系列症状。过高剂量的thc可引起副作用,如妄想、听觉和视觉的幻觉以及暂时性精神病。应当指出的是,这些副作用常常通过大麻中的植物化学物质(例如萜烯和其他较不主流的大麻素)的随行/协同作用而被抵消。例如,cbd已显示调节thc相关的副作用,如焦虑、心动过速、饥饿和镇静。在大麻中发现的其他植物化学物质可能具有类似的效果,这不仅会导致显著的效力增加,而且还会增加这些制剂的安全性以及减少由主要成分引起的任何负面/不利的效果。
大麻酚(cbn)是另一种主要大麻素,它显示具有非常温和的精神活性。研究表明,thc经过较长的时间并由于贮存不当的原因可以自然降解成大麻酚。效应:免疫调节,镇痛,抗惊厥,抗炎,且对耐甲氧西林金黄色葡萄球菌(mrsa)也显示出强大的活性,显示出有助于治疗烧伤,促进骨形成/生长,抑制抗癌蛋白(使化疗更有效)。cbn已显示能够增加thc的镇静作用。研究还表明,cbn可有效降低眼内压(类似于thc),使其成为治疗眼部疾病(如青光眼)的理想药物。
大麻中发现的各种大麻素中每一种都有其自己的医疗效益。研究表明,当它们共同作用并与大麻中的其他化合物(如萜烯)一起作用时,它们就能实现随行效应,其中大麻的医疗功效和安全性提高了许多倍。
萜烯
萜烯是在广泛各种植物和动物中发现的一类有机分子。这些分子以其特有的气味和味道而被人所知。在大麻中发现的不同萜烯浓度直接影响产生的味道和气味以及观察到的效果。即使小的萜烯浓度变化也会引起大麻的随行/协同效应的显著差异。
萜烯对于总体大麻体验来说是一种重要组分,不仅影响品系的味道和气味,而且影响其对精神和身体的作用。大麻中所有组分的总效应被称作“随行效应”。这个有文献记载的现象就是区分一个品系与另一个品系的所在,并且研究表明其很大程度上依赖于萜烯产生的生理效应。在大麻中已经鉴定出超过100种不同的萜烯;尽管它们没有像大麻素那么主流或被研究得那么充分,但是这些不同的分子在传递大麻的生理和精神活性作用方面是有用的。
大麻产品和施用大麻的方法
大麻食物和用于口服的大麻注入的药物通常与下列问题有关:不良的大麻味道、高卡路里含量、含麸质、含动物副产品,它们不引起随行效应,并且它们不能有效地规避肝脏首过效应。
口服给药的大麻类药物,如含有单一大麻素δ-9-四氢大麻酚的屈大麻酚,不能有效地利用在大麻植物中发现的所有医学可用的化合物。这忽略了随行效应,即一种科学证明的现象,其中在天然草本药物(如大麻)中发现的几种化合物与主要化合物(如大麻中的thc)具有协同效应。这种效应是天然草本药物(如大麻)的组分的结合的生理和精神活性特性的产物,为了最大限度地提高医疗功效和安全性。研究表明,这些协同效应导致药效提高三至四倍;这意味着代表性/总/完全的大麻提取物的效果将是唯一提取物thc的三至四倍。研究还表明,这些协同化合物有助于减轻一些主要成分(如大麻中的thc)的负面的副作用。这种多重药理效应是同行评议科学文献中公认和接受的理论。重要的是需要注意到,草本药物(如大麻)的潜在使用者在于他们往往含有次级化合物,如萜烯、类黄酮和其他大麻素,这些次级化合物与主要化合物(如thc)协同作用。
此外,屈大麻酚由芝麻籽油、thc提取物和凝胶胶囊组成。这显著限制了在大麻中发现的thc和其他医学上可行的化合物的吸收度。由于未能考虑肝脏首过效应,目前的技术未能利用已知的提高口服药物效力和功效的方法。这种疏忽导致在大麻中发现的医学上可行的化合物的功效和吸收度降低。肝脏首过效应可解释为药物在到达全身循环之前效力和浓度的丧失。在进入消化系统和肝门脉系统之后,所述药物被携带通过门静脉并进入肝脏,然后其被分布到全身。肝脏注意到这是一种药物而不是它所常见的营养物,进而把药物置于代谢路径上,从而大大降低了药物在体内的吸收。这种作用由四个主要系统介导:胃肠道酶、肠壁酶、细菌酶和肝酶。
大麻属:包括雌性和雄性品种的火麻、印度大麻和莠草大麻物种(和七个亚种)及它们的杂交品种(包括已建立的品系),已显示含有同时具有精神活性和药用效果的化学化合物。
几个世纪以来,大麻使用的主要方法是抽吸。研究表明,抽吸任何物质对呼吸系统都有明显的有害影响。此外,随着大麻成为广泛接受的药物,患者和医生都在寻求能够优化疗效、效力和持续时间而不会对患者产生任何不利影响的药物递送方法。其他形式的摄入包括:口服、栓剂、吸入器、汽化、局部、舌下以及更多。
抽吸大麻对大麻中医学上可行的成分是一种糟糕的递送系统,因为其效率低下,对患者有害,还因为其不能提供精确剂量的大麻。实际上,在大麻中发现的医学上可行的化合物中只有25-27%被吸收并输送到全身循环,使得这种方法在很大程度上低效。抽吸任何物质都会将焦油和致癌物引入呼吸道,因此对病人或使用者有害。与抽吸任何植物材料有关的焦油、一氧化碳、氨、氮的氧化物和氰化氢使它成为极差的药物输送选择。最后,抽吸并不能为患者和医生提供关于所消耗的剂量的任何合理信息。抽吸的大麻的生物利用度变化很大,取决于吸入深度、抽吸持续时间和闭气时间。这些对于成为一个可靠的药物输送系统来说有太多的变量。
抽吸大麻的一个常见的替代是口服,或食用。这种摄取方法存在三个主要缺点,本发明解决了所有这些问题。
首先,众所周知地,食用品和口服施用大麻注入的药物是低效的。这主要是由于在本发明的背景技术中详尽讨论的肝脏首过效应。实施例展示了克服这些问题的至少三种方法:(1)表面活性剂(如大豆卵磷脂)的包含有助于使混合物乳化,使活性成分分布更均匀并以更大的速率使所采用的脂质与感兴趣的医学上可行的化合物结合(引起效能、疗效和起效显著增加),(2)营养物(如醇、脂肪、蛋白质和碳水化合物)有助于“欺骗”肝脏将进入的物质识别为食物或营养物质,从而降低肝脏的首过效应的流行,和(3)多次重复加热和冷却已被证明可打破大麻素团簇并产生更有潜力和有效的最终产品。
对于食用品和大麻注入的药物的第二个缺点是起效缓慢。本发明的营养物和表面活性剂的使用确实缩短了起效时间,但并没有达到显著的程度。
第三个缺点以及来自使用大麻食用品或大麻注入的药物的使用者和患者最常见的抱怨是口味。本发明完全消除了这种抱怨,因为本发明是以胶囊的形式呈现的,因此在使用者施用时是无味的。
与大多数大麻食用品和大麻注入的药物相关的其他缺点:高卡路里含量、含有动物副产品、含有麸质、高钠、宗教饮食限制、含有食物过敏原并且它们常常忽视随行效应。关于高卡路里含量,本文实施的是低卡路里和无卡路里组合物(由于它们的大小与药物含量之比)。关于含有麸质,本文中实施的是无麸质组合物,以确保患有麸质不耐受症的患者仍然可以使用大麻注入的药物和大麻食用品。关于含高钠含量,本文实施的是无钠组合物。关于含有动物副产品,本文中实施的是素食组合物,这确保了没有动物副产品用于生产这种大麻食用品或大麻注入的药物。关于宗教饮食限制,本文中实施的是符合犹太教和符合伊斯兰教种类的各种组合物,这些组合物确保所有宗教背景的患者和使用者能够放心地使用所提供的的大麻食用品或大麻注入的药物。关于食物过敏原,本文实施的是完全不含过敏原的组合物,它们完全不含最常见的过敏原,例如但不限于花生、大豆、牛奶、鸡蛋等,从而确保食物过敏的人能够安全地使用大麻食用品和基于大麻的药物。最后,关于对随行效应的忽视,如本节之前详细描述的,本文实施的组合物是完全/总/代表性大麻提取物,其充分利用了随行效应。
在现有技术中,口服给药的基于大麻的药物,如含有单一大麻素δ-9-四氢大麻酚的屈大麻酚,不能有效地利用在大麻植物中发现的所有具有医学上可行的化合物。这忽略了随行效应,随行效应是一种科学证明的现象,其中在天然草本药物(如大麻)中发现的几种化合物与主要化合物(如大麻中的thc)协同作用。这种效应是天然草本药物(如大麻)的组分的组合的生理和精神活性特性的产物,从而最大限度地提高疗效和安全性。研究表明,这些协同效应引起三至四倍的药物疗效的提高;这意味着代表性/完全的大麻提取物的效果将是thc提取物(唯一提取物)的三至四倍。研究还表明,这些协同的化合物有助于减轻主要成分(如大麻中的thc)的一些副作用。这种多重药理效应是同行评议科学文献中公认和接受的理论。重要的是要注意到,草本药物(如大麻)的一个潜在特点是它们通常含有次要化合物,如萜烯、类黄酮和其他大麻素,这些次要化合物与主要化合物(如thc)协同作用。
而且,现有技术只提到火麻。大麻属:包括雌性和雄性品种的火麻、印度大麻和莠草大麻物种(和七个亚种)及它们的杂交品种(包括已建立的品系),已显示含有同时具有精神活性和药用效果的化学化合物。
对于口服给药,也可以通过将活性化合物与本领域众所周知的药学上可接受的载体结合来容易地配制即配(instant)组合物。这些药学上可接受的载体使得本发明实施例中的化合物被配制为片剂、丸剂、糖衣丸、胶囊、液体、凝胶、糖浆、浆液、悬浮液等,以供待治疗的患者口服摄取。口服药物制剂可通过将活性化合物与固体赋形剂结合,任选地研磨所得混合物,如有需要加入适当的助剂之后加工颗粒混合物,从而获得片剂或糖衣丸芯。合适的赋形剂尤其是填料,例如糖,包括乳糖、蔗糖、甘露醇或山梨醇;纤维素制剂,例如玉米淀粉、小麦淀粉、大米淀粉、马铃薯淀粉、明胶、黄树胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠、和/或聚乙烯吡咯烷酮(pvp)。如果需要,可以添加崩解剂,如交联聚乙烯吡咯烷酮、琼脂或海藻酸或其盐,如海藻酸钠。糖衣丸芯带有适当的涂层。为此,可使用浓缩糖溶液,其可选地含有阿拉伯树胶、滑石粉、聚乙烯吡咯烷酮、卡伯波凝胶、聚乙二醇和/或二氧化钛、漆溶液和合适的有机溶剂或溶剂混合物。染料或颜料可以添加到片剂或糖衣丸涂层中用于鉴定或表征活性化合物剂量的不同组合。为此,可使用浓缩糖溶液,其可任选地含有阿拉伯树胶、滑石粉、聚乙烯吡咯烷酮、卡伯波凝胶、聚乙二醇、和/或二氧化钛、漆溶液和合适的有机溶剂或溶剂混合物。染料或颜料可以添加到片剂或糖衣丸涂层中用于鉴定或表征活性化合物剂量的不同组合。
替代性地,所述制剂可以适合以每日一次、每周一次或每月一次给药的形式呈现;例如,活性化合物的不溶性盐可以适于提供肌肉注射制剂。本文所述的药物制剂可给药于患者自身,或以与其他活性成分混合的药物制剂形式(如联合疗法),或适合的药学上可接受的载体或一种或多种赋形剂。所应用的化合物的配制和给药技术可以在《remington′spharmaceuticalsciences》”(mackpublishingco.,easton,pa,第18版,1990)中找到。
产品的日剂量可以在很宽的范围内变化,例如,每个成人每天大约10至10000毫克。对于口服给药,制剂优选以片剂的形式提供,片剂包含约0.1、0.25、0.5、1.00、5.00、10.0、15.0、25.0、50.0、100、200、300、400、500、600、700、800、9001000、2000、3000、4000、5000、6000、7000、8000、9000或10000毫克的活性成分,以便于给待治疗的病人进行剂量的对症调整。即配药物制剂通常含有10mg到约2000mg的即配化合物,优选约50mg到约1000mg的活性成分。通常以每天大约0.002mg/kg至约150mg/kg体重的剂量水平提供有效量的即配化合物。优选地,该范围是每天大约0.02至约80mg/kg体重,特别是每天大约0.2mg/kg至约40mg/kg体重。所述化合物可按照每天约1至10次的方式给药。可以理解,基于多种因素,剂量可能因不同的人而差异很大。
随行效应
随行效应或在大麻中发现的植物化学物质(以不同比率)的组合效应,通常对于治疗用途而言相比单独的大麻素是更受欢迎的概念。单独的大麻素,如cbd,确实显示出它们自己的功效(例如,在精神分裂症的情况下),但是大麻中所有各种植物化学物质之间的相互作用为患者产生了一种更加有效和安全的药物。已知单独的thc(屈大麻酚)在患者中产生极其不利的影响,以至于一些患者停止服用该药物(厌食研究)。随行效应减轻了负面因素,凸显了正面因素。为了真正治疗疾病或微恙,可以对随行效应进行微调以满足患者的需要。
萜烯和大麻素已被证明是大麻的有益作用的主导因素。事实上,正是不同浓度的药学上可行的化合物导致了不同的品系(strains)(基因型)以及它们产生的化学型(可随生长条件而变化)。即使萜类或大麻素浓度的微小变化也可能导致大麻的随行/协同效应的显著差异。这种有文献记载的现象就是区别一个品系与另一个品系的所在,研究表明其很大程度上依赖于萜烯产生的生理效应。在大麻中已经鉴定出超过100种不同的萜烯;尽管没有像大麻素那样被深入研究,这些不同的分子在传递大麻的生理和精神活性效应方面是有用的。
在上面详述的基于溶剂的提取中,将残留溶剂从提取物中清除。在大麻提取物工业中使用的清除残留溶剂的主要方法是使用净化/真空炉/腔室。净化/真空炉通常以以下的方式操作:炉子包含架子,架子上放置有未被净化的大麻提取物的托盘。然后可以将净化/真空炉设置到各种温度和压力程序以加速清除过程,从而使这些提取物中的残留溶剂量低于由处理器/提取器操作状态所设定的极限。使用净化/真空炉/腔室所带来的主要和明显的缺点是,它们不只清除溶剂;它们还清除了其他挥发性化合物,例如萜烯(和其他具有药物/感官价值的化合物),如图19和20所示。该方法可以将大麻提取物与许多挥发性药物组分相分离,从而降低大麻提取物的总体药效和效能。
方法和装置的实施例
本文公开了大麻提取方法,其中保留了促进随行效应的这些化合物(包括但不限于大麻素、萜烯等)。在一些实施例中,图2a、2b和2c中公开的装置通过使用尺寸排阻过滤器来保留这些化合物,其中特定尺寸的化合物保留在腔室/反应容器中,而小于特定尺寸的化合物将通过尺寸排阻过滤器并离开腔室/反应容器。利用化合物之间的物理差别,可以配制出具有前所未有的质量的大麻产品,因为几乎不会损失大麻和大麻提取物中有助于其药效的化合物(有助于增强其随性效应的化合物)。
使用在大麻植物中发现的任何/所有医学上可行的化合物带来随行效应的有效利用,确保更安全和更有效的药物制剂。这些化合物激活和调节内源性大麻素系统,带来广泛不同的效果和可能的治疗应用。ecs参与了广泛多种生理和病理生理过程,包括但不限于神经发育、免疫功能、炎症、食欲、新陈代谢和能量平衡、心血管功能、消化、骨骼发育和骨密度、突触塑性与学习、疼痛、生殖、精神病、精神运动行为、记忆、苏醒/睡眠周期以及压力和情绪状态的调节。因此,大麻素(和其他变构化合物,如萜烯)理论上可以用作上述过程受到影响的任何疾病的新型疗法。这些疾病和微恙包括但不限于:恶心和呕吐、消耗综合征(艾滋)、食欲不振(在癌症和艾滋病患者以及神经性厌食症患者中出现)、多发性硬化、脊髓损伤、癫痫、疼痛、关节炎(和其他肌肉骨骼疾病)、运动障碍、青光眼、哮喘、高血压、精神障碍、痴呆、全身炎症、胃肠道疾病、急性应激障碍;情感障碍,包括抑郁症(重度抑郁症、胸腺障碍、儿童抑郁症、非典型性的抑郁症、双相障碍、躁狂和轻度躁狂)和焦虑障碍(广泛性焦虑障碍、社交焦虑障碍、恐惧症、强迫症、惊恐症、创伤后应激障碍);经前烦躁症(也称为月经前综合症);精神障碍,如短暂的精神障碍、精神分裂症、精神病性情绪障碍(抑郁和/或躁狂);注意力缺陷障碍(伴或不伴多动症);肥胖,进食障碍,如神经性厌食症和神经性贪食症;血管收缩导致的面红;可卡因和酒精成瘾;性功能障碍及相关疾病;急性和慢性疼痛综合征,如纤维肌痛、慢性下腰痛、三叉神经痛;内脏疼痛综合征,如肠易激综合征、非心胸痛、功能性消化不良、间质性膀胱炎、原发性外阴痛、尿道综合征、睾丸痛、颞下颌关节紊乱病、不典型性颜面疼痛、偏头痛和紧张性头痛;功能性躯体紊乱,例如慢性疲劳综合征;神经紊乱,包括癫痫、抽动秽语综合征、帕金森病、亨廷顿舞蹈病、阿尔茨海默病、皮层下和其他痴呆、迟发性运动障碍、rett综合征、肌萎缩性侧索硬化症等。还应注意的是,许多这些疾病和微恙的预后很差。大麻至少可以用来改善这些患者的生活质量。
本文公开的大麻提取过程的实施例包括保存大麻提取过程中的重要药物组分的使用方法和装置。(例如,参见图2a、2b、2c和3)。
在一些实施例中,在提取过程中使用大麻的所有种类或各种种类的任何组合,包括雌性和雄性中的火麻、印度大麻和莠草大麻以及它们的杂交品种(包括已建立的品系)。在一些实施例中,提供了使用图2a、2b和2c中所示的装置制备的代表性/总/完全制剂(preparation)。可以使用各种提取介质,包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇),以及大麻和其中发现的任何/所有医学上可行的化合物(包括但不限于大麻素、含氮化合物、氨基酸、蛋白质、酶、糖蛋白、碳氢化合物、简单醇、醛、酮和酸、脂肪酸、简单酯和内酯、甾类化合物、萜烯、非大麻酚、类黄酮、维生素和色素)及其物种(包括但不限于火麻、印度大麻、莠草大麻-以及它们的任何/所有亚种及任何/所有杂交品种以及任何/所有已建立的品系-既有雄性也有雌性品种-使用活的和干燥的大麻植物原料)的松香技术(热提取))、以及这些提取物变成丸剂形式用于口服给药(立即和延长释放)的后续转化。
在一些实施例中,使用一种或多种表面活性剂/一种或多种乳化剂和营养化合物,以便提高这些口服给药的大麻丸/胶囊和由总大麻提取而在其中发现的医学上可行的化合物在哺乳动物胃肠道中的生物利用度和随后的吸收(有效绕过肝脏的首过效应)。品种将包括但不限于:素食、符合犹太教、符合伊斯兰教、无麸质、效力极强、富含cbd、低效力、非脱羧(非精神活性)、活植物材料、无过敏原、延长释放、低钠或无钠、已建立的大麻品品系等。图2a、2b和2c中所示的装置可通过利用尺寸排阻过滤器来保留有药物价值的化合物(在大麻提取物净化过程和大麻/大麻提取物脱羧过程期间)。因此,该装置利用了力求保留的化合物和应被清除的化合物之间的物理差异。
以下部分提供了进一步实施例的描述。在此之后,提供了非限制性实例的描述。
提取大麻的方法的实施例
在一些实施例中,提供了大麻提取的方法。该方法包括:(i)向反应腔室中加入任何量的至少一种大麻植物或任何量的至少一种大麻植物的提取物,(ii)可选地通过从腔室中的所述量的至少一种大麻植物中提取大麻来生产大麻提取物,(iii)将提取大麻产生的副产物从反应腔室中去除,和(iv)将源自大麻的化合物保留在腔室中。所述腔室包括过滤器,所述过滤器的孔允许将提取过程中的副产物从反应腔室去除但阻止源自大麻的化合物的被去除。
任何种类的大麻,无论是目前已知的物种还是将来将要发现的物种,都可以加入到步骤(i)的反应腔室中。在给定的反应中,可以向反应腔室中添加任意数量的物种,直到包括添加大麻的所有物种。在一些实施例中,添加到反应腔室的大麻的物种包括火麻、印度大麻和莠草大麻。在一些实施例中,这些物种中的任一种被添加到反应腔室中。在一些实施例中,这些物种中的任意两种被添加到反应腔室中。在一些实施例中,所有这三个物种被添加到反应腔室中。
在一些实施例中,在提取过程中使用的大麻是活提取物。在一些实施例中,在提取过程中使用的大麻是干燥和/或固化的提取物。
在一些实施例中,在方法中使用的反应腔室是气密性反应腔室。
在一些实施例中,提取步骤(ii)包括基于溶剂的提取方法。本领域已知的任何用于提取大麻的溶剂可用于该提取步骤中。在一些实施例中,所使用的溶剂例如是异丙基、甲醇、正丙醇、丙烷、丁烷、异丁烷、甲醇和乙醇。
在一些实施例中,提取步骤(ii)不使用溶剂。在一些实施例中,提取是热提取、非加热提取、冷水提取、co2提取和松香技术提取。
在一些实施例中,提供了一种包括可选的大麻提取步骤和脱羧步骤的方法。本领域中已知的足以对大麻进行脱羧的任何温度/时间都可用于脱羧步骤。在一些实施例中,脱羧步骤包括使用酶或辅因子来催化脱羧步骤,例如脱羧酶。在一些实施例中,h2o用作脱羧反应的催化剂。在一些实施例中,脱羧步骤在惰性气体存在下进行。惰性气体可以是包括氦、氖、氩、氪、氙和氡的稀有气体中的任何一种。
在一些实施例中,大麻提取方法还包括在脱羧反应之前用惰性气体处理反应腔室的步骤。
脱羧步骤将导致co2的释放。在一些实施例中,通过使co2通过过滤器而使co2从反应腔室中释放。
在一些实施例中,在步骤(ii)中使用基于非溶剂的提取工艺。在一些实施例中,使用冷水提取。在一些实施例中,使用热提取。
在一些实施例中,提供了一种大麻提取方法,其中,在步骤(iv)中保留在腔室内的源自大麻的化合物包括大麻素。在一些实施例中,提供了一种大麻提取方法,其中,在步骤(iv)中保留在腔室内的源自大麻的化合物包括萜烯。在一些实施例中,保留在腔室中的化合物包括大麻素和萜烯。
在一些实施例中,提供了一种大麻提取方法,其中,在步骤(iv)中保留在腔室中的源自大麻的化合物包括大麻素、烯萜/类萜、氨基酸、含氮化合物、简单醇、醛、酮、酯、内酯和酸、脂肪酸、甾类化合物、非大麻酚、色素、类黄酮、维生素、蛋白质、酶、糖蛋白和碳氢化合物。保留在腔室内的化合物可以包括这些化合物中的任意一种或以多种的任何组合。
在一些实施例中,提供了一种大麻提取方法,其中,在步骤(iv)中保留在腔室内的源自大麻的化合物包括大麻中的至少545种不同的化合物。保留在腔室内的化合物可以包括所述至少545种不同化合物中的任意一种或多种的任意组合。在一些实施例中,在步骤(iv)中源自大麻的化合物包括以任意组合形式的大麻素、含氮化合物、氨基酸、蛋白质、酶、糖蛋白、碳氢化合物、简单醇、醛、酮和酸、脂肪酸、简单酯和内酯、甾类化合物、萜烯、非大麻酚、类黄酮、维生素和色素。在一些实施例中,在步骤(iv)中源自大麻的化合物包括大麻素、含氮化合物、氨基酸、蛋白质、酶、糖蛋白、碳氢化合物、简单醇、醛、酮和酸、脂肪酸、简单酯和内酯、甾类化合物、萜烯、非大麻酚、类黄酮、维生素和色素中的任意一中或多种的任意组合。
在一些实施例中,提供了一种方法,该方法包括使用各种提取流程(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇,异丙基,甲醇,正丁醇)以及松香技术(加热或未加热的加压提取))从植物原料(活体或干燥的)中提取大麻,利用任一或所有大麻物种(包括但不限于火麻、印度大麻、莠草大麻-以及任何/所有亚种及其它们的任何/所有杂交品种以及任何/所有已建立的品系-既有雄性也有雌性品种-同时使用活的和干燥的大麻植物原料)。
所得的提取物由下列化合物中的一种或多种的任意组合所组成:大麻素、萜烯、以及其中发现的任何/所有医学上可行的化合物(包括但不限于大麻素、含氮化合物、氨基酸、蛋白质、酶、糖蛋白、碳氢化合物、简单醇、醛、酮和酸、脂肪酸、简单酯和内酯、甾类化合物、萜烯、非大麻酚、类黄酮、维生素和颜料)。
在一些实施例中,提供了一种在脱羧过程和提取净化过程中保留萜烯(以及其他有药物和感官价值的化合物)的方法。在一些实施例中,该方法利用腔室/反应容器,该腔室/反应容器利用尺寸排阻过滤器(基于分子尺寸的过滤)作为保留萜烯(和其他有药物/感官价值的化合物)并同时允许co2(大麻素脱羧(例如大麻素的活化)的主要副产物)和残余溶剂(包括但不限于:醇,如乙醇,和烷烃,如丁烷)离开所述腔室/反应容器的手段。
在一些实施例中,提供一种方法,包括在盘管内冷凝目标化合物。在一些实施例中,在腔室中冷凝的化合物包括萜烯、有药物价值的化合物和有感官价值的化合物中的任意一种或多种。在一些实施例中,盘管是温度调节的。在一些实施例中,在化合物与过滤器接触之前立即将萜烯和/或化合物冷凝在盘管内。
本文描述的用于提取大麻的任何方法可以还包括使用表面活性剂的使用。本文描述的用于提取大麻的任何方法可以还包括乳化剂的使用。可以使用本领域已知的任何乳化剂。乳化剂的实例包括但不限于大豆卵磷脂、蛋黄、磷酸钠、硬脂酰乳酸钠等。
提取大麻的装置和使用该装置的方法的实施例
在一些实施例中,提供了一种用于提取大麻的装置。在一些实施例中,提供如图2a、2b和2c所示的提取大麻的装置。该装置包括具有反应腔室(20)和尺寸排阻过滤器(10)的气密性容器(1)。尺寸排阻过滤器包括孔(30),孔尺寸足以允许大麻提取过程和脱羧过程的副产物通过过滤器。尺寸排阻过滤器阻止源自大麻的化合物的通过。
在一些实施例中,尺寸排阻过滤器的过滤器尺寸
使用不同过滤器尺寸的一个实施例是利用co2(脱羧过程的最常见副产物)和月桂烯(在大麻中发现的最小的已知萜烯之一)之间的尺寸差异而通过过滤器。co2的最小投影面积为
表1
在一些实施例中,该装置包括位于在过滤器之前的盘管。在一些实施例中,盘管是温度调节的。在一些实施例中,盘管用于在萜烯和其他有药物和感官价值的分子到达尺寸排阻过滤器之前对其进行冷凝。
再回到图2a、2b和2c,在一些实施例中,该装置包括搅拌子(60),例如磁搅拌子。在一些实施例中,提供了旋转搅拌子的基座。在一些实施例中,装置的内表面衬有不粘涂层,可以使用本领域已知的任何不粘涂层。不粘涂层的例子包括但不限于聚四氟乙烯和聚硅氧烷。
将搅拌子与不粘表面结合的装置的实施例可有助于在已经通过尺寸排阻过滤器去除了提取过程和/或脱羧过程的任何副产物之后促进大麻提取物的移出。
在一些实施例中,该装置是温度控制的。在一些实施例中,装置是压力控制的。在一些实施例中,装置是温度和压力均受控制的。一种温度和压力均受受控的装置可以允许在大麻提取过程和/或脱羧过程中温度和压力的多种组合。例如,在较长的净化/脱羧持续时间期间可以利用较少的热量,以阻止任何不期望的副反应。
在一些实施例中,该装置包括用于引入大麻或大麻提取物的加载门(40),其可以被锁闭以保持所述装置的气密密封。加载门的尺寸可以根据需要进行调整,以允许将不同量和不同类型的大麻原料引入到装置中。
在一些实施例中,该装置包括附接到尺寸排阻过滤器并且位于反应腔室内的钢棒(50)。在一些实施例中,钢棒穿过反应腔室的中心。在一些实施例中,尺寸排阻滤波器能够在钢棒上上下移动。尺寸排阻过滤器在钢棒上上下移动可以将尺寸排阻过滤器放置到与正在经历提取过程和/或脱羧过程的原料的最佳距离处。
在一些实施例中,该装置包括一个或多个阀(70),其功能是将惰性气体引入反应腔室。在一些实施例中,该装置包括两个阀。
在一些实施例中,提供了提取大麻的方法,其中使用本文描述的任一装置。在一些实施方案中,提供了一种方法,其包括使用本文所述的任一装置,包括以下步骤:(i)向反应腔室中添加任意量的至少一种大麻植物或任意量的至少一种大麻植物的提取物,(ii)可选地通过从在腔室中所述量的至少一种大麻植物中提取大麻而生产大麻提取物,(iii)从反应腔室中去除由提取大麻产生的副产物,和(iv)将源自大麻的化合物保留在腔室中,其中,反应腔室包括过滤器,所述过滤器中的孔允许来自大麻提取过程的副产物从反应腔室中去除,并且阻止源自大麻的化合物从所述室中去除。
源自大麻的化合物的混合物的实施例
在一些实施例中,提供源自大麻的化合物的混合物。在一些实施例中,混合物包括图4-17所示的化合物的任一,以任何组合。
在一些实施例中,提供化合物的混合物,所述混合物包括至少一种源自大麻的萜烯化合物和至少一种源自大麻的大麻素化合物。
在一些实施例中,本文所述的化合物的任何一种混合物都包含至少5种源自大麻的萜烯化合物,例如,至少10种源自大麻的萜烯化合物,至少15种源自大麻的萜烯化合物,或者至少20种源自大麻的萜烯化合物。
在一些实施例中,化合物的混合物包括24种源自大麻的萜烯化合物。在一些实施例中,所述24种萜烯化合物包括:α-蒎烯,莰烯,β-蒎烯,β-月桂烯,3-蒈烯,α-萜品烯(α-terphinene),d-柠檬烯,对伞花烃,桉叶油素,顺式-β-罗勒烯,γ-萜品烯(γ-terpinen),萜品油烯,芳樟醇,反式-β-罗勒烯,葑醇,异胡薄荷醇(isopulegol),香叶醇,β-石竹烯,α-葎草烯,顺式-橙花叔醇,反式-橙花叔醇,愈创醇,石竹烯氧化物以及α-红没药醇。
在本文描述的化合物的混合物的任一实施例中,每种萜烯化合物的百分比质量在0.0001%和10%之间,例如0.0001%和0.1%之间,0.0005%和0.07%之间或0.001%和0.05%之间。
在一些实施例中,萜烯简况类似于图22所示的简况。
在一些实施例中,本文所述化合物的任何一种混合物都包含至少3种源自大麻的大麻素化合物(例如7种源自于大麻的化合物)。在一些实施例中,该7种大麻素化合物包括:thc-a、cbl-a、δ9-thc、cbn、cbc、cbg和thcv。
在本文描述的化合物的混合物的任一实施例中,每种大麻素的mg/ml在0.0001mg/ml和1000mg/ml之间,例如,0.01mg/l和25mg/ml之间或在0.1mg/ml和22mg/ml之间。
在一些实施例中,大麻素简况类似于图21所示的简况。
在一些实施例中,提供了源自大麻的化合物的混合物,该混合物包括大麻素、含氮化合物、氨基酸、蛋白质、酶、糖蛋白、碳氢化合物、简单醇、醛、酮和酸、脂肪酸、简单酯和内酯、甾类化合物、萜烯、非大麻酚、类黄酮、维生素和色素。在一些实施例中,提供了源自大麻的化合物的混合物,该混合物包括大麻素、含氮化合物、氨基酸、蛋白质、酶、糖蛋白、碳氢化合物、简单醇、醛、酮和酸、脂肪酸、简单酯和内酯、甾类化合物、萜烯、非大麻酚、类黄酮、维生素和色素中任一种或多种,以任意组合的形式。
在本文所描述的化合物的混合物的任一实施例中,所述化合物可以包含在胶囊内。在一些实施例中,胶囊是明胶胶囊,如图18所示。
在一些实施例中,本文描述的任一胶囊包括药物制剂。在一些实施例中,本文描述的大麻制剂中的任何一种均包括药物制剂。
治疗方法
在一些实施例中,提供了一种治疗方法,包括向有需要的患者施用药学上可接受量的本文描述的任一药物制剂。在一些实施例中,将混合物施用于患者以促使患者体验随行效果。
本文描述的任何药物制剂可被施用于治疗以下任一种或多种疾病:恶心和呕吐、消耗综合征(艾滋)、食欲不振(在癌症和艾滋病患者以及神经性厌食症患者中出现)、多发性硬化、脊髓损伤、癫痫、疼痛、关节炎(和其他肌肉骨骼疾病)、运动障碍、青光眼、哮喘、高血压、精神障碍、阿尔茨海默病和痴呆、全身炎症、胃肠道疾病。
如本文所用,术语“患者”指的是治疗的接受者并且包括动物界的所有有机体。在优选的实施例中,动物属于哺乳动物,如人类、牛、羊、猪、猫、水牛、犬、山羊、马、驴、鹿和灵长类动物。在一些实施例中,动物是人类。
如本文所用,术语“治疗”包括“预防”的意思。
本文使用的程度语言,例如本文使用的术语“近似”、“大约”、“一般”和“基本上”表示实施期望功能或实现期望结果的接近所述值、量或特性的值、量或特性。例如,术语“近似”、“大约”、“一般”和“基本上”可能指少于所述量的10%以内、少于所述量的5%以内、少于所述量的1%以内、少于所述量的0.1%以内以及少于所述量的0.01%之内的量。作为另一实例,在某些实施例中,术语“大体平行”和“基本上平行”指的是与完全平行偏离小于或等于15°、10°、5°、3°、1°、0.1°或其它的值、量或特性。类似地,在某些实施例中,术语“大体垂直”和“基本上垂直”指的是与完全垂直偏离小于或等于15°、10°、5°、3°、1°、0.1°或其它的值、量或特性。
实施例
在以下实例中进一步详细地公开了上面讨论的实施例的一些方面,这些实例并不以任何方式限制本公开的范围。
实例1
利用杂交品系的大麻提取
从源自任一和所有杂交大麻品系(大麻的杂交品种,包括但不限于火麻、印度大麻、和/或莠草大麻-以及任何/所有亚种-既有雄性也有雌性品种)的大麻植物原料开始,对样品进行干燥以及固化(适当的干燥和储存流程确保最大的萜烯含量),然后使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料提取药学上可行的化合物(主要是大麻素和萜烯),或替代地不进行提取。
对于基于溶剂的大麻提取物,从提取物中清除残留溶剂,同时保留有药物和感官价值的化合物。接着,对样品进行脱羧(在各种温度(90~180℃)下)。这种脱羧是在气密性容器中进行的,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将有机介质(包括但不限于:脂质、醇等)和表面活性剂(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到脱羧的提取物(或脱羧的植物原料)中。然后可选地使混合物经历加热步骤温度(90~180℃)。加热步骤的持续时间根据批次大小、最终产品的期望特性和其他因素而变化。改变温度、压力、方法和热暴露的持续时间极大地影响最终产品的医学特性。
在可选的步骤中,将营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)和食品着色剂添加到混合物中,然后混合物被冷冻。在一些提取中,混合物再次经受加热和冷冻循环。颜色为黄色/浅棕色/金黄色的混合物,被过滤并用于填充明胶胶囊(图18)。然后将胶囊储存起来。图21和图22显示了该脱羧方法所产生的萜烯和大麻素的量和百分比。
最终产品中的所有成分的比例可能不同,从0至100重量%。并非所有以上所列的上述成分或步骤都必须执行。例如(1)省略营养物不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例2
使用印度大麻品系的大麻提取
从源自任何和所有印度大麻品系(和任何/所有亚种-既有雄性品种也有雌性品种)的大麻植物原料开始,将样品干燥和固化(适当的干燥和储存流程确保最大萜烯含量),然后使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料中提取医学上可行的化合物(主要是大麻素和萜烯),或替代地不进行提取。
如果大麻提取物是基于溶剂的,那么可以从提取物中清除残余溶剂的同时保留具有药物和感官价值的化合物(如图3所示)。接下来,样品被完全(或部分)脱羧(在各种温度(90℃-180℃)下),压力、方法和持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。该脱羧步骤可以在气密性容器中进行,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将有机介质(包括但不限于:脂质、醇等)和表面活性剂(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到被脱羧的提取物(或脱羧的植物原料)中,然后可选地加热混合物(温度(90℃-180℃)并且持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。改变温度、压力、方法和热暴露的持续时间可以极大地影响最终产品的医学特性。营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)可选地添加到混合物中。在这一点上也可以添加食用色素。然后可选地将混合物冷冻。可以利用加热和冷冻的进一步重复。混合物应为黄色/浅棕色/金黄色。然后过滤并用于填充明胶胶囊。然后将胶囊储存起来。
最终产品中所有成分的比例可能有所不同,从0-100重量%。并非所有以上所列的成分或步骤都必须执行。例如,(1)省略营养物、表面活性剂或食用色素不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例3
使用火麻品系的大麻提取
从源自任何和所有火麻品系(和任何/所有亚种-既有雄性品种也有雌性品种)的大麻植物原料开始,将样品干燥和固化(适当的干燥和储存流程确保最大萜烯含量),然后使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料中提取医学上可行的化合物(主要是大麻素和萜烯),或替代地,不进行提取。
如果大麻提取物是基于溶剂的,那么可以从提取物中清除残余溶剂的同时保留具有药物和感官影响价值的化合物(如图3所示)。接下来,样品被完全(或部分)脱羧(在各种温度(90℃-180℃)下),压力、方法和持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。该脱羧步骤可以在气密性容器中进行,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将有机介质(包括但不限于:脂质、醇等)和表面活性剂(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到被脱羧的提取物(或脱羧的植物原料)中,然后可选地加热混合物(温度(90℃-180℃)并且持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。改变温度、压力、方法和热暴露的持续时间可以极大地影响最终产品的医学特性。营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)可选地添加到混合物中。在这一点上也可以添加食用色素。然后可选地将混合物冷冻。可以利用加热和冷冻的进一步重复。混合物应为黄色/浅棕色/金黄色。然后过滤并用于填充明胶胶囊。然后将胶囊储存起来。
最终产品中的所有成分的比例可能有所不同,从0-100重量%。并非所有以上所列的成分或步骤都必须执行。例如,(1)省略营养物、表面活性剂或食用色素不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例4
使用已建立品系的大麻提取
从源自任何和所有已建立品系(例如酸性柴油品系(sourdieselstrain)和任何/所有亚种(既有雄性品种也有雌性品种))的大麻植物原料开始,将样品干燥和固化(适当的干燥和储存流程确保最大萜烯含量),然后使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料中提取医学上可行的化合物(主要是大麻素和萜烯),或替代地,不进行提取。
如果大麻提取物是基于溶剂的,那么可以从提取物中清除残余溶剂的同时保留具有药物和感官影响价值的化合物(如图3所示)。接下来,样品被完全(或部分)脱羧(在各种温度(90℃-180℃)下),压力、方法和持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。该脱羧步骤可以在气密性容器中进行,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将有机介质(包括但不限于:脂质、醇等)和表面活性剂(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到被脱羧的提取物(或脱羧的植物原料)中,然后可选地加热混合物(温度(90℃-180℃)并且持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。改变温度、压力、方法和热暴露的持续时间可以极大地影响最终产品的医学特性。营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)可选地添加到混合物中。在这一点上也可以添加食用色素。然后可选地将混合物冷冻。可以利用加热和冷冻的进一步重复。混合物应为黄色/浅棕色/金黄色。然后过滤并用于填充明胶胶囊。然后将胶囊储存起来。
最终产品中的所有成分的比例可能有所不同,从0-100重量%。并非所有以上所列的成分或步骤都必须执行。例如,(1)省略营养物、表面活性剂或食用色素不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例5
使用未干燥或固化的活植物原料的大麻提取
从源自任何和所有大麻物种(包括但不限于火麻、印度大麻、莠草大麻-以及任何/所有亚种和他们的任何/所有杂交品种-既有雄性物种也有雌性物种)的活的/非干燥的大麻植物原料开始,使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料中提取医学上可行的化合物(主要是大麻素和萜烯),或替代地,不进行提取。
如果大麻提取物是基于溶剂的,那么可以从提取物中清除残余溶剂的同时保留具有药物和感官影响价值的化合物(如图3所示)。接下来,样品被完全(或部分)脱羧(在各种温度(90℃-180℃)下),压力、方法和持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。该脱羧步骤可以在气密性容器中进行,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将有机介质(包括但不限于:脂质、醇等)和表面活性剂(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到被脱羧的提取物(或脱羧的植物原料)中,然后可选地加热混合物(温度(90℃-180℃)并且持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。改变温度、压力、方法和热暴露的持续时间可以极大地影响最终产品的医学特性。营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)可选地添加到混合物中。在这一点上也可以添加食用色素。然后可选地将混合物冷冻。可以利用加热和冷冻的进一步重复。混合物应为黄色/浅棕色/金黄色。然后过滤并用于填充明胶胶囊。然后将胶囊储存起来。
最终产品中的所有成分的比例可能有所不同,从0-100重量%。并非所有以上所列的成分或步骤都必须执行。例如,(1)省略营养物、表面活性剂或食用色素不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例6
生产适于符合犹太教的提取物的大麻提取
从源自任何和所有大麻物种(包括但不限于火麻、印度大麻、莠草大麻-以及任何/所有亚种和他们的任何/所有杂交品种-既有雄性物种也有雌性物种)的大麻植物原料开始,将样品干燥和固化(适当的干燥和储存流程确保最大萜烯含量),使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料中提取医学上可行的化合物(主要是大麻素和萜烯),或替代地不进行提取。
如果大麻提取物是基于溶剂的,那么可以从提取物中清除残余溶剂的同时保留具有药物和感官影响价值的化合物(如图3所示)。接下来,样品被完全(或部分)脱羧(在各种温度(90℃-180℃)下),压力、方法和持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。该脱羧步骤可以在气密性容器中进行,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将有机介质(包括但不限于:脂质、醇等)和表面活性剂(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到被脱羧的提取物(或脱羧的植物原料)中,然后可选地加热混合物(温度(90℃-180℃)并且持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。改变温度、压力、方法和热暴露的持续时间可以极大地影响最终产品的医学特性。营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)可选地添加到混合物中。在这一点上也可以添加食用色素。然后可选地将混合物冷冻。可以利用加热和冷冻的进一步重复。混合物应为黄色/浅棕色/金黄色。然后过滤并用于填充明胶胶囊。然后将胶囊储存起来。
最终产品中的所有成分的比例可能有所不同,从0-100重量%。并非所有以上所列的成分或步骤都必须执行。例如,(1)省略营养物、表面活性剂或食用色素不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例7
生产符合伊斯兰教的提取物的大麻提取
根据伊斯兰法,因为它涉及饮食限制,任何被认为是“符合犹太教”也被认为是符合伊斯兰教的。因此,本实例制剂的组成与实例6完全相同。
实例8
生产符合素食的提取物的大麻提取
从源自任何和所有大麻物种(包括但不限于火麻、印度大麻、莠草大麻-以及任何/所有亚种和他们的任何/所有杂交品种-既有雄性物种也有雌性物种)的大麻植物原料开始,将样品干燥和固化(适当的干燥和储存流程确保最大萜烯含量),使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料中提取医学上可行的化合物(主要是大麻素和萜烯),或替代地不进行提取。
如果大麻提取物是基于溶剂的,那么可以从提取物中清除残余溶剂的同时保留具有药物和感官影响价值的化合物(如图3所示)。接下来,样品被完全(或部分)脱羧(在各种温度(90℃-180℃)下),压力、方法和持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。该脱羧步骤可以在气密性容器中进行,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将有机介质(包括但不限于:脂质、醇等)和表面活性剂(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到被脱羧的提取物(或脱羧的植物原料)中,然后可选地加热混合物(温度(90℃-180℃)并且持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。改变温度、压力、方法和热暴露的持续时间可以极大地影响最终产品的医学特性。营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)可选地添加到混合物中。在这一点上也可以添加食用色素。然后将混合物可选地冷冻。可以利用加热和冷冻的进一步重复。混合物应为黄色/浅棕色/金黄色。然后过滤并用于填充明胶胶囊。然后将胶囊储存起来。
在这种素食品种使用的所有成分均来源于非动物来源。最终产品中的所有成分的比例可能有所不同,从0-100重量%。并非所有以上所列的成分或步骤都必须执行。例如,(1)省略营养物、表面活性剂或食用色素不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例9
生产无麸质提取物的大麻提取
从源自任何和所有大麻物种(包括但不限于火麻、印度大麻、莠草大麻-以及任何/所有亚种和他们的任何/所有杂交品种-既有雄性物种也有雌性物种)的大麻植物原料开始,将样品干燥和固化(适当的干燥和储存流程确保最大萜烯含量),然后使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料中提取医学上可行的化合物(主要是大麻素和萜烯),或替代地不进行提取。
如果大麻提取物是基于溶剂的,那么可以从提取物中清除残余溶剂的同时保留具有药物和感官影响价值的化合物(如图3所示)。接下来,样品被完全(或部分)脱羧(在各种温度(90℃-180℃)下),压力、方法和持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。该脱羧步骤可以在气密性容器中进行,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将有机介质(包括但不限于:脂质、醇等)和表面活性剂(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到被脱羧的提取物(或脱羧的植物原料)中,然后可选地加热混合物(温度(90℃-180℃)并且持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。改变温度、压力、方法和热暴露的持续时间可以极大地影响最终产品的医学特性。营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)可选地添加到混合物中。在这一点上也可以添加食用色素。然后可选地将混合物冷冻。可以利用加热和冷冻的进一步重复。混合物应为黄色/浅棕色/金黄色。然后过滤并用于填充明胶胶囊。然后将胶囊储存起来。
最终产品中的所有成分的比例可能有所不同,从0-100重量%。并非所有以上所列的成分或步骤都必须执行。例如,(1)省略营养物、表面活性剂或食用色素不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例10
不利用脱羧步骤的大麻提取
从源自任何和所有大麻物种(包括但不限于火麻、印度大麻、莠草大麻-以及任何/所有亚种和他们的任何/所有杂交品种-既有雄性物种也有雌性物种)的大麻植物原料开始,将样品干燥和固化(适当的干燥和储存流程确保最大萜烯含量),然后使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料中提取医学上可行的化合物(主要是大麻素和萜烯),或替代地不进行提取。
如果大麻提取物是基于溶剂的,那么可以从提取物中清除残余溶剂的同时保留具有药物和感官影响价值的化合物(如图3所示)。接下来,样品被完全(或部分)脱羧(在各种温度(90℃-180℃)下),压力、方法和持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。该脱羧步骤可以在气密性容器中进行,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将有机介质(包括但不限于:脂质、醇等)和表面活性剂(一种或多种)(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到被脱羧的提取物(或被脱羧的植物原料)中,然后可选地加热混合物(温度(90℃-180℃)并且持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。改变温度、压力、方法和热暴露的持续时间可以极大地影响最终产品的医学特性。在本实施例中,大麻/大麻提取物将不脱羧。营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)可选地添加到混合物中。在这一点上也可以添加食用色素。然后可选地将混合物冷冻。可以利用加热和冷冻的进一步重复。混合物应为黄色/浅棕色/金黄色。然后过滤并用于填充明胶胶囊。然后将胶囊储存起来。
最终产品中的所有成分的比例可能有所不同,从0-100重量%。并非所有以上所列的成分或步骤都必须执行。例如,(1)省略营养物、表面活性剂或食用色素不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例11
生产高效能的大麻提取物
从源自任何和所有大麻物种(包括但不限于火麻、印度大麻、莠草大麻-以及任何/所有亚种和他们的任何/所有杂交品种-既有雄性物种也有雌性物种)的大麻植物原料开始,将样品干燥和固化(适当的干燥和储存流程确保最大萜烯含量),然后使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料中提取医学上可行的化合物(主要是大麻素和萜烯),或替代地不进行提取。
如果大麻提取物是基于溶剂的,那么可以从提取物中清除残余溶剂的同时保留具有药物和感官影响价值的化合物(如图3所示)。接下来,样品被完全(或部分)脱羧(在各种温度(90℃-180℃)下),压力、方法和持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。该脱羧步骤可以在气密性容器中进行,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将有机介质(包括但不限于:脂质、醇等)和表面活性剂(一种或多种)(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到被脱羧的提取物(或脱羧的植物原料)中,然后可选地加热混合物(温度(90℃-180℃)并且持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。改变温度、压力、方法和热暴露的持续时间可以极大地影响最终产品的医学特性。为了获得高效能版本,使用的大麻提取物相对于有机介质和其他成分的比例较大。例如,在本实施例中,大麻提取物相对于脂质和其他成分的比例可以是10∶1。营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)可选地添加到混合物中。在这一点上也可以添加食用色素。然后可选地将混合物冷冻。可以利用加热和冷冻的进一步重复。混合物应为黄色/浅棕色/金黄色。然后过滤并用于填充明胶胶囊。然后将胶囊储存起来。
最终产品中的所有成分的比例可能有所不同,从0-100重量%。并非所有以上所列的成分或步骤都必须执行。例如,(1)省略营养物、表面活性剂或食用色素不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例12
生产低效能的大麻提取物
从源自任何和所有大麻物种(包括但不限于火麻、印度大麻、莠草大麻-以及任何/所有亚种和他们的任何/所有杂交品种-既有雄性物种也有雌性物种)的大麻植物原料开始,将样品干燥和固化(适当的干燥和储存流程确保最大萜烯含量),然后使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料中提取医学上可行的化合物(主要是大麻素和萜烯),或替代地不进行提取。
如果大麻提取物是基于溶剂的,那么可以从提取物中清除残余溶剂的同时保留具有药物和感官影响价值的化合物(如图3所示)。接下来,样品被完全(或部分)脱羧(在各种温度(90℃-180℃)下),压力、方法和持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。该脱羧步骤可以在气密性容器中进行,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将有机介质(包括但不限于:脂质、醇等)和表面活性剂(一种或多种)(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到被脱羧的提取物(或被脱羧的植物原料)中,然后可选地加热混合物(温度(90℃-180℃)并且持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。改变温度、压力、方法和热暴露的持续时间可以极大地影响最终产品的医学特性。为了得到低效能的版本,使用的大麻提取物相对于有机介质和其他成分的比例较小。例如,在本实施例中,大麻提取物相对于脂质和其他成分的比例可以是1∶10。营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)可选地添加到混合物中。在这一点上也可以添加食用色素。然后可选地将混合物冷冻。可以利用加热和冷冻的进一步重复。混合物应为黄色/浅棕色/金黄色。然后过滤并用于填充明胶胶囊。然后将胶囊储存起来。
最终产品中的所有成分的比例可能有所不同,从0-100重量%。并非所有以上所列的成分或步骤都必须执行。例如,(1)省略营养物、表面活性剂或食用色素不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例13
生产cbd大麻提取物
从源自任何和所有具有确定的并且较高的cbd浓度的大麻物种(例如“charlotte’sweb”)(包括但不限于火麻、印度大麻、莠草大麻-以及任何/所有亚种和他们的任何/所有杂交品种-既有雄性物种也有雌性物种)的大麻植物原料开始,将样品干燥和固化(适当的干燥和储存流程确保最大萜烯含量),然后使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料中提取医学上可行的化合物(主要是大麻素和萜烯),或替代地不进行提取。
如果大麻提取物是基于溶剂的,那么可以从提取物中清除残余溶剂的同时保留具有药物和感官影响价值的化合物。接下来,样品被完全(或部分)脱羧(在各种温度(90℃-180℃)下),压力、方法和持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。该脱羧步骤可以在气密性容器中进行,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将有机介质(包括但不限于:脂质、醇等)和表面活性剂(一种或多种)(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到脱羧的提取物(或脱羧的植物原料)中,然后可选地加热混合物(温度(90℃-180℃)并且持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。改变温度、压力、方法和热暴露的持续时间可以极大地影响最终产品的医学特性。营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)可选地添加到混合物中。在这一点上也可以添加食用色素。然后可选地将混合物冷冻。可以利用加热和冷冻的进一步重复。混合物应为黄色/浅棕色/金黄色。然后过滤并用于填充明胶胶囊。然后将胶囊储存起来。
最终产品中的所有成分的比例可能有所不同,从0-100重量%。并非所有以上所列的成分或步骤都必须执行。例如,(1)省略营养物、表面活性剂或食用色素不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例14
生产缓释的大麻提取物
从源自任何和所有大麻物种(包括但不限于火麻、印度大麻、莠草大麻-以及任何/所有亚种和他们的任何/所有杂交品种-既有雄性物种也有雌性物种)的大麻植物原料开始,将样品干燥和固化(适当的干燥和储存流程确保最大萜烯含量),然后使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料中提取医学上可行的化合物(主要是大麻素和萜烯),或替代地不进行提取。
如果大麻提取物是基于溶剂的,那么可以从提取物中清除残余溶剂的同时保留具有药物和感官影响价值的化合物(如图3所示)。接下来,样品被完全(或部分)脱羧(在各种温度(90℃-180℃)下),压力、方法和持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。该脱羧步骤可以在气密性容器中进行,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将有机介质(包括但不限于:脂质、醇等)和表面活性剂(一种或多种)(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到脱羧的提取物(或被脱羧的植物原料)中,然后可选地加热混合物(温度(90℃-180℃)并且持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。改变温度、压力、方法和热暴露的持续时间可以极大地影响最终产品的医学特性。营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)可选地添加到混合物中。在这一点上也可以添加食用色素。可选地,可以将faah抑制剂添加到混合物中,从而极大地限制哺乳动物内源性大麻素系统中的大麻素的降解,并导致延长的精神活性和药物效果。然后可选地将混合物冷冻。可以利用加热和冷冻的进一步重复。混合物应为黄色/浅棕色/金黄色。然后过滤并用于填充明胶胶囊。然后将胶囊储存起来。
最终产品中的所有成分的比例可能有所不同,从0-100重量%。并非所有以上所列的成分或步骤都必须执行。例如,(1)省略营养物、表面活性剂或食用色素不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例15
生产无过敏原的大麻提取物
从源自任何和所有大麻物种(包括但不限于火麻、印度大麻、莠草大麻-以及任何/所有亚种和他们的任何/所有杂交品种-既有雄性物种也有雌性物种)的大麻植物原料开始,将样品干燥和固化(适当的干燥和储存流程确保最大萜烯含量),然后使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料中提取医学上可行的化合物(主要是大麻素和萜烯),或替代地不进行提取。
如果大麻提取物是基于溶剂的,那么可以从提取物中清除残余溶剂的同时保留具有药物和感官影响价值的化合物(如图3所示)。接下来,样品被完全(或部分)脱羧(在各种温度(90℃-180℃)下),压力、方法和持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。该脱羧步骤可以在气密性容器中进行,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将无过敏原的有机介质(包括但不限于:脂质、醇等)和无过敏原的表面活性剂(一种或多种)(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到被脱羧的提取物(或被脱羧的植物原料)中,然后可选地加热混合物(温度(90℃-180℃)并且持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。改变温度、压力、方法和热暴露的持续时间可以极大地影响最终产品的医学特性。可选地,无过敏原的营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)添加到混合物中。在这一点上也可以添加食用色素。然后将混合物可选地冷冻。可以利用加热和冷冻的进一步重复。混合物然后被过滤并用于填充明胶胶囊。然后将胶囊储存起来。
最终产品中的所有成分的比例可能有所不同,从0-100重量%。所有成分将是源于无过敏原来源。并非所有以上所列的成分或步骤都必须执行。例如,(1)省略营养物、表面活性剂或食用色素不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例16
生产低钠或无钠的大麻提取物
从源自任何和所有大麻物种(包括但不限于火麻、印度大麻、莠草大麻-以及任何/所有亚种和他们的任何/所有杂交品种-既有雄性物种也有雌性物种)的大麻植物原料开始,将样品干燥和固化(适当的干燥和储存流程确保最大萜烯含量),然后使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料中提取医学上可行的化合物(主要是大麻素和萜烯),或替代地,不进行提取。
如果大麻提取物是基于溶剂的,那么可以从提取物中清除残余溶剂的同时保留具有药物和感官影响价值的化合物(如图3所示)。接下来,样品被完全(或部分)脱羧(在各种温度(90℃-180℃)下),压力、方法和持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。该脱羧步骤可以在气密性容器中进行,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将有机介质(包括但不限于:脂质、醇等)和表面活性剂(一种或多种)(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到被脱羧的提取物(或被脱羧的植物原料)中,然后可选地加热混合物(温度(90℃-180℃)并且持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。改变温度、压力、方法和热暴露的持续时间可以极大地影响最终产品的医学特性。营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)可选地添加到混合物中。在这一点上也可以添加食用色素。然后可选地将混合物冷冻。可以利用加热和冷冻的进一步重复。混合物应为黄色/浅棕色/金黄色。然后过滤并用于填充明胶胶囊。然后将胶囊储存起来。
最终产品中的所有成分的比例可能有所不同,从0-100重量%。所有成分含有非常少的钠甚至不含钠。并非所有以上所列的成分或步骤都必须执行。例如,(1)省略营养物、表面活性剂或食用色素不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例17
其它大麻提取物的实例
从源自任何和所有大麻物种(包括但不限于火麻、印度大麻、莠草大麻-以及任何/所有亚种和他们的任何/所有杂交品种-既有雄性物种也有雌性物种)的大麻植物原料开始,将样品干燥和固化(适当的干燥和储存流程确保最大萜烯含量),然后使用各种提取方法(包括但不限于:冷水提取和干筛(杂凑)、co2、碳氢化合物(包括但不限于:丁烷、丙烷、己烷)、醇(包括但不限于:乙醇、异丙基、甲醇)和松香技术(热提取))从植物原料中提取医学上可行的化合物(主要是大麻素和萜烯),或替代地不进行提取。
如果大麻提取物是基于溶剂的,那么可以从提取物中清除残余溶剂的同时保留具有药物和感官影响价值的化合物(如图3所示)。接下来,样品被完全(或部分)脱羧(在各种温度(90℃-180℃)下),压力、方法和持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。该脱羧步骤可以在气密性容器中进行,以便阻止和限制蒸发的医学上可行的化合物(包括但不限于萜烯和大麻素)的逸出和降解。接下来,将有机介质(包括但不限于:脂质、醇等)和表面活性剂(一种或多种)(包括但不限于:大豆卵磷脂、蛋黄、丝兰提取物)添加到脱羧的提取物(或被脱羧的植物原料)中,然后可选地加热混合物(温度(90℃-180℃)并且持续时间可以根据批次大小、最终产品的期望特性和其他因素而变化)。改变温度、压力、方法和热暴露的持续时间可以极大地影响最终产品的医学特性。营养化合物(包括但不限于:醇、脂肪、碳水化合物和蛋白质)可选地添加到混合物中。在这一点上也可以添加食用色素。然后将混合物可选地冷冻。可以利用加热和冷冻的进一步重复。混合物应为黄色/浅棕色/金黄色。然后过滤并用于填充明胶胶囊。然后将胶囊储存起来。
最终产品中的所有成分的比例可能有所不同,从0-100重量%。所有成分含有非常少的钠甚至不含钠。并非所有以上所列的成分或步骤都必须执行。例如,(1)省略营养物、表面活性剂或食用色素不构成新产品,并且(2)省略冷冻步骤不构成新的制造方法。
实例18
使用以下命名约定进行cook:“cook1”和“cook3”。
“cook1”使用了3.00克带有阿富汗臭鼬(afghanskunk)品系名称的大麻提取物(华盛顿酒和大麻管制局批号#6034347010022992)。该大麻提取物是利用大麻植物原料的烃提取而制成的。在cook之前,设备腔室用氮气冲洗。然后将设备腔室和大麻提取物加热至250°f,持续1.5小时。从设备腔室通向尺寸排阻过滤器的阀门在整个cook过程中保持开放。在cook持续期间用冰浴对尺寸排阻过滤器之前的盘管进行冷却。在设备腔室冷却到室温(近45分钟)之后,然后使用60ml异丙醇冲洗盘管以重新获取任何冷凝的萜烯,然后在cook完成后使用该等量的异丙醇溶解提取物。
“cook3”使用了3.00克带有阿富汗臭鼬品系名称的大麻提取物(华盛顿酒和大麻管制局批号#6034347010022992)。该大麻提取物是利用大麻植物原料的烃提取而制成的。在此cook期间,容器暴露于环境条件下(匹配现有技术制备)。然后将容器和大麻提取物加热至250f,持续1.5小时。在cook完成后,在容器冷却到室温(近45分钟)之后,使用60ml异丙醇溶解提取物。
包括与这两次cook相对应的数据。“cook1”的数据如图24所示。“cook3”的数据如图25所示。如该数据所示,在含有基本相同的大麻素含量的同时,“cook1”含有的萜烯含量是“cook3”中发现的的萜烯含量的2.74倍。此外,“cook1”中几乎不含thc-a,而“cook3”中则含有0.27mg/g的thc-a。这表明“cook1”中脱羧过程已经完成,而cook3不是这样。“cook1”比“cook3”有更大的萜烯多样性。在“cook1”中,定量萜烯的6%为单萜烯,3%为单类萜,89%为倍半萜烯。在“cook3”中,定量萜烯的0%为单萜烯,2%为单类萜,96%为倍半萜烯。应该指出,当按挥发性排序时,单萜烯是最易挥发的,其次是单类萜,然后是倍半萜烯,最后是倍半类萜。
该数据表明,使用n2冲洗、冷却盘管和尺寸排阻过滤器在保留萜烯和促进脱羧过程方面更有效。“cook1”促进了除thc-a之外的其他大麻素的脱羧作用,如cbg-a。增加了活性大麻素和萜烯的多样性进一步加强了本公开中详细讨论的随行效应。
这些实例可以结合起来。例如:(1)一种无麸质制剂,其源自适于犹太教的并且效力极强的印度大麻品系(2)无过敏原制剂,其源自符合伊斯兰教的、无钠且低效的火麻品系(3)富含cbd的制剂,使用已建立的品系,该制剂源自活的植物原料并且缓慢释放、符合素食、并且是非脱羧的。
一种大麻提取方法,包括以下步骤:(i)向反应腔室中加入一定量的至少一种大麻植物或一定量的至少一种大麻植物的提取物;(ii)从反应腔室中去除由提取大麻产生的副产物;和(iii)将源自大麻的化合物保留在腔室内,
其中,反应腔室包括过滤器,过滤器包括孔,该孔允许将来自大麻提取过程的副产物从反应腔室中去除并且阻止源自至少一种大麻植物或至少一种大麻植物的提取物的化合物从腔室中去除或逸出。
在一些实施例中,所述至少一种大麻植物是从由火麻、印度大麻和莠草大麻组成的组中的至少一种。在一些实施例中,反应腔室是密闭腔室。在一些实施例中,提取大麻包括基于溶剂的提取。在一些实施例中,溶剂是由异丙基、甲醇、正丙醇、丙烷、丁烷、异丁烷、甲醇和乙醇组成的组中的至少一种。在一些实施例中,提取大麻不使用溶剂。在一些实施例中,非溶剂提取是由热提取、非加热提取、冷水提取、co2提取和松香技术提取组成的组中的至少一种。在一些实施例中,该方法还包括脱羧步骤,其中提取物或大麻植物原料被脱羧。在一些实施例中,该方法还包括将提取物或大麻植物原料脱羧后从反应腔室中去除co2。在一些实施例中,通过过滤器除去co2。在一些实施例中,脱羧反应发生在有惰性气体存在下。在一些实施例中,在脱羧步骤之前,用惰性气体对反应腔室进行处理。在一些实施例中,惰性气体由氦,氖,氩、氪、氙和氡组成的组中的至少一种。在一些实施例中,脱羧步骤还包括使用靶向酶或辅因子。
在一些实施例中,脱羧步骤还包括作为催化剂的h2o。在一些实施例中,反应腔室还包括磁性搅拌子。在一些实施例中,大麻提取物源自活大麻原料。在一些实施例中,大麻提取物源于干燥/固化大麻植物原料。在一些实施例中,腔室内来自大麻的化合物包括至少一种大麻素和至少一种萜烯。在一些实施方案中,腔室内来自大麻的化合物包括大麻素、萜烯/类萜、氨基酸、含氮化合物、简单醇、醛、酮、酯、内酯和酸、脂肪酸、甾类化合物、非大麻酚、颜料、类黄酮、维生素、蛋白质、酶、糖蛋白和碳氢化合物。在一些实施例中,步骤(iv)中腔室内源自大麻的化合物包括大麻中的至少约545种不同的化合物。
在一些实施例中,大麻提取的方法包括使用表面活性剂。在一些实施例中,大麻提取的方法包括使用乳化剂。在一些实施例中,大麻提取的方法使用任何一种或多种大麻。在一些实施例中,大麻提取的方法包括使用大麻植物的任何一个或多个亚种。在一些实施例中,大麻提取的方法包括使用任何一株或多株大麻植物。在一些实施例中,大麻提取的方法包括使用源自雌性来源的大麻植物。在一些实施例中,大麻提取的方法包括使用源自雄性来源的大麻植物。
在一些实施例中,提供一种用于大麻提取的装置,包括:(i)气密性容器,该气密性容器包括:(ii)内表面;(iii)外表面;(iv)反应腔室和(iv)尺寸排阻过滤器,其中,尺寸排阻过滤器包括足够尺寸的孔以允许提取过程和脱羧过程的副产物通过过滤器,但阻止来自大麻的化合物通过过滤器。在一些实施例中,孔大小为从约
在一些实施例中,反应腔室包括搅拌子。在一些实施例中,反应腔室是温度控制和压力控制的。在一些实施例中,搅拌子是磁性搅拌子。在一些实施例中,该装置还包括旋转搅拌子的搅拌基座。在一些实施例中,磁性搅拌子涂覆有不粘涂层。在一些实施例中,该装置的内表面包括不粘涂层。在一些实施例中,不粘涂层是聚硅氧烷。在一些实施例中,该装置还包括加载门。在一些实施例中,该装置还包括钢棒,其中钢棒在反应腔室中,并且钢棒附接到尺寸排阻过滤器。在一些实施例中,钢棒穿过反应腔室的中心。在一些实施例中,尺寸排阻过滤器被配置为在反应腔室内的钢棒上下移动。在一些实施例中,反应腔室还包括至少一个阀。在一些实施例中,所述至少一个阀包括两个阀。
在一些实施例中,提供了一种大麻提取方法,包括使用本文公开的任一装置,包括以下步骤:(i)向反应腔室中添加至少一种大麻植物或至少一种大麻植物的提取物;(ii)通过从在反应腔室中的所述至少一种植物或至少一种大麻植物的提取物提取大麻来生产大麻提取物;(iii)将由提取大麻产生的副产物从反应腔室中去除;以及(iv)将源自大麻的化合物保留在腔室中,其中,反应腔室包括过滤器,过滤器中的孔允许将来自大麻提取过程的副产物从反应腔室中去除并且阻止源自大麻的化合物从腔室中去除或逸出。
在一些实施例中,提供了化合物的分离混合物,包括至少一种源自大麻的萜烯化合物和至少一种源自大麻的大麻素化合物。在一些实施例中,化合物的混合物包括源自大麻的至少5种萜烯化合物。在一些实施例中,化合物的混合物包括源自大麻的至少10种萜烯化合物。在一些实施例中,化合物的混合物包括源自大麻的至少15种萜烯化合物。在一些实施方案中,化合物的混合物包括源自大麻的至少20种萜烯化合物。在一些实施方案中,化合物的混合物是24种源自大麻的萜烯化合物。在一些实施例中,所述24种源自大麻的萜烯化合物包括:α-蒎烯、莰烯、β-蒎烯、β-月桂烯、3-蒈烯、α-萜品烯、d-柠檬烯、对伞花烃、桉叶油素、顺式-β-罗勒烯、γ-萜品烯、萜品油烯、芳樟醇、反式-β-罗勒烯、葑醇、异胡薄荷醇、香叶醇、β-石竹烯、α-葎草烯、顺式-橙花叔醇、反式-橙花叔醇、愈创醇、石竹烯氧化物以及α-红没药醇。
在一些实施例中,每种萜烯化合物的百分比质量在0.0001%和010%之间。在一些实施例中,每种萜烯化合物的百分比质量在0.0005%和0.07%之间。在一些实施例中,每种化合物的百分比质量在0.001%和0.05%之间。
在一些实施例中,化合物的混合物包括源自大麻的至少3种大麻素化合物。在一些实施例中,化合物的混合物包括源自大麻的7种大麻素化合物。在一些实施例中,所述源自大麻的7种大麻素化合物包括:thc-a、cbl-a、δ9-thc、cbn、cbc、cbg和thcv。在一些实施例中,每种大麻素的mg/ml在0.01mg/ml和1000mg/ml之间。在一些实施例中,每种大麻素的mg/ml在0.1mg/ml和25mg/ml之间。
在一些实施例中,化合物的混合物在胶囊中。在一些实施例中,胶囊是明胶胶囊。在一些实施例中,胶囊包括药物制剂。
在一些实施例中,提供了一种大麻提取的方法,其中添加的大麻植物是火麻。在一些实施例中,添加的大麻植物的印度大麻。在一些实施例中,添加的大麻植物是莠草大麻。
在一些实施例中,提供一种治疗方法,包括:将药学上可接受量的根据权利要求58所述的混合物给药于有需要的患者。
在一些实施例中,将混合物给药于患者使患者体验随行效应。在一些实施例中,所述治疗针对以下任一种或多种:恶心和呕吐、消耗综合征(艾滋)、食欲不振(在癌症和艾滋患者以及神经性厌食症患者中出现)、多发性硬化、脊髓损伤、癫痫、疼痛、关节炎(以及其他肌肉骨骼疾病)、运动障碍、青光眼、哮喘、高血压、精神障碍、阿尔茨海默病和痴呆、全身炎症、胃肠道疾病。
根据权利要求1-18中任一项所述的方法,其中,腔室内源自大麻的化合物包括大麻素、含氮化合物、氨基酸、蛋白质、酶、糖蛋白、碳氢化合物、简单醇、醛、酮和酸、脂肪酸、简单酯和内酯、甾类化合物、萜烯、非大麻酚、黄酮类、维生素和色素。
在一些实施例中,提供源自大麻的化合物的分离混合物,包括大麻素、含氮化合物、氨基酸、蛋白质、酶、糖蛋白、碳氢化合物、简单醇、醛、酮和酸、脂肪酸、简单酯和内酯、甾类化合物、萜烯、非麻酚、类黄酮、维生素和色素。在一些实施例中,化合物的混合物包含在胶囊内。在一些实施例中,胶囊是明胶胶囊。在一些实施例中,胶囊包括药物制剂。
在一些实施例中,提供一种治疗方法,包括:向有需要的患者施用药学上可接受量的根据权利要求66所述的混合物。在一些实施例中,所述治疗用于治疗以下任一种或多种:恶心和呕吐、消耗综合征(艾滋)、食欲不振(在癌症和艾滋患者以及神经性厌食症患者中出现)、多发性硬化、脊髓损伤、癫痫、疼痛、关节炎(和其他肌肉骨骼疾病)、运动障碍、青光眼、哮喘、高血压、精神病、阿尔茨海默病和痴呆、全身炎症和胃肠道疾病。
在一些实施例中,提供了一种方法,包括以下步骤:(i)向反应腔室添加大麻或大麻提取物;(ii)将加工大麻产生的副产物从反应腔室中去除;和(iii)将源自大麻的化合物保留在腔室中,其中,反应腔室包括过滤器,所述过滤器包括孔,所述孔允许从反应腔室中去除加工大麻产生的副产物并且阻止源自大麻或大麻提取物的化合物的从腔室中去除或逸出。
上述文字说明书被认为足以使本领域技术人员能够实践本文的实施例。前面的描述详细描述了某些优选实施例,并描述了发明人所设想的最佳模式。然而,应当理解,无论上述内容如何详细地出现在文本中,本文的实施例可以以多种方式实施,并且本文的实施例应当根据所附权利要求书及其任何等同物来解释。
- 还没有人留言评论。精彩留言会获得点赞!