网格拟合算法的制作方法
本专利文献的公开内容的一部分包括受版权保护的材料。版权所有者不反对任何人照专利和商标办公室专利文件或记录原样复制本专利文献或专利公开内容,但除此之外版权所有者保留所有相关的版权。
背景技术:
1.技术领域
本发明涉及图像数据处理。更具体地,本发明涉及心脏的三维图像的建模和配准。
2.相关技术描述
如今,例如当心脏组织的区域异常地将电信号传导至相邻组织时,发生诸如心房纤颤等心律失常的情况下,常规进行医用导管插入术,由此扰乱正常的心动周期并且导致心律不齐。用于治疗心律失常的规程包括以外科的方式扰乱导致心律失常的信号源,以及扰乱用于此类信号的传导通路。通过经由导管施加能量(例如射频能量)来选择性地消融心脏组织,有时可能终止或更改不利电信号从心脏的一部分传播到另一部分。消融方法通过形成非传导性的消融灶来破坏不利的电通路。希望在此类规程中向操作者方便地示出心脏解剖结构。
包括位置传感器的导管可用于确定心脏表面上的点的轨线。这些轨线可用于推断运动特性,诸如组织的收缩性。如在授予benhaim并以引用方式并入本文的美国专利5,738,096中所公开,当在心脏中的足够数量的点处对轨线信息进行采样时,可构造描绘此类运动特性的标测图。
通常通过以下来测量心脏中某点处的电活动:将在远侧末端处或附近包括电传感器的导管推进到心脏中的该点,用传感器接触组织并采集该点处的数据。使用仅包括单个远侧末端电极的导管标测心腔的一个缺点是在对于腔室总体的详细图所需的必要数量的点的基础上逐点采集数据需要的时间较长。因此,已开发出多电极导管以同时在心室中的多个采样点处测量电活动,诸如本地激活时间(lat)。
例如,授予zar等人并以引用方式并入本文的共同转让的美国专利申请公布2017/0103570公开了三维心脏重建,其通过以下方式执行:使用具有标测电极的探头将导管插入到心脏中,从心脏中的感兴趣的区域中的相应位置采集电数据,将电数据的位置表示为点云,由点云重建心脏的模型,将一组滤波器施加至模型以产生过滤后的容积,分割过滤后的容积以限定心脏的组分,以及报告分割的过滤后的容积。
授予harley等人的美国专利8,428,700提出了基于在电极处测量的信号和关于电极位置的信息来生成患者心脏的电解剖表示。该方法包括用其它成像模态诸如mri执行导管配准规程,对所测量的信号进行注释,以及调节在空间上接近指定的所测量信号的其它所测量信号的注释。
技术实现要素:
典型的导管插入会话涉及将扫描的ct/mri图像与三维电解剖标测图进行配准。然而,在配准之后,在ct/mri图像与当前位置标测图中确定的实时解剖结构之间仍然存在差异。在规程期间,建立实时导管位置,并且验证导管电极与心脏壁接触,例如通过力阈值测量或通过组织接近指示来验证。将当前位置标测图与ct/mri图像配准。
一种网格拟合算法用于实时识别和解决差异。三维矩阵被构造成对当前位置标测图建模。然后将矩阵上的点调节成更密切地接近当前位置标测图上的点。
根据本发明的实施方案提供了一种方法,该方法通过以下方式来执行:将多电极探头插入到心脏中,构建电极的位置标测图以及模拟心脏的三维表面。该方法通过以下方式来进一步执行:将位置标测图放置成与心脏的采集的图像配准,基于位置标测图构建对心脏的三维表面建模的网格,以及相对于位置标测图中的标测点来调节网格的顶点的位置以改善网格与采集的图像的配准。
根据该方法的另一方面,网格为三角矩阵。
在该方法的一个方面,调节顶点的位置包括识别网格的在距选择的标测点预定距离内的所有顶点,基于所识别的顶点与所选择的标测点之间的距离来计算相应权重因子,根据相应权重因子来计算所识别的顶点的表示朝向所选择的标测点的移位的新位置,以及基于新位置来限定新网格。
根据该方法的又一方面,根据所识别的顶点与所选择的标测点之间的距离的平方反比来计算相应的权重因子。
在该方法的又一方面,新位置被确定为朝向在识别所有顶点和计算新位置的性能中确定的相应标测点的移位的矢量和。
根据该方法的附加方面,所识别的顶点与所选择的标测点之间的距离为测地距离。
根据该方法的另一方面,插入探头包括探知电极和心脏壁的组织接触。
根据本发明的实施方案还提供了一种设备,该设备包括适于插入到活体受检者的心脏中的多电极探头,以及处理器,该处理器被配置成从电极接收电信号并且执行以下步骤:构建电极的位置标测图,模拟心脏的三维表面,将位置标测图放置成与心脏的采集的图像配准,基于位置标测图来构建对心脏的三维表面建模的网格,以及相对于位置标测图上的标测点来调节网格的顶点的位置以改善网格与采集的图像的配准。
根据本发明的实施方案还提供了一种计算机软件产品,该计算机软件产品包含计算机程序指令存储在其中的非暂态计算机可读存储介质,该指令在由计算机运行时致使计算机执行以下步骤:构建电极的位置标测图,模拟心脏的三维表面,将位置标测图放置成与心脏的采集的图像配准,基于位置标测图来构建对心脏的三维表面建模的网格,以及相对于位置标测图上的标测点来调节网格的顶点的位置以改善网格与采集的图像的配准。
附图说明
为更好地理解本发明,就本发明的详细说明以举例的方式做出参考,该详细说明应结合以下附图来阅读,其中类似的元件用类似的参考标号来表示,并且其中:
图1为根据本发明的实施方案的用于评估活体受检者的心脏中的电活动的系统的立体说明图;
图2为根据本发明的实施方案的消融和有功电流位置(acl)电路的示意图;
图3为根据本发明的实施方案的处理器的各方面的框图;
图4为根据本发明的实施方案的沿着心脏导管的远侧段的长度截取的剖面图;
图5为根据本发明的实施方案的网格的示意图;
图6为根据本发明的实施方案的将心脏的三维模型拟合到ct/mri图像的方法的流程图;
图7为三角网格的可根据本发明的实施方案处理的一部分的示意图;
图8示出了根据本发明的实施方案与标测点配准的模拟矩阵;并且
图9示出了根据本发明的实施方案的遵循顶点位移的图8的矩阵。
具体实施方式
在以下描述中,列出了许多具体细节,以便提供对本发明的各种原理的全面理解。然而,对于本领域的技术人员而言将显而易见的是,并非所有这些细节都是实践本发明所必需的。在这种情况下,未详细示出熟知的电路、控制逻辑部件以及用于常规算法和过程的计算机程序指令的细节,以免不必要地使一般概念模糊不清。
以引用方式并入本文的文献将被视作本申请的整体部分,不同的是,就任何术语在这些并入文献中以与本说明书中明确或隐含地作出的定义矛盾的方式定义而言,应仅考虑本说明书中的定义。
综述
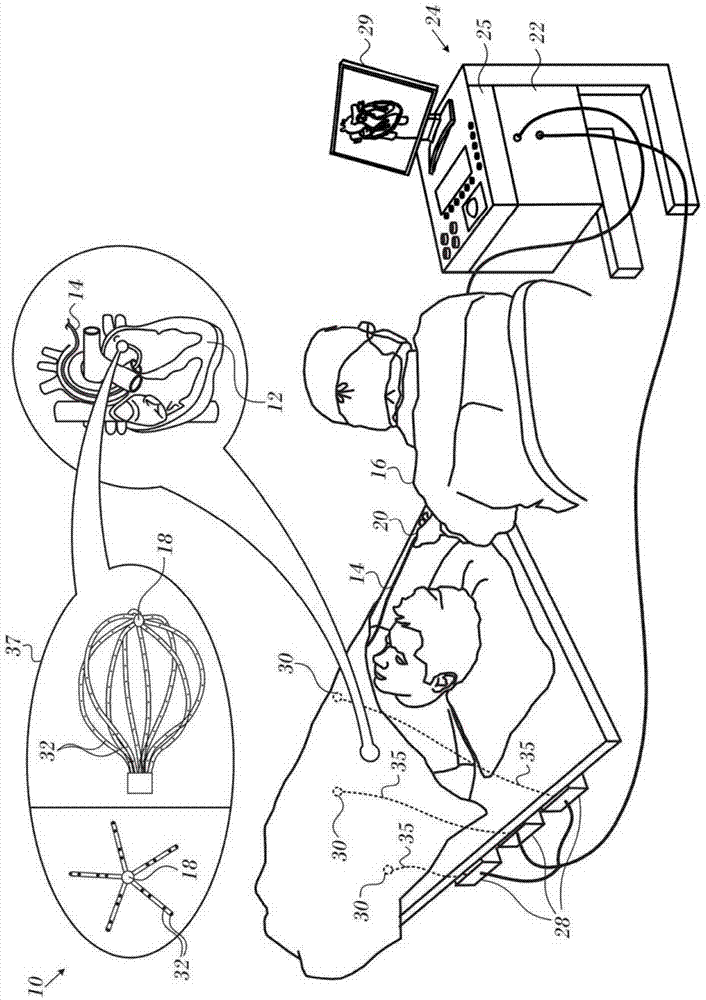
现在转到附图,首先参考图1,其为用于在活体受检者的心脏12上执行诊断和治疗规程的系统10的立体说明图,该系统根据本发明所公开的实施方案来构造和操作。该系统包括导管14,由操作者16将导管经由皮肤穿过患者的血管系统插入到心脏12的心室或血管结构中。操作者16,通常为医师,使导管的远侧末端18例如在消融目标位点处与心脏壁接触。可根据公开于美国专利6,226,542和6,301,496中和公开于共同转让的美国专利6,892,091中的方法来制备电活动标测图,这些专利的公开内容以引用方式并入本文。
系统10可包括用合适的软件编程以用于执行下文所述功能的通用或嵌入式计算机处理器。因此,尽管本文中的其它附图所示的系统10的部分被示出为包括多个单独的功能块,但这些块未必为单独的物理实体,而是可表示例如存储在可由处理器访问的存储器中的不同的计算任务或数据对象。这些任务可在运行于单个处理器上或运行于多个处理器上的软件中执行。该软件可在有形非暂态介质诸如cd-rom或非易失性存储器上被提供给一个处理器或多个处理器。另选地或除此之外,系统10可包括数字信号处理器或硬连线逻辑部件。一种体现系统10的元件的商品以商品名
可以通过施加热能对例如通过电激活图评估而确定为异常的区域进行消融,例如,通过将射频电流通过导管中的线传导至远侧末端18处的一个或多个电极,这些电极将射频能量施加到心肌。该能量在组织中被吸收,从而将该组织加热到该组织永久性地失去其电兴奋性的点(通常高于50℃)。此规程成功后,此过程在心脏组织中形成非传导性的消融灶,这些消融灶可中断导致心律失常的异常电通路。本发明的原理可应用于不同的心室,以诊断并治疗多种不同的心律失常。
导管14通常包括柄部20,在柄部上具有合适的控件,以使操作者16能够按消融手术所需对导管的远侧端部进行操纵、定位和取向。为了协助操作者16,导管14的远侧部分包括向位于控制台24中的处理器22提供信号的位置传感器(未示出)。处理器22可以履行如下所述的若干处理功能。
导管14为多电极导管,该导管可以是球囊或如球囊37的右部分中所示的篮形导管或如左部分中所示的样条导管。在存在多个电极32的任何情况下,这些电极用作感测电极,并在篮形或样条电极上具有已知位置,并且彼此关系已知。因此,一旦导管例如通过构造当前位置标测图定位于心脏中,则心脏中电极32中的每一个电极的位置为已知的。一种用于生成当前位置标测图的方法描述于授予bar-tal等人的共同转让美国专利8,478,383中,该专利以引用方式并入本文。
可以使电信号经由缆线34从位于导管14的远侧末端18处或附近的电极32,在心脏12和控制台24之间来回传送。可以通过缆线34和电极32将起搏信号和其它控制信号从控制台24传送至心脏12。
线连接件35将控制台24与体表电极30和用于测量导管14的位置和取向坐标的定位子系统的其它部件连接在一起。处理器22或另一个处理器(未示出)可以是定位子系统的元件。电极32和体表电极30可用于如以引用方式并入本文的授予govari等人的美国专利7,536,218中所提出的在消融位点处测量组织阻抗。温度传感器(未示出),通常为热电偶或热敏电阻器,可安装在导管14的远侧末端18附近。
控制台24通常包括一个或多个消融功率发生器25。导管14可以适于使用任何已知的消融技术将消融能量传导到心脏,例如,射频能量、超声能量和激光产生的光能。共同转让的美国专利6,814,733、6,997,924和7,156,816中公开了此类方法,这些专利以引用方式并入本文。
在一个实施方案中,定位子系统包括磁定位跟踪构造,该磁定位跟踪构造使用磁场生成线圈28,通过以预定的工作容积生成磁场并感测导管处的这些磁场来确定导管14的位置和取向。合适的定位子系统在以引用方式并入本文的美国专利7,756,576以及上述美国专利7,536,218中有所描述。
如上所述,导管14联接到控制台24,这使得操作者16能够观察并调控导管14的功能。控制台24包括处理器,优选为具有适当信号处理电路的计算机。该处理器被联接以驱动监视器29。信号处理电路通常接收、放大、过滤并数字化来自导管14的信号,这些信号包括由以上提到的传感器和位于导管14中的远侧的多个位置感测电极(未示出)生成的信号。由控制台24和定位系统接收并使用数字化信号,以计算导管14的位置和取向,并如下文另外详细描述地分析来自电极的电信号。
通常,系统10包括为简明起见而未示出于附图中的其它元件。例如,系统10可包括心电图(ecg)监视器,其被联接以接收来自一个或多个体表电极的信号,以便为控制台24提供ecg同步信号。如上文提及,系统10通常还包括基准位置传感器,其位于附接到受检者身体外部的外加基准贴片上,或者位于插入到心脏12中并相对于心脏12保持在固定位置的内置导管上。系统10可接收来自外部成像模态诸如mri单元等的图像数据并且包括图像处理器,该图像处理器可并入处理器22中或由处理器22调用以用于生成并显示图像。
现在参见图2,其为用于与图1所示的系统一起使用的消融和有功电流位置(acl)电路的示意图。这种构造类似于govari等人的美国专利申请公布2006/0173251和osadchy的美国专利申请公布2007/0038078中所描述的那种构造,这些申请公布均以引用方式并入本文。该构造可进行修改以根据本发明的原理进行操作。为了便于呈现,下文进行简要描述。
将多个体表电极42联接到受检者46的身体表面44(例如,皮肤),这些体表电极可为粘合剂皮肤贴片。体表电极42在本文中有时称为“贴片”。在心脏应用中,体表电极42通常被分布成围绕着心脏,三个在受检者的胸部上并且三个在背部上。然而,体表电极42的数量并非关键因素,并且它们可以放置在身体表面44上大体上在医疗规程部位附近的便利位置处。
通常设置在控制台24(图1)中的控制单元48包括电流测量电路50和一个或多个导管电极发射器52,该一个或多个导管电极发射器用于将电流以相应的工作频率通过电极42中的一个或多个驱动到体表电极42中的一个或多个。控制单元48联接到定位处理器(图1)。控制单元48联接到消融器54,该消融器包括至少一个消融发生器56。流过体表电极42和消融器体表电极58的电流在具有消融发生器56的电路中流动,并且由设置在体电极接收器60内的相应电流测量电路(在本文中有时称为“贴片测量电路”)来测量。体电极接收器60通常并入控制单元48中。另选地,它们可附连到体表电极42。导管电极被表示为测量电极62(圆形)和两用电极64(椭圆形)。两用电极64既用作消融电极,也用作测量电极中的一个。
体表电极42经由贴片盒66连接到体电极接收器60,该贴片盒保护该系统免受消融和除颤电流。通常,该系统被配置成具有六个体电极接收器60。贴片盒寄生阻抗68(z)在生产期间测量,并且因此是先验已知的。下面将讨论这些阻抗。
通常,虽然为方便起见只示出了两个测量电极62,但是使用了约80个测量电极进行阻抗测量。通常存在一个或两个消融电极。通过在导管上的电极和体表电极42之间传送电流,在定位系统中确定导管在体内的坐标。
控制单元48还可控制包括消融器54和两用电极64的消融电路。消融器54通常设置在控制单元48的外部并且并入了消融发生器56。消融器与消融器体表电极58连接并连接到消融器滤波器70,该消融器滤波器在此示例中被示出为位于控制单元48内。然而,这个位置并非必需的。开关72将消融器电路配置用于不同操作模式,如下所述。电压测量电路提供用于确定导管电极发射器52的输出。通过观察将注意到,消融电路连接到导管电极发射器52中的一个。
现在参考图3,其为根据本发明的实施方案的处理器22的各方面的框图。通常,处理器22位于控制台24(图1)中,但它可以是远程的或分布在多个站点之中。处理器22可使用跟踪模块诸如跟踪模块74,将来自上述位置感测装置的信号转换成由场生成线圈28(图1)限定的三维参照系中的位置坐标。处理器22联接到图形处理器76。图形处理器76是通常具有大约2,000个处理器的并行处理单元。
为了确定电极相对于心脏壁的位置,需要探知组织接触。一种可用的技术是如图4所示的基于温度计的方法,该图为根据本发明的实施方案的沿着心脏导管的远侧段78的长度截取的剖面图。远侧段78邻近组织80,并被假定浸没在流体82中,使得组织80具有接触流体的表面29。流体82通常包含血液与盐水溶液的混合物。以举例的方式,本文假定远侧段78由绝缘基底84形成,该绝缘基底具有圆柱体86的形状,并且一端被大致平坦的表面88封闭。圆柱体86具有对称轴线90。弯曲段92接合平坦表面88和圆柱体86。圆柱体86的典型直径为2.5mm,并且弯曲段92的典型半径为0.5mm。
远侧段78包括三个电极94、96、98,电极彼此绝缘。电极94、96、98通常包括形成在绝缘基底84上的薄金属层。通常,远侧末端具有与电极94、96、98绝缘的其它电极,为简单起见,未在图中示出。电极94具有平底杯形状,因此在本文中也称为杯形电极。杯形电极94通常具有在大约0.1mm至大约0.230mm范围内的厚度,第二电极94和第三电极96通常为环的形式,并且也被称为环形电极。
电极94、96、98通过线(未示出)连接到控制台24(图1)中的控制器。电极中的至少一个用于消融组织80。通常,在消融期间,消融电极和周围区域内产生热量。为了散热,使用杯形电极中的小冲洗孔100。孔100通常具有在大约0.1mm至0.2mm范围内的直径。冲洗管102向孔100供应盐水溶液,并且盐水溶液通过孔100的流速(导致流体82为血液和盐水溶液的混合物)通过控制台24(图1)中的冲洗模块(未示出)来控制。盐水流速通常在大约2cc/min至20cc/min的范围内,但也可以高于或低于此范围。
盐水温度传感器104(通常为热电偶)位于管102中,并向控制台24(图1)模块56中的电路提供信号,从而使得控制台24能够测量输入孔100的盐水溶液的温度。虽然盐水溶液可在室温下提供,例如在大约19℃至25℃的范围内,溶液在其流过导管期间可稍微加热,使得最终冲洗温度可能略高。
通常,一个或多个位置感测装置106并入远侧末端中。装置106被配置成向处理器22(图1)提供信号,从而使得系统能够探知远侧段78的位置和/或取向。
在一个实施方案中,远侧段78包括一个或多个大致相似的温度传感器108(以举例的方式,图中示出了两个),这些温度传感器通过绝缘体固定地连接到杯形电极94的外表面,以便从表面突出。传感器108具有大约0.3mm的典型直径和大约1.5mm的长度10。在一个实施方案中,传感器108是由generalelectriccompany(schenectady,newyork)生产的热敏电阻器ntcab6型。在一个另选的实施方案中,传感器108包括由semitecusacorporation(torrance,15califomia)生产的“f”型热敏电阻器。以举例的方式,以下描述假定存在三个传感器108,这些传感器关于轴线51对称分布并且位于杯形电极的弯曲段110上。杯形电极的弯曲段110覆盖20远侧末端的弯曲段92。弯曲段110为部分超环面形状,通常为部分圆环面形状,该部分圆环面具有大约0.5mm的管半径。
图4的放大部分112更详细地示出了传感器108中的一个。如部分112所示,绝缘体114将传感器108与杯形电极94的弯曲段110隔开。绝缘体114被选择成提供良好的绝热和电绝缘性能,并且在一些实施方案中,绝缘体114可包括将传感器108粘结到弯曲段110的粘合剂。线116将传感器108连接到控制台24(图1)。
通过使传感器108从杯形电极94的外表面突出,传感器108能够紧密接触组织80。因此,处理器22(图1)能够使用来自传感器108的信号以提供组织80的直接温度测量。在一个实施方案中,传感器108从电极94的外表面突出不超过0.7mm,并且通常突出大约0.5mm。
基于温度计的组织接触确定的附加的细节见于共同转让的美国专利申请公布20170079738中,该专利申请以引用方式并入本文。另选地,可使用如例如在共同转让的美国专利申请公布20170127974中所述的接触力传感器来确定组织接触,该专利申请以引用方式并入本文。另外,可使用如均授予sauarav等人的美国专利申请公布2008/0288038和2008/0275465所述的基于阻抗的方法来确定组织接触,这两篇专利申请以引用方式并入本文;或使用超声换能器来确定组织接触,如共同未决、共同转让的申请15637191所述,该专利申请以引用方式并入本文。该方法可与其它滤波器例如呼吸门控组合,以排除人工痕迹。
现在参见图5,该图为根据本发明的实施方案的网格的点118的示意图。当与心脏12的心内膜表面接触时,通过电极32(图1)配准点。通常,在上文提及的标测期间,处理器22初始存储如在由场生成线圈28限定的三维参照系120中测量的点118的三维坐标。然后处理器22将点118的三维坐标(在本文中也称为三维顶点)通过线段122连接,以产生一组连接的三维三角形,例如三角形124、126、128。名称为“dynamicfeaturerichanatomicalreconstructionfromapointcloud”的共同转让的美国专利申请公布20150164356中所述的规程可用于产生网格130,该专利申请以引用方式并入本文。其它合适的算法包括用于产生网格130的滚球算法。通常,如果使用滚球算法,则将球的尺寸设定为对应于下述体素的尺寸。另选地,网格可生成为delaunay三角剖分。网格的元素各自具有三维坐标。
在一个应用中,三角网格130对心内膜表面进行建模。处理器22(图3)使用图形处理器76来将网格130渲染成用于显示在监视器29上的图像(图1)。
最初,网格130上的实时位置被放置成与心脏的图像配准,该图像通过其它模态诸如计算机断层摄影术或磁共振成像(在本文中称为“ct/mri”图像)获得。一旦完成,感兴趣的点便可从图像的坐标转换到网格130的坐标。
然而,在配准规程之后,ct/mri图像与网格之间的残差仍然存在。根据本发明的实施方案,这些差异有所减少。现在参见图6,该图为根据本发明的实施方案的将心脏的三维模型拟合到ct/mri图像的方法的流程图。为了呈现清楚起见,以具体的线性顺序示出了过程步骤。然而,将显而易见的是,这些步骤中的多个可并行地、异步地或以不同的顺序执行。本领域的技术人员还应当理解,另选地,过程可例如在状态图表中被表示为多个相互联系的状态或事件。此外,可能不需要所有示出的过程步骤来实现该方法。算法包括:
对于每个标测点,优选地通过心肺门控过滤:
1.识别原始网格中的在过滤点的指定半径内的所有顶点。
2.对于每个所识别的顶点,基于其与过滤点的距离来计算权重因子。在一个实施方案中,权重因子为距离的平方反比。
3.按步骤2中计算的权重,使每个所识别的顶点朝向过滤点移位。
在初始步骤132处,通常用多电极标测导管(诸如,球囊或篮形导管)将导管插入到心脏中,其中电极具有在篮或样条上的已知位置,并且具有彼此已知的关系。
接下来,在步骤134处,使用上述方法中的一个,探知电极与心脏的壁接触。在完成步骤134之后,在步骤136处采集电流读数以确定电极在当前位置标测图中的位置,以便构建用于识别电极32中的每个在心脏中的位置的当前位置标测图。用于生成当前位置标测图的一种方法采用图2所示的电路。细节在上述美国专利8,478,383中有所描述。
接下来,在步骤138处,将当前位置标测图放置成与ct/mri图像配准。美国专利7517318和8320711以及美国专利申请公布20160120426的教导内容可用于完成该步骤,所有这些专利均共同转让并以引用方式并入本文。另选地,cartomergetm模块和上述carto系统的其它设施可以使用在相同或不同会话中准备的心脏的图像来完成该步骤。
接下来,在步骤140处,基于acl读数和当前位置标测图来制备三维模型,例如三角网格130(图5)。这可以使用上述美国专利申请公布20150164356的教导内容来完成。为矩阵的顶点分配对应于导管14的电极的标测坐标。
接下来执行网格拟合算法。对于网格中的每个顶点,识别测地距离gd内的所有标测点,以及相对于该顶点分配的标测点(1/gd^2)的相应权重。标测点可位于多于一个顶点的影响半径内,在这种情况下,为该标测点分配顶点的相应权重。根据所分配的权重使顶点朝向相应影响半径内的标测点移位。顶点的实际移位可表示为三维矢量和。
只要顶点继续发生显著改变,或者达到一些其它终止标准,就重复该算法。
在步骤142处,选择标测点。当前标测点的预限定距离(通常2mm至15mm)内的所有原始顶点将在以下步骤中进行评估。“原始顶点”是指在算法的当前迭代开始时的顶点位置。
在步骤143处,选择网格130的原始顶点。然后,在步骤144处,确定与最近对应标测图位置(在适当转换的三维坐标系中)的测地距离。
接下来,在决定步骤146处,确定步骤144中确定的距离是否小于预定距离。如果在步骤144处的确定为肯定的,则控制前进至步骤148。根据顶点与标测图位置之间的距离的平方反比来分配权重。
在执行步骤148之后或者如果决定步骤146处的确定为否定的,则在决定步骤150处,确定是否需要调节更多顶点。如果在决定步骤150处的确定为肯定的,则控制返回到步骤143以迭代循环。
如果在决定步骤150处的确定为否定的,则在决定步骤151处,确定是否有更多标测点仍待评估。如果在决定步骤151处的确定为肯定的,则控制返回到步骤142。
如果在决定步骤151处的确定为否定的,则在决定步骤153处,确定是否需要顶点移位,即,算法是否已收敛,使得所有所需的移位小于一些最小值,或者发生了一些其它终止条件,例如已执行给定的迭代次数。
如果在决定步骤153处的确定为否定的,则规程在最终步骤152处结束。否则,所计算的移位在步骤155处执行。通过使顶点根据所分配的权重朝向对应标测图位置移位来调节网格130。控制随后返回到步骤142,以使用新的网格位置迭代算法。
现在参见图7,该图是三角网格的可根据本发明的实施方案处理的一部分的示意图。最初在步骤140(图6)中构建的网格具有顶点154、156、158。根据acl的标测点被示出为点160、162、164、166,该标测点被放置成与ct/mri图像配准。对中在顶点154、156、158上的相同圆168、170、172的半径表示顶点与在顶点中产生移位的标测点之间的最大距离。
点162、164和顶点154位于圆172内。然而,点162比点164更靠近顶点154。因此,顶点154朝向点162移位距离d1,并且顶点154呈现第一新位置。点164也在圆172内。因此,基于点164与顶点154之间的原始距离来计算新权重。执行沿点164的方向的第二移位。最终位置174等同于如矢量图165指示的从顶点154指向点162和从顶点154指向点164的加权向量的总和。
顶点156与最近标测点160之间的距离超过圆168的半径。因此,顶点156未移位。
顶点158和点166位于圆170内。将注意到的是,点166几乎在圆170的边界处,而点162相对地更靠近顶点154,是顶点154与圆172的边界之间的大约一半。使顶点158朝向点166移位距离d2至位置176。距离d1和d2在图左侧对齐。显然,距离d2小于距离d1。
经调节的矩阵通过接合位置174、176和顶点156的虚线指示。
显而易见的是,当顶点移位时,其相邻点也会受到影响。这种效果可见于图8和图9中,其示出了模拟与标测点180配准的心脏三维表面的一部分的矩阵178的一部分。顶点182是距标测点180最近的顶点。
图8示出了在步骤155(图6)中的第一顶点移位之前标测点180与顶点182之间的关系。图9示出了在步骤155之后的矩阵178(为清楚起见,刻意放大效果)。顶点182现在已移位到标测点180。相邻顶点184、186、188也受到接近标测点180的影响,并且因此移位到标测点180。顶点184、186、188的位移小于顶点182的位移,因为它们距标测点180更远,并且它们在步骤148(图6)中的所分配的权重相应地低于顶点182的权重。
位移的影响是使顶点184、186、188远离甚至更远离标测点180的顶点,如图8和图9中的顶点184与远顶点196之间的关系差异以及图9中的区域190、192、194的失真所证实。顶点196不受标测点180的影响,并且在决定步骤146(图6)中将被忽略。
本领域技术人员应当理解,本发明不限于上文具体示出和描述的内容。相反,本发明的范围包括上文所述各种特征的组合与子组合两者,以及本领域的技术人员在阅读上述说明书时可想到的未在现有技术范围内的上述各种特征的变型和修改。
- 还没有人留言评论。精彩留言会获得点赞!