BRAF抑制剂用于制备治疗程序性坏死疾病的新型药物及其筛选方法与流程
本发明涉及细胞学药理学领域,具体地说,涉及braf抑制剂用于制备治疗程序性坏死疾病的新型药物,还涉及用于制备治疗程序性坏死疾病的新型药物braf抑制剂的筛选方法。
背景技术:
细胞有序增殖、分化和死亡之间的动态平衡是维持内环境稳态的首要条件,程序性坏死是一种重要的细胞死亡方式,与凋亡不同,其不依赖caspase蛋白酶的死亡方式,而是通过rip3和rip1的蛋白激酶,其相互作用及磷酸化影响程序性坏死。细胞坏死是细胞受到强烈理化或生物因素作用引起细胞无序变化的死亡过程,表现为细胞胀大,胞膜破裂,细胞内容物外溢,核变化较慢,dna降解不充分,引起局部严重的炎症反应等。目前,研究证据表明程序性坏死参与了诸多临床难题,最典型的为病原体感染如病毒感染引起的急性重型肝细胞坏死,炎症性疾病如急性胰腺炎、缺血性伤害、神经退化等。坏死细胞凋亡是基于细胞坏死的可调控性渐渐为人研究的新现象,该现象发生在广谱caspase抑制剂z-vad存在的条件下,tnfr1与其相应的天然配体结合后发生的具有坏死样形态特征和自噬活化作用的程序性细胞死亡。
美国袁筠英教授及其同事通过对大约15000种化合物的筛选,找到一种称作程序性坏死抑制剂necrostatin-1(nec-1)的小分子化合物,能阻断坏死样细胞凋亡发生的关键步骤,而特异性地抑制坏死样细胞凋亡。继nec-1之后,科学家又陆续报道nec-1家族的同分异构体nec-3、nec-5和nec-7,并且证实了它们阻断程序性坏死的作用。有报道nec-1的细胞靶点是受体相互作用蛋白1激酶(receptor-interactingprotein1kinase,rip-1),rip-l是细胞死亡通路的开关,与细胞坏死、细胞凋亡及自吞噬死亡均有密切关系,以nec-l为代表的necrostatin家族是研究程序性坏死的机制及其引发疾病的重要工具。除nec-1之外,没有合适的工具进行坏死潜在机制的研究,同时坏死性疾病的靶向药物也存在缺失,亟需开发新型药物。
目前,研究和开发创新药物的基础是选择适当的筛选模型筛选样品,发现作用优良并具有特点的药物。开展高通量药物筛选,是发现创新药物的重要技术手段之一,采用适当药物作用靶点对大量化合物样品进行筛选,而且筛选规模越大,发现新药的机会越多。基于细胞模型的筛选,特别适用于功能蛋白难以分离、生化分析不能完成的复杂靶标(这些靶标可能涉及受体或细胞因子间复杂的相互作用)或多靶标。根据作用形式的不同,细胞模型可以分为作用于靶标(位于单一细胞位置,细胞膜上或细胞内)的筛选和作用于细胞整体功能、活性的筛选;其中前者作用位点和机制清楚,但必须明确靶标的生理功能及相应检测方法,后者能直接反映药物对细胞的整体反应,包括细胞毒性、细胞增殖特性,生长和死亡情况等。
传统的基于天然产物或小分子化合物库筛选药物主要存在两大缺陷,一是在新药和治疗性生物制品的开发创新方面研发时间长,投资风险大;二是筛选出的药物溶解性和安全性亟需动物及临床验证。同时,对于靶向坏死抑制剂的药物筛选及应用,目前主要存在以下几个不足之处,包括:(1)以nec-1为代表的necrostatin家族是一种小分子化合物,虽然容易穿过血脑屏障,是良好的分子机制研究工具,但因其化合物家族难溶于水或者电解质溶液,难以作为临床药物进行新药研发工作;(2)nec-1不是食药监局批准的上市药物,其体内的安全性、细胞毒性和组织毒性缺乏数据支撑,不利于后期临床新药的评估应用;(3)已有新药筛选平台大多是基于未知天然产物或化合物的筛选,其投入成本高,筛选周期和验证实验所需时间长;(4)基于未知化合物筛选出的药物,其对于人体的靶向性不明确,缺乏细胞毒性、细胞代谢和药物毒理学、药物动力学的数据;(5)目前已有的筛选平台基于普通细胞系或动物,筛选平台所用的模式细胞不利于判断药物对于程序性坏死的敏感度测试。
技术实现要素:
鉴于此,本发明的目的在于提供braf抑制剂用于制备治疗程序性坏死疾病的新型药物,还提供上述用于制备治疗程序性坏死疾病的新型药物braf抑制剂的筛选方法,基于fda批准的药物库,选择坏死通路敏感细胞系l929-fadd基因敲除细胞株作为细胞增殖和坏死的模式细胞,从fda药物库的小分子化合物(1068种)中筛选影响抑制细胞死亡的小分子化合物,并进行不同药物浓度的相关性检测,明确其毒性-效应浓度,基于对毒性和恢复效率的综合考量,获得通过抑制细胞发生坏死来实现其制备治疗程序性坏死疾病的新型药物braf抑制剂。
本发明解决其技术问题所采用的技术方案是:
第一方面,braf抑制剂用于制备治疗程序性坏死疾病的新型药物。
进一步地,上述braf抑制剂用于制备治疗程序性坏死疾病的新型药物,通过抑制细胞发生坏死来实现。
更进一步地,上述braf抑制剂用于制备治疗程序性坏死疾病的新型药物,通过靶向抑制细胞发生坏死来实现。
第二方面,上述用于制备治疗程序性坏死疾病的新型药物braf抑制剂的筛选方法,选择坏死通路敏感细胞系l929-fadd基因敲除细胞株作为细胞增殖和坏死的模式细胞,从fda药物库的若干小分子化合物中筛选影响抑制细胞死亡的小分子化合物,再对筛选所得小分子化合物进行不同药物浓度的检测,明确其毒性-效应浓度,并从毒性和恢复效率综合评估,获得通过抑制细胞发生坏死实现其作为制备治疗程序性坏死疾病的新型药物braf抑制剂;具体地,包括以下步骤:
(1)所述坏死通路敏感细胞系l929-fadd基因敲除细胞株复苏、培养与冻存,和
(2)所述药物库的若干小分子化合物定量,且以nec-1作为阳性对照,和
(3)构建用于制备治疗程序性坏死疾病药物的小分子化合物筛选的细胞模型,和
(4)检测步骤(3)中所述细胞模型的细胞存活率,并筛选小分子化合物,和
(5)蛋白免疫沉淀检验验证步骤(4)中所述小分子化合物在坏死信号通路上的表达。
进一步地,步骤(1)的具体方法为:于液氮中取出冻存的l929细胞和l929-fadd-ko细胞,迅速置于37℃水浴,不断晃动细胞快速融解,然后将所述的l929细胞和l929-fadd-ko细胞分别转入培养皿中加入培养基进行培养过夜,细胞贴壁后换液继续培养,待细胞生长至90%密度时传代;其中,
所述l929细胞的培养基为含10%fbs的高糖dmem培养基,于5%co2、37℃和饱和湿度条件下培养;
所述l929-fadd-ko细胞的培养基为含10%fbs的高糖dmem培养基且加入0.05μl/mlpruo和0.33μl/mlnec-1,于5%co2、37℃和饱和湿度条件下培养;
再选生长状态好、生长旺盛的细胞用pbs洗两次后,用胰酶消化至细胞变圆,用rpmi-1640培养基终止反应,800rpf离心5分钟后弃上清,加入冻存液,将细胞分装于冻存管中,放入程序降温盒中保存于-80℃超低温冰箱中,24小时后转移至液氮中;其中,
所述rpmi-1640培养基内含10%胎牛血清、1%青霉素和链霉素,终止反应条件为:95%空气、5%二氧化碳、37℃;
所述冻存液的成分为:10%dmso和90%小牛血清。
进一步地,步骤(2)中小分子化合物定量为:每管100μl,浓度为10mm,使用浓度为30μm,且以使用浓度为30μm的nec-1作为阳性对照。
进一步地,步骤(3)中所述细胞模型的构建方法具体为:
在白色96孔板里加入l929-fadd-ko细胞,每孔50μl,细胞数量为5000个/孔,经不同药物组处理后均放入培养箱24小时;其中,药物组包括:
control组:将完全培养基加入至含有l929-fadd-ko细胞白色96孔板,每孔50μl;
tnfα组:按1ml:1μl的比例在完全培养基加入20ng/ml的tnf-α,再加入至含有l929-fadd-ko细胞白色96孔板,每孔50μl,tnf-α的终浓度为10ng/ml;
nec-1组:按1ml:0.66μl的比例在完全培养基加入90mm浓度的nec-1,再加入至含有l929-fadd-ko细胞白色96孔板,每孔50μl,nec-1的终浓度为30μm;
tnfα+nec-1组:按1ml:0.66μl的比例在完全培养基里加入tnfα+nec-1,然后加入至含有l929-fadd-ko细胞白色96孔板,每孔50μl,tnf-α与nec-1的终浓度保持不变;
tnfα+fdaapprovaldrug组:按1ml:0.66μl的比例在完全培养基里加入tnfα和1086种不同的fda药物,然后加入至含有l929-fadd-ko细胞白色96孔板,每孔50μl,tnf-α与fda药物的终浓度保持不变。
进一步地,步骤(4)中检测所述细胞模型细胞存活率的方法具体为:将celltiter-glo试剂加入经过步骤(3)所述药物组处理后的白色96孔板,每孔100μl,再将上述白色96孔板放在振荡器上温和振荡混匀2分钟,培养箱孵育5分钟,使细胞充分裂解产生稳定的发光信号,检测化学发光强度,其强度代表atp的量,与细胞数量一致,统计在不同暴露浓度下细胞存活率,从细胞存活率筛选,得到用于制备治疗程序性坏死疾病的新型药物braf抑制剂。
本发明的有益效果是:
1、与常用的坏死抑制剂nec-1相比,本发明筛选的braf抑制剂在坏死敏感细胞系l929-fadd敲除株、人细胞系ht29和动物模型上均有极好的抑制坏死效果,其水溶性比nec-1好,braf抑制剂是fda已获批的临床药物,靶向性和安全性有保障,更易于临床推广。
2、本发明的筛选方法基于fda批准药物库,利用坏死敏感细胞系建立高通量筛选平台,通过坏死敏感特殊细胞系和fda药物批准库联合应用,既加快了药物动力学和毒理学的实验过程,又能靶向性在坏死通路上进行“老药新用”坏死抑制剂筛选,避免新药研发投入时间长、实验风险大等缺陷,节约医药资源,降低成本和失败风险、提高成功率,充分开发现有药物的新用途。
附图说明
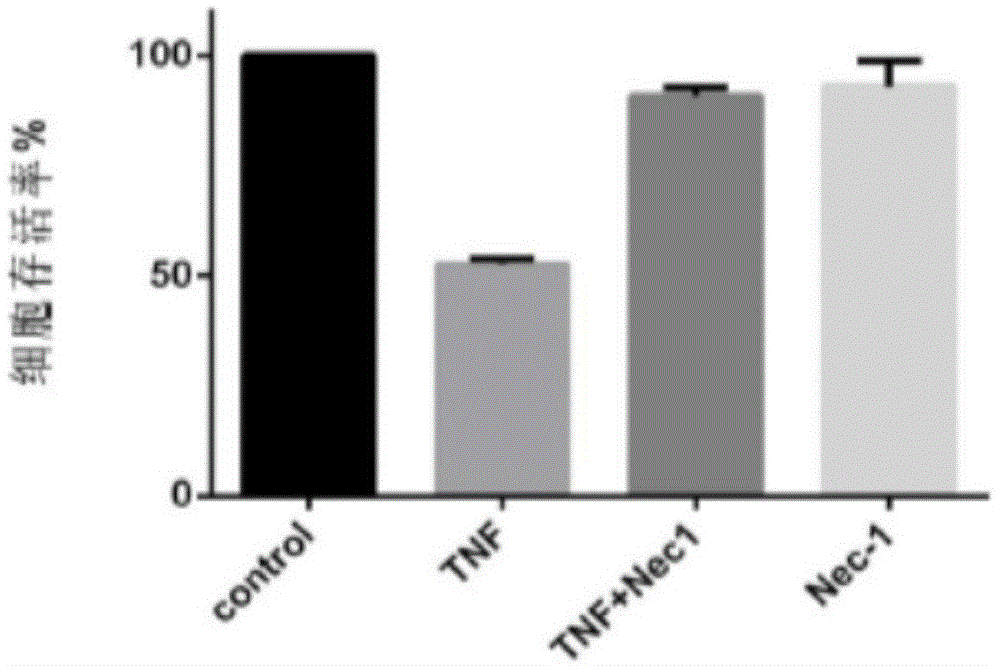
图1为l929-fadd-ko细胞经tnf、nec-1和tnf+nec-1处理后的细胞存活率。
图2为不同浓度、不同处理时间下筛选物坏死抑制功能检测结果示意图。
图3为筛选物抑制rip-1和rip-3磷酸化水平的表达。
具体实施方式
下面结合附图和实施例对本发明进一步说明。
braf抑制剂用于制备治疗程序性坏死疾病的新型药物的筛选方法,选择坏死通路敏感细胞系l929-fadd基因敲除细胞株作为细胞增殖和坏死的模式细胞,从fda药物库的若干小分子化合物中筛选影响抑制细胞死亡的小分子化合物,再对筛选所得小分子化合物进行不同药物浓度的检测,明确其毒性-效应浓度,然后从毒性和恢复效率综合评估,获得braf抑制剂,通过抑制细胞发生坏死实现其作为制备治疗程序性坏死疾病药物的用途;具体步骤为:
(1)坏死通路敏感细胞系l929-fadd基因敲除细胞株复苏、培养与冻存,和
(2)药物库的若干小分子化合物定量,且以nec-1作为阳性对照药物,和
(3)构建用于制备治疗程序性坏死疾病的新型药物筛选的细胞模型,和
(4)检测步骤(3)中细胞模型的细胞存活率,并筛选小分子化合物,和
(5)蛋白免疫沉淀检验验证步骤(4)中筛选所得小分子化合物在坏死信号通路上的表达。
步骤(1)的具体方法为:于液氮中取出冻存的l929细胞和l929-fadd-ko细胞,迅速置于37℃水浴,不断晃动细胞快速融解,然后将的l929细胞和l929-fadd-ko细胞分别转入培养皿中加入培养基进行培养过夜,细胞贴壁后换液继续培养,待细胞生长至90%密度时传代;其中,l929细胞的培养基为含10%fbs的高糖dmem培养基,于5%co2、37℃和饱和湿度条件下培养;l929-fadd-ko细胞的培养基为含10%fbs的高糖dmem培养基且加入0.05μl/mlpruo和0.33μl/mlnec-1,于5%co2、37℃和饱和湿度条件下培养;
再选生长状态好、生长旺盛的细胞用pbs洗两次后,用胰酶消化至细胞变圆,用rpmi-1640培养基终止反应,800rpf离心5分钟后弃上清,加入冻存液,将细胞分装于冻存管中,放入程序降温盒中保存于-80℃超低温冰箱中,24小时后转移至液氮中;其中,rpmi-1640培养基内含10%胎牛血清、1%青霉素和链霉素,终止反应条件为:95%空气、5%二氧化碳、37℃;冻存液的成分为:10%dmso和90%小牛血清。
步骤(2)小分子化合物定量为:每管100μl,浓度为10mm,使用浓度为30μm,且以使用浓度为30μm的nec-1作为阳性对照。
步骤(3)细胞模型的构建方法具体为:在白色96孔板里加入l929-fadd-ko细胞,每孔50μl,细胞数量为5000个/孔,经不同药物组处理后均放入培养箱24小时;其中,药物组包括:
control组:将完全培养基加入至含有l929-fadd-ko细胞白色96孔板,每孔50μl;
tnfα组:按1ml:1μl的比例在完全培养基加入20ng/ml的tnf-α,再加入至含有l929-fadd-ko细胞白色96孔板,每孔50μl,tnf-α的终浓度为10ng/ml;
nec-1组:按1ml:0.66μl的比例在完全培养基加入90mm浓度的nec-1,再加入至含有l929-fadd-ko细胞白色96孔板,每孔50μl,nec-1的终浓度为30μm;
tnfα+nec-1组:按1ml:0.66μl的比例在完全培养基里加入tnfα+nec-1,然后加入至含有l929-fadd-ko细胞白色96孔板,每孔50μl,tnf-α与nec-1的终浓度保持不变;
tnfα+fdaapprovaldrug组:按1ml:0.66μl的比例在完全培养基里加入tnfα和1086种不同的fda药物,然后加入至含有l929-fadd-ko细胞白色96孔板,每孔50μl,tnf-α与fda药物的终浓度保持不变。
步骤(4)细胞模型的细胞存活率的检测方法为:分别用l929-fadd-ko和l929细胞检测筛选所得小分子化合物的ic50值,用不同浓度梯度的fda坏死相关小分子化合物进行处理,给予24h的暴露时间,未给药的空白对照组给予同体积的完全培养基。在暴露结束后,用化学发光法检测细胞活性,并统计在不同暴露浓度下细胞的存活率,通过计算机软件计算的得出ic50。
将celltiter-glo试剂加入经过药物处理后的白色96孔板,每孔100μl,后将微孔板放在振荡器上温和振荡混匀2分钟,培养箱孵育5分钟,使细胞充分裂解产生稳定的发光信号,检测化学发光强度,其强度代表atp的量,与细胞数量一致。
实施例1
用阳性对照tnf(tnfα组)和nec-1抗坏死抑制剂的拮抗组(nec-1组),在fadd-ko细胞系中检测并确定该细胞系对于不同功能药物的敏感度,各组药物处理l929-fadd-ko细胞24h后,通过atp水平检测细胞存活率,control组作为标准,化学发光仪检测数据分析如表1和图1所示,tnfα组(10ng/ml)对细胞的杀伤力几乎达到50%,nec-1组(30μm)能将细胞恢复到90%。
表1l929fadd-ko细胞经tnf、nec-1、tnf+nec-1处理后的细胞存活率
实施例2
用l929细胞增殖模型对fda药物库进行坏死相关的初筛,经一千余个fda药物(10μm)分别处理24小时后,若同一药物处理的三个复孔细胞存活率均高于50%(数值0.5以上),认为该药对l929-fadd-ko细胞具有较强抑制坏死作用,可以作为候选药物。
将上述候选药物用不同浓度、不同处理时间下进行坏死抑制功能检测,以人源细胞系ht29为细胞模型,发现8小时和24小时不同时间处理并无差异,10um和30um的药物浓度均能取得很好的效果,其中braf抑制剂的效果最佳,如图2所示。
将细胞作为control组,tnf坏死组,tnf+braf抑制剂组,tnf+nec-1组进行靶点验证,nec-1作为阳性对照,筛选出的候选药物进行靶向验证。从免疫共沉淀数据可知,braf抑制剂组也可以抑制rip-1和rip-3的表达,并且还可以抑制rip-1和rip-3磷酸化水平的表达(prip-1和prip-3),说明筛选药物可以在通过抑制蛋白活性抑制坏死的发生,进一步说明braf抑制剂和阳性药物nec-1在抑制坏死上是同样的通路和靶点,可以作为制备治疗坏死抑制药物的新用途,如图3所示。
- 还没有人留言评论。精彩留言会获得点赞!