一种药物洗脱器械及其制造方法与流程
本发明涉及植入式医疗器械领域,具体涉及一种药物洗脱器械及其制造方法。
背景技术:
药物洗脱支架在治疗心血管疾病中的应用越来越广泛。目前,大多数的药物洗脱支架的内表面和外表面都涂覆有药物,当将药物洗脱支架植入血管中后,只有支架的外表面和侧表面与血管壁接触,支架的外表面和侧表面释放出来的活性药物会进入血管壁中发挥疗效,而支架的内表面的活性药物不仅无法起到治疗作用,反而会被释放进入血液,并循环至全身,可能会对其他器官起到毒副作用。另外,支架的内表面的活性药物还会抑制支架内皮化,从而增加血栓形成的风险。
并且,现有的药物洗脱支架的药物的释放周期过短,导致药物的释放难以与病变组织的修复进程相匹配,从而难以有效地起到治疗的作用。
技术实现要素:
基于此,有必要提供一种活性药物的释放周期较长,且血栓风险较低的药物洗脱器械。
一种药物洗脱器械,包括基体和载药层;所述基体具有外表面、侧表面和内表面,所述载药层含有药物载体和活性药物,所述基体的外表面、侧表面和内表面均被所述载药层覆盖;所述活性药物仅分布在所述载药层的覆盖所述外表面和侧表面的至少部分区域,且在所述至少部分区域的厚度方向上,靠近所述基体的一侧的活性药物的浓度大于远离所述基体的一侧的活性药物的浓度。
在其中一个实施例中,在所述至少部分区域的厚度方向上,从靠近所述基体的一侧至远离所述基体的一侧,所述活性药物的浓度逐渐降低。
在其中一个实施例中,所述基体上形成有凹槽或微孔,所述凹槽或微孔中填充有活性药物,且所述载药层覆盖所述凹槽或微孔。
在其中一个实施例中,所述凹槽或微孔被所述载药层的分布有所述活性药物的所述至少部分区域所覆盖;或者,
所述凹槽或微孔被所述载药层的不分布有所述活性药物的区域所覆盖。
在其中一个实施例中,所述药物洗脱器械还包括纯药层,所述纯药层包覆所述基体的外表面和侧表面的至少部分区域,且所述纯药层被所述载药层完全覆盖。
在其中一个实施例中,所述载药层中的活性药物仅分布在所述载药层的覆盖所述基体的外表面的区域;或者,所述载药层中的活性药物仅分布在所述载药层的覆盖所述基体的外表面的部分区域;或者,所述载药层中的活性药物分布在所述载药层的覆盖所述基体的外表面的区域和侧表面的区域;或者,所述载药层中的活性药物分布在所述载药层覆盖在所述基体的外表面的区域和至少部分侧表面的区域。
在其中一个实施例中,所述载药层的覆盖所述基体的外表面的区域的厚度和覆盖所述侧表面的区域的厚度均大于所述载药层覆盖所述基体的内表面的区域的厚度。
在其中一个实施例中,所述载药层的厚度为3~20微米。
在其中一个实施例中,所述药物载体为可降解聚合物,所述可降解聚合物与所述活性药物的质量比为10:1至1:3。
一种药物洗脱器械的制造方法,包括:
提供基体,所述基体具有外表面、内表面和侧表面;
将活性药物溶解于溶剂i中形成药物溶液,然后将所述药物溶液涂覆在可所述基体的外表面和侧表面的至少部分区域,干燥后在所述基体上形成覆盖所述外表面和侧表面的至少部分区域的纯药层;及,
将药物载体溶解于溶剂ii中形成涂层溶液,然后将所述涂层溶液涂覆在所述基体的外表面、内表面和侧表面,所述溶剂ii溶解所述纯药层中的活性药物,干燥后在所述基体的表面形成含有所述活性药物和药物载体的载药层,所述基体的所述外表面、侧表面和内表面均被所述载药层覆盖,所述载药层中的活性药物分布在所述载药层的覆盖所述外表面和侧表面的至少部分区域,且在所述至少部分区域的厚度方向上,靠近所述基体的一侧的活性药物的浓度大于远离所述基体的一侧的活性药物的浓度。
上述药物洗脱器械的活性药物仅分布在载药层的覆盖基体的外表面和侧表面的至少部分区域,而载药层的覆盖内表面的区域没有活性药物的分布。因而,该药物洗脱器械能够避免活性药物对其他器官产生毒副作用,且避免了活性药物对器械内皮化的抑制作用,从而有利于内皮细胞在器械上爬附,以降低血栓风险。并且,在载药层的覆盖基体的外表面和侧表面的至少部分区域的厚度方向上,靠近基体的一侧的活性药物的浓度大于远离基体的一侧的活性药物的浓度,有利于延长活性药物的释放周期,从而有利于活性药物的释放与病变组织的修复进程相匹配,提高疗效。
附图说明
通过阅读下文优选实施方式的详细描述,各种其他的优点和益处对于本领域普通技术人员将变得清楚明了。附图仅用于示出优选实施方式的目的,而并不认为是对本发明的限制。而且在整个附图中,用相同的参考符号表示相同的部件。在附图中:
图1为一实施方式的药物洗脱器械的结构示意图;
图2为另一实施方式的药物洗脱器械的结构示意图;
图3为另一实施方式的药物洗脱器械的结构示意图;
图4为另一实施方式的药物洗脱器械的结构示意图;
图5为另一实施方式的药物洗脱器械的结构示意图;
图6为另一实施方式的药物洗脱器械的结构示意图。
具体实施方式
下面将参照附图更详细地描述本公开的示例性实施方式。虽然附图中显示了本公开的示例性实施方式,然而应当理解,可以以各种形式实现本公开而不应被这里阐述的实施方式所限制。相反,提供这些实施方式是为了能够更透彻地理解本公开,并且能够将本公开的范围完整的传达给本领域的技术人员。
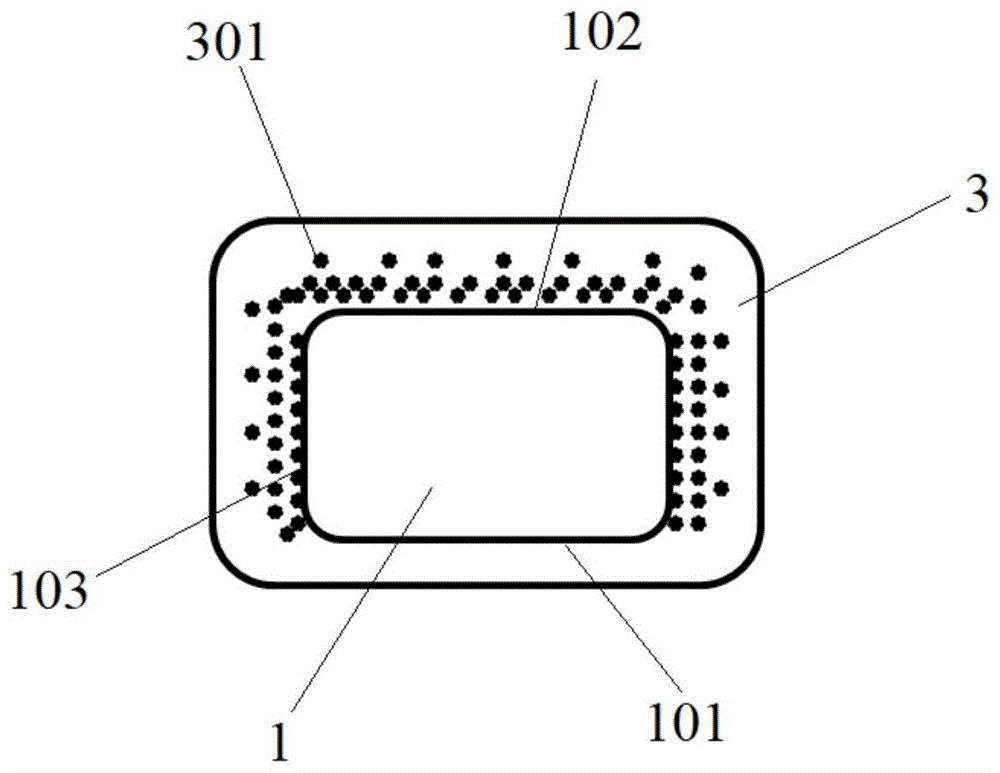
参阅图1,一实施方式提供的一种药物洗脱器械,包括基体1和载药层3。
基体1为镂空的管腔结构。基体1具有内表面101、外表面102和侧表面103。其中,当将药物洗脱器械植入血管中时,内表面为101为与血液直接接触的表面,外表面102为与血管壁直接接触的表面,内表面101和外表面102相对,侧表面103连接内表面101和外表面102。
在一实施方式中,基体1可由生物可吸收的材料的制成。例如,基体1由铁、铁基合金、镁、镁基合金、锌、锌基合金或可吸收的高分子材料等材料制成。可吸收的高分子材料为聚乳酸、聚乙醇酸等等。本实施方式中,基体1由碳含量不高于2.11wt.%的铁基合金制成或基体1由纯铁制成。
在其他实施方式中,基体1由生物不可吸收的材料制成。例如,基体1由镍钛合金、钴铬合金或不锈钢等材料制成。
载药层3完全覆盖基体1的内表面101、外表面102和侧表面103。载药层3含有药物载体(图1未示)和活性药物301。活性药物301仅分布在载药层3的覆盖基体1的外表面102和侧表面103的至少部分区域,载药层3的覆盖基体1的内表面101的区域不含有活性药物301。如此,避免了内表面101上含有活性药物301而导致活性药物301释放到血液中而引起毒副作用的现象。并且,在将该药物洗脱器械植入血管病变部位后,在没有抑制作用的前提下,内皮细胞会爬附于基体1的内表面101上而形成内皮细胞层。内表面101上不含有活性药物301,避免了对内皮细胞爬附的抑制作用,有利于内皮细胞在基体101的内表面101上快速爬附而快速地形成内皮细胞层,从而有利于避免血栓的形成,降低血栓风险。
并且,在载药层3的覆盖基体1的外表面102和侧表面103的区域的厚度方向上,靠近基体1的一侧的活性药物301的浓度大于远离基体1的一侧的活性药物301的浓度。靠近基体1的一侧的活性药物301的浓度大于远离基体1的一侧的活性药物301的浓度有利于延缓活性药物301的释放周期,避免活性药物301释放过快,以控制活性药物301长效释放,促进活性药物301的释放与病变组织的修复进程相匹配,从而提高疗效。
在一实施方式中,在载药层3的覆盖基体1的外表面102和侧表面103的区域的厚度方向上,从靠近基体1的一侧至远离基体1的一侧,活性药物301的浓度逐渐降低,有利于进一步控制活性药物301的释放,提高疗效。
其中,活性药物301仅分布在载药层3的覆盖基体1的外表面102和侧表面103的至少部分区域,是指活性药物301分布在载药层3的覆盖基体1的外表面102和侧表面103的全部区域,活性药物301在载药层3的覆盖基体1的内表面101的区域没有分布;或者,活性药物301仅分布在载药层3的覆盖基体1的外表面102的全部区域和侧表面103的部分区域,活性药物301在载药层3的覆盖基体1的内表面101的区域也没有分布;或者,活性药物301仅分布在载药层3的覆盖基体1的外表面102的全部区域,活性药物301在载药层3的覆盖基体1的内表面101的区域和侧表面103的区域均没有分布;或者,活性药物301仅分布在载药层3的覆盖基体1的外表面102的部分区域,除了该区域,载药层3的覆盖基体1的外表面102的其他区域没有活性药物301分布,并且,活性药物301在载药层3的覆盖基体1的内表面101的区域和侧表面103的区域均没有分布。
在一实施方式中,活性药物301选自抑制血管增生药物、抗血栓类药物、抗炎症反应药物及抗致敏药物中的至少一种。其中,抑制血管增生药物选自紫杉醇、紫杉醇衍生物、雷帕霉素及雷帕霉素衍生物中的至少一种。抗血小板类药物为西洛他唑。抗血栓类药物为肝素。抗炎症反应药物为地塞米松。抗致敏药物选自苯海拉明、氯苯那敏、异丙嗪、氢化可的松、曲安奈德、甲基强的松龙、氯雷他定、非索非那定、左西替利嗪、咪唑斯汀及依巴斯汀中的至少一种。
在一实施方式中,药物载体为可降解聚合物。在一实施方式中,可降解聚合物选自可降解聚酯和可降解酸酐中的至少一种。
在一实施方式中,可降解聚酯选自聚乳酸、聚乙醇酸、聚乳酸乙醇酸共聚物、聚己内酯、聚丙烯酸酯、聚羟基脂肪酸酯、聚丁二酸酯、聚水杨酸酐酯、聚三亚甲基碳酸酯、聚二氧六环酮、聚(β-链烷酸酯)、聚(β-羟基丁酸酯)、聚乙二酸乙二醇酯及聚羟基丁酸酯戊酸酯共聚物中的至少一种。可降解聚酸酐选自聚1,3-双(对羧基苯氧基)丙烷-葵二酸、聚芥酸二聚体-葵二酸及聚富马酸-葵二酸中的至少一种。
在一实施方式中,可降解聚合物由形成上述可降解聚酯的单体和形成上述可降解酸酐的单体中的至少两种共聚而成。
上述可降解聚酯和可降解聚酸酐的降解会在基体1的周围产生酸性产物,从而形成局部低ph值环境,当基体1由可吸收的金属或合金形成时,有利于加速基体1后期的腐蚀。
在一实施方中,载药层3的厚度为3~20微米。在一实施方式中,载药层3中的可降解聚合物(药物载体)与活性药物301的质量比为10:1至1:3。通过合理地设置可降解聚合物与活性药物301的质量比,以较好地实现活性药物301的控释,有利于活性药物301的释放与组织修复进行相匹配。同时,当基体1为可降解或可腐蚀的基体时,合理地设置载药层3的厚度,使得载药层3所含的可降解聚合物的降解周期与基体1的降解或腐蚀周期相匹配,实现在组织修复完成后,可降解聚合物的降解产物加速基体1的降解或腐蚀,从而有利于降低炎症反应,降低远期临床风险。
需要说明的是,载药层3的厚度为3~20微米是指载药层3的平均厚度为3~20微米,即载药层3的覆盖基体1的内表面101的区域的厚度、覆盖外表面102的区域的厚度及覆盖侧表面103的区域的厚度的平均值为3~20微米。
在一实施方式中,载药层3的覆盖基体1的外表面102的区域的厚度和覆盖侧表面103的区域的厚度均大于载药层3覆盖基体1的内表面101的区域的厚度。即,载药层3为厚度不对称的层状结构。
在一实施方式中,基体1上开设有凹槽或微孔。请参阅图2,图2所示的实施方式中,基体1上开设有凹槽104,且凹槽104的开口端所在的表面与基体1的外表面102共面。凹槽104中填充有活性药物。载药层3的含有活性药物301的区域覆盖凹槽104。凹槽104中填充的活性药物与载药层3中的活性药物301可以相同,也可以不同。并且,凹槽104的填充的活性药物的释放晚于载药层3中的活性药物301的释放。如此,进一步延长了活性药物(活性药物301和凹槽104中填充的活性药物)的释放周期,从而提高疗效。
在另一实施方式中,载药层3覆盖凹槽104,但载药层3的分布有活性药物301的区域不覆盖凹槽104,载药层3的不分布有活性药物301的区域覆盖凹槽104。如此,亦能延缓凹槽104中填充的活性药物的释放,从而有利于整体上延缓该药物洗脱器械的活性药物(活性药物301和凹槽104中填充的活性药物)的释放。
在一实施方式中,基体1由可吸收材料制成,且凹槽104中填充的活性药物与载药层3中的活性药物301不同。其中,载药层3中的活性药物301为抑制血管增生药物,以抑制血管增生。凹槽104中填充的活性药物为抗炎症反应药物。载药层3逐渐降解、活性药物301逐渐释放,发挥抑制血管增生作用,当血管中的病变组织修复完成时,基体1开始降解或腐蚀,载药层3的降解裸露出基体1,基体1的凹槽104中填充的抗炎症反应药物逐渐释放而发挥疗效,抑制由于基体1降解或腐蚀可能产生的炎症反应。
在一实施方式中,基体1上开设有用于填充活性药物的微孔。其中,微孔的开孔方向平行于基体1的厚度方向,微孔从基体1的外表面102延伸至内表面101,和/或,微孔的开孔的方向垂直于基体1的厚度方向,微孔从基体1的一侧的侧表面103延伸至另一侧的侧表面103。
请参阅图3,在一实施方式中,药物洗脱器械还包括纯药层2。纯药层2仅含有活性药物,不含有任何药物载体及其他物质。纯药层2中的活性药物与载药层3中的活性药物301相同。图3所示的实施方式中,纯药层2完全包覆在基体1的外表面102和侧表面103,且纯药层2完全不覆盖基体1的内表面101。在另一实施方式中,如图4所示,纯药层2完全包覆在基体1的外表面102,仅部分覆盖基体1的侧表面103,且纯药层2完全不覆盖基体1的内表面101。在另一实施方式中,如图5所示,纯药层2完全包覆在基体1的外表面102,且纯药层2完全不覆盖基体1的侧表面103和内表面101。在另一实施方式中,纯药层2仅覆盖基体1的外表面102的部分区域,基体1的外表面102有部分区域不被纯药层2所覆盖,并且纯药层2完全不覆盖基体1的内表面101和侧表面103。在基体1和载药层3之间设置纯药层2,即分层设置含有活性药物的层,有利于进一步延长活性药物的释放周期。
当药物洗脱器械还包括纯药层2时,基体1上可以开设有用于载药的凹槽104或微孔,或者,基体1也可以不开设任何凹槽104或微孔。图6所示的实施方式中,药物洗脱器械包括纯药层2,且基体1上开设有凹槽104,纯药层2覆盖凹槽104。
上述药物洗脱器械的载药层3完全包覆基体1的内表面101、外表面102和侧表面103,即载药层3为完整的、连续的涂层,通过完整的、连续的涂层载药,且避免基体1的内表面101不含有活性药物301,不仅血栓风险低,还能使药物洗脱器械扩张时,载药层3不易与基体1发生分离而从基体1上脱落。
因此,上述药物洗脱器械的活性药物301的释放周期较长,有利于活性药物301的释放与病变组织的修复进程相匹配,从而提高疗效。并且,基体1的内表面101上不含有活性药物301,能够避免活性药物301的副作用,且有利于内皮细胞在器械上爬附,以降低血栓风险。同时,该药物洗脱器械的可靠性较高,在扩张过程中载药层3不易与基体1发生分离而从基体1上脱落。在植入体内后,活性药物301的释放与组织修复进程相一致,且载药层3的降解与基体1的腐蚀相匹配,以促进基体1快速腐蚀,远期临床风险较低。
在一实施方式中,基体1的表面经过粗糙化处理,有利于纯药层2和/或载药层3在基体1上的附着,有利于提高该药物洗脱器械的可靠性,避免在扩张过程中,纯药层2和/或载药层3从基体1上脱落。
上述药物洗脱器械可以为药物洗脱支架等其他器械,包括但不限于心血管支架、脑血管支架、外周血管支架、胆道支架、食道支架、气道支架或骨科植入物等等。
一实施方式的药物洗脱器械的制造方法,包括如下步骤:
a、提供基体,该基体具有外表面、内表面和侧表面。
在一实施方式中,在进行下一步的步骤之前,还包括对基体的表面进行粗糙化处理和/或在基体上开设凹槽或微孔的步骤。
b、将活性药物溶解于溶剂i中形成药物溶液,然后将药物溶液涂覆在基体的外表面和侧表面中的至少部分区域,干燥后在基体上形成覆盖外表面和侧表面的至少部分区域的纯药层。
药物溶液仅包含活性药物和溶剂i。涂覆的方法包括但不限于喷涂、浸提、蘸取、辊压或静电纺丝等方式。涂覆过程中,将基体的内表面进行遮蔽,避免在基体的内表面形成药物涂层。在一实施方式中,在涂覆过程中,将一圆柱形内撑杆伸入基体的内腔中实现对基体的内表面的遮蔽。
c、将药物载体溶解于溶剂ii中形成涂层溶液,然后将涂层溶液涂覆基体的外表面、内表面和侧表面,溶剂ii溶解纯药层中的活性药物,干燥后在基体的表面形成含有活性药物和药物载体的载药层,基体的外表面、侧表面和内表面均被载药层覆盖,载药层中的活性药物分布在载药层的覆盖外表面和侧表面的部分的至少部分区域,且在该至少部分区域的厚度方向上,靠近基体的一侧的活性药物的浓度大于远离基体的一侧的活性药物的浓度。
涂层溶液仅含有药物载体和溶剂ii,而不含有任何活性药物。溶剂ii溶解纯药层中的活性药物是指溶剂ii部分溶解纯药层中的活性药物或全部溶解纯药层中的活性药物。
通过控制步骤c中涂层溶液的固含量(药物载体的浓度)和涂覆速度,可以控制纯药层中的药物是否全部被溶剂ii溶解并转移到载药层中来,并且实现在载药层的覆盖基体的至少部分区域的厚度方向上,靠近基体的一侧的活性药物的浓度大于远离基体的一侧的活性药物的浓度。进一步地,在载药层覆盖基体的至少部分区域的厚度方向上,从靠近基体的一侧至远离基体的一侧,活性药物的浓度逐渐降低。
在完成步骤b之后,先取下圆柱形内撑杆再进行步骤c的步骤,使得载药层完全包覆基体的内表面、外表面和侧表面。
在一实施方式中,涂层溶液中的药物载体的浓度为1mg/ml~15mg/ml,涂覆速度为0.01ml/min~0.20ml/min。
在一实施方式中,当最终得到的药物洗脱器械还包含纯药层时,可以通过同时控制涂层溶液中的药物载体的浓度、涂覆速度和纯药层的厚度实现。例如,当涂层溶液中的药物载体的浓度及涂层溶液的涂覆速度一定时,可以增加纯药层的厚度,使得最终得到的药物洗脱器械还包含位于基体和载药层之间的纯药层。
上述药物洗脱器械的制造方法通过先在基体上形成纯药层,然后再通过溶剂转移的方式将纯药层中的活性药物转移至载药层中,使得活性药物分散于药物载体中,并且在载药层的覆盖基体的至少部分区域的厚度方向上,靠近基体的一侧的活性药物的浓度大于远离基体的一侧的活性药物的浓度,通过载药层的药物载体及活性药物的浓度分布控制活性药物的长效释放。采用该药物洗脱器械的制造方法制造得到的药物洗脱器械不仅活性药物的释放周期较长、血栓风险较低,并且,通过先形成纯药层,再通过溶剂转移活性药物使活性药物分散于药物载体中的方式,一方面实现了在基体的内表面不含有活性药物,另一方面,相对于传统的将活性药物和药物载体同时溶解于溶剂中获得涂层溶液,并用内撑杆或阻挡杆对基体的内表面进行遮蔽后,再将涂层溶液喷涂在基体上的方式,无论是纯药层还是载药层,上述药物洗脱器械的制造方法所获得的涂层的完整性较好,不会因为在形成同时含有活性药物和药物载体的涂层之后,再将器械与内撑杆或阻挡杆剥离时,对涂层造成损伤。因此,上述药物洗脱器械的制造方法的生产良率较高。
下面以30008规格的药物洗脱支架为例,通过具体实施例对上述药物洗脱器械进一步阐述。
30008规格的药物洗脱支架是指在名义扩张压力(名义扩张压是指将支架扩张至名义直径时所用的压力)下,扩张后的名义直径为3mm,名义长度为8mm。其中,名义直径是指基体扩张后的内径(植入血管中并扩张完成后,基体的内径),名义长度为基体扩张后的长度(植入血管中并扩张完成后,基体的长度)。
下述对具体实施例的检测和实验方法作如下说明:
i、药物释放周期的测试方法:
将药物洗脱支架植入到新西兰兔的髂动脉,在植入后x个月随访节点上处死新西兰兔,取出支架,用合适的溶剂萃取支架中的药物(如乙腈),采用高效液相色谱(hplc)对支架上剩余药量进行检测,将检测结果与支架植入前的通过涂层质量计算得到的支架理论药量进行对比,得到支架剩余药物的质量百分比,如支架上剩余的药物的质量百分比≤5%,则认为x个月为此支架的药物释放周期。
设备:安捷伦高效液相色谱仪1260;色谱柱:安捷伦zobaxsbc184.6*150mm5μm。建议测试参数:检测波长:278nm,柱温:50℃,流动相:乙腈:水=65:35,流速:1.0ml/min。
ii、支架涂层完整性测试方法:
将药物洗脱支架经过模拟输送后在额定爆破压下扩开,然后将扩开后的支架在显微镜下,放大50倍至200倍观察其涂层破损及脱落情况。
iii、支架涂层中药物分布的测试方法:
支架表面药物的分布情况,可以通过拉曼光谱来表征,具体表征方法为:使用赛默飞世尔公司的拉曼光谱仪,在532nm的波长条件,对涂层外表面和侧表面进行拉曼光谱分析,沿基体的厚度方向,从靠近基体的一侧至远离基体的一侧,以一定的步长(例如1μm)逐步往外聚焦测试,当活性药物的特征峰强度逐渐减弱,则说明活性药物的从从靠近基体的一侧至远离基体的一侧逐步减少。
iv:涂层厚度的测试方法:
将支架镶嵌在树脂中磨样,通过sem观察支架截面,测量涂覆在支架上的药物涂层厚度。
v:内皮化速度测试方法:
内皮化速度测试:将药物洗脱器械植入兔子髂动脉,一定时间后,取出药物洗脱器械所在的血管,用戊二醛浸泡(如6h),干燥,然后沿轴向剪开,喷金,sem测量观察药物洗脱器械内皮覆盖率,当覆盖率达到90%以上,说明该药物洗脱器械完成内皮化。
vi:炎性反应积分测试方法
将药物洗脱支架植入兔子髂动脉,一定时间后,取出药物洗脱支架所在的血管用福尔马林浸泡。将福尔马林固定好的组织标本,通过化学处理方法将支架杆去除,然后进行石蜡包埋,使用leica公司2135型切片机切片,切片厚度4-5μm,然后进行he染色,观察病理。
炎症积分计算:0分:在中膜和内膜周围没有炎症细胞(淋巴细胞、嗜酸性粒细胞、巨噬细胞等)。1分:在中膜和内膜周围由少量的炎症细胞浸润。2分:在内膜、中膜和外膜有中等量的炎症细胞浸润,占25%-50%血管面积。3分:在内膜、中膜和外膜有大量的炎症细胞。环绕整个血管,占据50%以上的血管面积,多次观测计算平均值。积分越大,表示炎症越严重。
需要说明的是,上述各项参数或性能的测试方法,不限于上述所列举的方法,任何本领域技术人员掌握的方法均可用以测试。
实施例1
先分别配制浓度为5mg/ml的雷帕霉素的乙酸乙酯溶液和浓度为3mg/ml的聚消旋乳酸的乙酸乙酯溶液;准备30008规格的由纯铁形成的基体,并将基体套在内撑杆上,轻微压缩基体使得基体的内表面紧贴内撑杆。然后通过超声喷涂将雷帕霉素的乙酸乙酯溶液喷涂到基体上,干燥后取下内撑杆得到含有纯药层的支架,其中,纯药层完全覆盖基体的外表面和侧表面;再将聚消旋乳酸的乙酸乙酯溶液喷涂到支架的内表面、外表面和侧表面上,该步骤的涂覆速度为0.03ml/min,聚消旋乳酸的乙酸乙酯溶液中的乙酸乙酯将纯药层中的雷帕霉素全部溶解到聚消旋乳酸涂层中,干燥后得到药物洗脱支架,该药物洗脱支架包含铁基基体和载药层,载药层覆盖铁基基体的外表面、内表面和侧表面,载药层的覆盖外表面和侧表面的区域上,沿基体的厚度方向,雷帕霉素的含量从靠近基体的一侧至远离基体的一侧逐渐减小。其中,支架上的雷帕霉素和聚消旋乳酸的质量比为1:3,载药层的平均厚度10μm。
该支架在体外经过模拟输送后,在额定爆破压下扩开,结果显示载药层完整无起皮、无剥落;支架在植入新西兰兔髂动脉1个月后完全内皮化,活性药物的释放周期为12个月。
实施例2
先分别配制浓度为5mg/ml的雷帕霉素的乙酸乙酯溶液和浓度为10mg/ml的聚消旋乳酸的乙酸乙酯溶液;准备30008规格的由纯铁形成的基体,并将基体套在内撑杆上,轻微压缩基体使得基体的内表面紧贴内撑杆。然后通过超声喷涂将雷帕霉素的乙酸乙酯溶液喷涂到基体上,干燥后取下内撑杆得到含有纯药层的支架,其中,纯药层完全覆盖基体的外表面和侧表面;再将聚消旋乳酸的乙酸乙酯溶液喷涂到支架的内表面、外表面和侧表面上,该步骤的涂覆速度为0.10ml/min,聚消旋乳酸的乙酸乙酯溶液中的乙酸乙酯将纯药层中的雷帕霉素部分溶解到聚消旋乳酸涂层中,干燥后得到药物洗脱支架,该药物洗脱支架包含铁基基体、纯药层和载药层,纯药层完全覆盖铁基基体的外表面和侧表面,载药层完全覆盖纯药层,且载药层覆盖铁基基体的外表面、内表面和侧表面,载药层的覆盖外表面和侧表面的区域上,沿基体的厚度方向,雷帕霉素的含量从靠近基体的一侧至远离基体的一侧逐渐减小。其中,支架上的雷帕霉素和聚消旋乳酸的质量比为1:3,载药层的平均厚度10μm。
该支架在体外经过模拟输送后,在额定爆破压下扩开,结果显示载药层完整无起皮、无剥落;支架在植入新西兰兔髂动脉1个月后完全内皮化,活性药物释放周期为15个月。
实施例3
先分别配制浓度为5mg/ml的雷帕霉素的乙酸乙酯溶液和浓度为10mg/ml的聚消旋乳酸的乙酸乙酯溶液;准备30008规格的由纯铁形成的基体,基体的表面经过粗糙化处理,基体上开设有凹槽,凹槽的开口端所在的平面与基体的外表面共面,将基体套在内撑杆上,轻微压缩基体使得基体的内表面紧贴内撑杆。然后通过超声喷涂将雷帕霉素的乙酸乙酯溶液喷涂到基体上,干燥后取下内撑杆得到含有纯药层的支架,且基体的凹槽中填充有雷帕霉素,纯药层完全覆盖基体的外表面和侧表面;再将聚消旋乳酸的乙酸乙酯溶液喷涂到支架的内表面、外表面和侧表面上,该步骤的涂覆速度为0.08ml/min,聚消旋乳酸的乙酸乙酯溶液中的乙酸乙酯将纯药层中的雷帕霉素部分溶解到聚消旋乳酸涂层中,干燥后得到药物洗脱支架,该药物洗脱支架包含铁基基体、纯药层和载药层,且铁基基体的凹槽中填充有雷帕霉素,纯药层完全覆盖铁基基体的外表面和侧表面,载药层完全覆盖纯药层,且载药层覆盖铁基基体的外表面、内表面和侧表面,载药层的覆盖外表面和侧表面的区域上,沿基体的厚度方向,雷帕霉素的含量从靠近基体的一侧至远离基体的一侧逐渐减小。其中,支架上的雷帕霉素和聚消旋乳酸的质量比为1:3,载药层的平均厚度10μm。
该支架在体外经过模拟输送后,在额定爆破压下扩开,结果显示载药层完整无起皮、无剥落;支架在植入新西兰兔髂动脉1个月后完全内皮化,活性药物的释放周期为18个月。
实施例4
先分别配制浓度为5mg/ml的雷帕霉素的乙酸乙酯溶液和浓度为10mg/ml的聚己内酯的乙酸乙酯溶液;准备30008规格的由纯铁形成的基体,并将基体套在内撑杆上,轻微压缩基体使得基体的内表面紧贴内撑杆。然后通过超声喷涂将雷帕霉素的乙酸乙酯溶液喷涂到基体上,干燥后取下内撑杆得到含有纯药层的支架,其中,纯药层完全覆盖基体的外表面,完全不覆盖基体的侧表面;再将聚己内酯的乙酸乙酯溶液喷涂到支架的内表面、外表面和侧表面上,该步骤的涂覆速度为0.20ml/min,聚己内酯的乙酸乙酯溶液中的乙酸乙酯将纯药层中的雷帕霉素部分溶解到聚消旋乳酸涂层中,干燥后得到药物洗脱支架,该药物洗脱支架包含铁基基体、纯药层和载药层,纯药层仅覆盖铁基基体的外表面,载药层完全覆盖纯药层,且载药层覆盖铁基基体的外表面、内表面和侧表面,载药层的覆盖外表面的区域上,沿基体的厚度方向,雷帕霉素的含量从靠近基体的一侧至远离基体的一侧逐渐减小。其中,支架上的雷帕霉素和聚消旋乳酸的质量比为1:10,载药层的平均厚度10μm。
该支架在体外经过模拟输送后,在额定爆破压下扩开,结果显示载药层完整无起皮、无剥落;支架在植入新西兰兔髂动脉1个月后完全内皮化,活性药物的释放周期为15个月。
实施例5
先分别配制浓度为5mg/ml的紫杉醇的乙酸乙酯溶液和浓度为15mg/ml的聚消旋乳酸的乙酸乙酯溶液;准备30008规格的由纯镁形成的基体,并将基体套在内撑杆上,轻微压缩基体使得基体的内表面紧贴内撑杆。然后通过超声喷涂将紫杉醇的乙酸乙酯溶液喷涂到基体上,干燥后取下内撑杆得到含有纯药层的支架,其中,纯药层完全覆盖基体的外表面和部分覆盖基体的侧表面;再将聚消旋乳酸的乙酸乙酯溶液喷涂到支架的内表面、外表面和侧表面上,该步骤的涂覆速度为0.1ml/min,聚消旋乳酸的乙酸乙酯溶液中的乙酸乙酯将纯药层中的紫杉醇部分溶解到聚消旋乳酸涂层中,干燥后得到药物洗脱支架,该药物洗脱支架包含镁基基体、纯药层和载药层,纯药层完全覆盖镁基基体的外表面、部分覆盖基体的侧表面,载药层完全覆盖纯药层,且载药层覆盖镁基基体的外表面、内表面和侧表面,载药层的覆盖外表面的区域和覆盖侧表面的部分区域上,沿基体的厚度方向,紫杉醇的含量从靠近基体的一侧至远离基体的一侧逐渐减小。其中,支架上的紫杉醇和聚消旋乳酸的质量比为1:1,载药层的平均厚度3μm。
该支架在体外经过模拟输送后,在额定爆破压下扩开,结果显示载药层完整无起皮、无剥落;支架在植入新西兰兔髂动脉1个月后完全内皮化,活性药物的释放周期为6个月。
实施例6
先分别配制浓度为5mg/ml的肝素的水溶液和浓度为3mg/ml的聚消旋乳酸的乙酸乙酯溶液;准备30008规格的由左旋聚乳酸形成的基体,并将基体套在内撑杆上,轻微压缩基体使得基体的内表面紧贴内撑杆。然后通过超声喷涂将肝素的水溶液喷涂到基体上,干燥后取下内撑杆得到含有纯药层的支架,其中,纯药层完全覆盖基体的外表面和侧表面;再将聚消旋乳酸的乙酸乙酯溶液喷涂到支架的内表面、外表面和侧表面上,该步骤的涂覆速度为0.02ml/min,聚消旋乳酸的乙酸乙酯溶液中的乙酸乙酯将纯药层中的肝素全部溶解到聚消旋乳酸涂层中,干燥后得到药物洗脱支架,该药物洗脱支架包含左旋聚乳酸基体和载药层,且载药层覆盖左旋聚乳酸基体的外表面、内表面和侧表面,载药层的覆盖外表面和侧表面的区域上,沿基体的厚度方向,肝素的含量从靠近基体的一侧至远离基体的一侧逐渐减小。其中,支架上的肝素和聚消旋乳酸的质量比为3:1,载药层的平均厚度20μm。
该支架在体外经过模拟输送后,在额定爆破压下扩开,结果显示载药层完整无起皮、无剥落;支架在植入新西兰兔髂动脉2个月后完全内皮化,活性药物的释放周期为6个月。
实施例7
先分别配制浓度为5mg/ml的地塞米松的乙酸乙酯溶液和浓度为10mg/ml的聚乳酸-羟基乙酸共聚物的乙酸乙酯溶液;准备30008规格的由纯锌形成的基体,基体的表面经过粗糙化处理,基体上开设有凹槽,凹槽的开口端所在的平面与基体的外表面共面,将基体套在内撑杆上,轻微压缩基体使得基体的内表面紧贴内撑杆。然后通过超声喷涂将地塞米松的乙酸乙酯溶液喷涂到基体上,干燥后取下内撑杆得到含有纯药层的支架,且基体的凹槽中填充有地塞米松,纯药层完全覆盖基体的外表面和侧表面;再将支架套在带有阻挡杆的夹具上,阻挡杆直径小于支架内径,将聚乳酸-羟基乙酸共聚物的乙酸乙酯溶液喷涂到支架上,干燥后得到载药层。阻挡杆部分遮挡了基体的内表面,使得得到的载药层的覆盖基体的外表面的区域的厚度和覆盖侧表面的区域的厚度均大于载药层覆盖基体的内表面的区域的厚度,该步骤的涂覆速度为0.08ml/min,聚乳酸-羟基乙酸共聚物的乙酸乙酯溶液中的乙酸乙酯将纯药层中的地塞米松部分溶解到聚乳酸-羟基乙酸共聚物涂层中,干燥后得到药物洗脱支架,该药物洗脱支架包含锌基基体、纯药层和载药层,且锌基基体的凹槽上填充有地塞米松,纯药层覆盖锌基基体的外表面和侧表面,载药层完全覆盖纯药层,且载药层覆盖锌基基体的外表面、内表面和侧表面,载药层的覆盖外表面和侧表面的区域上,沿基体的厚度方向,地塞米松的含量从靠近基体的一侧至远离基体的一侧逐渐减小。其中,支架上的地塞米松和聚乳酸-羟基乙酸共聚物的质量比为1:1,载药层的平均厚度5μm。
该支架在体外经过模拟输送后,在额定爆破压下扩开,结果显示载药层完整无起皮、无剥落;支架在植入新西兰兔髂动脉2个月后完全内皮化,活性药物的释放周期为9个月。
实施例8
先分别配制浓度为5mg/ml的氯雷他定的乙酸乙酯溶液和浓度为1mg/ml的聚左旋乳酸的乙酸乙酯溶液;准备30008规格的由纯铁形成的基体,基体的表面经过粗糙化处理,基体上开设有凹槽,凹槽的开口端所在的平面与基体的外表面共面,并将基体套在内撑杆上,轻微压缩基体使得基体的内表面紧贴内撑杆。然后通过超声喷涂将氯雷他定的乙酸乙酯溶液喷涂到基体上,干燥后取下内撑杆得到含有纯药层的支架,其中,纯药层完全覆盖基体的外表面和侧表面;再将聚左旋乳酸的乙酸乙酯溶液喷涂到支架的内表面、外表面和侧表面上,该步骤的涂覆速度为0.03ml/min,聚左旋乳酸的乙酸乙酯溶液中的乙酸乙酯将纯药层中的氯雷他定全部溶解到聚左旋乳酸涂层中,干燥后得到药物洗脱支架,该药物洗脱支架包含铁基基体和载药层,且载药层覆盖铁基基体的外表面、内表面和侧表面,载药层的覆盖外表面和侧表面的区域上,沿基体的厚度方向,氯雷他定的含量从靠近基体的一侧至远离基体的一侧逐渐减小。其中,支架上的氯雷他定和聚左旋乳酸的质量比为1:6,载药层的平均厚度15μm。
该支架在体外经过模拟输送后,在额定爆破压下扩开,结果显示支架涂层完整无起皮、无剥落;支架在植入新西兰兔髂动脉1个月后完全内皮化,支架的药物释放周期为15个月。
实施例9
先分别配制浓度为5mg/ml的地塞米松的乙酸乙酯溶液、浓度为5mg/ml的雷帕霉素的乙酸乙酯溶液和浓度为3mg/ml的聚消旋乳酸的乙酸乙酯溶液;准备30008规格的由纯铁形成的基体,基体的表面经过粗糙化处理,基体上开设有凹槽,凹槽的开口端所在的平面与基体的外表面共面,并将基体套在内撑杆上,轻微压缩基体使得基体的内表面紧贴内撑杆。然后通过超声喷涂将地塞米松的乙酸乙酯溶液喷涂到基体上的凹槽中,干燥后继续喷涂雷帕霉素的乙酸乙酯溶液到基体上,干燥后取下内撑杆得到含有纯药层的支架,且凹槽含有地塞米松,其中,纯药层(仅含雷帕霉素)完全覆盖基体的外表面和侧表面;再将聚消旋乳酸的乙酸乙酯溶液喷涂到支架的内表面、外表面和侧表面上,该步骤的涂覆速度为0.01ml/min,聚消旋乳酸的乙酸乙酯溶液中的乙酸乙酯将纯药层中的雷帕霉素全部溶解到聚消旋乳酸涂层中,干燥后得到药物洗脱支架,该药物洗脱支架包含铁基基体、载药层和凹槽中地塞米松,且载药层覆盖铁基基体的外表面、内表面和侧表面,载药层的覆盖外表面和侧表面的区域上,沿基体的厚度方向,雷帕霉素的含量从靠近基体的一侧至远离基体的一侧逐渐减小。其中,支架上的地塞米松、雷帕霉素和聚消旋乳酸的质量比为1:2:6,载药层的平均厚度10μm。
该支架在体外经过模拟输送后,在额定爆破压下扩开,结果显示支架涂层完整无起皮、无剥落;支架在植入新西兰兔髂动脉1个月后完全内皮化,支架的雷帕霉素释放周期为12个月,12个月的炎性反应积分为1分。
实施例10
先分别配制浓度为5mg/ml的雷帕霉素的乙酸乙酯溶液和浓度为10mg/ml的聚消旋乳酸的乙酸乙酯溶液;准备30008规格的由纯铁形成的基体,基体的表面经过粗糙化处理,基体上开设有凹槽,凹槽的开口端所在的平面与基体的外表面共面,通过喷墨打印机将雷帕霉素的乙酸乙酯溶液喷涂到基体外表面的局部区域上,干燥后取下内撑杆得到含有纯药层的支架,且基体的凹槽中填充有雷帕霉素,纯药层完全覆盖基体的外表面和侧表面;再将聚消旋乳酸的乙酸乙酯溶液喷涂到支架的内表面、外表面和侧表面上,该步骤的涂覆速度为0.08ml/min,聚消旋乳酸的乙酸乙酯溶液中的乙酸乙酯将纯药层中的雷帕霉素部分溶解到聚消旋乳酸涂层中,干燥后得到药物洗脱支架,该药物洗脱支架包含铁基基体、纯药层和载药层,且铁基基体的凹槽中填充有雷帕霉素,纯药层仅部分覆盖铁基基体的外表面,且铁基基体的载药层完全覆盖纯药层,且载药层覆盖铁基基体的外表面、内表面和侧表面,载药层的覆盖外表面和侧表面的区域上,沿基体的厚度方向,雷帕霉素的含量从靠近基体的一侧至远离基体的一侧逐渐减小。铁基基体的部分凹槽被载药层的不分布有所述活性药物的区域所覆盖。其中,支架上的雷帕霉素和聚消旋乳酸的质量比为1:3,载药层的平均厚度10μm。
该支架在体外经过模拟输送后,在额定爆破压下扩开,结果显示载药层完整无起皮、无剥落;支架在植入新西兰兔髂动脉1个月后完全内皮化,活性药物的释放周期为18个月。
对比例1
先配制雷帕霉素和聚消旋乳酸的质量比为1:3的乙酸乙酯的混合溶液;准备30008规格的铁基基体,并将铁基基体套在内撑杆上,轻微压缩铁基基体使得铁基基体的内表面紧贴内撑杆。然后通过超声喷涂将上述混合溶液喷涂到铁基基体上,干燥后取下内撑杆得到含有载药层的支架。该支架包含铁基基体和载药层,载药层覆盖铁基基体的外表面和侧表面。其中,支架上的雷帕霉素和聚消旋乳酸的质量比为1:3,载药层的平均厚度为10μm。
该支架在体外经过模拟输送后,在额定爆破压下扩开,结果显示载药层破损,载药层的部分区域脱落;支架在植入新西兰兔髂动脉1个月后完全内皮化,活性药物的释放周期为3个月,12个月的炎性反应积分为2分。
对比例2
先配制雷帕霉素和聚消旋乳酸的质量比为1:1的乙酸乙酯的混合溶液;准备30008规格的铁基基体。通过超声喷涂将上述混合液喷涂到铁基基体上,干燥后得到含有载药层的支架,该支架包含铁基基体和载药层,其中,载药层完全包覆铁基基体的表面。载药层的平均厚度为20μm。
该支架在体外经过模拟输送后,在额定爆破压下扩开,结果显示载药层完整无起皮、无剥落;支架在植入新西兰兔髂动脉3个月后完全内皮化,活性药物的释放周期为3个月。
应理解的是,文中使用的术语仅出于描述特定示例实施方式的目的,而无意于进行限制。除非上下文另外明确地指出,否则如文中使用的单数形式“一”、“一个”以及“所述”也可以表示包括复数形式。术语“包括”、“包含”、“含有”以及“具有”是包含性的,并且因此指明所陈述的特征、步骤、操作、元件和/或部件的存在,但并不排除存在或者添加一个或多个其它特征、步骤、操作、元件、部件、和/或它们的组合。文中描述的方法步骤、过程、以及操作不解释为必须要求它们以所描述或说明的特定顺序执行,除非明确指出执行顺序。还应当理解,可以使用另外或者替代的步骤。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!