用于治疗骨髓相关疾病用途的放射性免疫缀合物的制作方法
本发明涉及放射性免疫缀合物用于治疗骨髓相关疾病的用途,特别是al-淀粉样变性。
发明背景
骨髓是骨骼内部的软的组织。它负责产生红细胞、白细胞、髓细胞、浆细胞和血小板。骨髓包含干细胞,干细胞是能够转化为人体所需的任何细胞的原始细胞。根据需要,干细胞分化成为特定类型的细胞。只有成熟的细胞从骨髓释放到血流中。
骨髓相关疾病通常与任何成熟血细胞或前体或前驱未成熟细胞的产生中的异常有关。
在本发明的一种实施方式中,骨髓相关疾病是那些可以通过干细胞移植(例如自体干细胞移植或同种异体干细胞移植)治疗的疾病。在本发明的一个方面,骨髓相关疾病是那些可以通过造血干细胞移植治疗的疾病。干细胞移植,特别是造血干细胞移植,在某些疾病中用于替换掉例如在骨髓的代谢水平、免疫水平、基因水平或恶性转化上的缺陷。
在al-淀粉样变性中,骨髓中浆细胞的异常赘生性克隆过度产生单克隆免疫球蛋白轻链,其在器官中自组装并沉积,导致器官功能障碍。沉积物具有特有的β-折叠二级结构,由电子显微镜看到,为8-10nm线性非分支原纤维。实际上,除了大脑以外的任何器官或器官的组合都可能受到影响。
al-淀粉样变性是通过对组织活检标本进行刚果红染色(其在偏振光下显示出病征性苹果绿二色性)诊断的。最近,在英国国家淀粉样变性中心开发了放射性标记的血清淀粉样蛋白p闪烁扫描法(sap)作为用于对淀粉样蛋白沉积进行非侵入性成像和监测的工具,并已明确地表明,各种类型的淀粉样沉积物存在于动态转换的状态下,且当相应的原纤维前体蛋白的丰度充分降低时可能消退。
al-淀粉样变性具有终生发病率,且在英国每一千人中就有0.5-1之间的人死于al-淀粉样变性。男性和女性的发病率相同,且诊断时的平均年龄为65岁。如果不进行治疗,它将不可阻挡地发展,且直到最近,中位存活期也仅为6-15个月。
在确定了al-淀粉样变性沉积物的免疫球蛋白性质之后,文献中出现了声称对细胞毒性治疗有有益的响应的病例报告。在由梅奥诊所(mayoclinic)小组对219名患者进行的前瞻性随机试验中,系统地将口服美法仑(melphalan)和泼尼松龙(prednisolone)(mp)的疗效与秋水仙碱(作为安慰剂)进行了比较。mp组和秋水仙碱组中的中位存活期分别为17个月和8.5个月,首次有力地证明了细胞毒性治疗对al-淀粉样变性的益处(kyleetal.,thenewenglandjournalofmedicine,1997;336(17):1202-7)。为了确定哪些al-淀粉样变性患者可能从mp治疗中获益最大,梅奥诊所研究人员报告了在有计划的24-36个月中对接受该治疗的153名患者的长期随访(gertzetal.,journalofclinicaloncology,1999;17(1):262-7)。使用严格的响应标准,其包括完全消除任何治疗前血清或尿液单克隆蛋白连同改善器官功能障碍,18%的患者有响应。响应者中的中位存活期为89.4个月,且实现响应的中位时间为11.7个月。然而,响应者中有四分之一死于脊髓发育不良或急性白血病。
al-淀粉样变性中对mp相对较差且迟缓的响应促使人们对使用高剂量美法仑疗法和干细胞移植(asct)产生了兴趣。这在1996年首次被报道,且随后不久comenzo和他的同事报告了一系列25例患者(comenzoetal.,blood,1998;91(10):3662-70)。几个中心随后报告了约60%的患者从该程序中存活的临床疗效。然而,淀粉样蛋白患者的治疗相关死亡率显著且一贯地高于骨髓瘤患者。在两项有经验的单中心美国研究中100天死亡率为约14%,且在两项多中心欧洲研究中为~40%,反映了淀粉样蛋白对多器官系统功能的损害。这些发现强调了改进选择进行asct的患者和改善周围移植临床管理的需要,同时激发了人们对替代的、毒性较小的治疗方案的兴趣。
在美国,患者的选择被细化(comenzoetal.,blood,2002;99(12):4276-82)且asct仍是治疗al-淀粉样变性的治疗性“黄金标准”。波士顿小组最近报告了对患有全身性al-淀粉样变性的701名连续患者的长期随访结果;394人(56%)被认为符合条件进行asct,其中82人由于患者选择或疾病进展而没有继续进行(skinneretal.,anninternmed,2004;140(2):85-93)。312名开始治疗的患者中治疗相关死亡率(trm)为13%,且整个群体的中位存活期为4.6年。不符合条件的患者中中位存活期仅为4个月。有趣的是,dispenzieri等人研究了从1983年至1997年在梅奥诊所治疗的al-淀粉样变性患者的数据,并确定了现在已符合条件进行asct的229名患者。他们的中位存活期为42个月,且5年和10年存活率分别为36%和15%,表明asct的存活优势部分是由于患者选择,而不是特定的治疗方案。一项法国随机试验进一步对asct在al-淀粉样变性中的作用产生怀疑,由于在具有里程碑意义的分析中,相比口服美法仑地塞米松化疗,asct组中~22%的治疗相关死亡率高且没有改善总体存活率(jaccardetal.,thenewenglandjournalofmedicine,2007;357(11):1083-93)。然而,高trm和低于预期的响应引起了对该项研究的许多批评。因此,asct的作用仍不清楚,且在英国国家淀粉样变性中心的实践最近已很少推荐asct作为一线疗法,而是考虑到其在没有充分响的患者中的作用,推荐诸如长春新碱、阿霉素和地塞米松(vad)的中等剂量化疗方案的一线疗法。最近确定了在1994年和2004年之间在英国国家淀粉样变性中心发现且进行了asct的所有92名al-淀粉样变性患者中的结果,整个群体的中位总存活期是63个月,且尽管trm为23%,但回顾性分析确定了没有trm的患者子集(goodmanetal.,haematologica/thehematologyjournal,2005;90(s1):201)。从nac研究中确定的因素引发了在英国对患者选择标准进行改进,且2003-2011年中进行asct的83名患者的数据显示trm为6%。
即使在高度选择的患者组中,治疗的trm和发病率仍然存在。大多数治疗发病率是由于高剂量美法仑的毒性导致粘膜炎,由于药物的终末器官损伤或血细胞减少的并发症。
高剂量美法仑治疗必须在患者接受其自身造血干细胞(自体移植;asct)或遗传上相关的人类供体的造血干细胞(同种异体移植)之前应用。这种预处理是消除患者的造血系统以及恶性干细胞两者的关键步骤,从而为患者成功移植做好准备并产生最佳的治疗效果。
由于高剂量美法仑预处理步骤的毒性,asct仅能应用于身体状况相对较好的符合条件的患者,主要是年龄小于65岁的较年轻患者和/或器官功能良好的患者。
尽管仔细挑选了所谓的符合条件的患者,但仍有个位数百分比的治疗相关死亡率(trm),主要由高剂量美法仑治疗的各种毒性和直接或间接后果造成。显然,一直需要使得降低主要由高剂量美法仑治疗导致的治疗相关死亡率成为可能的选择性治疗方法。
使用对某些抗原,诸如cd45、cd33,cd20,cd19和cd66,有选择性的单克隆抗体的许多放射性免疫缀合物(ric)已经成为用于血液恶性肿瘤(诸如急性淋巴细胞白血病(all)、急性髓系白血病(aml)和转变的脊髓发育不良(mds))中移植之前骨髓预处理的研究的对象(matthewsd.etal.,blood,1999,94:1237-1247;jurcicjg,cancerbiotherradiopharm.,2000,15:319-326;bunjesd.etal.,blood,2001,98:565-572)。放射性免疫缀合物除了标准预处理方案外也被应用。然而,大多数这些放射性免疫缀合物在器官中显示出非选择性摄取。放射性免疫缀合物的非靶向摄取的原因是多因素的,且包括体内免疫缀合物的特异性和非特异性摄取以及不稳定性。由于所使用的抗体的选择性和/或所附着的放射性标记的稳定性,已知的ric在肝脏、肺和肾脏中显示出严重的剂量限制性毒性(例如,如由bunjesetal.,blood,2001,98:565-572研究的使用188re标记的抗cd66mab分子所观察的)。不幸的是,仅有少部分的注射剂量达到了期望目标(karger,contrib.oncol.basel,1992,43,100-145)。该限制是在靶向抗体领域中许多临床研究未成功的主要原因,其中,剂量限制性毒性不允许产生期望的治疗效果。
wo2007/062855描述了使用由90y放射性标记的cd66单克隆抗体对多发性骨髓瘤的治疗。所述放射性免疫缀合物不在肝脏或肾脏中累积,并选择性地靶向髓和脾脏。在第一步骤中,进行使用111in标记的抗cd66放射性免疫缀合物的剂量学研究,以确定相应患者对治疗的适合性。那些显示出良好剂量学(多于90%)的患有多发性骨髓瘤的患者用90y标记的抗cd66进行预处理(逐步从5mbq/kglbw至45mbq/kglbw)。在第一调节步骤之后,患者接受标准的高剂量美法仑治疗,然后进行自体造血干细胞移植。
从随机临床ii期研究的结果显示,在抗cd66抗体靶向放射治疗(atrt)之后进行高剂量美法仑和asct(组a)与高剂量美法仑和asct(组b)相比,显示出从50%的完全消退率,而组b具有的完全消退率仅为25%。两个治疗组的副作用概况相当。
wo2011/144744提出在用于治疗炎性和/或自身免疫性疾病的干细胞移植之后,使用靶向放射性免疫缀合物(ric)联合细胞毒性剂,诸如美法仑。
发明人意外地发现,使用包括cd66结合组分和放射性核素的ric的骨髓预处理中的靶向放射性免疫疗法,适合用于治疗患有骨髓相关疾病(诸如al-淀粉样变性)的患者,特别是人类患者,且没有可检测到的副作用发生。
因此,本发明的一个方面是放射性免疫缀合物(ric),其包括cd66结合组分和放射性核素,用于治疗骨髓相关的疾病,诸如al-淀粉样变性。
即,根据本发明,包括cd66结合组分和放射性核素的放射性免疫缀合物(ric)可以用作在骨髓相关的疾病(诸如al-淀粉样变性)的治疗中给药的药物。
在另一方面,包括cd66结合组分和放射性核素的放射性免疫缀合物可用作骨髓预处理药物,特别地在干细胞移植前,更特别地在造血干细胞移植前。骨髓预处理可包括免疫消除和清髓处理,以预防移植排斥和/或减少骨髓中缺陷细胞的数量。
骨髓预处理可以例如通过使用本领域已知的组织病理学染色程序确定骨髓的耗竭来测量,或者通过评估外周血细胞计数的程度来测量。可替代地,可以评估移植细胞的接受度作为对成功预处理的度量。
在优选的实施方式中,随后的干细胞移植可以是自体的或同种异体的。结果表明,根据本发明的骨髓预处理不会引起诸如恶心呕吐、发热、粘膜炎、腹泻和脓毒症的任何副作用,其在现有技术骨髓预处理中经常发生。因此,与根据现有技术方案进行的骨髓预处理治疗(诸如高剂量化疗,例如高剂量美法仑治疗)相比,在骨髓预处理中使用根据本发明的ric减少或甚至避免了住院治疗。在优选的实施方式中,本发明的ric优选地用作骨髓预处理中的药物,而不需额外的细胞毒性或细胞抑制剂,诸如美法仑。
在另一实施方式中,本发明的ric和与标准现有技术剂量相比剂量减少的细胞毒性剂或细胞抑制剂一起用作骨髓预处理中的药物。
治疗方案可包括给药适合于骨髓的成像和/或治疗性照射的放射性核素。ric给药优选地是与其他治疗措施特别是干细胞移植联合的预处理方案。ric的放射性核素可以是治疗有效的放射性核素。例如,治疗有效的放射性核素可以是β-或β/γ-发射放射性核素,诸如钇-90(90y)、碘-131(131i)、钐-153(153sm)、钬-166(166ho)、铼-186(186re)、铼-188(188re)或镥-177(177lu),或可以是α-发射体,诸如砹-211(211at)、铋-212(212bi)、铋-213(213bi)或锕-225(225ac)。在优选的实施方式中,治疗有效的放射性核素为钇-90(90y)。
ric的放射性核素也可以是成像放射性核素,即适合于监测和/或确定ric的药代动力学的放射性核素。例如,成像放射性核素可以是铟-111(111in)、碘-131(131i)或锝-99m(99mtc)。在优选的实施方式中,成像放射性核素为铟-111(111in)。
在特别优选的实施方式中,本发明包括在给药前确定治疗性ric的治疗有效剂量。该确定可以例如基于疾病进展的严重程度对待治疗的受试者或一组受试者分别进行。例如,本发明可包括给药包括成像放射性核素的ric,以及随后给药包括治疗有效的放射性核素的ric。借助首先给药成像ric,可以对相应受试者(例如人类患者)分别确定和/或调整随后给药的治疗性ric的有效剂量。在该实施方式中,成像ric和治疗性ric的cd66结合组分优选地是相同的,至少在cd66结合特异性和/或亲和性方面是相同的。
在优选的实施方式中,在给药治疗性ric之前2-10天,优选地2-8天,向患者给药成像ric。
然而,应注意的是,如果已经收集了足够的患者数据,例如在数据库中,那么在给药治疗性ric之前可能没有必要给药成像ric以确定ric的治疗活性量。因此,本发明的另一优选的实施方式包括通过评估已有的数据,例如来自数据库的数据,特别地结合患者的骨髓细胞性的免疫组织化学分析,从而确定ric的治疗有效剂量。
cd66结合组分优选地是包括至少一种抗体结合结构域的多肽,例如抗体,特别是单克隆抗体、嵌合抗体、人源化抗体或重组抗体,诸如单链抗体或其片段,例如蛋白水解抗体片段,诸如fab-、fab'-或f(ab)2-片段,或重组抗体片段,诸如单链fv-片段。
cd66结合组分也可以是包括至少一种抗体结合结构域和其他结构域(例如效应结构域)的融合多肽,诸如酶或细胞因子。可替代地,cd66结合的分子可以是锚蛋白或支架多肽。
在优选的实施方式中,cd66结合组分选择性地与人类cd66抗原或其表位(例如cd66a、b、c或e)结合。在特别优选的实施方式中,cd66结合组分是bw250/183抗体。该抗体的小鼠、人源化和重组形式在ep-a-0388914、ep-a-0585570和ep-a-0972528中描述,其通过引用并入本文。
放射性核素优选地通过螯合剂与cd66结合组分连接,该连接优选地为共价连接。更优选地,放射性核素通过下式的结构与cd66结合组分连接
[(螯合剂)-(r1)p-(r2-r3)n]m-(cd66结合组分)
其中n为0或1,
m为1至15,
p为0或1,
r1和r3独立地选自由-nh-cs-nh-、-nhconh-、-nhcoch2s-、-s-s-、-nh-nh-、-nh-、-s-、-conhnh-、-sch2ch2coonh-、-sch2ch2so2-、-sch2ch2so2nh-、-conh-、-o-ch2ch2o-、-co-、-coo-、-nh-o-、-conho-、-s-(ch2)3c(nh)nh-、-nh-coo-、-o-和
r2选自由c1-c18亚烷基、支链c1-c18、-ch2-c6h10-、亚对烷基苯基、对亚苯基、间亚苯基、亚对烷氧基苯基、亚萘基、-[ch2ch2o]x-、-[ch2ch2soch2ch2]x-、-[ch2ch2so2ch2ch2]x-或-[nhchr4co]y-组成的组,其中x为1至200,y为1至20,且其中r4选自由h-、me-、hsch2-、异丙基、丁烷-2-基、ch3sch2ch2-、苄基、1h-吲哚-3-基-甲基、hoch2-、hoocch2-、ch3ch(oh)-、hoocch2ch2-、4-羟基苄基、h2ncoch2-、h2ncoch2ch2-、4-氨基丁烷-1-基、2-胍基乙基、1h-咪唑-5-基-甲基和2-甲基丙烷-1-基组成的组。
例如,螯合剂可以选自由二亚乙基三胺五乙酸(dtpa)、1,4,7,10-四氮杂环十二烷-n,n′,n″,n″′-四乙酸(dota)、1,4,8,11-四氮杂环十四烷-n,n′,n″,n″′-四乙酸(teta)、1,4,7-三氮杂环壬烷-n,n′,n″-三乙酸(nota)、2,2'-(2-(((1s,2s)-2-(双(羧甲基)氨基)环己基)-(羧甲基)氨基)乙基氮烷二基)二乙酸(环己烷-dtpa)、2,2'-(2-(((1r,2r)-2-(双(羧甲基)氨基)环己基)-(羧甲基)氨基)乙基氮烷二基)二乙酸、2,2'-(2-(((1s,2r)-2-(双(羧甲基)氨基)环己基)-(羧甲基)氨基)乙基氮烷二基)二乙酸、2,2'-(2-(((1r,2s)-2-(双(羧甲基)氨基)环己基)-(羧甲基)氨基)乙基氮烷二基)二乙酸、2,2',2”,2”'-(2,2'-(1s,2s)-环己烷-1,2-二基双((羧甲基)氮烷二基)双(乙烷-2,1-二基))双(氮烷三基)四乙酸、2,2',2”,2”'-(2,2'-(1s,2r)-环己烷-1,2-二基双((羧甲基)氮烷二基)双(乙烷-2,1-二基))双(氮烷三基)四乙酸、(1r)-1-苄基-二亚乙基三胺五乙酸、(1s)-1-苄基-二亚乙基三胺五乙酸、(2r)-2-苄基-二亚乙基三胺五乙酸、(2s)-2-苄基-二亚乙基三胺五乙酸、(2r)-2-苄基-(3r)-3-甲基-dtpa、(2r)-2-苄基-(3s)-3-甲基-dtpa、(2s)-2-苄基-(3s)-3-甲基-dtpa、(2s)-2-苄基-(3r)-3-甲基-dtpa、(2r)-2-苄基-(4r)-4-甲基-dtpa、(2r)-2-苄基-(4s)-4-甲基-dtpa、(2s)-2-苄基-(4s)-4-甲基-dtpa、(2s)-2-苄基-(4r)-4-甲基-dtpa、(1r)-1-苄基-(3r)-3-甲基-dtpa、(1r)-1-苄基-(3s)-3-甲基-dtpa、(1s)-1-苄基-(3s)-3-甲基-dtpa、(1s)-1-苄基-(3r)-3-甲基-dtpa、(1r)-1-苄基-(4r)-4-甲基-dtpa、(1r)-1-苄基-(4s)-4-甲基-dtpa、(1s)-1-苄基-(4s)-4-甲基-dtpa、(1s)-1-苄基-(4r)-4-甲基-dtpa、2,2'-((1r,2r)-2-(((r)-2-(双(羧甲基)氨基)-3-苯基丙基)(羧甲基)氨基)环己基氮烷二基)二乙酸、2,2'-((1s,2s)-2-(((s)-2-(双(羧甲基)氨基)-3-苯基丙基)(羧甲基)氨基)环己基氮烷二基)二乙酸、2,2'-((1r,2r)-2-(((s)-2-(双(羧甲基)氨基)-3-苯基丙基)(羧甲基)氨基)环己基氮烷二基)二乙酸、2,2'-((1s,2s)-2-(((r)-2-(双(羧甲基)氨基)-3-苯基丙基)(羧甲基)氨基)环己基氮烷二基)二乙酸、2,2'-((1r,2s)-2-(((r)-2-(双(羧甲基)氨基)-3-苯基丙基)(羧甲基)氨基)环己基氮烷二基)二乙酸、2,2'-((1s,2r)-2-(((s)-2-(双(羧甲基)氨基)-3-苯基丙基)(羧甲基)氨基)环己基氮烷二基)二乙酸、2,2'-((1s,2r)-2-(((r)-2-(双(羧甲基)氨基)-3-苯基丙基)(羧甲基)氨基)环己基氮烷二基)二乙酸、2,2'-((1r,2s)-2-(((s)-2-(双(羧甲基)氨基)-3-苯基丙基)(羧甲基)氨基)环己基氮烷二基)二乙酸、(2s)-2-苄基-1,4,7,10-四氮杂环十二烷-n,n′,n″,n″′-四乙酸、(2r)-2-苄基-1,4,7,10-四氮杂环十二烷-n,n′,n″,n″′-四乙酸、6-苄基-1,4,8,11-四氮杂环十四烷-n,n′,n″,n″′-四乙酸、2-苄基-1,4,7-三氮杂环壬环-n,n′,n″-三乙酸、苄基-3-甲基-二亚乙基三胺五乙酸(2b3m-dtpa)、(r)-2-氨基-3-(苯基)丙基)反式-(s,s)-环己烷-1,2-二胺-五乙酸)(bn-chx-a”-dtpa,又命名为chx-a”-dtpa)及其盐和衍生物组成的组,
特别地是(r)-2-氨基-3-(苯基)丙基)反式-(s,s)-环己烷-1,2-二胺-五乙酸)(bn-chx-a”-dtpa,又称为chx-a”-dtpa)及其盐。
本发明还涉及根据式i的具有结构cd66结合组分-nh-cs-nh-bn-chx-a”-dtpa,又称为cd66结合组分-nh-cs-nh-chx-a”-dtpa的放射性免疫缀合物及其盐(例如氯盐),
以及其在治疗骨髓相关疾病(诸如al-淀粉样变性)中的用途。更优选地,放射性免疫缀合物为bw250/183-nh-cs-nh-bn-chx-a”-dtpa(又称为bw250/183-nh-cs-nh-chx-a”-dtpa)或其盐。
给药用于治疗人类患者的治疗性ric的剂量优选地为≥约10mbq/kg瘦体重(lbw),优选地≥约15mbq/kglbw,更优选地≥约20mbq/kglbw,仍更优选地≥约25mbq/kglbw,仍更优选地≥约30mbq/kglbw,且仍更优选地≥约35mbq/kglbw。优选地,治疗放射性免疫缀合物的剂量范围最高至60mbq/kglbw,优选地最高至50mbq/kglbw,更优选地最高至45mbq/kglbw。
ric可以根据已知方法进行给药,例如通过输注,任选地与药学上可接受的载体一起。
优选地给药本发明的ric作为包括额外措施的疗法中的预处理方案,额外措施诸如干细胞移植,特别是自体或同种异体干细胞移植,更特别地是自体干细胞移植。优选地在干细胞移植前6-16天,优选地6-12天,向患者给药治疗放射性免疫缀合物。
在另一优选的实施方式中,根据本发明的骨髓相关疾病(诸如al-淀粉样变性)的治疗不包括在干细胞移植之后和/或之前至少四周给药额外的抗肿瘤剂(诸如美法仑)或免疫抑制剂。
在另一优选的实施方式中,根据本发明的骨髓相关疾病(诸如al-淀粉样变性)的治疗使用治疗性ric是用于向接受了高剂量美法仑治疗然后进行干细胞移植但疾病继续进展的患者给药。
在另一优选的实施方式中,根据本发明的使用治疗性ric的骨髓相关疾病(诸如al-淀粉样变性)的治疗是用于向接受了诱导治疗,例如万珂(velcade)、地塞米松、沙利度胺(thalidomide);或万珂、地塞米松、环磷酰胺;或万珂、地塞米松;或美法仑、泼尼松(prednisone);或泊马度胺(pomalidomide)、地塞米松)但疾病继续进展的患者给药。
在另一优选的实施方式中,根据本发明的使用治疗性ric的骨髓相关疾病(诸如al-淀粉样变性)的治疗是用于向接受了诱导治疗(万珂、地塞米松、沙利度胺;或万珂、地塞米松、环磷酰胺;或万珂、地塞米松;或美法仑、泼尼松;或泊马度胺、地塞米松)且对这些相应治疗组合有血液学响应的患者给药。
在另一优选的实施方式中,根据本发明的使用治疗性ric的骨髓相关疾病(诸如al-淀粉样变性)的治疗是用于向不符合在hsct之前进行hd-美法仑的条件的患者给药。
治疗方案,特别是用于治疗骨髓相关疾病(诸如al-淀粉样变性)的治疗方案,可包括以下步骤:
(a)任选地向患者给药成像ric,
(b)向患者给药治疗性ric,以及
(c)移植自体或同种异体干细胞。
治疗方案,特别是用于治疗骨髓相关疾病(诸如al-淀粉样变性)的治疗方案,可由以下步骤组成:
(a)任选地向患者给药成像ric,
(b)向患者给药治疗性ric,
(c)任选地给药抗生素,以及
(d)移植自体或同种异体干细胞。
治疗方案,特别是用于治疗骨髓相关疾病(诸如al-淀粉样变性)的治疗方案,可包括以下步骤:
(a)任选地向患者给药成像ric,
(b)向患者给药治疗性ric,
(c)任选地给药抗生素、抗真菌剂和/或抑病毒剂,以及
(d)移植自体或同种异体干细胞。
根据本发明的抗生素可以是氟喹诺酮、环丙沙星(cipro)、左氧氟沙星(levaquin/quixin)、加替沙星(tequin)、莫西沙星(avelox)、氧氟沙星(ocuflox/floxin/floxacin)、诺氟沙星(noroxin)。
根据本发明的抑病毒剂可以是阿昔洛韦(aciclovir)、更昔洛韦(ganciclovir)或缬更昔洛韦(valganciclovir)。
根据本发明使用的抗真菌剂可以是氟康唑、两性霉素b、制霉菌素(nystatin)、纳他霉素(natamycin)、利莫西丁(rimocidin)、非律平(filipin)、坎地辛(candicin)、哈霉素(hamycin)、表霉素(perimycin)、制皮菌素(dermostatin)。
优选的治疗方案,特别是用于治疗骨髓相关疾病(诸如al-淀粉样变性)的优选的治疗方案,可包括以下步骤:
(a)在步骤(b)之前特别地2-10天,更特别地2-8天,任选性向患者给药成像ric,
(b)在步骤(c)之前特别地6-16天,更特别地12-16天,向患者给药治疗性ric,以及
(c)移植自体或同种异体干细胞。
用于治疗骨髓相关疾病特别是al-淀粉样变性的特别优选的治疗方案包括以下步骤:
(i)在步骤(ii)之前特别地2-10天,更特别地2-8天,任选地向患者给药有111in的抗体bw250/183的成像ric,
(ii)在步骤(iii)之前特别地6-16天,更特别地12-16天,向患者给药有90y的抗体bw250/183的治疗性ric,以及
(iii)移植自体或同种异体干细胞。
令人惊讶的是,发现治疗骨髓相关疾病(诸如al-淀粉样变性)时,并不需要给药额外的抗肿瘤药剂(诸如美法仑或免疫抑制剂)来预处理骨髓。因此,仅用放射性免疫缀合物作为预处理剂来治疗这样的疾病,可最小化或甚至避免通常与使用抗肿瘤和/或免疫抑制剂的标准预处理相关的任何副作用。本发明允许治疗移植不符合条件的al-淀粉样变性患者。
进一步惊讶地发现,接受了高剂量美法仑治疗然后进行干细胞移植但疾病继续进展的患有骨髓相关疾病(诸如al-淀粉样变性)的患者,可以根据用本发明的治疗性放射性免疫缀合物以及随后的干细胞移植来治疗。
还发现,接受了诱导治疗但继续进展的患有骨髓相关疾病(诸如al-淀粉样变性)的患者,可以用根据本发明的治疗性放射性免疫缀合物以及随后的干细胞移植来治疗。
将通过以下实施例更详细地解释本发明。
附图说明
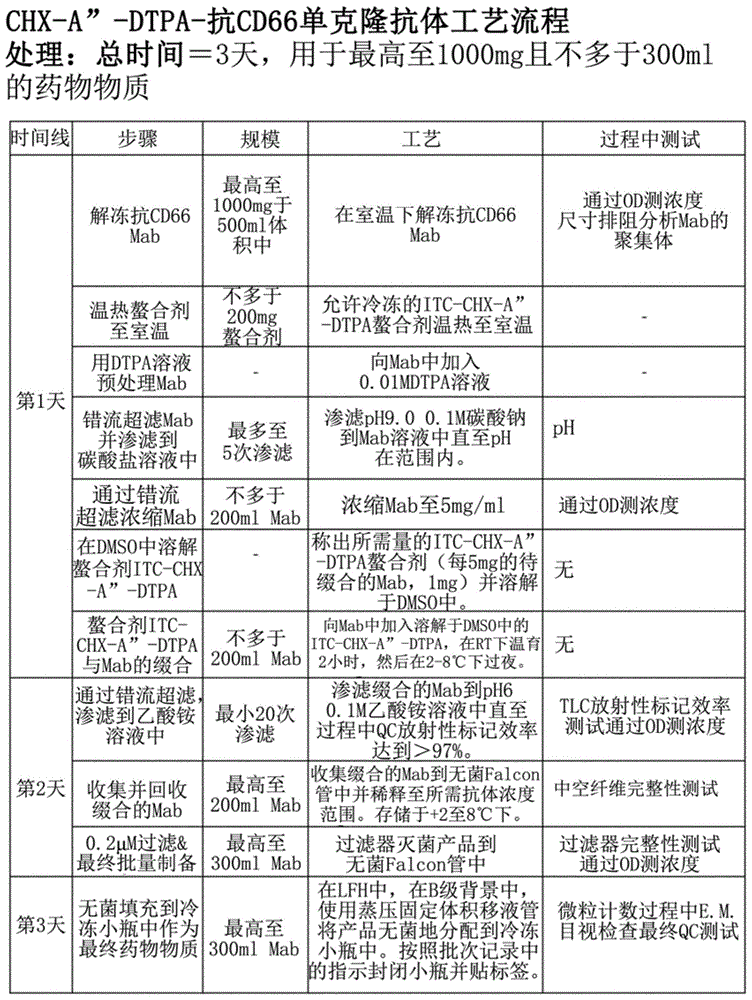
图1免疫缀合物chx-a”-dtpa-抗cd66单克隆抗体的制备
图2111铟chx-a”-dtpa-抗cd66药物产品的放射性标记工艺的流程图
图390钇chx-a"-dtpa-抗cd66药物产品的放射性标记工艺的流程图
图490钇标记的chx-a”-dtpa-抗cd66药物产品的组成
图5输注[111in]-抗cd66药物产品之后的连续全身γ图像
图6a[111in]-抗cd66药物产品输注之后的γ相机图像
图6b[90y]-抗cd66药物产品输注之后的韧致辐射图像
图790y-抗cd66治疗之后患者的flc响应
实施例
材料
cd66结合组分
分子量和式
鼠igg1κ单克隆抗体抗cd66bw250/183是分子量(mw)为150kda的单体蛋白质,且由预期mw(分别为大约50和25kda)的igg重链和轻链组成。该抗体又称如下:
inn名称:贝索单抗(besilesomab)
化学名称:单克隆抗体bw250/183
实验室代号:mabbw250/183
cas登记号:537694-98-7
螯合剂
ncs-chx-a”-dtpa螯合剂
用于抗体上的共价缀合事件的合成双功能螯合剂通过大环类化合物合成(1309recordcrossing,dallas,tx75235,usa)。iupac名称是2,2'-(2-(((s)-1-(双(羧甲基)氨基)-3-(4-异硫氰基苯基)丙烷-2基)(羧甲基)氨基)丙基氮烷二基)二乙酸,又称为异硫氰基-(r)-2-氨基-3-(苯基)丙基)反式-(s,s)-环己烷-1,2-二胺-五乙酸)(缩写为itc-chx-a”-dtpa或itc-bn-chx-a”-dtpa)。低mw量螯合物(mw:704da)具有以下化学式c26h34n4o10s.3hcl,且以固体灰白色粉末存在。
放射性免疫缀合物的制备
chx-a”-dtpa-抗cd66药物物质批次no.ab012的批次规格为122ml(355mg),对应于152ml工作体积(426mg)的起始单克隆抗体制剂抗cd66mab250/183(orpegenpharmagmbh或glycotopebiotechnologygmbh,德国或celonic,德国)。chx-a”-dtpa-抗cd66药物物质批次no.ab013的批次规格为250ml(775mg),对应于376ml工作体积(1051mg)的起始单克隆抗体制剂抗cd66mab250/183(orpegenpharmagmbh)。
图1概述了所进行的制造工艺和过程控制。
a)材料解冻
工艺的第一步是解冻在批次记录中规定的特定数量小瓶的抗cd66mab。将mab在室温下在层流罩(lfh)中解冻,然后将小瓶合并到单个无菌falcon管中。取过程qc样品进行尺寸排阻分析,以确认mab主要为单体的,并报告结果。
将螯合剂itc-chx-a”-dtpa从冷冻箱取出,并允许在室温下温热至室温最少1小时。
b)mab的错流超滤——渗滤到0.1m碳酸钠ph9.0溶液中。
生产该药物物质工艺的主要工艺步骤是错流超滤/渗滤(uf/df)步骤。这些滤筒是一次性的,单次使用且可获得用于处理的许多不同的截留分子量(spectrumlaboratories,美国)。在使用前,将滤筒和uf/df设备在使用经验证的蒸压循环进行杀菌之前按照制造商的建议进行预处理以除去甘油。通常,进行uf/df步骤以过滤、渗滤(缓冲液交换)并充分浓缩产品至预定的规格。在允许保留mab,同时允许盐和其他低分子量杂质通过的限定的操作参数(诸如跨膜压力、速率以低剪切力方式)下运行50kdamw截留中空纤维筒。滤筒和组件是封闭的工艺,其在b级洁净室背景中的a级层流罩内运行。
在处理之前,向lfh中的mab溶液中加入1:10vol:vol的0.01mdtpa溶液(即每10ml的mab,1ml的dtpa)。将mab轻轻混合,并在室温下温育30分钟。将mab溶液引入lfh中的中空纤维错流组件中,然后将mab用最小5体积的ph9.00.1m碳酸钠渗滤(透滤)至ph在可接受的范围内。取过程中qc样品以确认ph在缀合所需的8.9-9.2ph范围内。将mab从中空纤维筒中回收到无菌falcon管中。取过程中qc样品以通过od280nm监测mab的浓度。
c)mab与螯合物的缀合
所需的itc-chx-a”-dtpa螯合剂的量如下计算——每5mg的待缀合mab,1mg。将螯合剂小心称重到无菌容器中,然后溶解于dmso(每20μl的dmso溶解1mg的螯合剂)。将itc-chx-a”-dtpa螯合剂通过稳定混合到mab中从而小心地加入(为了加入至mab,使用小量的碳酸盐缓冲液将容器中任何存在的配体洗出)。将盖重新放置在mab容器上,并通过手动旋转非常轻柔地混合溶液。对试管进行标记,并在室温下放置2小时,然后在+2至8℃下温育过夜。
d)mab的错流超滤——渗滤/浓缩到乙酸盐缓冲液中
在lfh中,将mab溶液渗滤到ph60.1m乙酸铵溶液中,直到过程中qc放射性标记效率达到>97%。一旦放射性标记效率>97%,就通过释放跨膜压力而将mab从中空纤维错流设备回收到无菌falcon管中。取过程中qc样品以通过od280nm测定mab浓度,如有需要,则用乙酸盐缓冲液进一步稀释mab至2.5-3.3mg/ml的可接受范围内。最终的mab溶液储存于+2至8℃。
e)药物物质无菌过滤&填充到冷冻小瓶中
在lfh中,在b级背景下,使用0.22μm过滤器将产品过滤灭菌到无菌falcon管中。过滤器经过完整性测试以确保它在可接受的泡点范围内。在lfh中,在b级背景中,使用蒸压固定体积移液管将产品无菌地分配到无菌冷冻小瓶中。在工艺中,由操作员执行e.m以包括连续的空气颗粒计数。按照gmp将小瓶封闭并贴标签,然后存储于低于-70℃下。
该双功能螯合的chx-a”-dtpa-抗cd66单克隆抗体仍然为预期mw大小和组成的单体igg1。通过免疫反应性分析显示,该制制剂维持其对cd66抗原的特异性。
chx-a”-dtpa-抗cd66单克隆抗体易溶于水,且当溶解于ph6.0乙酸铵缓冲液时呈现为无可见颗粒的无色、透明溶液。
药物产品
111铟标记的chx-a”-dtpa-抗cd66药物产品
111铟标记的chx-a”-dtpa-抗cd66药物产品是以单剂量单位制造的,用于个体患者。药物产品111铟标记的chx-a”-dtpa-抗cd66将用过量的111铟至最大300mbq来制备,以允许在制造过程中的残留活性损失和在输注前的延迟。将向每个患者给药185mbq±10%的剂量。待给药的体积将基于小瓶中放射性的浓度来计算。残留的放射性标记的产品将被重新测量,并与原始活性进行核对,以允许准确记录向患者给药的实际活性。111铟chx-a”-dtpa-抗cd66药物产品的放射性标记工艺的流程图在图2中示出。
111铟标记的chx-a”-dtpa抗cd66药物产品是用放射性核素111铟标记的与双功能螯合剂缀合的单克隆抗体。
该放射性标记的抗体缀合物的两种组分是:
1)chx-a”-dtpa-抗cd66单克隆抗体(“药物物质”)
2)放射性核素111铟
由在每个站点处的放射性药物学部门按照gmp指南分别为每个患者制备单克隆抗体缀合物的放射性标记,并作为无菌、无热原和无颗粒溶液提供用于静脉输注液,其包含贝索单抗(1.0-1.5mg),用0.9%氯化钠溶液bp稀释至8.0ml,用铟-111标记,以在合成结束时得到最终的放射性浓度为大约23mbq/ml(可接受范围为20-30mbq/ml)。在制造结束时每批次药物产品的体积将为大约8-10ml。患者剂量将在一个10ml注射器中呈现。
可替代地,具有in111的单克隆抗体缀合物的放射性标记可以在放射性药物制造站点集中完成,且药物产品将在4-8℃下运送到治疗患者的相应移植中心。
90钇标记的chx-a”-dtpa-抗cd66药物产品
90钇标记的chx-a”-dtpa-抗cd66药物产品是以单剂量单位制造的,用于个体患者。每批次/单剂量单位的组成在图4中示出。药物产品90钇chx-a”-抗cd66用过量的大约25%90钇制备,以允许制造过程中的残留活性损失。根据该方案,向患者给药的实际剂量将取决于患者的瘦体重和给定的活性。待给药的体积基于这些因素以及小瓶中放射性的浓度来计算。重新测量残留的放射性标记的产品,并与原始活性进行核对,以允许准确记录向患者给药的实际活性。90钇chx-a”-dtpa-抗cd66药物产品的放射性标记工艺的流程图在图3中示出。
单克隆抗体缀合物的放射性标记由在每个站点处的放射性药物学部门按照gmp指南分别为每个患者制备,并作为无菌、热原和无颗粒溶液提供用于静脉输注液,其包含chx-a”-dtpa抗cd66(1.0-1.5mg),用0.9%氯化钠溶液bp稀释至大约8.0ml,用90钇标记,以在合成结束时得到最终的放射性浓度在200-500mbq/ml的范围内。
可替代地,具有y90的单克隆抗体缀合物的放射性标记可以在放射性药物制造站点集中完成,且药物产品将在4-8℃下运送到治疗患者的相应移植中心。
吸收性质
将放射性标记的111in抗cd66放射性免疫缀合物在缓冲盐水溶液中静脉给药。连续γ相机成像显示了最初血液相,并在4-6小时的输注内被骨髓吸收(图5)。
分布
人体内的生物分布显示出由红骨髓的细胞组分持续吸收,通常在中轴骨(椎骨、骨盆)、肋骨、颅骨和长骨的近侧区中。输注[111in]-抗cd66之后的γ图像示于图6a中,且输注[90y]-抗cd66之后的轫致辐射图像示于图6b中,表明抗cd66的各种放射性标记的形式具有相似的生物分布。
研究目的
本研究的主要目的是确定与在al-淀粉样变性患者中使用[90y]-标记的抗cd66作为自体干细胞移植前的唯一预处理相关的毒性。毒性测定通过ctcae版本4.0标准和干细胞移植测量来衡量,并在三个输注的放射活性水平上建立最大耐受辐射剂量(mtd)。
此外,该研究允许通过使用已建立的流式细胞术有效方法来测量恶性浆细胞群的变化(如通过血清flc分析所测量)从而评定克隆响应。还检查了疾病响应、心脏恢复、进展时间和总体存活率,同时确定患者的移植状态。
最后,该研究允许对之前在该患者组中i期和ii期试验中开发的剂量学模型进行评定。
结果测量/端点
[90y]-标记的抗cd66单克隆抗体作为全身性al-淀粉样变性患者中自体干细胞移植的唯一预处理方案的毒性使用ctcae版本4.0标准来测定。
使用[90y]-放射性标记的抗cd66mab作为靶向放射疗法的克隆响应通过系列flc实验来测量。将如用于进行并报告全身性轻链淀粉样变性中的临床试验的共识指南中的建议来汇总这些响应。
使用已建立的验证的流式细胞术方法,确定通过跟踪骨髓中恶性浆细胞群的变化而对[90y]-放射性标记的抗cd66mab的克隆响应。
通过测量(d100)治疗前后的nt-probnp水平来确定疾病响应和心脏恢复。
评估了使用[90y]-标记的抗cd66mab对进展时间和总体存活率的影响。
确定了使用相同放射性标记的抗cd66以及90y-标记的抗cd66后的成像/计量学的之前i期和ii期试验中开发的剂量学模型的效用。
自体干细胞的移植取决于血小板恢复>50×109/l且中性粒细胞>0.5×109/l(ebmt标准)的时间。
评估了在用于al淀粉样变性的自体干细胞移植的情况下,在暴露于抗cd66mab之后形成人抗小鼠抗体或人抗小鼠免疫球蛋白抗体(hama)的患者的比例。
试验设计
这是一项公开标签的、i/iia期多中心研究,关于以下方面评估了在al-淀粉样变性患者中使用放射性标记的抗cd66:
1)安全性和毒性
2)疾病响应。从一个剂量水平到下一个的进展将取决于所显示的毒性概况,但不基于疾病响应。患者将从参加国家淀粉样变性中心的患者中招募,以诊断和监测他们的疾病,且在他们之中高剂量治疗是一个治疗选项。
有三种治疗水平,代表增加的输注放射活性水平:
1.30.0mbq/kg瘦体重[90y]-放射性标记的鼠抗cd66
2.40.0mbq/kg瘦体重[90y]-放射性标记的鼠抗cd66
3.45.0mbq/kg瘦体重[90y]-放射性标记的鼠抗cd66
毒性
患者将被依次招募,并根据当时的活性剂量水平接受治疗。作为安全系数,在下一名患者以相同剂量水平接受治疗之前必须经过等于移植后d+30的间隔,且剂量水平变化之间为移植后d+60(尽管可能在前面的患者达到移植后d+30或d+60之前患者就被招募并同意了),假设没有毒性被记录。如果没有患者表现出毒性,则在该相同剂量水平下将最多招募3名患者,并可以开始下一个剂量水平(在等于d+60的间隔之后)。如果1名患者出现确定的毒性,则招募继续在相同剂量水平上进行,但在相同剂量水平上最多招募6名的患者。如果接受相同剂量水平治疗的最初的3名患者中有2名或更多名出现毒性,则研究停止。如果经复查,由独立数据监测委员会(idmc)确定毒性并非由于放射性标记的抗体直接导致,则试验可在相同剂量水平下继续进行,但最多扩大至6名患者。如果idmc确定毒性与放射性标记的抗体直接相关,则停止试验,然后将输注的放射活性水平设置为mtd。六名患者之后,如果多于2名患者出现由idmc归因于由放射性标记的抗体引起的毒性,则试验将停止,否则可以继续下一个剂量水平(如上所述)。
如果idmc认为,在任何输注的活性(“剂量”)水平上均没有特定的毒性,则最终的输注活性水平可以扩大到6名患者,以提供关于毒性和疾病响应的额外信息。
疾病响应
在研究期间,将确定每名患者中的疾病响应(游离轻链(flc)的变化)。因为可影响al-淀粉样变性患者的合并病症,如果如通过治疗和移植后flc和克隆浆细胞群的减少所表明,实现了良好临床疾病响应,那么证明明确的mtd是不合适的(即通过进一步增加输注的放射活性)。最佳输注放射将在所有患者中产生cr率而没有明显的毒性。i期研究的结果将用于指导进一步试验(ii期)的形式,其目的旨在确定最佳输注放射活性以及因此在该特定患者群体中的估计的骨髓放射剂量。如果在任何输注活性水平上都没有显示出毒性,则将第三水平扩大到6名患者会为疾病响应提供额外的证据。
患者
满足淀粉样变性的asct的资格标准且有迹象表明自体干细胞移植作为优选的治疗选项的所有全身性al-淀粉样变性患者均符合本研究的条件。
入选标准
具有以下特点的患者符合本研究的条件
·年龄≥18岁
·诊断为全身性al-淀粉样变性,为新的诊断或复发性疾病
·可测量的克隆浆细胞不调
·淀粉样蛋白相关的器官功能障碍或器官综合征
·预计期望寿命为至少6个月(如在试验开始时定义的)
·足够用于两次移植手术的干细胞
·骨髓(bm)细胞密度>20%
·符合al淀粉样变性中asct的资格,定义为满足所有以下标准:
oecog性能状态为0或1
o心肌肌钙蛋白t<0.07μg/l
onyha心脏衰竭等级为<3
o根据共识指南,淀粉样变性涉及的器官不多于3个
o肌酐清除率或同位素gfr≥30ml/min
o胆红素≤1.5倍且碱性磷酸酶≤3×正常的上限
oast或alt<2.5×正常范围的上限
o由超声波心动描记术测出的平均左心室壁厚度<16mm
o不存在临床上重要的淀粉样蛋白相关的自主神经病变
o不存在临床上重要的淀粉样蛋白相关的胃肠道出血
·能够提供书面知情同意
·有生育潜力的女性应采取适当形式的避孕
o宫内节育器(iud)
o基于激素的避孕(药片、避孕针等)
o双屏障避孕(避孕套和封堵帽,例如有杀精子剂的隔膜或宫颈帽)
o真正禁欲(此定义为在剂量测定和成像访问直至最后的研究访问中,接受[111in]后,避免异性性行为
排除标准
具有以下特点的患者不符合本研究的条件
·明显的多发性骨髓瘤症状
·不明的或非al型淀粉样变性
·局限性al-淀粉样变性(其中淀粉样沉积局限于典型的单一器官,例如膀胱或喉,与该器官内的克隆增生性疾病有关)
·在不存在明显的淀粉样相关器官综合征(例如孤立的腕管综合征)的情况下,微小或偶然的al-淀粉样沉积。
·nyhaiii级或iv级心脏衰竭
·由于淀粉样蛋白的肝受累引起胆红素>1.5倍正常的上限
·并发的活性恶性肿瘤,除了经手术切除的皮肤基底细胞癌或其他原位癌
·怀孕、哺乳期或不愿采取适当的避孕
·对任何研究药物不耐受/敏感
·已知人类抗小鼠抗体或人类抗小鼠免疫球蛋白抗体(hama)为阳性
·不能够提供书面知情同意
·参与了另一imp试验
试验评估
治疗-访问1
剂量测定和成像
给药ric前的患者的预先给药
即使当缺乏针对特定物种的抗体时,例如hama,接受动物源抗体的患者偶尔会出现诸如发热、寒战、肌痛的症状。抗cd66的累积临床经验表明,由于输注抗体而产生的副作用是罕见的,报道为每10,000次输注中发生0.5-1.0次。
必须立即提供复苏设施;这包括呼吸支持设备——氧气供应、通风设备、面罩和袋子。肾上腺素必须是可用的并可随时给药。
所有受试者将在输注放射性标记的抗cd66之前30-60分钟接受预先给药,由4mg氯苯那敏和1g扑热息痛组成,两者均口服,将避免使用类固醇(例如氢化可的松),除非发生明显症状,在这种情况下将给予50-100mg的氢化可的松。如果放射性标记的抗cd66的使用与大多数受试者中的症状相关,则将复审使用类固醇作为预先给药的一部分。
给药[111in]-标记的ric和剂量测定(干细胞收获后2-4周)——药物产品a
将给予小成像剂量的[111in]-标记的抗cd66,大约185mbq。
治疗-访问2
给药[90y]-标记的ric(第-14天)
标记的抗cd66的输注应在剂量测定后至少一周进行,其并将通过中心静脉导管,或者如果患者尚未插管,则通过外周插管,前5分钟的初始输注速率为5mg/hr;如果耐受,则速率可增加至10mg/hr。如果受试者出现任何明显的症状,诸如喉咙发紧、呼吸困难、严重寒战或发冷,则可能需要降低速率或停止输注。输注完毕之后,将用10-20ml生理盐水冲洗导管。
在这些输注速率下,总共2mg的标记的抗体将需要12分钟来输注。
治疗–访问3(第-7天至[90y]后第0天)
患者将被复查并开始预防性抗生素(环丙沙星250mgbd,阿昔洛韦400mgbd和氟康唑100mgod)。
自体干细胞再输注(第0天)
所有患者都将在移植中心接受移植,视情况而定使用住院或门诊护理设施。基于使用相同[90y]-抗cd66的i期和ii期试验的经验,预计患者的外周血计数将从[90y]-输注后d7下降,在d8-10达到最低点[相当于移植前d-6至d-4]。患者如果尚未住院治疗则将被收治。在他们干细胞移植之后(第0天),研究小组将每天评估他们的不良事件以及对额外的抗生素或血液制品的适当需求。患者将在充分的造血移植之后,并从任何感染中恢复且不依赖血液制品支持时出院。将在出院后于第30天和第100天时对患者进行随访。试验随访将在第100天完成,且将继续按照标准医疗实践进行非试验随访。
至疾病复发或进展的时间和到下一次治疗的时间将不作为正式评估的一部分被包括在试验的范围。然而,所有进行al-淀粉样变性的asct的患者都要定期接受其咨询顾问的长期随访,并也定期复查。
结果
前三名已接受高剂量美法仑及随后的asct治疗并复发的al-淀粉样变性患者,在用111in-标记的药物产品进行适当的剂量测定之后,使用30mbq/kg的90y-标记的药物产品进行治疗。
三名患者在用90y-标记的药物产品进行预处理期间未出现任何副作用,未见严重不良反应(saes)或非预期的意外严重不良反应(susar)。在所有三名患者中,均观察到克隆性游离轻链的下降。在一个病例中,看到了具有flc的持续正常化以及al-淀粉样变性的临床症状和疾病参数的改善的完整的响应。该试验已得到数据和安全委员会的批准,可以继续下一输注活活性水平。
这些发现是绝对独特和意外的。在没有任何副作用的情况下如由flc减少所表明的疾病消退的诱导是一项显著的成果,其为患有al-淀粉样变性的患者带来了重大益处。
图7示出了在以30mbq/kg的剂量接受ric治疗的患者中血清游离轻链的浓度随时间的变化。flc浓度,其是al-淀粉样变性的可靠生物标志物,在一个月内从80mg/l下降至约25mg/l。flc水平维持在10和30mg/l之间——这是健康人中的典型数值——持续几个月。一名患者完全缓解,其通过游离轻链的正常化、骨髓活检和最小残留疾病的确定进行分析。在移植后15个月患者处于生化完全缓解状态。
另外两名患者在ric治疗之后也显示出显著降低的flc水平。
- 还没有人留言评论。精彩留言会获得点赞!