用于冷冻和消融生物组织的电外科器械的制作方法
本发明涉及一种使用微波能量消融生物组织的电外科探针。具体地讲,该探针可用于肺或子宫中,例如以消融肿瘤、病灶或肌瘤以及治疗哮喘。该探针可穿过外科观测装置或导管的工作通道插入,或者可用于腹腔镜手术或开放手术。
背景技术:
由于支气管树的尺寸小,尤其是朝向可能形成小结节的周边区域,因此很难进入肺部肿瘤。这导致了许多治疗选择的采用,例如化学疗法(靶向药物、抗癌药(化学治疗剂))、放射疗法(电离辐射的递送)、手术(侵入性和微创性)和射频/微波消融。用于摘除肺部肿瘤的外科手术包括肺切除术(摘除一只肺)、肺叶切除术(摘除肺叶)、袖式肺叶切除术(切除肺叶以及与其相连的部分支气管)、楔形切除术(摘除肺的楔形部分)和肺段切除术/肺段切除(切除特定肺段)。
生物组织主要由水组成。人体软器官组织的水含量通常介于70%和80%之间。水分子具有永久电偶极矩,这意味着在整个分子上存在电荷不平衡。当分子旋转以使它们的电偶极矩与所施加电场的极性对准时,这种电荷不平衡使得分子响应于通过施加时变电场所生成的力而移动。在微波频率下,快速的分子振荡导致摩擦加热并且随后以热的形式耗散场能。这称为介电加热。
微波消融疗法利用了这一原理,在微波消融疗法中,靶组织中的水分子通过以微波频率施加局部电磁场而迅速加热,从而导致组织凝固和细胞死亡。使用微波发射探针来治疗肺部和其他身体组织的各种病症是已知的。例如,在肺部,微波辐射可用于治疗哮喘和消融肿瘤或病灶。
常规的微波消融探针被设计为经皮插入患者体内。然而,此类探针难以经皮定位到运动的肺中,这可能导致诸如气胸和血胸(分别是在胸膜腔内存在空气和血液)的并发症。其他微波消融探针可通过外科观测装置(例如,支气管镜或其他类型的内窥镜)递送至靶部位,所述外科观测装置可以延伸穿过诸如气道的体内通道。这允许进行微创治疗,微创治疗可以降低患者的死亡率并降低术中和术后并发症的发生率。
期望使用探针将微波能量递送到靶组织,因为辐射部分可以定位在靶部位附近,使得较高比例的功率被传输到靶部位,并且较低比例的功率损失到周围的健康组织。这减少了治疗的副作用并且提高了效率。
由于微波能量在生物组织中迅速耗散,因此生物组织通常被描述为有损耗材料。因此,从消融探针辐射的微波能量在其完全耗散之前不会在生物组织中传播太远。微波能量耗散的生物组织体积与频率有关,并且可以用称为趋肤深度的量来描述。趋肤深度被定义为距消融探针辐射天线表面的距离,在该距离处,与天线辐射的总功率相比,微波功率降低了1/e(其中e是自然对数等于一的数)。
举例来讲,图5示出了在0.5–10ghz频率范围内趋肤深度与频率的曲线图,所述频率范围覆盖了典型的微波消融频率范围。使用测得的复介电常数数据计算体内肝脏的趋肤深度。如图5所示,在5.8ghz的示例性消融频率下,趋肤深度为约8mm。这意味着大部分微波能量在距辐射天线表面不到1cm的距离处耗散。因此,微波消融探针的治疗区域大小被限制在辐射天线周围的小区域内。
可通过增加递送到辐射天线的微波能量的量(即,传递到天线的功率)来增加治疗区域的大小。然而,将能量传送到天线的电缆本身是有损耗的,并且通常损耗率随着电缆直径的减小而增加。这有效地限制了可以递送的能量的量,以避免由电缆加热引起的附带损害。微波能量的量的增加也会导致探针生成大量的热量,使得有必要使用冷却机制以避免损伤探针和/或患者。
技术实现要素:
最一般地,本发明提供了一种用于将微波能量施加到生物组织的电外科设备,其中该设备能够冷冻该设备的辐射尖端部分周围的区域中的生物组织并将微波能量施加到该冷冻组织。由于与非冷冻组织相比,冷冻组织中的水分子的振动和旋转自由度减小,因此当微波能量通过冷冻组织传输时,介电加热所损失的能量较少。所以,通过冷冻辐射尖端部分周围的区域,从辐射尖端部分辐射的微波能量可以低损耗地通过冷冻区域传输到冷冻区域周围的组织中。与常规的微波消融探针相比,这使得治疗区域的大小增加,而无需增加递送到辐射尖端部分的微波能量的量。一旦冷冻区域周围的组织被微波能量消融,则可以使冷冻区域逐渐解冻,使得冷冻区域耗散微波能量并被消融。本发明的设备还使得微波能量和组织冷冻的各种组合能够用于有效地消融生物组织。电外科装置可被配置成通过内窥镜的工作通道被馈送,使得其可以被用于执行微创外科手术。
根据本发明的第一方面,提供了一种用于治疗生物组织的电外科器械,该器械包括:用于传送微波电磁(em)能量的传输线;辐射尖端,该辐射尖端安装在传输线的远侧端部处以从传输线接收微波em能量并将该微波em能量辐射到辐射尖端周围的治疗区中;用于将组织冷冻流体传送到治疗区的流体供给源;以及热传递部分,该热传递部分被连接以在传输线的远侧端部处接收来自流体供给源的组织冷冻流体,其中热传递部分被布置成在组织冷冻流体与治疗区中的生物组织之间提供热连通,以冷冻治疗区中的生物组织。
辐射尖端可包括微波天线。该天线可以是在传输线的端部上形成的常规单极天线。传输线可以是同轴传输线,例如常规的同轴电缆。同轴电缆的内导体可以连接到微波天线的辐射尖端,微波能量可以从该辐射尖端辐射。辐射尖端可包括一种或多种介电材料以提供天线的介电负载,以便增强或形成微波天线的能量发射轮廓。同轴馈电电缆包括外导体,该外导体通过介电材料与内导体分离。
电外科器械可用于向其附近的物质(诸如生物组织、流体或其他材料)施加微波能量。微波能量可能会引起生物组织中的介电加热,这可用于消融天线周围局部体积中的组织。因此,通过将天线直接插入治疗区(包括例如肿瘤、病灶或肌瘤)中,可以将微波能量施加到治疗区中的组织上以将其消融。
电外科器械能够使位于辐射尖端周围的治疗区中的生物组织冷冻。在本文中,如果生物组织中包含的水为冰形式,即生物组织中的水分子保持为晶体结构,则将生物组织称为“冷冻的”。如果组织中的水分子处于液态,则将组织称为“非冷冻的”。与非冷冻组织相比,冷冻组织在微波频率下具有较低的介电损耗因子,因此使其能够比非冷冻组织更有效地传输微波能量。介电损耗因子与材料的介电常数的虚部有关,并且指示材料中的能量耗散。
组织冷冻流体可以是低温液体或气体,并且在本文中可以称为致冷剂。术语“致冷剂”可以指用于产生低于0℃的温度的物质。可以使用液体、气体或固体致冷剂。合适的致冷剂包括但不限于液态氮、液态二氧化碳和液态一氧化二氮。流体供给源可设置有由绝热材料制成的绝热层和/或真空套,以防止设备的其他部件被致冷剂冷却。这也可以确保仅治疗区中的组织被冷冻,并且患者的可能紧邻致冷剂传送管道的其他部位不受致冷剂的影响。
可以调节组织冷冻流体通过流体供给源的流动,以控制电外科器械的冷却能力。例如,可以增加组织冷冻流体的流动以提高冷却能力,从而使治疗区中的组织冷冻。可以减少或停止组织冷冻流体的流动,以使治疗区中的组织解冻。冷却能力可以确定被冷冻的组织的体积(例如,冷却能力越大,被冷冻的组织的体积越大)。在本文中,术语“冷却能力”用于描述器械去除某个区域的热量的能力。
热传递部分可被布置成使得其被由流体供给源递送的组织冷冻流体冷却,并且使得它可以与治疗区中的生物组织直接接触。以这种方式,可以使热传递部分与待冷冻的组织接触。然后组织冷冻流体可以冷却热传递部分,该热传递部分继而冷冻组织。热传递部分可以由导热材料诸如金属或其他合适的材料制成。热传递部分可具有被配置成与来自流体供给源的组织冷冻流体接触的第一部分以及被配置成与生物组织接触的第二部分。加热器可以安装在热传递部分之上或附近,以便能够更准确地控制热传递部分的温度。
流体供给源可被布置成使组织冷冻流体循环通过热传递部分。例如,流体供给源可包括用于将组织冷冻流体传送到热传递部分的递送管道,以及用于远离热传递部分传送组织冷冻流体的排放管道。这防止了压力在致冷器械中积聚。术语“用过的致冷剂”是指已经与组织冷冻元件的第一部分接触并由此从组织冷冻元件吸收热量的致冷剂。
热传递部分可包括用于例如在其第一部分接收组织冷冻流体的封闭贮存器。贮存器的入口可以连接到递送管道的出口,并且贮存器的出口可以连接到排放管道的入口。该器械可包括用于使组织冷冻流体流过器械的泵。
热传递部分的第二部分可包括由生物惰性材料制成的保护性外层。
在一些示例中,器械使组织冷冻流体在闭合回路中循环。在其他示例中,热传递部分可包括用于将组织冷冻流体递送到治疗区中的出口。出口可包括喷嘴,该喷嘴被布置成将组织冷冻流体喷射到治疗区中。在这样的示例中,器械还可包括减压管,治疗区中的气体可通过该减压管逸出。这避免了压力在治疗区中积聚,该压力可能对患者造成内部伤害。在使用液态致冷剂的情况下,这一点尤其重要,因为液态致冷剂与温热的组织接触时会迅速膨胀成气体。
减压管可具有位于器械的远侧端部附近的气体入口以及位于器械的近侧端部附近的排放出口,治疗区中的气体可通过该气体入口进入,并且气体可通过该排放出口排出。气体入口和/或排放出口可装配有单向阀,以防止气体通过减压管进入治疗区。气体入口和/或排放出口可装配有减压阀,该减压阀被配置成在治疗区中的压力达到预定阈值时自动打开,以确保将治疗区中的压力保持在安全水平。器械还可包括位于其远侧端部附近的压力传感器,用于监视治疗区中的压力。
热传递部分可具有其他构造。例如,热传递部分可包括球囊,该球囊流体地连接到流体供给源,使得可以用组织冷冻流体进行填充。
热传递部分可包括组织冷冻元件,该组织冷冻元件可在暴露位置与缩回位置之间移动,在暴露位置中,组织冷冻元件朝远侧突出超过辐射尖端,在缩回位置中,组织冷冻元件从辐射尖端后缩。可以使用一根或多根控制线在两个位置之间移动组织冷冻元件。这使得组织冷冻元件仅在用户希望利用冷冻功能时才展开,使得组织冷冻元件在不使用时不会引起任何意外伤害。电外科器械的远侧端部还可包括护套或保护壳,当处于缩回位置时,该护套或保护壳覆盖组织冷冻元件,以进一步提高安全性。
传输线和流体供给源可以在共同的电缆内。在一些示例中,流体供给源与传输线集成。例如,传输线可以是同轴传输线,该同轴传输线包括内导体、外导体和介电材料,该介电材料将内导体和外导体分离,并且其中内导体是中空的,以提供用于流体供给源的通路。组织冷冻元件可以可滑动地安装在通路中。中空内导体的内壁可以形成致冷剂递送管道的一部分。因此,冷却剂还可用于冷却同轴馈电电缆。
两种功能的集成可以提供紧凑的装置并简化消融过程,因为在消融过程中不需要将不同的部件插入内窥镜的工作通道中或从内窥镜的工作通道移除。
器械可包括温度传感器,该温度传感器安装在传输线的远侧端部以检测治疗区的温度。对组织冷冻流体流动和微波能量递送的控制可以基于检测到的温度。
器械可以在用于治疗生物组织的电外科设备中使用,该设备还包括被布置成供应微波电磁(em)能量的电外科发生器以及组织冷冻流体供应源。电外科器械可被连接以从电外科发生器接收微波em能量并从组织冷冻流体供应源接收组织冷冻流体。该设备还可包括控制器,该控制器被配置成:使组织冷冻流体通过流体供给源流到热传递部分,以冷冻治疗区中的生物组织;检测治疗区中的状况,以确定治疗区中的生物组织是否被冷冻;并且响应于确定治疗区中的生物组织被冷冻,使微波能量从辐射尖端被递送。控制器还可被配置成响应于确定治疗区中的生物组织被冷冻,减少或停止组织冷冻流体通过流体供给源的流动。控制器可被配置成基于以下任一项或多项来确定治疗区中的生物组织是否被冷冻:检测到的治疗区的阻抗和检测到的治疗区的温度。
控制器可以是常规计算装置,其操作性地连接到器械以控制组织冷冻流体的流动。例如,控制器可以控制一个或多个阀和/或泵,所述阀和/或泵可用于调节致冷剂通过递送管道的流动。当控制器确定治疗区中的生物组织被冷冻时减少或停止致冷剂的流动避免了冷冻所需靶区域之外的组织的风险,这可能会导致对周围的健康组织的损伤。
相反,如果控制器确定治疗区中的生物组织未冷冻或正在解冻,则控制器可增加致冷剂通过递送管道的流动,以冷冻治疗区中的组织。控制器还可被配置成定期监视治疗区中组织的状态(例如,冷冻或非冷冻),并调节致冷剂通过致冷剂传送管道的流动,使得治疗区中的组织达到所需状态(例如,冷冻或非冷冻)。因此,控制器提供了用于控制治疗区中组织的冷冻的自动机制,并降低了损伤治疗区之外的组织的风险。
在一些实施方案中,控制器可被配置成响应于确定治疗区中的生物组织被冷冻,使电外科器械将微波能量递送至治疗区中的生物组织。控制器可被配置成控制发生器,该发生器被连接以将微波能量提供给电外科器械。在一些示例中,控制器可以与发生器集成。由于当递送微波能量时治疗区中的生物组织被冷冻,因此微波能量可以低损耗地通过冷冻组织传输到周围的非冷冻组织,该非冷冻组织可以被微波能量消融。这可以增加所治疗组织的有效体积。
控制器可以使用若干种方法来确定治疗区中的生物组织是否被冷冻。在一些实施方案中,电外科设备还可包括设置在辐射尖端部分附近的传感器,并且控制器可被配置成基于从传感器获得的测量结果来确定治疗区中的生物组织是否被冷冻。传感器可以是用于测量生物组织的特性的任何合适的传感器,其中该特性根据组织的状态(即冷冻或非冷冻)而变化。例如,传感器可以是被布置成测量治疗区中的生物组织的温度的温度传感器。传感器可以是压力传感器,其被布置成在组织冷冻时检测压力的变化(例如,由于水在冷冻时膨胀)。
在其他示例中,控制器可被配置成基于治疗区中的生物组织的阻抗测量来确定治疗区中的生物组织是否被冷冻。阻抗测量例如可通过将微波能量的脉冲递送到辐射尖端部分并测量反射回同轴馈电电缆的微波能量来进行。由于辐射尖端部分与治疗区中的生物组织之间的阻抗失配,微波能量可在辐射尖端部分处反射。生物组织的阻抗是感兴趣频率下生物组织的介电常数和电导率的函数,因此取决于生物组织是冷冻的还是非冷冻的。通过测量反射的微波能量,可以估计治疗区中生物组织的阻抗,以便确定生物组织是否被冷冻。可使用低功率微波脉冲测量生物组织的阻抗,使得测量不会引起任何组织消融。
任选地,电外科设备还可包括用于将流体输送到治疗区和从治疗区输送流体的单独的流体递送机构。流体递送机构可用于将流体注入治疗区中和/或从治疗区抽吸流体。流体递送机构可包括:柔性流体传送管道,该柔性流体传送管道沿着所述同轴电缆延伸;以及刚性插入元件,该刚性插入元件与流体递送管道的远侧端部连通并被布置成延伸到治疗区中。例如,刚性插入元件可以是中空针,其可以使用一根或多根控制线露出以刺穿治疗区中的组织。流体递送机构还可用于从治疗区抽吸组织样品,以便进行活检。
上面论述的电外科设备可以形成完整电外科系统的一部分。例如,该设备可包括外科观测装置,该外科观测装置具有用于非经皮插入患者体内的柔性插入线,其中柔性插入线具有沿其长度延伸的器械通道,并且其中电外科器械的尺寸被设计为配合在器械通道内。
应当指出,器械的微波消融和组织冷冻功能可以独立使用。例如,可将微波能量直接施加到组织而不冷却或冷冻组织,以便消融组织。还可通过反复冷冻和解冻一定体积的组织来消融组织,而无需向其施加微波能量。因此,本发明的电外科设备提供了一种柔性组织消融工具,因为其能够根据特定情况的要求来组合不同的消融技术。
本文还公开了一种用于治疗生物组织的方法,该方法包括:将外科观测装置的器械线非经皮地插入患者中,该外科观测装置具有沿其长度延伸的器械通道;将如上所述的电外科器械沿着器械通道传送到其远侧端部处的治疗区;使组织冷冻流体流过流体供给源,以冷冻治疗区中的生物组织;以及在生物组织在治疗区中冷冻之后,将微波能量递送到辐射尖端部分。该方法可以利用本文论述的电外科设备和系统的任何特征。例如,该方法可包括:检测治疗区中的温度;并且基于所检测到的温度控制微波能量的递送。另选地或除此之外,该方法可包括:检测治疗区中的阻抗;并且基于所检测到的阻抗控制微波能量的递送。
在本文中,术语“近侧”和“远侧”分别是指更远离和更靠近治疗区的结构(例如,电外科器械、同轴馈电电缆等)的端部。因此,在使用中,使用者可触及该结构的近侧端部,而远侧端部更靠近治疗部位,即患者。
除非上下文另外指出,否则术语“传导的”在本文中用于表示导电的。
以下使用的术语“纵向”是指沿着器械通道的平行于同轴传输线的轴线的方向。术语“横向”是指垂直于纵向的方向。术语“内部”意指在径向上更靠近器械通道的中心(例如,轴线)。术语“外部”意指在径向上更远离器械通道的中心(轴线)。
术语“电外科”与在外科手术期间使用并且利用微波电磁(em)能量的器械、设备或工具相关地使用。在本文中,“微波em能量”可以意指具有在300mhz至100ghz的范围内、优选在1ghz至60ghz的范围内的稳定固定频率的电磁能量。微波em能量的优选标定频率包括915mhz、2.45ghz、5.8ghz、14.5ghz、24ghz。5.8ghz可以是优选的。
在使用中,治疗区可包括患者肺部、子宫、胃肠道或其他器官中的生物组织。
附图说明
以下参考附图论述本发明的示例,在附图中:
图1是作为本发明的实施方案的用于组织消融的电外科设备的示意图;
图2是适用于本发明的消融器械的远侧端部的示意性剖视图;
图3是适用于本发明的另一种消融器械的远侧端部的示意性剖视图;
图4a是作为本发明的实施方案的组织消融方法的示意图;
图4b是作为本发明的实施方案的另一种组织消融方法的示意图;并且
图5是在用于组织消融的微波频率范围内计算的趋肤效应与频率的曲线图。
具体实施方式、其他选项和偏好
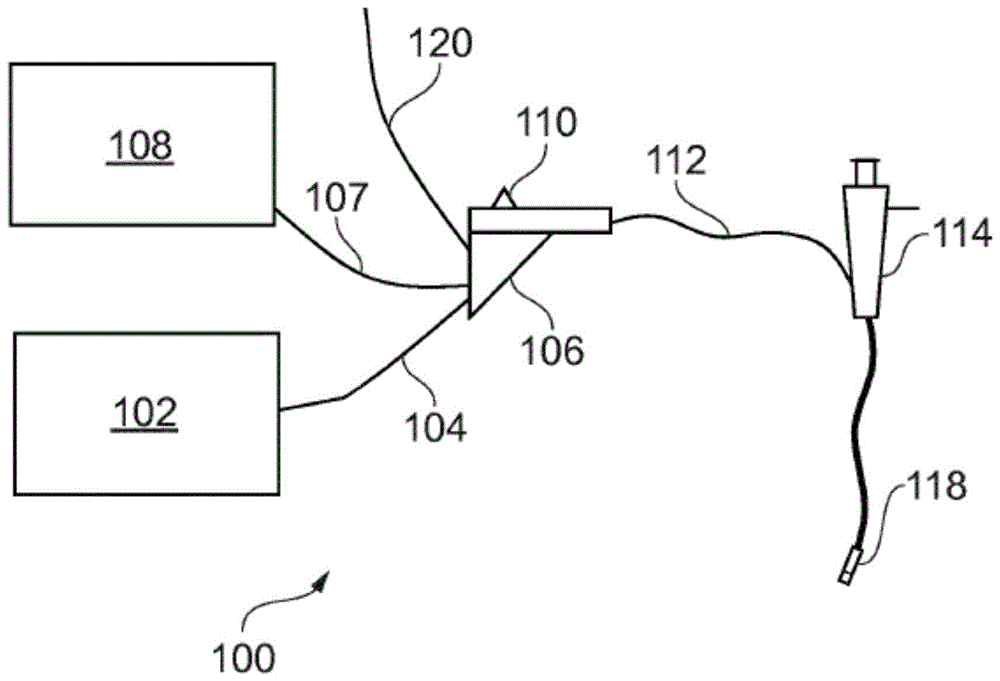
图1是作为本发明的实施方案的完整电外科设备100的示意图。设备100被布置成使用从微波天线递送的微波能量来治疗生物组织(例如,肿瘤、病灶或肌瘤)。设备100能够冷冻一定体积的生物组织,并且通过向冷冻组织施加微波能量来消融冷冻组织周围的组织。将微波能量施加到冷冻组织使得微波能量能够进一步传输到组织样品中,因为冷冻的组织不像非冷冻组织那样强烈地耗散微波能量。这使得可通过所施加的微波能量进行治疗的组织的总体积得以增大,而无需增加所递送的微波能量的量。
系统100包括用于可控地供应微波能量的发生器102。适用于此目的的发生器在wo2012/076844中有所描述,该文献以引用方式并入本文。发生器可被布置成监视从器械接收的反射信号,以便确定用于递送的适当功率水平。例如,发生器可被布置成计算在器械的远侧端部处观察到的阻抗,以便确定最佳递送功率水平。
发生器102通过交接电缆104连接到交接接头106。交接接头106还经由致冷剂传送管道107连接到致冷剂供应单元108,诸如致冷剂运载容器。如果需要,交接接头106可以容纳器械控制机构,该器械控制机构可通过滑动触发器110来操作,例如以控制一根或多根控制线或推杆(未示出)的纵向(即前后)移动。如果有多根控制线,则交接接头上可能存在多个滑动触发器以提供完全控制。排放传送管道120也可以连接到交接接头106,用过的致冷剂和/或排放气体可通过该交接接头排出。交接接头106的功能是将来自发生器102、致冷剂供应单元108、排放传送管道120和器械控制机构的输入组合成单个挠性轴112,该挠性轴从交接接头106的远侧端部延伸。
挠性轴112可插入外科观测装置114(诸如支气管镜、内窥镜、胃镜、腹腔镜等)的工作(器械)通道的整个长度。挠性轴112具有远侧组件118(在图1中未按比例绘制),该远侧组件被成形为穿过外科观测装置114的工作通道并且在外科观测装置的工作通道的远侧端部处突出(例如在患者体内)。远侧端部组件118包括用于递送微波能量的微波天线以及连接到致冷剂传送管道107以冷冻组织的组织冷冻元件(未示出)。尖端构造将在下面更详细地论述。
致冷剂可经由致冷剂传送管道107从致冷剂供应单元108递送到组织冷冻元件。在某些实施方案中,致冷剂用于冷却组织冷冻元件(例如,经由热交换过程)。在这种情况下,致冷剂可经由致冷剂传送管道107流入组织冷冻元件中,并经由排放传送管道120从组织冷冻元件流出。在其他实施方案中,组织冷冻元件包括用于将致冷剂喷射到靶区域上的喷嘴。然后,致冷剂可经由排放传送管道120从靶区域逸出,以避免在靶区域中积聚压力。排放传送管道120的近侧端部可以向大气开放,或者可连接到可以收集用过的致冷剂的收集室(未示出)。根据要使用的致冷剂,不同的致冷剂供应单元可以连接到致冷剂传送管道107。
远侧组件118的结构可被布置成具有适合于穿过工作通道的最大外径。通常,诸如内窥镜的外科观测装置中的工作通道的直径小于4.0mm,例如2.8mm、3.2mm、3.7mm、3.8mm中的任一个。挠性轴112的长度可以等于或大于1.2m,例如2m或更大。在其他示例中,可在将柔性轴112穿过工作通道插入之后(并且在将器械线引入患者体内之前),将远侧组件118安装在轴的远侧端部处。另选地,柔性轴112可以在进行近侧连接之前从远侧端部插入工作通道中。在这些布置中,可允许远侧端部组件118具有大于外科观测装置114的工作通道的尺寸。
上述设备是引入装置的一种方式。其他技术也是可能的。例如,装置也可以使用导管插入。
本发明寻求提供一种可通过将微波能量直接施加到组织和/或通过冷冻一定体积的组织并将微波能量施加到冷冻组织来消融生物组织的装置。该装置特别适合于肺或子宫中的组织的消融,但也可用于消融其他器官中的组织。为了有效消融靶组织,微波天线和组织冷冻元件应尽可能靠近靶组织定位(在许多情况下,在靶组织内部)。为了到达靶组织(例如,在肺中),将需要引导装置通过通路(例如,气道)并绕过障碍物。这意味着器械理想地将是柔性的并且具有较小的横截面。具体地讲,装置在其尖端附近应是非常柔性的,在尖端处可能需要沿着诸如细支气管的通路来操纵该装置,所述通路可以是狭窄且弯曲的。
还优选的是,装置可以与其他器械一起操作,以使医师能够接收来自靶部位的信息。例如,内窥镜可以帮助操纵器械绕过障碍物并转向期望位置。其他器械可包括温度计或相机。
图2是作为本发明的实施方案的电外科装置200的远侧端部的示意性剖视图。电外科装置200包括电外科器械201和致冷器械202。
电外科器械201包括同轴馈电电缆204,该同轴馈电电缆在其近侧端部处连接到发生器(诸如发生器102),以便传送微波能量。同轴馈电电缆204包括内导体206,该内导体通过第一介电材料210与外导体208分离。同轴馈电电缆204优选地对于微波能量而言是低损耗的。扼流圈(未示出)可以设置在同轴馈电电缆204上,以抑制从远侧端部反射的微波能量的反向传播,从而限制沿装置的向后加热。
同轴馈电电缆204在其远侧端部处以用于辐射微波能量的辐射尖端部分205终止。在该实施方案中,辐射尖端部分205包括内导体206的远侧导电部分212,该远侧导电部分在外导体208的远侧端部209之前延伸。远侧导电部分212在其远侧端部处被由第二介电材料形成的介电尖端214围绕,该第二介电材料不同于第一介电材料210。介电尖端214的长度短于远侧导电部分212的长度。中间介电套筒216在同轴电缆202的远侧端部与介电尖端214的近侧端部之间围绕远侧导电部分212。中间介电套筒216由第三介电材料形成,该第三介电材料不同于第二介电材料,但可以与第一介电材料210相同。介电尖端214可具有任何合适的远侧形状。在图2中,其具有圆顶形状,但这不一定是必要的。例如,其可以是圆柱形、圆锥形等。然而,平滑的圆顶形状可能是优选的,因为当通过小通道操纵时,其增加天线的移动性。电外科器械201容纳在保护套218中,该保护套使电外科器械201电绝缘。保护套218可以由诸如ptfe的非粘性材料制成或涂覆有非粘性材料,以防止组织粘附到器械。
中间介电套筒216的特性优选地被选择(例如通过模拟等)为使得辐射尖端部分205形成四分之一波长阻抗变换器,以将发生器的输入阻抗匹配到与辐射尖端部分205接触的生物组织负载中。辐射尖端部分205的这种构造可以围绕辐射尖端部分205产生近似球形的辐射图案。这使用户能够准确地辐射靶组织,并减少对健康组织的辐射或损伤。根据所需的辐射图案,可以使用不同的辐射尖端部分构造。例如,可通过沿着辐射尖端部分205的一侧延伸外导体208来产生不对称的辐射图案。
致冷器械202包括在致冷器械202的远侧端部处靠近辐射尖端部分205定位的组织冷冻元件220。组织冷冻元件220包括用于接收通过致冷剂传送管道224递送的致冷剂的贮存器222。组织冷冻元件220还包括尖端部分226,该尖端部分热连接到贮存器222,使得尖端部分226可以被贮存器222中的致冷剂冷却。组织冷冻元件220可以例如由单块导热材料形成,而贮存器222由材料中的腔形成。
致冷器械202还包括排放传送管道228,该排放传送管道连接到贮存器222,以将致冷剂从贮存器222传送到设备的近侧端部,在近侧端部处可收集或处置致冷剂。因此,如流动方向箭头230所示,可通过致冷剂传送管道224传送致冷剂,使得将其递送到贮存器222中。致冷剂可以在贮存器222中累积,从而使组织冷冻元件220的尖端部分226冷却,使得其可用于冷冻组织。如箭头232所示,可通过排放传送管道228将贮存器222中的过量致冷剂抽空,以避免贮存器222中压力的积聚。就液态致冷剂(例如液态氮)而言,致冷剂在从尖端部分吸收热量时可膨胀成气体。气体也可以形成致冷剂的一部分,所述部分通过排放传送管道228被抽空。致冷剂传送管道224和排放传送管道228都可以装配有单向阀,以确保致冷剂仅沿箭头230和232指示的方向流动。位于电外科装置的近侧端部处的泵可用于在致冷剂传送管道224和排放传送管道228中循环致冷剂。
绝热套筒234围绕致冷剂传送管道224、排放传送管道228以及组织冷冻元件220的一部分。绝热套筒234防止热量在管道中的致冷剂与周围环境之间交换。除此之外或另选地,致冷剂传送管道224和排放传送管道228本身可以由绝热材料制成。可通过在绝热套筒234内部的空间中形成真空来改善管道的绝热。管道的绝热确保仅组织冷冻元件220附近的组织可以被冷冻,从而避免对患者造成意外的冷损伤。
组织冷冻元件220可以在绝热套筒234内沿其长度滑动。组织冷冻元件220的外表面与绝热套筒的内表面之间的配合可以足够紧密,使得其形成气密的滑动密封。贮存器222可以可滑动地连接到管道224和228(例如,经由滑动密封件),以使组织冷冻元件220能够相对于管道224和228移动。另选地,贮存器222与管道222和228之间的连接可以是固定的,使得管道224和228与绝热套筒234中的组织冷冻元件一起移动。组织冷冻元件220可以使用控制线236沿着绝热套筒234滑动,该控制线穿过绝热套筒234并且在一端处连接到组织冷冻元件220。组织冷冻元件可以完全或部分地缩回到绝热套筒234中,使得其尖端部分226不突出超过电外科器械201的远侧端部。当使用者希望使用组织冷冻元件220冷冻生物组织时,组织冷冻元件220可以被暴露,使得其突出超过电外科器械201的远侧端部,使得其可以与靶组织接触。当器械被导航到靶区域时,组织冷冻元件220可被置于其缩回位置,以避免尖端部分226卡到组织上或引起意外伤害。上述机构的替代机构是可能的,以使组织冷冻元件220能够相对于电外科器械201移动。
加热器和温度传感器(未示出)可以安装在组织冷冻元件220的尖端部分226附近,以便能够准确控制尖端部分226处的温度。加热器可以是电阻芯片,当电流通过该电阻芯片时加热。通过使加热器生成的热量与致冷剂提供的冷却能力平衡,可以在尖端部分226处获得稳定的温度。pid控制器可用于控制尖端部分226的温度。加热器还可用于加热尖端部分226,以解冻冷冻的组织。
致冷器械202可以相对于电外科器械201固定,使得这两个部件形成单个集成装置,该集成装置被配置成配合在内窥镜的工作通道中。例如,绝热套筒234可以固定到电外科器械201的保护套218。
图2所示的组织冷冻元件220的尖端部分226是圆顶形的。但是,其他形状也是可能的。例如,其可以是圆柱形、圆锥形等。通常,期望尖端部分226的形状使得其最大化尖端部分226与靶组织之间的热传递,以便有效地冷冻组织。因此,可能希望使用使尖端部分226与靶组织之间的接触区域最大化的形状。在一些情况下,尖端部分226可具有锐利的尖端,使得其可以刺穿组织并插入靶组织内部。在一些示例中,尖端部分226和介电尖端214可以是或形成装置200的共同尖端结构的一部分。
电外科装置200的远侧端部还可包括位于辐射尖端部分205附近的传感器238,以测量辐射尖端部分周围的治疗区中的组织的特性。测量结果可经由布线240从传感器238获得。例如,传感器238可以是用于测量治疗区中的组织的温度的温度传感器。传感器238也可以是用于测量治疗区中的压力变化的压力传感器。来自传感器238的测量结果可用于确定治疗区中的组织何时被冷冻,以便确定何时向治疗区施加微波能量。
在一些实施方案中,电外科装置200还可包括外部护套,该装置的远侧端部处的部件容纳在该外部护套中。外部护套可具有孔,组织冷冻元件220可通过该孔突出。外部护套可具有平滑的形状,使得不会向生物组织呈现尖角,以避免意外伤害。
图3是作为本发明的另一个实施方案的电外科装置300的远侧端部的示意性剖视图。在该实施方案中,致冷器械被集成到电外科器械中。电外科装置300包括同轴馈电电缆301,该同轴馈电电缆可以在其近侧端部处连接到发生器(例如,发生器102),以便传送微波能量。同轴馈电电缆301包括内导体303,该内导体通过第一介电材料306与外导体304分离。同轴馈电电缆301优选地对于微波能量而言是低损耗的。扼流圈(未示出)可以设置在同轴电缆上,以抑制从远侧端部反射的微波能量的反向传播,从而限制沿装置的向后加热。
同轴馈电电缆301在其远侧端部处以用于辐射微波能量的辐射尖端部分302终止。在该实施方案中,辐射尖端部分302包括内导体303的远侧导电部分308,该远侧导电部分在外导体304的远侧端部309之前延伸。内导体303是中空的,其中内导体的内表面限定穿过内导体303延伸的通道312。远侧导电部分308在其远侧端部处被由第二介电材料形成的介电尖端310围绕,该第二介电材料不同于第一介电材料306。介电尖端310是圆顶形的并具有穿过其延伸的通道,并且内导体303穿过该通道。孔314形成在内导体303的远侧端部处。
通道312可以在近侧端部处连接到致冷剂供应单元(例如,致冷剂供应单元108),使得通道312可充当致冷器械的致冷剂传送管道。流体连接到通道312的喷嘴316位于内导体的孔314附近。喷嘴316被布置成将通过通道312传送的致冷剂朝向辐射尖端部分302前方的靶部位(即图3中的右侧)喷射,如虚线318所示。喷嘴316可以例如是狭缝阀,但其他类型的喷嘴也是可能的。喷嘴316被配置成防止来自靶部位的流体进入通道312,因此可包括单向阀。在一些实施方案中,喷嘴316可包括细管,以便提供浓缩且定向的致冷剂喷雾。在一些实施方案中,喷嘴316可以在通道312中滑动(例如,使用一根或多根控制线),使得可以使喷嘴突出超过辐射尖端部分302。这样,当电外科装置200被导向到适当位置时,喷嘴316可以缩回,然后可被部署以喷射靶组织。
电外科装置200还包括减压管320,辐射尖端部分302周围的治疗区中的气体可通过该减压管逸出。这避免了治疗区中的压力积聚,该压力可能导致对患者的内部伤害。在致冷剂是冷气体的情况下,从喷嘴316喷射的冷气体可以冷却治疗区中的组织,然后经由减压管320离开治疗区。在致冷剂是低温液体的情况下,从喷嘴316喷射的低温液体可冷却治疗区中的组织并膨胀成气体。然后,所产生的气体可经由减压管320离开治疗区。
优选地,减压管320被配置成使得气体可以仅从电外科装置200的远侧端部(即,从治疗区)流到电外科装置200的近侧端部。这是为了避免气体经由减压管320进入治疗区。减压管320可以在其近侧端部处排放到大气,或者可以连接到气体收集室。减压管320还可以装配有减压阀,该减压阀被配置成当治疗区中的压力达到预定阈值时允许气体沿着减压管320流动。以这种方式,可以将治疗区中的压力维持在安全水平。
第一介电材料306可以是绝热材料,或者可包括绝热层,使得外导体304不被通道312中的致冷剂冷却。以这种方式,当致冷剂流过通道312时,同轴馈电电缆301的外表面不会变冷,从而避免了冷冻治疗区之外的患者身体部分的风险。另选地,同轴馈电电缆301可包括围绕外导体304的外表面的绝热套筒和/或真空护套。
流过通道312的冷却剂可以冷却内导体303,并耗散通过同轴馈电电缆301传播的任何微波能量所生成的热量。这使得同轴馈电电缆301所携带的微波能量的量增加,而不会使同轴馈电电缆301过热。因此,图3所示的构造使得能够施加更大量的微波能量,这可以增加被微波能量消融的组织的体积。
电外科装置300还可包括一个或多个传感器和/或加热器,类似于结合图2所论述的那些。
应当指出,与图2和图3所示的实施方案不同的特征组合是可能的,其中图2和图3所示的实施方案仅作为示例给出。例如,图2的致冷器械202可以穿过与图3所示类似的电外科器械的中空内导体插入。以这种方式,致冷剂传送管道224、排放传送管道228和组织冷冻元件220可被容纳在类似于通道312的通道内,使得致冷器械202完全集成到电外科器械中。又如,图2的低温系统202可以由包括与结合图3描述的那些类似的喷嘴和减压管的致冷剂喷射机构代替。
图4a示出了使用根据本发明的电外科装置进行的生物组织消融的示意图。电外科装置400的远侧端部诸如结合图2和图3描述的那些被插入待消融的靶组织中。使用电外科装置400的致冷器械,冷冻电外科装置400的远侧端部周围的一定体积的组织402。这是通过使冷却剂穿过冷却剂传送管道流到电外科装置400的远侧端部处的组织冷冻元件来完成的。在使用图2中的电外科装置的情况下,贮存器222可以填充有致冷剂以冷却组织冷冻元件220的尖端部分226。然后,组织冷冻元件220可以从绝热套筒234中滑出,使得其与靶组织接触并导致该体积的组织402冷冻。在使用图3中的电外科装置的情况下,可将来自致冷剂传送管道的致冷剂喷射到靶组织上,以冷冻该体积的组织402。被冷冻的组织的体积402可以取决于致冷剂通过致冷剂传送管道的流速和/或组织冷冻元件的温度(在一些实施方案中,可以使用加热器来控制)。
一旦该体积的组织402被冷冻,微波能量就被递送到电外科器械的辐射尖端部分,使得微波能量被施加到冷冻组织。微波能量以相对低的损耗通过该体积402的冷冻组织传输到非冷冻组织404的周围层中,如箭头406所示。微波能量随着热量在组织层404中迅速耗散,从而引起组织层404的消融。当组织层404被消融时,该体积的组织402可以保持冷冻,例如通过保持致冷剂通过致冷剂传送管道的恒定流动和/或控制组织冷冻元件的温度。
可通过测量组织的各种特性来确定电外科装置400的远侧端部周围的组织状态(例如,冷冻或非冷冻)。例如,使用安装在电外科装置400的远侧端部附近的一个或多个传感器,可以测量温度和/或压力以给出组织是否被冷冻的指示。电外科器械可用于测量其远侧端部周围的组织的阻抗,从而确定组织是否被冷冻。阻抗测量还可用于估计远侧端部周围的被冷冻的组织的体积。组织的阻抗可通过沿着同轴馈电电缆向下发送微波能量脉冲至辐射尖端部分并测量反射回同轴馈电电缆的任何微波能量来测量。
一旦消融了层404中的组织,就可以使体积402中的组织逐渐解冻,使得该组织可通过施加的微波能量逐渐消融。可通过减少致冷剂通过致冷剂传送管道的流动和/或提高组织冷冻元件的温度(例如使用安装在其上的加热器)来使组织解冻。通过适当地控制致冷剂通过致冷剂传送管道的流动和/或组织冷冻元件的温度,可以分阶段减少被冷冻的组织的体积。在每个阶段,可以施加微波能量以消融先前被冷冻的冷冻组织周围的组织层。
该过程示于图4b中。最初,组织层414、412和410被冷冻,使得当将微波能量施加到冷冻组织时,外层408可以被消融。然后,使层410解冻,保持层414和412冷冻,使得可通过微波能量消融层410。再将层412解冻,使得其也可以被消融。最后,通过直接施加微波能量来解冻和消融最内层414。以这种方式,可消融的组织的总体积由组织层408的外表面限定。该体积可能远远大于可通过将相同量的微波能量直接施加于非冷冻组织来消融的组织体积。
控制器可用于控制消融过程中的各个步骤。控制器可被配置成从位于电外科器械的远侧端部附近的一个或多个传感器获得测量结果,以便确定电外科器械的辐射尖端部分周围的治疗区中的组织是否被冷冻。控制器还可被配置成执行阻抗测量以确定治疗区中的组织是否被冷冻。根据确定的结果,控制器可被配置成调节致冷剂在致冷剂递送管道中的流动和/或组织冷冻元件的温度(例如,以增大或减小治疗区中的冷冻组织的体积)。一旦确定所需体积的组织已被冷冻,控制器可被配置成将微波能量递送到辐射尖端部分。控制器还可被配置成如结合图4b所述连续消融组织层。
控制器可以是其上安装有用于执行上述各种步骤的软件的常规计算装置。该计算机可以连接到发生器102,使得其可以控制向电外科器械的辐射尖端部分的微波能量供应。该计算机还可以连接到致冷剂供应单元108,以控制致冷剂通过致冷剂传送管道的流动(例如,通过控制致冷剂供应单元108中的阀)。可将来自电外科装置上的任何传感器的输出连接到控制器,使得控制器可以从传感器获得测量结果。如果加热器设置在电外科设备上,则其输入也可以连接到控制器。以这种方式,控制器提供用于执行组织消融的自动化系统。
- 还没有人留言评论。精彩留言会获得点赞!